【研究意义】大鳞副泥鳅(Paramisgurnus dabryanus)属鲤形目鳅科花鳅亚科副泥鳅属[1],是一种常见的小型经济鱼类[2],自然分布于长江、嘉陵江和岷江水系、辽河中下游、黄河及黑龙江地区[3]。其肉质鲜美,蛋白质含量高且脂肪含量较低[4],具有补血益气、壮阳利尿功效[5],已成为我国近年新兴的淡水养殖品种[6]。随着大鳞副泥鳅养殖规模日益扩大,人工育苗才能满足苗种需求。然而,人工育苗多为近亲交配,易产生种质退化、遗传多样性下降和抗病抗逆性能降低等问题,严重影响大鳞副泥鳅养殖业的可持续健康发展。精液超低温冷冻保存技术作为有效、持久的精子保存手段,方便苗种场之间运输和开展不同品种或品系以及不同地理种群间鱼类的杂交[7],发挥杂交优势,是解决近亲交配问题的有效手段之一。【前人研究进展】关于鱼类精液超低温冷冻保存的研究国内外均有报道。研究发现,10%甲醇与CCSE2稀释液组合在黄颡鱼(Pelteobagrus fulvidraco)的精子超低温冷冻保存中效果最好,冻精活力为42.86(±2.67)%[8]。美洲鲥鱼(Alosa sapidissima)精液以鱼用任氏液和10%(V/V)甲醇作为抗冻保护液,解冻后冻精活力可达80.3(±2.58)%[9]。缺帘鱼(Brycon cephalus)精子超低温保存以Ringers液为稀释液、16%二甲亚砜为保护剂,解冻后精子活力为35.2(±4.5)%[10]。以D-15为稀释液、10%乙二醇(EG)为抗冻剂,采用两步降温法超低温冷冻保存翘嘴鲌(Culter alburnus Basilewsky)精子,解冻后精子活力为62.67%[11]。大鳞副泥鳅精液常温(4 ℃、20~24 ℃)保存,精子活力保持时间较短(≤132 h)[13],超低温冷冻保存的冻精激活率为70%,但精子活力较低[12]。可见,不同鱼类的精液超低温冷冻保存方法存在差异。【本研究切入点】鱼类精子超低温保存方法较多,测定精子活力标准不一[9,12-13],难以比较冻存效果。为此在前人鱼类精子超低温保存研究的基础上,从不同稀释液、抗冻剂及解冻后精子活力等方面探讨大鳞副泥鳅精子冷冻保存的方法。【拟解决的关键问题】通过筛选不同稀释液和抗冻剂,优化抗冻剂的体积分数以及精液稀释比例,探究适宜的精液超低温冷冻保存方法,以期为大鳞副泥鳅的精液保存和生产应用提供技术支撑。
1 材料与方法
1.1 试验材料
试验于2019年5—7月在广西大学动物科学技术学院水产实验室进行。供试鱼为二龄大鳞副泥鳅雄鱼(100条),体长20.3(±2.4)cm,质量78(±5)g,由广西水产科学研究院那马基地赠送。大鳞副泥鳅在实验室暂养两周,水温26(±2)℃,每天喂食1次商品颗粒饲料,确认健康状态良好后用于后续试验。
1.2 试验方法
1.2.1 精液获取与活力测定 选取健康状况良好的雄鱼采集精液。操作过程使用30 mg/L MS-222溶液对供试鱼进行麻醉处理,用毛巾擦干鱼体水分后挤压腹部采集精液(采集过程应避免尿液、粪便和血渍污染)。为测定精子活力,取5 μL鲜精液和10 μL纯水在载玻片上混匀,在400倍显微镜下观察并记录精子活力。精子活力(%)=呈直线运动的精子数/精子总数×100[14]。经镜检,精子活力达90%以上可用于后续试验。
1.2.2 精液冷冻保存与解冻 将所需稀释液与精液按一定比例混匀,加入所需体积分数的抗冻剂,混匀后分装于冻存管(1 mL/管)进行超低温冷冻。冷冻方法采用三步冷冻法:首先在液氮面上方6 cm处平衡10 min,然后在液氮面上平衡5 min,最后投入液氮中冷冻保存。解冻与冻精质量的测定:打开液氮罐,将保存的精子从液氮中取出,于液氮口处平衡5 min后,37 ℃水浴快速解冻直至融化,立即取5 μL精液放入显微镜视野下,用纯水激活观察精子活力。
1.2.3 精液稀释液筛选 为筛选大鳞副泥鳅精液超低温冷冻保存的最佳稀释液,参照相关文献制备稀释液Ⅰ(鱼用任氏液)[9]、Ⅱ(Hanks精子保存液,由A液和B液组成,使用时各取5 mL,加入蒸馏水至 100 mL)[15]、Ⅲ[16]、Ⅳ[13, 17]、Ⅴ[12],各稀释液具体配方见表1。稀释液配制完成后置于4 ℃保存备用。分别将5种稀释液与精液以2∶1比例混合,然后加入甘油(终浓度5 %)作为抗冻剂(重复加样3次),置于液氮罐冷冻保存,1周后检测和比较各稀释液的冻精活力。
表1 供试精液稀释液配方
Table 1 Formula of diluent for tested semen
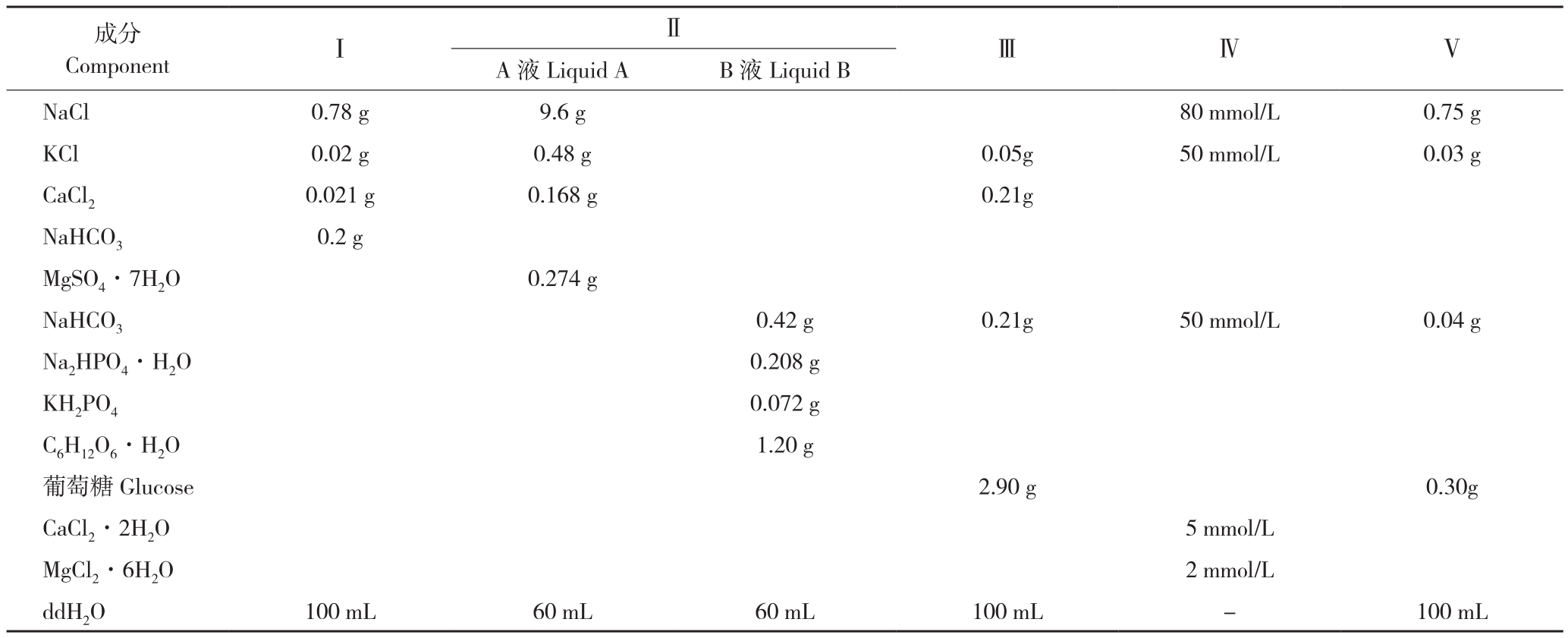
ComponentⅠⅡⅢⅣⅤA液Liquid A B液Liquid B成分NaCl 0.78 g 9.6 g 80 mmol/L 0.75 g KCl 0.02 g 0.48 g 0.05g 50 mmol/L 0.03 g CaCl2 0.021 g 0.168 g 0.21g NaHCO3 0.2 g MgSO4·7H2O 0.274 g NaHCO3 0.42 g 0.21g 50 mmol/L 0.04 g Na2HPO4·H2O 0.208 g KH2PO4 0.072 g C6H12O6·H2O 1.20 g葡萄糖Glucose 2.90 g 0.30g CaCl2·2H2O 5 mmol/L MgCl2·6H2O 2 mmol/L ddH2O 100 mL 60 mL 60 mL 100 mL - 100 mL
1.2.4 精液抗冻剂筛选与优化 为筛选大鳞副泥鳅精液超低温冷冻保存的最佳抗冻剂,将最佳稀释液与精液以2∶1比例混合,分为3组,分别加入抗冻剂二甲基亚砜(DMSO)、甘油(Gly)和甲醇(METH),终浓度均为5%(重复加样3次),置于液氮罐冷冻保存,1周后检测和比较冻精活力,筛选最佳抗冻剂。为优化最佳抗冻剂体积分数,将最佳稀释液与精液以2∶1比例混合,分为8组,分别加入最佳抗冻剂,使最终体积分数分别为2.5%、5%、7.5%、10%、12.5%、15%、17.5%和20%,置于液氮罐冷冻保存,1周后检测和比较冻精活力,确定最佳抗冻剂的最优体积分数。
1.2.5 精液稀释比例优化 确定最佳精液稀释液和最佳抗冻剂的最佳体积分数后,将精液与最佳精液稀释液按照1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7和1∶8比例稀释,加入最佳体积分数的最佳抗冻剂(重复加样3次),然后置于液氮罐冷冻保存,1周后检测并比较冻精活力,确定精液与最佳稀释液的最佳稀释比例。
试验数据采用IBM SPSS Statistics 20进行单因素方差分析,采用Graphpad prism 8.0.1制作图表。
2 结果与分析
2.1 不同稀释液对精液超低温冷冻保存效果的影响
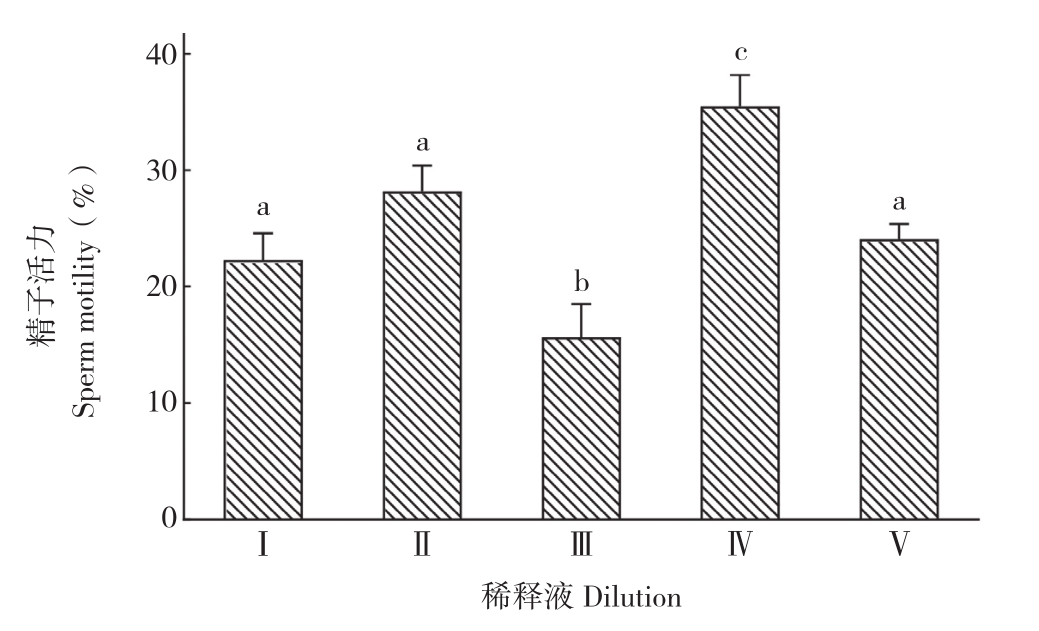
图1 不同稀释液对精液超低温冷冻保存效果的影响
Fig. 1 Effects of different diluents on ultra-low temperature cryopreservation of semen
柱上小写英文字母不同者表示差异显著Different lowercase letters on the bar chart represent significant differences
由图1可见,稀释液Ⅳ处理的冻精活力最高,达到35.5(±2.7)%,显著高于其他4种稀释液;稀释液Ⅰ、稀释液Ⅱ和稀释液Ⅴ处理的冻精活力分别为22.3(±2.3)%、28.2(±2.2)%和24.1(±1.3)%,三者之间无显著差异;效果最差的为稀释液Ⅲ,冻精活力仅为15.2(±2.9)%。
2.2 不同抗冻剂及其体积分数对精液超低温冷冻保存效果的影响
由图2可见,5% DMSO抗冻剂对大鳞副泥鳅精液的冷冻保存效果最好,精子活力为40.7(±2.5)%;甘油对精子冷冻保存效果最差,精子活力仅为24.8(±1.7)%。配制不同浓度的DMSO抗冻剂,比较不同浓度DMSO对精液超低温冷冻保存的效果,结果(图3)显示,10% DMSO对大鳞副泥鳅精液的冷冻保存效果最好,冻精活力达54.6(±1.5)%;20% DMSO的冷冻保存效果最差,冻精活力仅为14.9(±2.4)%。
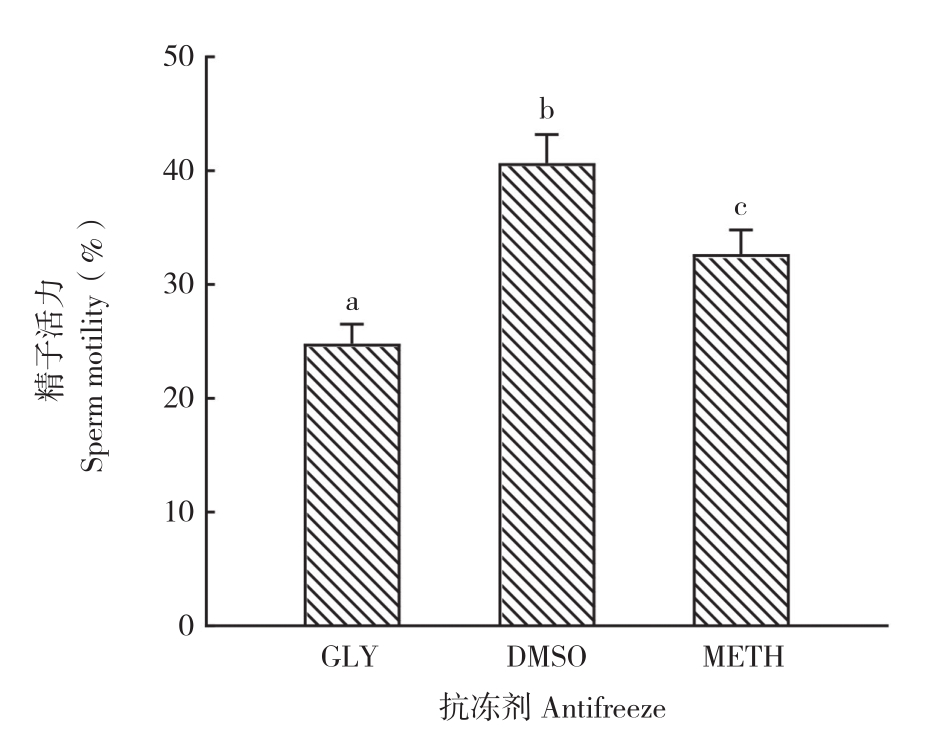
图2 不同抗冻剂对精液超低温冷冻保存效果的影响
Fig. 2 Effects of different antifreeze on ultra-low temperature cryopreservation of semen
柱上小写英文字母不同者表示差异显著Different lowercase letters on the bar chart represent significant differences

图3 不同体积分数DMSO对精液超低温冷冻保存效果的影响
Fig. 3 Effect of different volume fraction of DMSO on ultra-low temperature cryopreservation of semen
柱上小写英文字母不同者表示差异显著Different lowercase letters on the bar chart represent significant differences
2.3 不同稀释比对精液超低温冷冻保存效果的影响
将精液与稀释液Ⅳ以1∶1、1∶2、1∶3、1∶ 4、1∶5、1∶ 6、1∶7和1∶8体积比混合,DMSO(终浓度10%)为抗冻剂,比较不同稀释比例对大鳞副泥鳅精液的冷冻保存效果。结果(图4)显示,精液与稀释液以1∶3比例混合对精液的冷冻保存效果最好,精子活力达到65.4(±2.3)%;以1∶8比例混合对精液的冷冻保存效果最差,精子活力仅为17.4(±2.0)%。
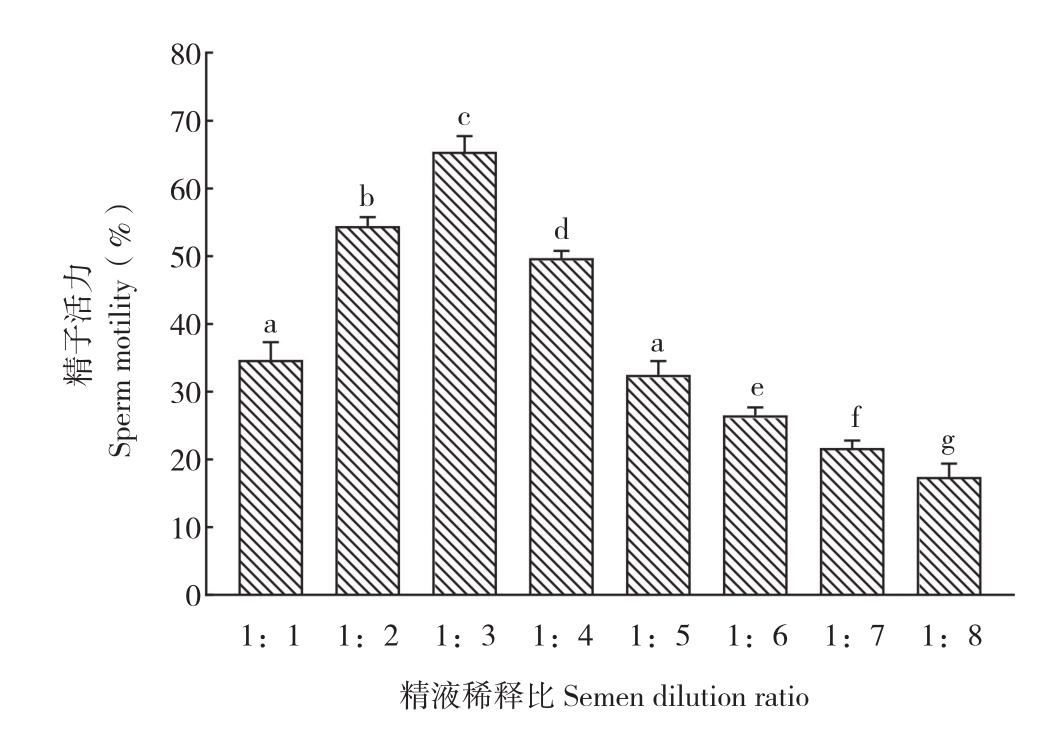
图4 不同稀释比对精液超低温冷冻保存效果的影响
Fig. 4 Effect of different dilution ratio on ultra-low temperature cryopreservation of semen
柱上小写英文字母不同者表示差异显著Different lowercase letters on the bar chart represent significant differences
3 讨论
3.1 精子超低温冷冻保存的稀释液选择
稀释液在精子超低温冷冻保存过程中能降低抗冻剂毒性,通过调节鱼类精浆中Na+、Ca2+、K+、Mg2+等离子浓度,从而影响精子细胞质渗透压、细胞兴奋性和精子的激活[18]。良好的稀释液可为精子提供合适的生理环境,延长其在体外存活时间和防止精子激活[9]。研究发现,稀释液Ⅰ、Ⅱ、Ⅲ分别在美洲鲥鱼、黄鳝(Monopterus albus)、蛇鮈(Saurogobio dabryi)的精子超低温保存中效果较好[9, 15, 16];稀释液Ⅳ对大银鱼(Protosalanx hyalocranius)[17]和虹鳟(Oncorhynchus mykiss)[19]精子的超低温保存效果较好;稀释液Ⅴ对大鳞副泥鳅[12]的精子超低温保存具有一定效果,由于检测标准不同,故无法对两者保存效果进行比较。本研究统一检测标准,比对不同精液稀释比,检测精子活力,结果显示,稀释液Ⅳ用于大鳞副泥鳅精液超低温冷冻保存,冻精活力较高,可能大鳞副泥鳅与大银鱼和虹鳟的精浆成分和渗透压较为接近,表明稀释液Ⅳ可为这些鱼类提供合适的生理环境。
3.2 精子超低温冷冻保存的抗冻剂选择
渗透性抗冻剂通过调节精子细胞渗透压降低精子的冰点,减少冰晶对精子的损伤起到保护作用。不同鱼类最适抗冻保护剂的种类不同[20]。GLY和METH作为抗冻剂分别适用于大黄鱼(Larimichthys crocea)[21]和河川沙塘鳢(Odontobutis potamophilus)[22]精子的超低温冷冻保存;DMSO作为抗冻剂在乌克兰鳞鲤[23]精液的超低温冷冻保存中效果较好。本研究发现5%~12.5% DMSO对大鳞副泥鳅精液冷冻保存的抗冻效果较好,其中10% DMSO保存效果最好,冻精活力可达54.6(±1.5)%。早期虽有报道显示7.5% DMSO用于大鳞副泥鳅精液超低温冷冻保存,冻精激活率为70%,但冻精活力较低[12],原因可能是稀释液和精液的稀释比例不同。也有学者认为DMSO作为抗冻剂,浓度应控制在5%~15%[24],与本研究结果相符。可见,DMSO适合于包括大鳞副泥鳅在内的多种鱼类精液的冷冻保存。
3.3 精子超低温冷冻保存的精液稀释比选择
在精子的超低温冷冻保存过程中,精液稀释比例也是影响冻精活力的重要因素。有学者认为,在淡水鱼中精液与抗冻液的稀释比例多在1∶9~1∶3之间[25];也有研究认为,对于多数淡水鱼类,其精液与稀释液的最佳稀释比例在1∶10~1∶2之间[26]。本研究结果表明,大鳞副泥鳅精液超低温冷冻保存最适的稀释比例为1∶3,这与前人研究结果一致。
4 结论
本研究优化了大鳞副泥鳅精液的超低温冷冻保存技术,对5种精液稀释液进行筛选,得到了大鳞副泥鳅精液的最佳稀释液Ⅳ,稀释液Ⅳ与3种不同抗冻剂搭配,筛选出效果最佳的抗冻剂为DMSO,并对其体积分数进行优化,得到最佳抗冻剂DMSO的最佳体积分数为10% ,进一步优化精液与最佳稀释液Ⅳ的体积比为1∶3。研究结果表明,使用稀释液Ⅳ为精液稀释液(精液与稀释液Ⅳ体积比为1∶3),终浓度10% DMSO为抗冻剂,对大鳞副泥鳅精液超低温冷冻保存的效果最佳,超低温精液冷冻后解冻精子,精子活力可达65.4(±2.3)%。本试验结果促使大鳞副泥鳅精液保存技术得到进一步完善,并为生产实际提供科学参考。
[1] 雷坤,谢业扬,马远雄,王邦杰,范道周,陆专灵,徐娣美,何有柯,韦友传.稻田养殖的大鳞副泥鳅出血病病原菌的分离鉴定与药敏试验[J]. 淡水渔业,2019,49(6):70-74. doi:10.13721/j.cnki.dsyy.2019.06.011.LEI K, XIE Y Y, MA Y X, WANG B J, FAN D Z, LU Z L, XU D M, HE Y K, WEI Y C. Isolation, identification and susceptibility testing of the causative agent of Paramisgurnus dabryanus disease in rice farming[J]. Freshwater Fisheries, 2019,49(6):70-74. doi:10.13721/j.cnki.dsyy.2019.06.011.
[2] 姚金明,陈秀梅,刘明哲,牛小天,单晓枫,王桂芹.饲料中添加虾青素对大鳞副泥鳅生长和体色的影响[J]. 饲料工业,2019,40(8):46-51. doi:10.13302/j.cnki.fi.2019.08.009.YAO J M, CHEN X M, LIU M Z, NIU X T, SHAN X F, WANG G Q.Effects of astaxanthin on growth and body color of Paramisgurnus dabryanus[J]. Feed Industry, 2019, 40(8): 46-51. doi:10.13302/j.cnki.fi.2019.08.009.
[3] 白晓慧,蔡超,郝爽,刘克明,刘义,李楠,焦万明,贾文平.大鳞副泥鳅5个野生群体的遗传多样性分析[J]. 基因组学与应用生物学,2019,38(7):2958-2965. doi:10.13417/j.gab.038.002958.BAI X H, CAI C, HAO S, LIU K M, LIU Y, LI N, JIAO W M, JIA W P.Genetic diversity analysis of five wild populations of Paramisgurnus dabryanus[J]. Genomics and Applied Biology, 2019,38(7):2958-2965. doi:10.13417/j.gab.038.002958.
[4] 张厚冰,苏应忠.沿江平原地区泥鳅野生资源状况调查[J]. 渔业致富指南,2020(4):15-19.ZHANG H B, SU Y Z. Survey on the wild resources of loach in the coastal plain region[J]. Fishery Guide to be Rich, 2020(4):15-19.
[5] 董家莲.泥鳅池塘高产养殖技术[J]. 畜牧兽医科学(电子版),2019(22):80-81.DONG J L. Loach pond high yield culture technology[J]. Graziery Veterinary Sciences(Electronic Version), 2019(22):88-81.
[6] 杨乔乔,安贤惠,韩迎亚,马臻,朱明,隆小华,李联泰.大鳞副泥鳅腐皮病病原菌及其拮抗菌的分离筛选[J]. 水产科学,2019,38(5):666-675. doi:10.16378/j.cnki.1003-1111.2019.05.012.YANG Q Q, AN X H, HAN Y Y, MA Z, ZHU M, LONG X H, LI L T.Isolation and screening of Paramisgurnus dabryanus canker pathogens and their antagonists[J]. Fisheries Science, 2019,38(5):666-675.doi:10.16378/j.cnki.1003-1111.2019.05.012
[7] 黄梦璐,王洁,王磊.我国鱼类精子超低温冷冻保存的研究进展[J].河南水产,2019(6):20-23.HUANG M L, WANG J, WANG L. Research progress on ultra-low temperature ryopreservation of fish spermatozoa in China[J]. Henan Fisheries, 2019(6):20-23.
[8] 夏良萍,陈梦婷,陈悦萍,徐丹丹,采克俊. 黄颡鱼精子超低温冷冻保存技术[J]. 江苏农业科学,2013,41(10):196-198. doi:10.15889/j.issn.1002-1302.2013.10.149.XIA L P, CHEN M T, CHEN Y P, XU D D, CAI K J. Ultra-low temperature cryopreservation of sperm from Pelteobagrus fulvidraco[J]. Jiangsu Agricultural Sciences, 2013, 41(10):196-198.doi:10.15889/j.issn.1002-1302.2013.10.149.
[9] 王明华,钟立强,陈友明,丁淑燕,秦钦,边文冀,蔡永祥,陈校辉.3种长江珍稀鱼类精子超低温冷冻保存的初步研究[J]. 中国农学通报,2015. 31(5):55-58.WANG M H, ZHONG L Q, CHEN Y M, DING S Y, QIN Q, BIAN W J, CAI Y X, CHEN X H. Preliminary study of ultra-low temperature cryopreservation of sperm from three rare Yangtze River fish species[J]. Chinese Agricultural Science Bulletin, 2015, 31(5):55-58.
[10] 史东杰,孙砚胜,孙向军,梁拥军,张欣,马峻峰. 缺帘鱼精子超低温保存的初步研究[J]. 吉林农业大学学报,2009, 31(4):467-471.doi:10.13327/j.jjlau.2009.04.025.SHI D J, SUN Y S, SUN X J, LIANG Y J, ZHANG X, MA J F.Preliminary study of ultra cryopreservation of sperm from curtaindeficient fish[J]. Journal of Jilin Agricultural University, 2009,31(4):467-471. doi:10.13327/j.jjlau.2009.04.025.
[11] 程顺,顾志敏,刘士力,蒋文枰,迟美丽,贾永义. 翘嘴鲌精子生理特性及超低温冷冻的研究[J]. 江苏农业科学,2019, 47(7):175-179. doi:10.15889/j.issn.1002-1302.2019.07.042. doi:10.15889/j.issn.1002-1302.2019.07.042.CHENG S, GU Z M, LIU S L, JIANG W P, CHI M L, JIA Y Y. Study on the physiological characteristics of bleak bleak-eyed sperm and ultralow temperature freezing[J]. Jiangsu Agricultural Sciences, 2019, 47(7):175-179. doi:10.15889/j.issn.1002-1302.2019.07.042.
[12] 陈兵,大鳞副泥鳅精液超低温保存[J]. 武汉大学学报(自然科学版),1991(4):127-130. doi:10.14188/j.1671-8836.1991.04.007.CHEN B, The ultra-low temperature preservation of loach(Paramisgurnus debryanus Sanvage)[J]. Journal of Wuhan University(Natural Science Edition), 1991(4):127-130.doi:10.14188/j.1671-8836.1991.04.007.
[13] 万全,李飞,王冰.5种配方和5种糖类对大鳞副泥鳅精子保存效果的研究[J]. 水生态学杂志,2009, 30(5):85-89. doi:10.15928/j.1674-3075.2009.05.031.WAN Q, LI F, WANG B. Study on the effect of 5 formulations and 5 sugars on the preservation of sperm of Paramisgurnus dabryanus[J].Journal of Hydroecology, 2009, 30(5):85-89. doi:10.15928/j.1674-3075.2009.05.031.
[14] 李诗兵,雷浩兵. 猪人工授精技术问答(上)[J]. 当代畜牧,2007(10):42-43.LI S B, LEI H B. Questions and answers on the technology of artificial insemination in pigs(part I)[J]. Contemporary Animal Husbandry,2007(10):42-43.
[15] 苟兴能. 黄鳝精子保存液的初步研究[J]. 科学养鱼,2008(11):40-41.GOU X N. Preliminary study of sperm preservation solution for eel[J].Scientific Fish Farming, 2008,(11):40-41.
[16] 丁淑荃,万全,李飞,许进进,潘冬冬. 蛇鮈精子保存液的筛选及其效果研究[J]. 生物学杂志,2012,29(6):62-64.DING S Q, WAN Q, LI F, XU J J, PAN D D. Screening of minnow sperm preservation solution and its effect[J]. Journal of Biology, 2012, 29(6):62-64.
[17] 连晋,雷普勋,刘忠松. 精子保存方法在大银鱼人工繁殖中的应用研究[J]. 科学养鱼,2001(1):34.LIAN J, LEI P X, LIU Z S. A study on the application of sperm preservation methods in the artificial reproduction of large silverfish[J]. Scientific Fish Farming, 2001(1):34.
[18] COSSON J. The ionic and osmotic factors controlling motility of fish spermatozoa[J]. Aquaculture International, 2004, 12(1):69-85.doi:10.1023/B:AQUI.0000017189.44263.bc.
[19] 连晋,王拴文. 虹鳟精子液态低温保存方法[J]. 淡水渔业,1999(12):16-17.LIAN J, WANG S W. Liquid cryopreservation method for rainbow trout sperm[J]. Freshwater Fisheries, 1999(12):16-17.
[20] 柴龙会,黄璞祎,暴旭.葛氏鲈塘鳢耐受完全结冰缺氧环境的能力及生理生化响应[J]. 大连海洋大学学报,2020,35(2):218-222.doi:10.16535/j.cnki.dlhyxb.2019-068.CHAI L H, HUANG P Y, BAO X. Tolerance and physiological and biochemical response of Grussian perch in snakehead mudskipper to complete freezing anoxic environment[J]. Journal of Dalian Ocean University, 2020,35(2):218-222. doi:10.16535/j.cnki.dlhyxb.2019-068.
[21] 林丹军,尤永隆. 大黄鱼精子生理特性及其冷冻保存[J]. 热带海洋学报,2002(4):69-75.LIN D J, YOU Y L. Physiological characteristics of rhubarb sperm and their cryopreservation[J]. Tropic Oceanology, 2002(4):69-75.
[22] 程顺,迟美丽,顾志敏,贾永义,刘士力,蒋文枰,王雨辰.河川沙塘鳢精子质量的影响因素及其精子超低温冷冻[J]. 中国畜牧杂志,2018,54(6):69-74. doi:10.19556/j.0258-7033.2018-06-069.CHENG S, CHI M L, GU Z M, JIA Y Y, LIU S L, JIANG W P, WANG Y C. Factors affecting sperm quality of Ophiocephalus Argus and its cryopreservation[J]. Chinese Journal of Animal Science, 2018,54(6):69-74. doi:10.19556/j.0258-7033.2018-06-069.
[23] 马林,李楠,郝爽,吴会民,姜巨峰,刘克明,白晓慧,刘肖莲,李春艳,尤宏争.乌克兰鳞鲤精子超低温冷冻保存方法研究[J]. 水产科学,2019,38(4):473-478. doi:10.16378/j.cnki.1003-1111.2019.04.006.MA L, LI N, HAO S, WU H M, JIANG J F, LIU K M, BAI X H, LIU X L,LI C Y, YOU H J. Method of ultra-low temperature cryopreservation of Ukrainian common carp spermatozoa[J]. Fisheries Science, 2019,38(4):437-478. doi:10.16378/j.cnki.1003-1111.2019.04.006.
[24] 张崇英,陈脊宇,周亚,李文娟,薛小腧.胭脂鱼(Myxocyprinus asiaficus)精液超低温冷冻保存及酶活性测定[J]. 基因组学与应用生物学,2020,39(4):1556-1564. doi:10.13417/j.gab.039.001556.ZHANG C Y, CHEN J Y, ZHOU Y, LI W J, XUE X S. Ultra-low temperature cryopreservation and enzyme activity assay of rouge(Myxocyprinus asiaficus)semen[J]. Genomics and Applied Biology, 2020,39(4):1556-1564. doi:10.13417/j.gab.039.001556.
[25] 王鑫伟,史应学,竺俊全,王建平.光唇鱼精子的超低温冷冻保存及酶活性检测[J]. 农业生物技术学报,2017,25(4):639-649.doi:10.3969/j.issn.1674-7968.2017.04.014.WANG X W, SHI Y X, ZHU J Q, WANG J P. Ultralow-temperature cryopreservation and enzyme activity assay of spermatozoa of the bald-lip fish[J]. Journal of Agricultural Biotechnology, 2017,25(4):639-649. doi:10.3969/j.issn.1674-7968.2017.04.014.
[26] TIERSCH T R, YANG H, JENKINS J A. Sperm cryopreservation in fish and shellfish[J]. Society of Reproduction and Fertility supplement,2007, 65:493-508.