【研究意义】锰是作物必需营养元素,但过量锰对作物有害[1-4]。近年来,广西、广东主要蔗区均发生严重的幼苗锰毒黄化问题[5-7]。锰毒问题已对我国蔗糖产业可持续发展构成了严重的威胁[5-6],解决甘蔗锰毒问题对我国蔗糖产业可持续发展有重要意义。【前人研究进展】氮素形态是影响植物对锰吸收和毒害的重要因素,但氮源的影响因植物种类或品种不同结果可能截然不同。以菠菜为材料,刘备[8]研究发现铵态氮可抑制菠菜对锰等元素的吸收,张西科等[9]研究发现硝态氮为氮源甜瓜锰毒害较强,而Horst等[10]研究发现硝态氮为氮源减轻了豇豆的锰毒害。Hustedet等[11]研究发现硝态氮为氮源的小麦较铵态氮氮源积累更多的锰,而刘蒙蒙等[12]研究发现施用铵态氮后小麦积累更多的锰而施用硝态氮有利于锰向籽粒转移。本实验室前期研究发现,氮源也影响甘蔗对锰的吸收[13]。然而,氮源对甘蔗锰毒害的影响尚未详细报道。【本研究切入点】在锰毒胁迫下甘蔗对锰的吸收、锰在植株中的分配及叶片光合作用是否受到不同氮源的影响。【拟解决的关键问题】铵态氮源是否有利于克服甘蔗锰毒黄化。
1 材料与方法
1.1 试验材料
供试甘蔗品种为桂糖32号,参照武欣等[14]的方法育苗。
1.2 试验方法
试验于2019年4—11月在广西大学亚热带农业生物资源保护与利用国家重点实验室温室中进行。选长势一致的甘蔗幼苗根系浸入至不加氮(对照)、1.0 mmol/L NaNO3(硝态氮,NO3-)、1.0 mmol/L NH4Cl(铵态氮,NH4+)和不同浓度MnCl2(锰)溶液中培养,基础营养液为1/5霍格兰(不含氮)营养液(pH 5.5)。试验采用完全随机区组设计,每个处理3次重复。
为探究氮源对锰引起的甘蔗幼苗黄化的影响,将上述准备的甘蔗幼苗浸入到缺氮(CK)或含不同氮源(NO3- 1.0 mmol/L,NH4+ 1.0 mmol/L)和MnCl2(0.5 mmol/L)溶液中培养0、8、12、17、21 d后分别测定+1叶叶绿素含量,且在培养11 d后测定+1叶光合特性和光合荧光特性指标,培养后17 d拍照记录幼苗生长和叶片黄化状况;在不同氮源和0、0.1、0.2 mmol/L MnCl2溶液培养17 d后,测定植株生物产量及根系、新叶片(+1叶和0叶)、老叶片、新叶鞘和老叶鞘锰含量,计算植株对锰的吸收量、叶片/叶鞘锰含量比值、老叶/新叶锰含量比值;在不同氮源和0.5 mmol/L MnCl2溶液中培养0、2、4、8 d后,测定新叶细胞汁液锰含量及其占叶片中锰全量的比值。
1.3 测定项目及方法
采用便携式叶绿素含量测定仪(Konica Minolta)测定叶绿素含量,采用石墨消化(Pro D60,长沙基隆公司)消解-原子吸收分光光度计(PinAAcle 900T,美国铂金埃尔默公司)火焰法测定锰含量,采用光合作用测定仪(LI-6400XT,美国LI-COR公司)测定光合速率,采用叶绿素荧光(PAM-2500,德国WALZ公司)测定叶绿素荧光参数,参照Sasaki等[15]的方法分离细胞汁液。
试验数据采用Duncan新复极差法进行差异显著性测验。
2 结果与分析
2.1 氮源对甘蔗幼苗生长的影响
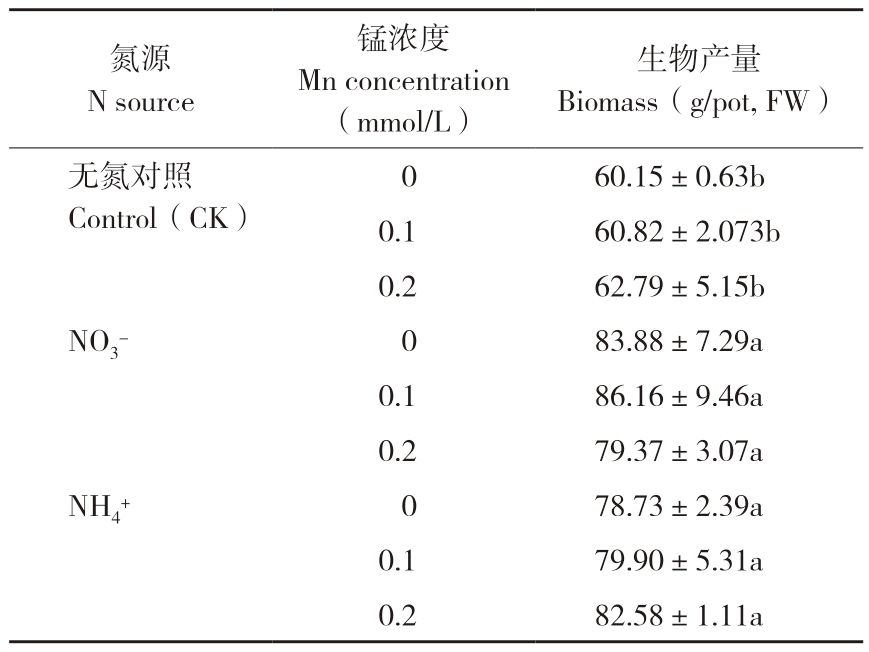
由表1可知,在无氮(CK)培养液中加入硝酸盐(NO3-)或铵盐(NH4+)后甘蔗生物产量显著提高,且铵态氮和硝态氮对甘蔗生物产量的影响相似,0、0.1、0.2 mmol/L MnCl2溶液中以硝酸盐和铵盐作氮源处理的生物产量差异不显著。
2.2 氮源对甘蔗植株锰吸收和叶片锰含量的影响
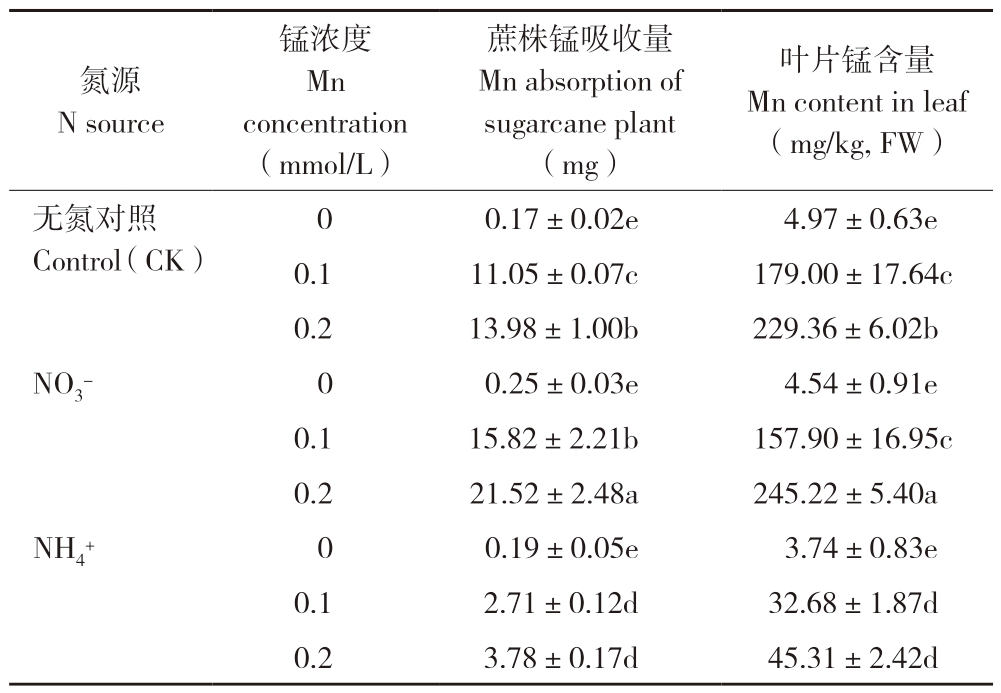
在锰毒胁迫下甘蔗植株对锰的吸收量显著增加,然而,不同氮源处理的植株对锰的吸收量不同。从表2可以看出,锰浓度为0.1 mmol/L时,以硝态氮和铵态氮作氮源的蔗株锰吸收量分别为15.82、2.71 mg;锰浓度为0.2 mmol/L时,铵态氮作氮源的蔗株锰吸收量(3.78 mg)仅为硝态氮作氮源(21.52 mg)的17.6%,说明铵态氮显著抑制甘蔗对锰的过量吸收。
表1 氮源对甘蔗幼苗生物产量的影响
Table 1 Effects of N sources on biomass of sugarcane seedlings
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after the data in the same column represent significant differences.
生物产量Biomass(g/pot, FW)无氮对照Control(CK)氮源N source锰浓度Mn concentration(mmol/L)60.15±0.63b 0.1 60.82±2.073b 0.2 62.79±5.15b NO3- 0 83.88±7.29a 0.1 86.16±9.46a 0.2 79.37±3.07a NH4+ 0 78.73±2.39a 0.1 79.90±5.31a 0.2 82.58±1.11a 0
在培养液中加入氯化锰使甘蔗叶片锰含量显著增加(表2)。0.1、0.2 mmol/L锰处理下,以硝酸盐作氮源的叶片锰含量分别为157.90、245.22 mg/kg,而以铵盐作氮源的叶片锰含量分别为32.68、45.31 mg/kg,后者仅相当于前者的20.7%和18.5%,且铵态氮作氮源的叶片锰含量也显著低于缺氮处理(CK)。表明培养液中的铵态氮能有效降低蔗株锰含量。
表2 氮源对甘蔗植株锰吸收量及叶片锰含量的影响
Table 2 Effects of N sources on Mn absorption of sugarcane plants and Mn content in leaves
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after data in the same column represent significant differences.
叶片锰含量Mn content in leaf(mg/kg, FW)无氮对照Control(CK)氮源N source锰浓度Mn concentration(mmol/L)蔗株锰吸收量Mn absorption of sugarcane plant(mg)0.17±0.02e 4.97±0.63e 0.1 11.05±0.07c 179.00±17.64c 0.2 13.98±1.00b 229.36±6.02b NO3- 0 0.25±0.03e 4.54±0.91e 0.1 15.82±2.21b 157.90±16.95c 0.2 21.52±2.48a 245.22±5.40a NH4+ 0 0.19±0.05e 3.74±0.83e 0.1 2.71±0.12d 32.68±1.87d 0.2 3.78±0.17d 45.31±2.42d 0
2.3 氮源对甘蔗叶片锰分配的影响
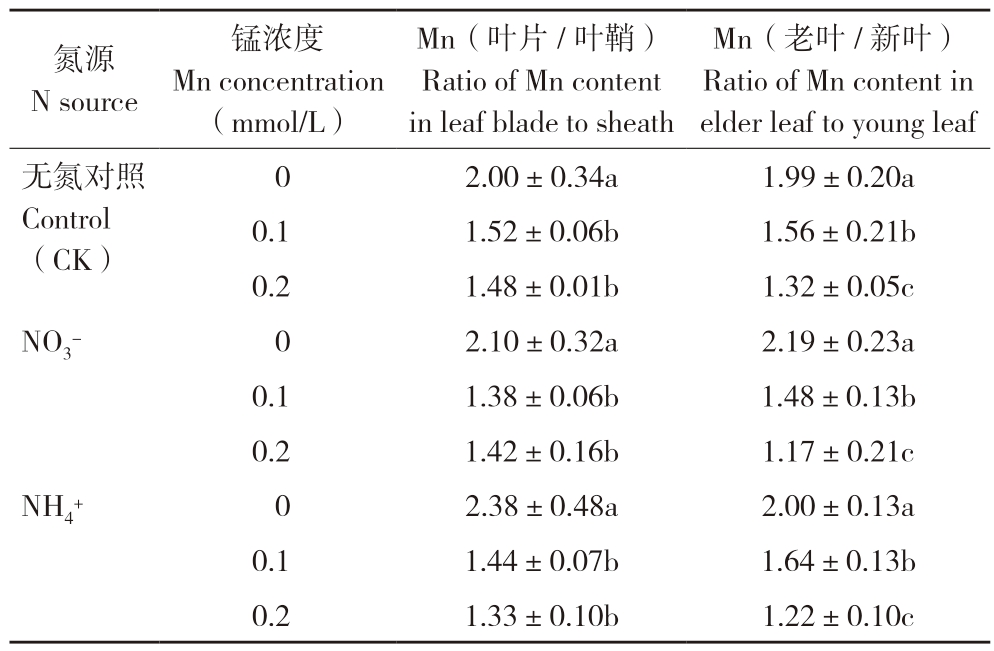
由表3可知,在锰(0.1、0.2 mmol/L)胁迫处理下,甘蔗老叶和新叶锰含量的比值显著降低,但不同氮源处理间的差异不显著,以硝态氮作氮源的比值分别为1.64和1.17,而以铵态氮作氮源的比值分别为1.48和1.22;新叶的叶片和叶鞘锰含量的比值在不同氮源处理间差异也不显著,叶片/叶鞘锰含量的比值介于1.33~1.52之间。
由表4可知,新叶细胞汁液中分配的锰含量占新叶锰全量的42.0%~71.2%,但此占比随着处理时间(2~8 d)延长而减少,处理后4、8 d以硝态氮作氮源的锰含量占比分别为51.3%和48.4%,与铵态氮作氮源的占比(53.3%,47.0%)相近。说明氮源不影响锰在叶片及其细胞汁液中的分配。
表3 氮源对甘蔗叶片锰分配的影响
Table 3 Effect of N sources on the distribution of Mn in sugarcane leaves
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after the data in the same column represent significant differences.
氮源N source锰浓度Mn concentration(mmol/L)Mn(叶片/叶鞘)Ratio of Mn content in leaf blade to sheath Mn(老叶/新叶)Ratio of Mn content in elder leaf to young leaf 2.00±0.34a 1.99±0.20a 0.1 1.52±0.06b 1.56±0.21b 0.2 1.48±0.01b 1.32±0.05c NO3- 0 2.10±0.32a 2.19±0.23a 0.1 1.38±0.06b 1.48±0.13b 0.2 1.42±0.16b 1.17±0.21c NH4+ 0 2.38±0.48a 2.00±0.13a 0.1 1.44±0.07b 1.64±0.13b 0.2 1.33±0.10b 1.22±0.10c无氮对照Control(CK)0
表4 氮源对锰在甘蔗叶片细胞汁液中分配的影响
Table 4 Effects of N sources on Mn distribution in cell saps of sugarcane leaves
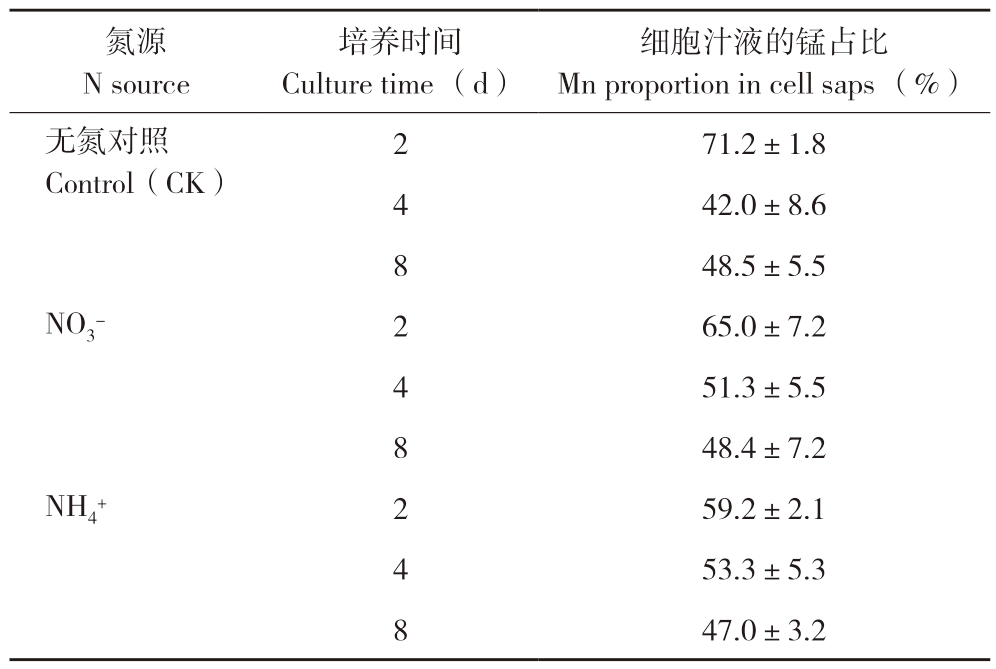
细胞汁液的锰占比Mn proportion in cell saps (%)无氮对照Control(CK)氮源N source培养时间Culture time (d)71.2±1.8 4 42.0±8.6 8 48.5±5.5 NO3- 2 65.0±7.2 4 51.3±5.5 8 48.4±7.2 NH4+ 2 59.2±2.1 4 53.3±5.3 8 47.0±3.2 2
2.4 氮源对锰引起的甘蔗叶片黄化的影响
研究发现,过多的锰可诱导甘蔗幼叶黄化[7]。由图1可知,0.5 mmol/L锰处理后17 d,以硝态氮作氮源的甘蔗幼叶明显黄化,而以铵态氮作氮源的幼叶叶色浓绿、无明显黄化现象。由图2可知,锰胁迫下以硝态氮作氮源的蔗株叶片的叶绿素含量(SPAD值)随处理时间(0~17 d)加长而逐渐降低,而以铵态氮作氮源的蔗株叶片SPAD值无显著变化;锰胁迫处理后9~17 d以铵态氮作氮源的叶片SPAD值均有高于硝态氮作氮源的趋势。这些结果说明铵态氮有利于减轻锰引起的甘蔗叶片黄化。

图1 氮源对锰引起甘蔗幼苗黄化的影响
Fig.1 Effects of N sources on Mn-induced chlorosis in sugarcane seedlings

图2 氮源对甘蔗幼苗叶片SPAD值的影响
Fig.2 Effect of nitrogen source on SPAD value of sugarcane seedling leaves
小写英文字母不同者表示差异显著
Different lowercase letters represent significant differences
2.5 氮源对甘蔗叶片光合特性的影响
由表5可知,锰胁迫下,对照、硝态氮、铵态氮处理的甘蔗幼苗的光合速率分别为16.73、24.76、28.80 μmol/m2·s,铵态氮源的光合速率显著高于硝态氮源的植株;铵态氮处理的蒸腾速率(9.64 mmol/m2·s)也显著高于硝态氮(8.37 mmol/m2·s)和对照;不同氮源处理间气孔导度的差异不显著。可见,在锰胁迫下,铵态氮处理有利于提高甘蔗幼苗的光合速率和蒸腾速率。
表5 氮源对甘蔗幼苗光合特性的影响
Table 5 Effects of N sources on photosynthetic characteristics of sugarcane seedlings
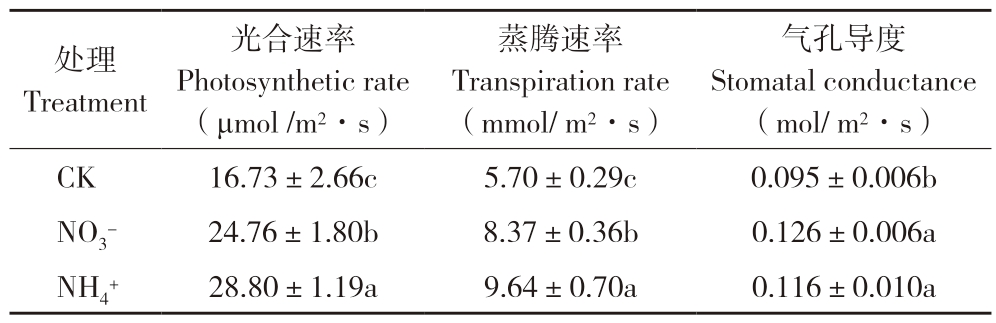
注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after data in the same column represent significant differences.
气孔导度Stomatal conductance(mol/ m2·s)CK 16.73±2.66c 5.70±0.29c 0.095±0.006b NO3- 24.76±1.80b 8.37±0.36b 0.126±0.006a NH4+ 28.80±1.19a 9.64±0.70a 0.116±0.010a处理Treatment光合速率Photosynthetic rate(μmol /m2·s)蒸腾速率Transpiration rate(mmol/ m2·s)
2.6 氮源对甘蔗叶片光合荧光特性的影响
实际光合效率(YII为任一光照状态下PSⅡ的实际量子产量,光化学淬灭系数qP反映了光合活性的高低,而调节性能量耗散的量子产量YNPQ是光保护的重要指标。Fv/Fm表示PSⅡ最大量子产量,反映植物的潜在最大光合能力。锰胁迫下,铵态氮处理YII和qP显著高于硝态氮处理和对照,相反,铵态氮处理的YNPQ和Fv/Fm显著低于硝态氮;另一方面,不同处理间植物接受的光强过剩pN和非调节性能量耗散的量子产量YNO差异不显著,表明植株受到的光损伤程度相似(表6)。这说明在锰胁迫下铵态氮处理的甘蔗幼苗有较强的光合活性。
3 讨论
在酸性土壤中,锰毒是限制植物生长发育最重要的因素之一。过量的锰可诱导甘蔗叶片黄化[5,16-17]。本研究发现,在锰胁迫下铵态氮源可有效抑制锰引起的甘蔗幼苗黄化。虽然短期处理后氮源处理间幼苗的生物产量差异不显著,但铵态氮处理的叶片叶绿含量显著高于硝态氮处理,叶色肉眼可见明显较硝态氮处理的浓绿。
不同氮源处理会影响植物对锰的吸收。水培溶液中的铵态氮对菠菜锰的吸收有一定的抑制作用[8],硝态氮处理较铵态氮处理使小麦积累更多的锰[11]。本研究发现,在锰胁迫下铵态氮源可以有效的降低甘蔗对锰的吸收,叶片中锰的含量也显著降低。然而,在锰胁迫下氮源并不影响锰在地上部分的分配,不同氮源处理甘蔗幼苗叶片与叶鞘锰的比值、新叶与老叶锰的比值、锰在叶片细胞汁液中的分配比均无显著差异。可见,铵态氮有效抑制甘蔗幼苗对锰的吸收、降低叶片锰含量,并从而减轻叶片黄化。
表6 氮源对甘蔗叶片光合荧光特性的影响
Table 6 Effects of N sources on photosynthetic fluorescence characteristics of sugarcane leaves

注:同列数据后小写英文字母不同者表示差异显著。
Note: Different lowercase letters after the data in same column represent significant differences.
处理Treatment YII qP YNPQ Fv/Fm qN YNO CK 0.353±0.016b 0.554±0.046b 0.228±0.010a 0.729±0.005 0.422±0.061 0.408±0.024 NO3- 0.360±0.013b 0.572±0.039b 0.230±0.023a 0.727±0.012 0.469±0.056 0.411±0.033 NH4+ 0.429±0.025a 0.682±0.042a 0.168±0.006b 0.706±0.005 0.398±0.023 0.404±0.027
高锰处理下空心莲子草叶片叶绿素含量与对照相当,对原初反应伤害不大,但是导致电子传递受阻,叶片实际光化学效应与电子传递速率降低,进而抑制空心莲子草的光合作用[18]。在锰毒胁迫下,甘蔗幼苗的光合速率也受显著抑制[19]。高锰浓度处理后杉木幼苗叶片叶绿素荧光参数下降[20]。本研究也发现,在锰胁迫下铵态氮处理的甘蔗叶片的光合速率和蒸腾速率均高与硝态氮处理。铵态氮处理的叶片光合活性也高于硝态氮处理。可见,在锰胁迫下培养液中铵态氮有利于提高甘蔗的光合作用。
4 结论
本研究结果表明,0~17 d短期锰毒胁迫虽然对甘蔗植株的生物产量的影响不显著,但显著增加植株对锰的吸收量和叶片锰含量并降低叶片叶绿素含量,导致幼叶黄化;氮源对甘蔗幼苗锰毒黄化有强烈影响,锰胁迫下硝态氮为氮源的植株,叶片SPAD值随锰处理时间加长而显著降低并出现叶片黄化症状;铵态氮为氮源的植株,锰处理对SPAD值的影响不显著;锰胁迫下,铵态氮为氮源的植株锰吸收量、叶片锰含量显著低于硝态氮的植株而叶片光合速率、蒸腾速率、光合活性高于硝态氮的植株。可见,生长介质中的铵盐有利于减轻甘蔗幼苗的锰毒黄化。
[1] DONCHEVA S N, POSCHENRIEDER C, STOYANOVA Z L,GEORGIEVA K, VELICHKOVA M, BARCELO J.Silicon amelioration of manganese toxicity in Mn-sensitive and Mn-tolerant maize varieties[J].Environmental Botany, 2009, 65:189-197.doi: 10.1016/j.envexpbot.2008.11.006.
[2] HUE N V, SILVA J A, UEHARA G.Managing manganese toxicity in former sugarcane soils on Oahu[J].Soil and Crop Management,1998, 6:1-7.
[3] MORA M L, ROSAS A, RIBERA A, RENGEL Z.Differential tolerance to Mn toxicity in perennial ryegrass genotypes: involvement of antioxidative enzymes and root exudation of carboxylates[J].Plant Soil, 2009, 320:79-89.doi: 10.1007/s11104-008-9872-1.
[4] REICHMAN S M, MENZIES N W, ASHER C J, MULLIGAN D R.Seedling responses of four Australian tree species to toxic concentrations of manganese in solution culture[J].Plant Soil, 2004,258:341-350.doi: 10.1023/b:plso.0000016564.14512.eb.
[5] 龙光霞,黄渝岚,何红,唐新莲,赵国梅,蒋立序,黎晓峰.甘蔗幼苗失绿的土壤营养特性初探[J].南方农业学报,2011, 42(8): 931-934.doi: 10.3969/j.issn.2095-1191.2011.08.025.LONG G X, HUANG Y L, HE H, TANG X L, ZHAO G M, JIANG L X, LI X F.Characterizing nutrient status of soils causing chlorosis in sugarcane seedlings[J].Journal of Southern Agriculture, 2011, 42(8): 931-934.doi: 10.3969/j.issn.2095-1191.2011.08.025.
[6] HUANG Y L, YANG S, LONG G X, ZHAO Z K, LI X F.Manganese toxicity in sugarcane plantlets grown on acidic soils of Southern China[J].Plos One, 2016, 11(3):e0148956.doi: 10.1371/journal.pone.0148956.
[7] 吴星,黄渝岚,杨曙,赵尊康,黎晓峰.锰胁迫对甘蔗幼苗缺铁和失绿的影响[J].广西植物,2015,35(6):863-867.doi: 10.11931/guihaia.gxzw201406027.WU X, HUANG Y L,YANG S, ZHAO Z K, LI X F.Impact of manganese stress on chlorosis and iron-deficiency in sugarcane seedlings[J].Guihaia, 2015, 35(6): 863-867.doi: 10.11931/guihaia.gxzw201406027.
[8] 刘备.不同形态氮配比及包膜控释肥对几种蔬菜产量品质的影响[D].泰安: 山东农业大学,2015.LIU B.Effects of different ratios of nitrogen forms and coated controlled-release fertilizers on yield and quality of several vegetables[J].Taian: Shandong Agricultural University, 2015.
[9] 张西科,张福锁,毛达如.植物锰中毒研究进展[J].土壤学进展,1994, 22(5):13-31.ZHANG X K, ZHANG F S, MAO D R.Advances in the study of plant manganese poisoning[J].Progress in Soil Science, 1994, 22(5):13-31.
[10] HORST W J, FECHT M, NAUMANN A, WISSEMEIER A.Physiology of manganese toxicity and tolerance in Vigna unguiculata(L)Walp[J].Journal of Plant Nutrition and Soil Science, 1999, 162(3):263-274.doi: 10.1002/(SICI)1522-2624(199906)162:33.0.CO;2-A.
[11] HUSTED S, THOMSEN M U, MATTSSON M, SCHJOERRING J K.Influence of nitrogen and sulphur form on manganese acquisition by barley(Hordeum vulgare)[J].Plant Soil, 2005, 268: 309-317.doi:10.1007/s11104-004-0317-1.
[12] 刘蒙蒙,王宜伦,韩燕来,苗玉红,谭金芳.施用不同形态的氮素对小麦产量及锰素积累的影响[J].江西农业学报,2012, 24(5): 94-96.doi: 10.3969/j.issn.1001-8581.2012.05.031.LIU M M, WANG Y L ,HAN Y L, MIAO Y H, TAN J F.Effects of nitrogen application on wheat yield and manganese accumulation[J].Acta Agriculturae Jiangxi, 2012, 24(5): 94-96.doi: 10.3969/j.issn.1001-8581.2012.05.031.
[13] 于华,陈杨明珠,黎晓峰.氮素形态对甘蔗锰毒黄化的影响[J].西南农业学报,2018,31(9): 1821-1824.doi:10.16213/j.cnki.scjas.2018.9.010.YU H, CHEN Y M Z, LI X F.Effects of nitrogen forms on excessive Mn-induced chlorosis in sugarcane[J].Southwest China Journal of Agricultural Sciences, 2018,31(9): 1821-1824.doi:10.16213/j.cnki.scjas.2018.9.010.
[14] 武欣,陈杨明珠,凌桂芝,黎晓峰.生长素萘乙酸对甘蔗锰毒的调控[J].广东农业科学,2018, 45(5): 14-18.doi: 10.16768/j.issn.1004-874X.2018.05.003.WU X, CHEN Y M Z, LING G Z, LI X F.Regulation of NAA on sugarcane manganese toxicity[J].Guangdong Agricultural Sciences,2018,45(5):14-18.doi: 10.16768/j.issn.1004-874X.2018.05.003.
[15] SASAKI A, YAMAJI N, XIA J X, MA J F.OsYSL6 is involved in the detoxification of excess in rice[J].Plant Physiology, 2011,157(4):1832-40.doi:10.1104/pp.111.186031.
[16] 杨曙,吴星,黄渝岚,赵尊康,黎晓峰.高锰诱导甘蔗幼苗缺铁的成因分析[J].广东农业科学,2015,42(10):16-20.doi: 10.16768/j.issn.1004-874X.2015.10.016.YANG S, WU X, HUANG Y L, ZHAO Z K, LI X F.Cause of iron deficiency of sugarcane seedlings induced by high manganese[J].Guangdong Agricultural Sciences, 2015,42(10):16-20.doi:10.16768/j.issn.1004-874X.2015.10.016.
[17] YANG S, YI K, CHANG M M, LING G Z, ZHAO Z K, LI X F.Sequestration of Mn into the cell wall contributes to Mn tolerance in sugarcane(Saccharum officinarum L.)[J].Plant Soil, 2019,436:475-487.doi: 10.1007/s11104-019-03937-x.
[18] 朱金文.高锰胁迫下空心莲子草的生理生化特性和草甘膦耐性研究[D].杭州:浙江大学,2008.ZHU J W.Physiological and biochemical characteristics and glyphosate tolerance of alligator weed(Alternanthera philoxeroides)under manganese stress[D].Hangzhou: Zhejiang University, 2008.
[19] 周攀,黎晓峰.锰毒胁迫下甘蔗生长、膜脂氧化及叶绿素荧光特性[J].广西农学报,2018,33(2):4-7,11.doi: 10.3969/j.issn.1003-4374.2018.02.004.ZHOU P, LI X F.Growth, membrane lipid oxidation and chlorophyll fluorescence characteristics of sugarcane under manganese stress[J].Journal of Guangxi Agriculture, 2018, 33(2):4-7,11.doi: 10.3969/j.issn.1003-4374.2018.02.004.
[20] 孙玉青.铝、锰、钙复合作用对杉木幼苗叶绿素含量、荧光特性及养分吸收的影响[D].福州: 福建农林大学,2011.SUN Y C.Effects of aluminum, manganese and calcium on chlorophyll content, fluorescence characteristics and nutrient absorption of Chinese fir seedlings[D].Fuzhou: Fujian Agriculture and Forest University,2011.