【研究意义】茄子(Solanum melongena)属常异花作物,天然杂交率低,杂种优势明显。但是采用常规杂交育种选育一个新品种所需群体大、年限较长、耗费大量人力物力、品种更新换代慢。单倍体育种可以快速固定优良性状、缩短育种周期、获得纯合双单倍体,而且还方便用于诱变突变体离体选择和基因工程。获得植株单倍体的方法很多,如配子体的离体诱导[1-2]、远缘杂交[3]和单倍体诱导系[4]等,其中利用小孢子培养获得纯合双单倍体植株是常用、有效的方法之一。【前人研究进展】1996年,Miyoshi[5]研究发现在不含糖的培养基中,茄子小孢子在35℃条件下3 d完成脱分化。连勇等[6]利用KM培养基对茄子体细胞融合的杂种小孢子进行培养,获得大量再生植株。宋彦平等[7]以附加7.5%葡萄糖的KM培养基为基本培养基,对茄子杂交种单核靠边期小孢子进行游离培养试验获得愈伤组织,但不同基因型之间小孢子愈伤组织诱导率差异显著。朱朝辉等[8]采用不同培养基分段暗培养茄子游离小孢子方法获得愈伤组织。佟曦然等[9]研究发现,不同游离方式获得的茄子小孢子的发育途径不同,经挤压法获得的小孢子只形成愈伤组织,而采用自然散落法获得的小孢子则产生胚状体。范适等[10]研究结果显示,基因型对小孢子诱导频率影响大,对露地生长的花药进行变温处理有利于愈伤组织诱导。【本研究切入点】目前,关于茄子小孢子培养的研究主要集中在供体植株基因型、小孢子发育时期和预处理、植株生长环境、培养基种类和培养方式、细胞学观察等方面,但是二倍体茄子游离小孢子发育同步性差,小孢子愈伤组织诱导率低、难分化成苗等因素制约着该技术的广泛应用[11]。【拟解决的关键问题】本研究以二倍体茄子游离小孢子为材料,对影响小孢子发育同步性、愈伤组织诱导率、生长速度、活力、转绿率(成熟)、芽分化的若干因素进行研究,以期建立一个再生频率高的茄子游离小孢子再生体系,为茄子小孢子培养技术在育种中的广泛应用提供参考。
1 材料与方法
1.1 试验材料
试验于2016-2018年在福州市蔬菜科学研究所进行,供试材料为荷兰茄子品种HLB,采自本所试验基地。选取长势良好、无病虫害的植株取样,茄子小孢子的游离方法参考朱朝辉等[8]。
1.2 试验方法
1.2.1 不同培养方式对愈伤组织诱导的影响 (1)静止和振荡培养对愈伤组织诱导的影响。将游离出的茄子小孢子添加至N3液体培养基(参考朱朝辉等[8]进行改良)中25℃恒温培养,培养过程采用以下方式多次添加培养基:A0,不添加(CK);A1,直接添加;A2,先吸除部分原来培养基,再添加等体积新鲜培养基;A3,将原来培养基连同孢子、小愈伤组织一起均分两皿,添加相应体积新鲜培养基。培养方式为黑暗振荡培养(转速为80 r/min)和黑暗静止培养,每个处理设置10皿,培养8 d时统计愈伤组织数量,并观察其生长速度。
(2)培养基不同更换方式对愈伤组织诱导的影响。在黑暗静止培养条件下,比较多次添加N3培养基对愈伤组织诱导及生长的影响,设以下处理:B0,不添加培养基(CK);B1,直接添加等体积培养基;B2,先吸除部分培养基,再添加等体积N3培养基;B3,先平均分成2皿,再添加N3培养基至原体积。每个处理设置5皿,每皿5个愈伤组织,每隔8 d添加1次,共添加2次。培养8、16、24 d时(添加前)统计新生愈伤组织数量,并观察其生长速度,
1.2.2 愈伤组织大小及固液共培对其成活率和质量的影响 分别将长至1~2 mm、2~4 mm、>4 mm的愈伤组织接种至以下4种培养基中:M0(MS+0.8%琼脂+3%蔗糖+36 g/L甘露醇)培养基、M1(M0+1 mL N3)培养基、M2(M0+2 mL N3)培养基、M3(M0+3 mL N3)培养基。每个处理接种5皿,每皿接种5个同类型愈伤组织,培养20 d后统计愈伤组织成活率。
1.2.3 不同诱导时间及培养基类型对愈伤组织分化的影响 (1)不同诱导时间对愈伤组织分化的影响。将培养16、24、32 d诱导获得的>2 mm的愈伤组织转接至M2培养基上培养,每个时间段诱导的愈伤组织均接种5皿,每皿5个,培养50 d后统计成活率。(2)不同甘露醇质量浓度对愈伤组织转绿(成熟)的影响。将>2 mm的愈伤组织分别接种在添加0、18、36、54 g/L甘露醇的MS固体培养基中进行培养,每个处理接种30瓶,每瓶接种1个愈伤组织,培养50 d后统计转绿和变褐愈伤组织数量。(3)不同激素组合对愈伤组织芽分化的影响。将转绿愈伤组织接种于附加不同激素的MS固体培养基中进行芽分化试验,ZT、KT、NAA、IAA采用两两组合区组设计,共16个处理(表1),每个处理接种30瓶,每瓶接种1个愈伤组织,培养30 d后统计芽分化率。培养温度25(±1)℃,光照时间14 h/d,光强3 000~4 000 lx。
表1 茄子小孢子愈伤组织芽分化的试验设计
Table 1 Test design of bud differentiation of eggplant microspores callus
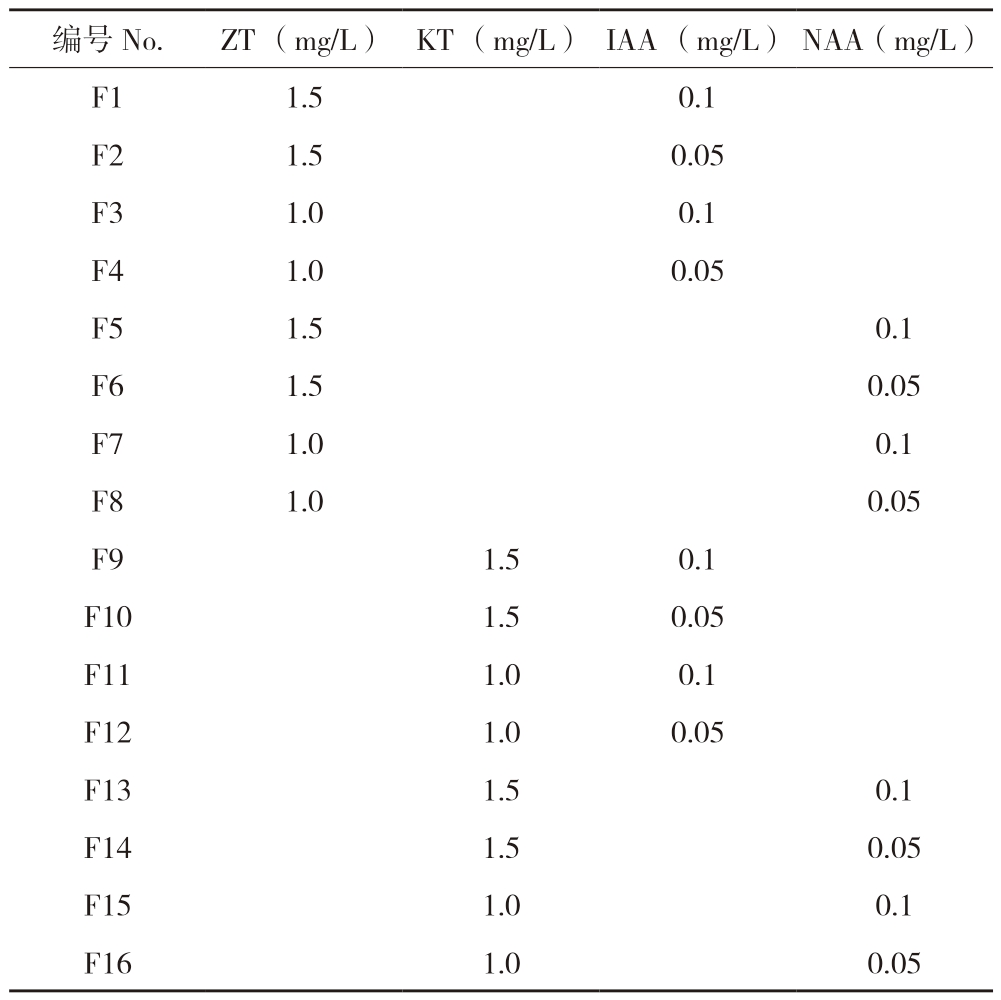
编号No.ZT (mg/L)KT (mg/L)IAA (mg/L)NAA (mg/L)F1 1.5 0.1 F2 1.5 0.05 F3 1.0 0.1 F4 1.0 0.05 F5 1.5 0.1 F6 1.5 0.05 F7 1.0 0.1 F8 1.0 0.05 F9 1.5 0.1 F10 1.5 0.05 F11 1.0 0.1 F12 1.0 0.05 F13 1.5 0.1 F14 1.5 0.05 F15 1.0 0.1 F16 1.0 0.05
1.2.4 再生植株倍性鉴定 从愈伤组织上分离2~3 cm的芽,转入生根培养基(MS+蔗糖30 g/L+琼脂7 g/L+NAA 5 mg/L+IAA 0.5 mg/L)中培养30 d分化出发达根系,形成完整植株。采用Accuri C6 Plus流式细胞仪鉴定再生植株的倍性。
试验数据采用Excel 2003进行统计分析,采用SPSS 17.0进行极差分析,采用Duncan’s法进行差异显著性检验。
2 结果与分析
2.1 不同培养方式对愈伤组织诱导的影响
2.1.1 静止和振荡培养对愈伤组织诱导的影响 静止培养和振荡培养对愈伤组织诱导和生长影响较大。振荡培养条件下,不同处理间新生愈伤组织数量差异不显著,平均0.2~0.6个/皿,且生长速度较快;静止培养条件下,A1、A2、A3处理诱导的愈伤组织数量达3.2~3.8个/皿,显著高于A0处理,且生长速度较快,A0处理诱导的愈伤组织数量为1.4个/皿(表2),其生长速度较慢。此结果显示,静止培养有利于茄子愈伤组织诱导,振荡培养有利于愈伤组织生长。
2.1.2 培养基不同更换方式对愈伤组织诱导的影响 在静止培养条件下,N3培养基的不同更换方式和更换时间对茄子愈伤组织诱导率产生了显著影响。第1次添加后,B0处理中愈伤组织生长缓慢,新增愈伤组织数量显著低于B1、B2、B3处理。B1、B2、B3处理中愈伤组织的生长速度和新生愈伤组织数量差异均不明显,表现愈伤组织生长快,平均每皿新生愈伤组织3.3~3.6个。第2次添加后,不同处理新生愈伤组织数量差异较大,B2和B3处理间差异不显著,分别有3.6、3.4个/皿,但显著高于B0(0.4个/皿)和B1(0.8个/皿)处理。第3次添加后,新生愈伤组织的数量只有B2处理是3.6个/皿,其他处理显著降低。B0、B1处理第1次添加后新生愈伤组织数量显著高于第2、3次添加,B2处理3次添加后新生愈伤组织数量差异不显著,B3处理第1、2次添加后新生愈伤组织数量差异不显著,显著高于第3次添加。此结果显示,多次部分更换新鲜培养基(B2处理)效果最好,表现为单皿诱导的愈伤组织总量增加(表3)。
表2 不同培养方式对愈伤组织发生及诱导的影响
Table 2 Effect of different culture methods on callus formation and induction

注:同列数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。
Note: Different lowercase letters after data in the same column represent significant differences, and different capital letters represent extremely significant differences.
培养基Medium振荡培养Shaking culture 静止培养Still culture愈伤组织生长速度Callus growth rate新生愈伤组织数量(个/皿)Number of new callus(number/dish)A0 (CK) 快 0.2cB 慢 1.4bB A1快0.6 bcB 快 3.2aA A2快0.4bcB 快 3.8aA A3快0.6bcB 快 3.8aA新生愈伤组织数量(个/皿)Number of new callus (number/dish)愈伤组织生长速度Callus growth rate
2.2 愈伤组织大小及固液共培对其成活率和质量的影响
本研究结果表明,茄子愈伤组织直接在固体培养基(M0)上分化培养时,成活的愈伤组织均呈白色紧实状,其成活率与大小关系密切:1~2 mm的愈伤组织成活率只有34.67%,褐化死亡多;2~4 mm与>4 mm的愈伤组织成活率差异不显著,分别为85.33%和82.67%(表4)。
在固体培养基中添加N3液体培养基进行固液共培,愈伤组织成活率可达82%以上,且与其大小关系不大。但液体培养基的体积对愈伤组织质量影响较大:当添加1~2 mL N3培养基进行固液共培时,愈伤组织紧实、呈白色;当添加的N3培养基大于2 mL时,愈伤组织成活率虽然较高,但呈透明水浸状,这种愈伤组织在后续芽诱导过程中褐化死亡率高。可见,进行固液共培所添加的N3液体培养基以1~2 mL最适宜。
2.3 不同诱导时间及培养基类型对愈伤组织分化的影响
2.3.1 不同诱导时间对愈伤组织分化的影响 小孢子愈伤组织诱导时间对后期分化培养影响较大,培养16 d诱导的愈伤组织分化培养时成活率最高,达93.33%,与培养24 d的(86.00%)差异不显著。培养16 d、24 d诱导的愈伤组织分化培养时成活率均显著高于32 d,培养32 d诱导的成活率最低,为42.67%。
表3 新鲜培养基添加方式和次数对愈伤组织诱导和生长的影响
Table 3 Effects of addition method and frequency of fresh culture medium on callus induction and growth

注:同列数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。
Note: Different lowercase letters after data in the same column represent significant differences, and different capital letters represent extremely significant differences.
第1次添加First addition 第2次添加Second addition 第3次添加Third addition新生愈伤组织数量(个/皿)Number of new callus(number/dish)B0(CK) 慢 2.4±0.24bcAB 慢 0.4±0.24deC 慢 0±0eC B1 快 3.4±0.24abA 快 0.8±0.20deC 快 0.2±0.2deC B2 快 3.8±0.37aA 快 3.6±0.40abA 快 3.6±0.24abA B3 快 3.8±0.37aA 快 3.4±0.24abA 快 1.4±0.24cdBC处理Treatment 愈伤组织生长速度Callus growth rate新生愈伤组织数量(个/皿)Number of new callus(number/dish)愈伤组织生长速度Callus growth rate新生愈伤组织数量(个/皿)Number of new callus(number/dish)愈伤组织生长速度Callus growth rate
表4 愈伤组织大小及固液共培对其成活率和质量的影响
Table 4 Effects of callus size and solid-liquid co-culture on survival rate and quality of callus
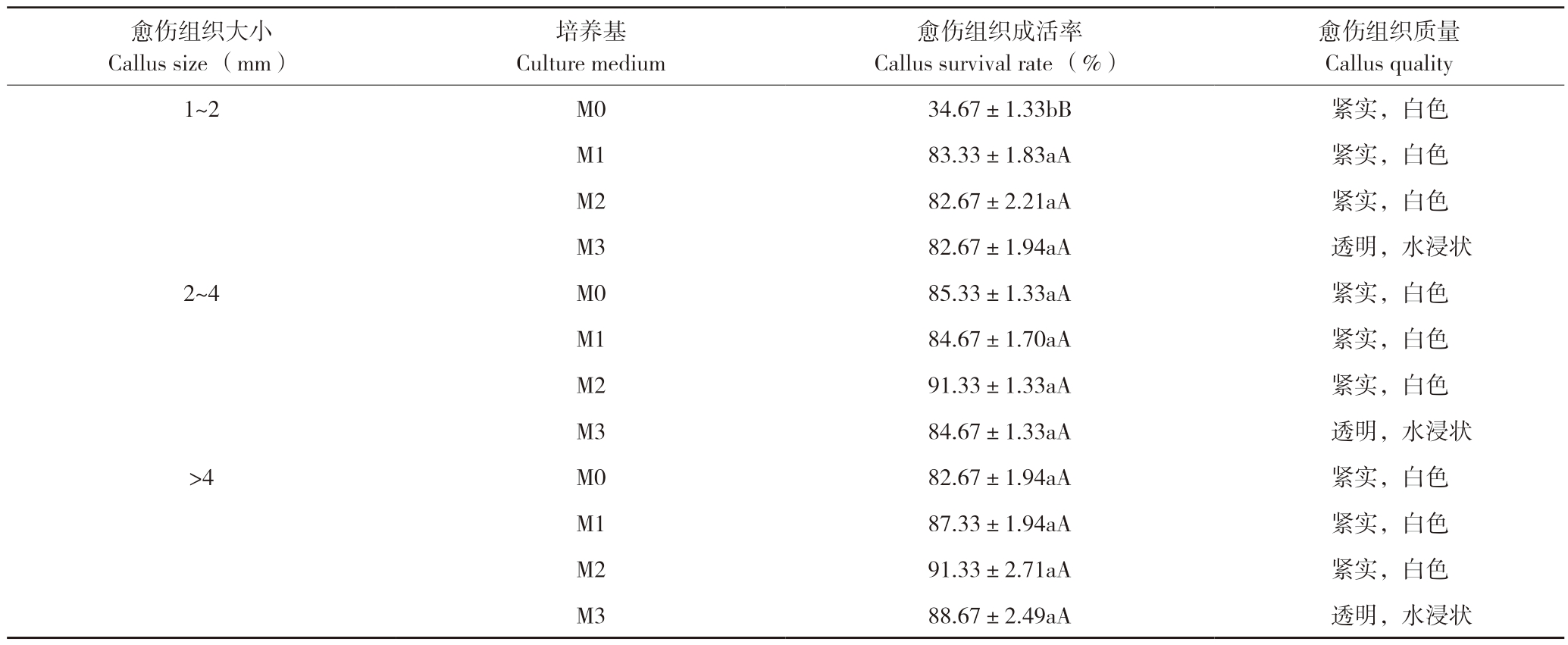
注:同列数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。
Note: Different lowercase letters after data in the same column represent significant differences, and different capital letters represent extremely significant differences.
愈伤组织质量Callus quality 1~2 M0 34.67±1.33bB 紧实,白色M1 83.33±1.83aA 紧实,白色M2 82.67±2.21aA 紧实,白色M3 82.67±1.94aA 透明,水浸状2~4 M0 85.33±1.33aA 紧实,白色M1 84.67±1.70aA 紧实,白色M2 91.33±1.33aA 紧实,白色M3 84.67±1.33aA 透明,水浸状>4 M0 82.67±1.94aA 紧实,白色M1 87.33±1.94aA 紧实,白色M2 91.33±2.71aA 紧实,白色M3 88.67±2.49aA 透明,水浸状愈伤组织大小Callus size (mm)培养基Culture medium愈伤组织成活率Callus survival rate (%)
2.3.2 不同甘露醇质量浓度对愈伤组织转绿(成熟)的影响 愈伤组织转绿是进一步分化的前提,在固体培养基中添加适量甘露醇有利于其转绿,在不含甘露醇的培养基上培养时转绿率仅52.00%;当甘露醇质量浓度为18 g/L时,愈伤组织转绿率为81.33%;甘露醇质量浓度为36 g/L时,其转绿率最高达94.64%;但甘露醇过高浓度会增加愈伤组织褐化数量,当甘露醇质量浓度增高至54 g/L时,其转绿率降为45.67%。
2.3.3 不同激素组合对愈伤组织芽分化的影响 在16种不同激素配方中,F6组合的芽分化率最高、达57.78%(表5),与其他组合的差异达到极显著水平,芽分化率第二的是F5组合(36.66%),F10组合最低只有3.3%。观察芽生长势,F6组合芽长势好,叶片呈绿色、舒展,茎节正常粗壮。因此,F6组合(ZT 1.5 mg/L+NAA 0.05 mg/L)最适合茄子愈伤组织芽分化。
2.7 再生植株倍性鉴定
当芽长至2~3 cm即可从愈伤组织上分离,转入生根培养基(MS+蔗糖30 g/L+琼脂7 g/L+NAA 5 mg/L+IAA 0.5 mg/L)培养30 d,分化出发达根系,形成完整植株(图1)。经驯化、移栽成活率可达96%。本试验获得37株再生植株,采用流式细胞仪检测出32株为二倍体,5株为单倍体。
表5 不同激素组合对茄子小孢子愈伤组织芽分化的影响
Table 5 Effects of different hormone combinations on bud differentiation of eggplant microspore callus
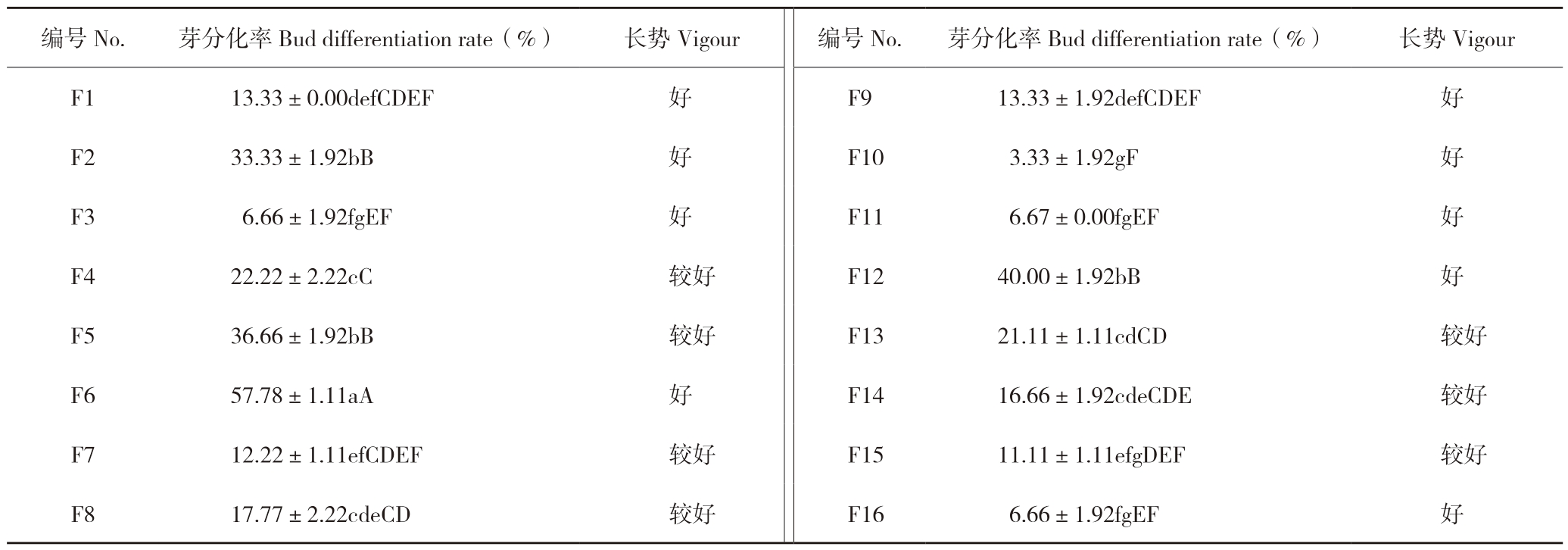
注:同列数据后小写英文字母不同者表示差异显著,大写英文字母不同者表示差异极显著。
Note: Different lowercase letters after data in the same column represent significant differences, and different capital letters represent extremely significant differences.
编号No.芽分化率Bud differentiation rate(%) 长势Vigour 编号No.芽分化率Bud differentiation rate(%) 长势Vigour F1 13.33±0.00defCDEF 好 F9 13.33±1.92defCDEF 好F2 33.33±1.92bB 好 F10 3.33±1.92gF 好F3 6.66±1.92fgEF 好 F11 6.67±0.00fgEF 好F4 22.22±2.22cC 较好 F12 40.00±1.92bB 好F5 36.66±1.92bB 较好 F13 21.11±1.11cdCD 较好F6 57.78±1.11aA 好 F14 16.66±1.92cdeCDE 较好F7 12.22±1.11efCDEF 较好 F15 11.11±1.11efgDEF 较好F8 17.77±2.22cdeCD 较好 F16 6.66±1.92fgEF 好

图1 愈伤组织分化及植株再生
Fig.1 Callus differentiation and plant regeneration
A:2~4 mm愈伤组织转绿;B:愈伤组织芽分化;C:不定芽分化出根系;D:再生植株
A: Greening of 2-4 mm callus; B: Callus differentiation; C: Root system differentiated from adventitious buds; D: Regeneration plants
3 讨论
3.1 愈伤组织诱导的影响
茄子小孢子培养本身有一些机制尚不明确,小孢子发育同步性低,愈伤组织诱导率不高。本研究结果发现,振荡培养有利于小孢子愈伤组织生长,这与前人的结论[12-13]一致,但振荡培养不利于愈伤组织诱导,而静止培养条件下愈伤组织诱导率较高。培养基添加方式对愈伤组织诱导影响大,本试验发现,在静止培养条件下,采用部分更换方式添加N3培养基可以提高愈伤组织单皿诱导总量。随着培养时间延长,有害物质不断积累[14],处理B1和B3中新生愈伤组织数量迅速下降。B2采用部分更换培养基的方法,不但为细胞分裂提供充足的营养物质,而且还减少或稀释了培养基中的有害物质[15],有利于新愈伤组织的诱导和生长,所以在2次更换培养基新生的愈伤组织数量基本稳定。
固液共培时,添加1~2 mL N3液体培养基能使愈伤组织部分暴露在空气中更容易获得氧气,成活率高,质量好;当N3液体培养基体积达到3 mL以上时,茄子小孢子愈伤组织浸没在液体中,获得氧气较少,含水量高,玻璃化趋重,降低愈伤组织质量。这与袁素霞等[16]观察到“结球甘蓝(Brassica oleracea L.)和青花菜(Brassica oleracea L.var. italic Planch)小孢子胚在液体培养基中滞留时间越长、玻璃化程度越重”的结果相似。因此,添加1~2 mL N3培养基进行固液共培,是茄子小孢子愈伤组织分化培养的适宜方式。
3.2 愈伤组织分化的影响
添加较高质量浓度的甘露醇可以提高培养基渗透压,使愈伤组织生长缓慢、结构致密,为分化积累必要营养物质,从而提高转绿(成熟)率,缩短分化时间。本研究中茄子愈伤组织在含36 g/L甘露醇的培养基中培养时转绿率最高,这与前人“培养基添加甘露醇可以提高马铃薯(Solanum tuberosum)原生质体愈伤组织分化率、缩短分化期”的结果[17-18]一致。但过高质量浓度的甘露醇(50 g/L)会造成培养基渗透压过高,加重茄子愈伤组织褐化率,这与赖钟雄[19]在龙眼(Dimocarpus longgana Lour)幼胚成熟培养中发现“较高浓度蔗糖有利幼胚成熟、但过高蔗糖浓度则会加重外植体褐变”的结果相似。
在不同激素处理中,ZT 1.5 mg/L+NAA 0.05 mg/L的激素组合有利于茄子愈伤组织芽分化,这与连勇等[6]在茄子体细胞杂种游离小孢子培养研究中的结果有所不同,其原因可能是基因型、小孢子游离方法、培养环境等不同所致。
4 结论
通过对茄子游离小孢子培养体系进行优化试验,结果表明茄子游离小孢子在黑暗静止条件下培养,愈伤组织的诱导效果较好;2次更换部分N3液体培养基可以获得更多高质量愈伤组织;添加1~2 mL N3液体培养基进行固液共培有利于愈伤组织生长和成活,但过多液体培养基会降低愈伤组织质量;早诱导的愈伤组织分化培养成活率高;在添加36 g/L甘露醇的MS固体培养基中培养的愈伤组织转绿率最高,达94.64%;ZT 1.5 mg/L+NAA 0.05 mg/L激素组合有利于愈伤组织芽分化,分化率达57.78%。
[1] FERRIE A M R, CASWELL K L.Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production[J].Plant Cell Tissue and Organ Culture, 2011, 104(3):301-309.doi:10.1007/s11240-010-9800-y.
[2] MARIA A G.Anther culture for haploid and doubled haploid production[J].Plant Cell Tissue and Organ Culture,2011, 104(3): 283-300.doi:10.1007/s11240-010-9852-z.
[3] 蔡华,马传喜,司红起,乔钰强,陆维忠.利用小麦与玉米远缘杂交诱导小麦双单倍体的研究进展[J].麦类作物学报,2006,26(4):154-157.doi:10.7606/j.issn.1009-1041.2006.04.176.CAI H, MA C X, SI H Q, QIAO Y Q,LU W Z.Advance on producing duoble haploid of wheat by wide hybridization between wheat and maize[J].Journal of Triticeae Crops, 2006, 26(4): 154-157.doi:10.3969/j.issn.1009-1041.2006.04.035.
[4] 谭静,徐春霞,陈洪梅,罗黎明.利用单倍体诱导系选育玉米自交系研究[J].玉米科学,2007,15(4):56-58.doi:10.3969/j.issn.1005-0906.2007.04.015.TAN J,XU C X, CHEN H M,LUO L M.Investigation of haploidinducation techniques for inbred line developmention maize[J].Journal of Maize Sciences, 2007, 15(4): 56-58.doi:10.3969/j.issn.1005-0906.2007.04.015.
[5] MIYOSHI K.Callus induction and plantlet formation through culture of isolated microspores of eggplant[J].Plant Cell Reports,1996,15(6):391-395.doi:10.1007/BF00232061.
[6] 连勇,刘富中,陈钰辉,宋燕,张松林,DARASINH S.茄子体细胞杂种游离小孢子培养获得再生植株[J].园艺学报,2004,31(2):233-235.doi:10.3321/j.issn:0513-353X.2004.02.021.LIAN Y, LIU F Z, CHEN Y H, SONG Y,ZHAN S L, DARASINH S.Plantlet regeneration by isolated microspore culture of somatic hybrid of eggplant[J].Acta Horticulturae Sinica, 2004, 31(2):233-235.doi:10.3321/j.issn:0513-353X.2004.02.021.
[7] 宋彦平,申书兴,王彦华,陈雪平,罗双霞.茄子游离小孢子培养获得愈伤组织的研究[J].河北农业大学学报,2007,30(3):32-35.doi:10.3969/j.issn.1000-1573.2007.03.007.SONG Y P, SHEN S X, WANG Y H, CHEN X P, LUO S X.Studies on microspore culture of eggplant obtained callus[J].Journal of Agricultural University of Hebei,2007,30(3):32-35.doi:10.3969/j.issn.1000-1573.2007.03.007.
[8] 朱朝辉,钟开勤,黄建都,林翮飞,陈继兵.茄子游离小孢子培养初探[J].热带作物学报,2011,32(10):1883-1887.doi:10.3969/j.issn.1000-2561.2011.10.019.ZHU C H, ZHONG K Q, HUANG J D, LIN H F,CHEN J B.Culturing the isolated microspore of eggplant (Solanum melongena L.)[J].Chinese Journal of Tropical Crops, 2011, 32(10):1885-1887.doi:10.3969/j.issn.1000-2561.2011.10.019.
[9] 佟曦然,顾淑荣,朱至清,蒋钟仁,张树根,惠志明,李春玲.茄子游离小孢子培养中小孢子发育的细胞学观察[J].农业生物技术学报,2007,15(5):861-86 6.doi:10.39 69/j.issn.1674-7968.2007.05.024.TONG X R, GU S R, ZHU Z Q, JIAN Z R, ZHANG S G, HUI Z M, LI C L.Cytological observations on androgenesis in isolated microspores cultures of eggplant[J].Journal of Agricultural Biotechnology,2007, 15(5):861-866.doi:10.3969/j.issn.1674-7968.2007.05.024.
[10] 范适,刘富中,陈钰辉,宋燕,刘志敏,张野,连勇.茄子小孢子培养技术研究[J].南方农业学报,2017,48(9):1641-1647.doi:10.3969/j.issn.2095-1191.2017.09.17.FAN S, LIU F Z, CHEN Y H, SONG Y, LIU Z M, ZHANG Y,LIAN Y.Microspore culture technology for eggplant[J].Journal of Southern Agriculture, 2017, 48(9):1641-1647.doi:10.3969/j.issn.2095-1191.2017.09.17.
[11] 马欣,申书兴,连勇,刘富中,陈钰辉.茄子花药和游离小孢子培养技术研究进展[J].长江蔬菜,2006(7):39-41.doi:10.3865/j.issn.1001-3547.2006.07.032.MA X, SHEN S X, LIAN Y, LIU F Z, CHEN Y H.Progress of anther and isolated microspore culture techniques of eggplant[J].Journal of Changjiang Vegetables, 2006(7):39-41.doi:10.3865/j.issn.1001-3547.2006.07.032.
[12] 申书兴,梁会芬,张成合,王文雅,刘世雄,李振秋,王东平,郭英华.提高大白菜小孢子胚胎发生及植株获得率的几个因素研究[J].河北农业大学学报,1999, 22(4):65-68.SHEN S X, LIANG H F, ZHANG H C, WANG W Y, LIU S X, LIZ Z Q, WANG D P, GUO Y H.The studies on formation of microspore embryo and plantlet in Chinese cabbage[J].Journal of Agricultural University of Hebei,1999, 22(4):65-68.
[13] 赵俊,巫东堂,赵军良,董晓飞,赵美华,王秀英,李改珍.影响大白菜游离小孢子培养若干因素的研究[J].山西农业科学,2008,36(8):26-28.doi:10.3969/j.issn.1002-2481.2008.08.009.ZHAO J, WU D T, ZHAO J L, DONG X F, ZHAO M H, WANG X Y,LI G Z.Impact of chinese cabbage free microspore culture of a number of factors[J].Journal of Shanxi Agricultural Sciences, 2008, 36(8):26-28.doi:10.3969/j.issn.1002-2481.2008.08.009.
[14] 蒋武生,姚秋菊,张晓伟,原玉香,耿建峰.活性炭和振荡培养对提高大白菜胚诱导率的影响[J].中国瓜菜,2008,21(4):1-3.doi:10.3969/j.issn.1673-2871.2008.04.001.JIANG W S, YAO Q J, ZHANG X W, YUAN Y X, GENG J F.Influence of activated charcoal and agitation culture on frequency of embryogenesis from microspore of Chinese cabbage[J].China Cucurbits and Vegetables, 2008,21(4):1-3.doi:10.3969/j.issn.1673-2871.2008.04.001.
[15] 袁素霞,孙继峰,刘玉梅,方智远.植物游离小孢子胚胎形成机理[J].生物技术通报,2011(10): 7-16.doi:10.13560/j.cnki.biotech.bull.1985.2011.10.018.YUAN S X, SUN J F, LIU Y M, FANG Z Y.Mechanisms of microspore embryogenesis induction and embryo formation[J].Biotechnology Bulletin, 2011(10): 7-16.doi:10.13560/j.cnki.biotech.bull.1985.2011.10.018.
[16] 袁素霞,刘玉梅,方智远.结球甘蓝与青花菜小孢子植株再生[J].植物学报,2010, 45(2):226-232.doi:10.3969/j.issn.1674-3466.2010.02.012.YUAN S X, LIU Y M, FANG Z Y.Plant regeneration from microspore-derived embryos in cabbage (Brassica oleracea var.capitata) and broccoli (Brassica oleracea var.italica)[J].Chinese Bulletin of Botany, 2010, 45(2):226-232.doi:10.3969/j.issn.1674-3466.2010.02.012.
[17] 李世君,李向辉,孙勇好.马铃薯无菌苗叶肉原生质体再生植株[J].生物工程学报,1989,5(1):57-63.doi:10.3321/j.issn:1000-3061.1989.01.001.LI S J, LI X H, SUN Y H.Plant regeneration of mesophyll protoplasts from axenic shoot of potato (Solanum tuberosum L.)[J].Chinese Journal of Biotechnology, 1989, 5(1):57-63.doi:10.3321/j.issn:1000-3061.1989.01.001.
[18] 祁新,赵颖君,王艳秋,齐义杰,顾德峰.马铃薯悬浮细胞原生质体培养及植株再生[J].吉林农业大学学报,2000,22(1):52-55.doi:10.3969/j.issn.1000-5684.2000.01.012.QI X, Z H AO Y J, WA NG Y Q, QI Y J, GU D F.Pl a nt regenerationfromthe protoplasts of suspension cell culture of potato[J].Journal of Jilin Agricultural University, 2000, 22(1):52-55.doi:10.3969/j.issn.1000-5684.2000.01.012.
[19] 赖钟雄.龙眼生物技术研究[M].福州:福建科学技术出版社,2003:19-20.LAI Z X.Studies on biotechnology of Longan (Dimocarpus longan Lour)[M].Fuzhou: Fujian Science and Technology Press,2003:19-20.