【研究意义】消化道器官是鱼类从外界环境获取营养物质以满足自身能量需求的基础。肠道作为消化道器官的重要组成部分,其形态结构的变化往往受到食物组成、食物质量以及动物能量需求等因素的影响[1]。目前,国内外学者对消化道形态组织[2]、内分泌细胞[3]、微生物[4]等方面进行了相关研究,但关于消化道发育模式则鲜有报道[5]。
【前人研究进展】异速生长又被称作相对生长,是指生物在早期生长发育过程中,由于受到基因和外界环境因素的影响,身体各部分功能器官的生长速度具有不同步性[6]。生物体存在异速生长的现象自被报道后引起广大学者的密切关注[7]。越来越多研究发现,生物体在代谢速率[8]、胚胎生长和发育[9]及种群最大生长尺度等方面均存在异速生长现象。而国内对鱼类异速生长的研究大部分聚焦仔鱼在早期生存和环境适应中表现出来的器官异速生长[10-12]。面对复杂多变的外界环境,鱼类器官的异速生长能够提高其主动摄食和逃避敌害的能力,从而实现自我保护。
【本研究切入点】银鮈(Squalidus argentatus)又名亮壳、银色颌须鮈等,隶属鲤形目(Cypriniformes)鲤科(Cyprinidae)鮈亚科(Gobioninae)银鮈属(Squalidus)[13],广泛分布于我国各主要水系[14],产漂流性卵[15]。银鮈易捕获,在多数地区捕获渔获量大,而且肉质厚爽、鲜嫩味美,具有一定的经济价值。目前关于银鮈的研究大部分集中在繁殖生物学[16]、胚胎发育[17]、生长和死亡率[18]等方面,关于其食物组成及肠道发育模式的研究鲜有报道。
嘉陵江是长江流域面积最大的河流,但由于梯级航电枢纽建设(目前已建和在建水利枢纽共15级),渠化明显,鱼类栖息地破坏严重,原有自然流态河道多已成为库区,使得鱼类群落结构发生了较大变化[19],特别是对于产漂流性鱼卵的鱼类,库区的形成不利于其繁殖,致使其资源量必然随着航电枢纽的建设而减少。嘉陵江中游苍溪江段作为嘉陵江航电工程开发的缩影,在该江段附近共有3级航电枢纽,分别为亭子口航电枢纽、苍溪航电枢纽以及沙溪航电枢纽,鱼类生境破坏严重。
【拟解决的关键问题】本研究以采集于嘉陵江苍溪江段的银鮈作为研究对象,分析其食物组成、肠道形态结构,并探讨其异速生长模式与食物组成的关系,旨在探讨银鮈广泛分布的原因,同时为研究鱼类对环境适应性提供科学的参考依据。此外,由于人类影响,嘉陵江银鮈的生存必将受到威胁,本研究结果能在一定程度上为银鮈及其他鱼类的资源保护提供指导。
1 材料与方法
1.1 研究区域概况
嘉陵江由北向南流经陕西、甘肃、四川和重庆三省一市,干流全长1 119 km,流域面积达1.6×105 km2,年径流量670亿m3[13]。嘉陵江上游包括源头至广元昭化江段,中游为昭化至重庆合川江段,合川江段至河口为下游江段[20]。本研究样品采自嘉陵江中游苍溪江段(图1),采样范围为31°38′51″~31°48″24″N,105°52′30″~105°55′47″E。苍溪江段受人类活动影响严重,在约35 km的河道上建有3级梯级航电枢纽,相应江段几乎全部成为库区,对鱼类栖息地生境影响严重。

图1 嘉陵江中游苍溪江段银鮈采集地
Fig.1 Sampling sites of Squalidus argentatus in midstreamof the Jialing River
1.2 样品采集
于2016年6月和8月,利用定置刺网(8 m×1.2 m×2 cm)在嘉陵江中游苍溪江段共采集银鮈46尾。为避免鱼类食物被消化,每次放置网具的时间不超过4 h。鱼类一旦被捕获,立即带回野外实验室进行处理。
1.3 样品处理
在野外实验室,首先测量鱼体的全长、体长、体重。随后立即对鱼进行生物学解剖,记录鱼肠充塞度(0~5,0表示空肠,1表示肠道饱满度为20%,5表示肠道饱满度为100%,依此类推),并将肠充塞度≥3的肠道内容物取出保存于10%的福尔马林溶液中,以待后续进行鱼类食物组成观察。然后,立即将肠道洗净,利用游标卡尺和电子天平分别测量鱼类前肠、中肠和后肠的长度及重量,鱼体整体肠道长度与重量分别等于前肠、中肠及后肠三区的长度与重量之和。
1.4 食性观察
为了避免因食物消化给食物鉴定带来误差,仅选用肠充塞度≥3的样本用于食性分析。在室内鉴定时,先用0.5 mm网目筛网将肠道内容物过滤。过滤液全部收集用作藻类及浮游动物类群鉴定,而留在筛网上的大型食物类群(如水生昆虫、软体动物等)则主要通过肉眼或解剖镜(Nikon SM-6)进行鉴定计数,并在电子天平上直接称量食物重量。藻类及浮游动物的鉴定通过显微镜(Leica DM500)进行鉴定计数,小型食物的种类通过体积转换法[21]进行计算,具体鉴定方法参照文献[22-23]。
食物的鉴定主要参照《中国淡水藻类系统、分类及生态》[24]、《Aquatic Insects of China Useful for Monitoring Water Quality》[25]、《淡 水微型生物与底栖动物图谱》[26]以及《水生生物学》[27]等文献资料。
1.5 数据分析
1.5.1 肠道指数分析 肠道作为银鮈(为无胃鱼)的消化器官,对银鮈生长发育起着至关重要的作用。本研究对银鮈肠道发育通过比肠长(Relative gut length,RGL)、Zihler指数(Zihler index,ZI)、比肠重(Relative gut mass,RGM)以及单位长度肠道质量(W/L)4个指数来描述和衡量。其中,RGL和ZI侧重于鱼体肠道长度的描述,而RGM和W/L更偏向于肠道质量和发达程度的衡量。各指数计算方法参照文献[5]。
银鮈前肠、中肠及后肠间各肠道指数的差异通过单因素方差分析(One-Way ANOVA)进行检验,采用SPSS 22.0软件计算分析。
1.5.2 异速生长模式分析 银鮈异速生长模型采用幂函数方程(Y=aXb)计算。本研究中以银鮈全长为自变量,其整体肠道或肠道各分区长度为因变量,a为Y轴截距,b为异速生长指数[28]。为了优化分析,对数据统一进行Log转换,其后通过R软件(Segmented分析包)[29]进行统计分析。通过t检验,当b>1时,表明肠道为快速生长;当b<1时,为慢速生长;若b与1无显著性差异,则可认为是等速生长。异速生长曲线图采用Origin 9.0绘制。
1.5.3 食性分析 银鮈食物组成采用出现率、数量百分比、质量百分比、相对重要指数、相对重要指数百分比等5个指数衡量,各指数计算公式如下:
出现率(%)=(含有某种食物的肠道数量/解剖后有食物的肠道数量)×100
数量百分比(%)=(某种食物出现的个数/所有食物的总个数)×100
质量百分比(%)=(某种食物的质量/所有食物的总质量)×100
相对重要指数=出现率百分比×(数量百分比+重量百分比)
相对重要指数百分比(%)=(相对重要指数/相对重要指数的总和)×100
2 结果与分析
2.1 样品采集情况
本研究共采集银鮈46尾,所有肠充塞度均≥3,全部用于食性分析。46尾银鮈全长介于96.0~152.0 mm之间,平均130.5 mm;体长介于79.0~123.0 mm之间,平均106.7 mm;体重介于8.2~36.7 g之间,平均22.8 g。
2.2 银鮈肠道形态特征
解剖发现银鮈属于无胃鱼类,肠道盘曲方式简单,呈“S”型。前肠、中肠和后肠的比肠长(RGL)平均值分别为0.2219、0.1811、0.3705,比肠重(RGM)平均值分别为0.0070、0.0056、0.0058,Zihler指数(ZI)平均值分别为0.8412、0.6862、1.4046,单位肠道质量(W/L)平均值分别为0.0067、0.0051、0.0034(表1)。单因素方差分析表明,银鮈前肠、中肠与后肠三区的RGL、RGM、ZI、W/L之间均存在显著差异。LSD多重比较结果显示,银鮈的RGL和ZI具有相似结果,其中中肠最小、前肠次之、后肠最大;RGM比较结果为前肠最低、中肠其次、后肠最高,但后肠与中肠差异不显著;W/L两两比较结果显示后肠最低、中肠次之、前肠最高,上述结果可能与各肠道分区的功能有关。
表1 银鮈肠道指数
Table 1 The intestinal index of Squalidus argentatus
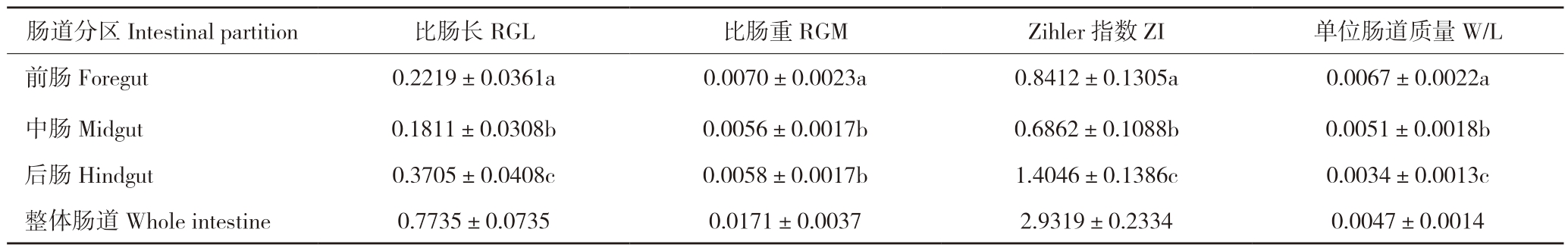
注:同列数据后小写英文字母不同者表示差异显著。
Notes: Different lowercase letters after data in the same column represent significant differences.
肠道分区 Intestinal partition 比肠长 RGL 比肠重 RGM Zihler指数 ZI 单位肠道质量 W/L前肠 Foregut 0.2219±0.0361a 0.0070±0.0023a 0.8412±0.1305a 0.0067±0.0022a中肠 Midgut 0.1811±0.0308b 0.0056±0.0017b 0.6862±0.1088b 0.0051±0.0018b后肠 Hindgut 0.3705±0.0408c 0.0058±0.0017b 1.4046±0.1386c 0.0034±0.0013c整体肠道 Whole intestine 0.7735±0.0735 0.0171±0.0037 2.9319±0.2334 0.0047±0.0014
2.2 银鮈肠道异速生长模式分析
对银鮈整体肠道以及肠道各分区异速生长整体分析表明,整体肠道(b=1.5388>1,P<0.05)、前肠(b=1.8288>1,P<0.05)以及中肠(b=1.8496>1,P<0.05)均为快速生长;而后肠的异速生长指数(b=1.2418)与1比较差异不显著,故可认为是等速生长(表2)。
t检验结果表明,整体肠道和前肠出现了生长拐点(图2)。其中,整体肠道出现生长拐点对应的鱼体全长为131.00 mm,对应鱼体肠道长度为83.45 mm(表3)。整体肠道在拐点前,异速生长指数为1.7491(P<0.05),为快速生长;拐点后,异速生长指数为1.4305(P>0.05),为等速生长(图2A)。而前肠出现生长拐点时对应的鱼体全长为129.39 mm,对应的前肠长度为23.28 mm(表3)。前肠在拐点前,异速生长指数为2.6565(P<0.05),为快速生长;拐点后,异速生长指数为0.5463(P>0.05),表现出等速生长(图 2B)。而中肠和后肠未出现生长拐点(图2C和图2D)。
2.3 银鮈食物组成分析
由于前肠为主要的摄食消化场所,因此,本研究以前肠拐点为依据,将银鮈划分为拐点前和拐点后进行食性观察并分别进行统计。其中拐点前(全长<129.39 mm)共包括24尾,拐点后(全长≥129.39 mm)共包括22尾。
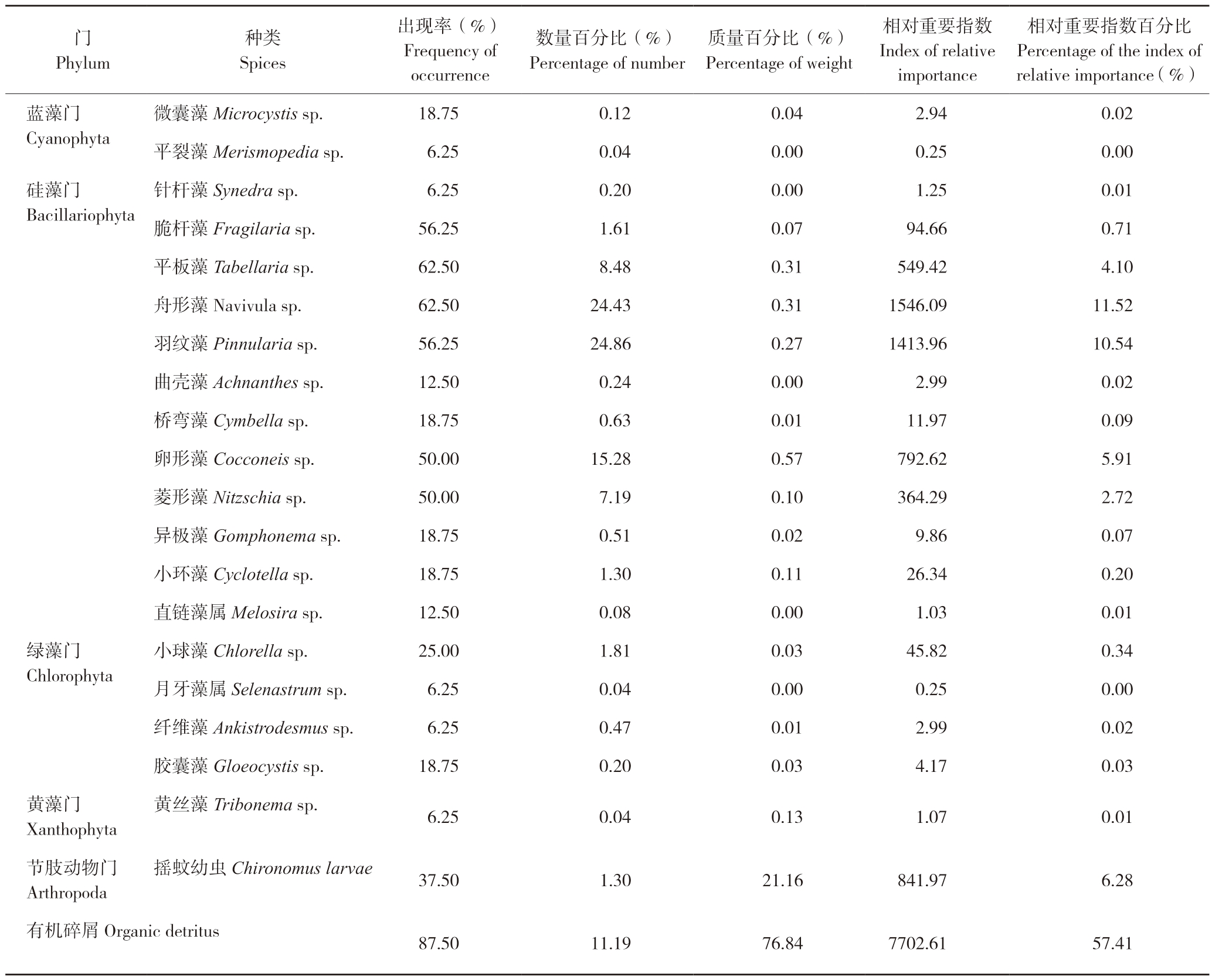
拐点前,银鮈食性主要包括藻类、水生昆虫及有机碎屑,其中藻类包括硅藻、蓝藻、绿藻以及黄藻。从出现率来看,拐点前有机碎屑出现率最高(87.5%),其次是舟形藻和平板藻,出现率均为62.5%;从数量百分比来看,拐点前羽纹藻最高(24.86%),其次是舟形藻(24.43%)和卵形藻(15.28%);从质量百分比来看,拐点前碎屑最高(76.84%),其次是摇蚊幼虫(21.16%)和舟形藻(0.31%);从相对重要指数百分比来看,拐点前有机碎屑最高(57.41%),其次是舟形藻(11.52%)和羽纹藻(10.54%)(表4)。总体而言,拐点前,银鮈的主要食物包括有机碎屑、摇蚊幼虫以及硅藻等。
表2 银鮈肠道生长方程
Table 2 The growth equation of Squalidus argentatus
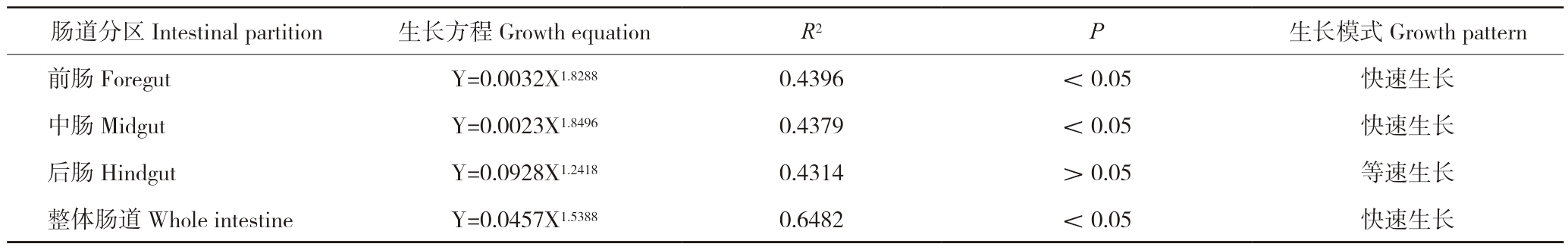
肠道分区Intestinal partition 生长方程Growth equation R2 P 生长模式Growth pattern前肠 Foregut Y=0.0032X1.8288 0.4396 <0.05 快速生长中肠 Midgut Y=0.0023X1.8496 0.4379 <0.05 快速生长后肠 Hindgut Y=0.0928X1.2418 0.4314 >0.05 等速生长整体肠道Whole intestine Y=0.0457X1.5388 0.6482 <0.05 快速生长
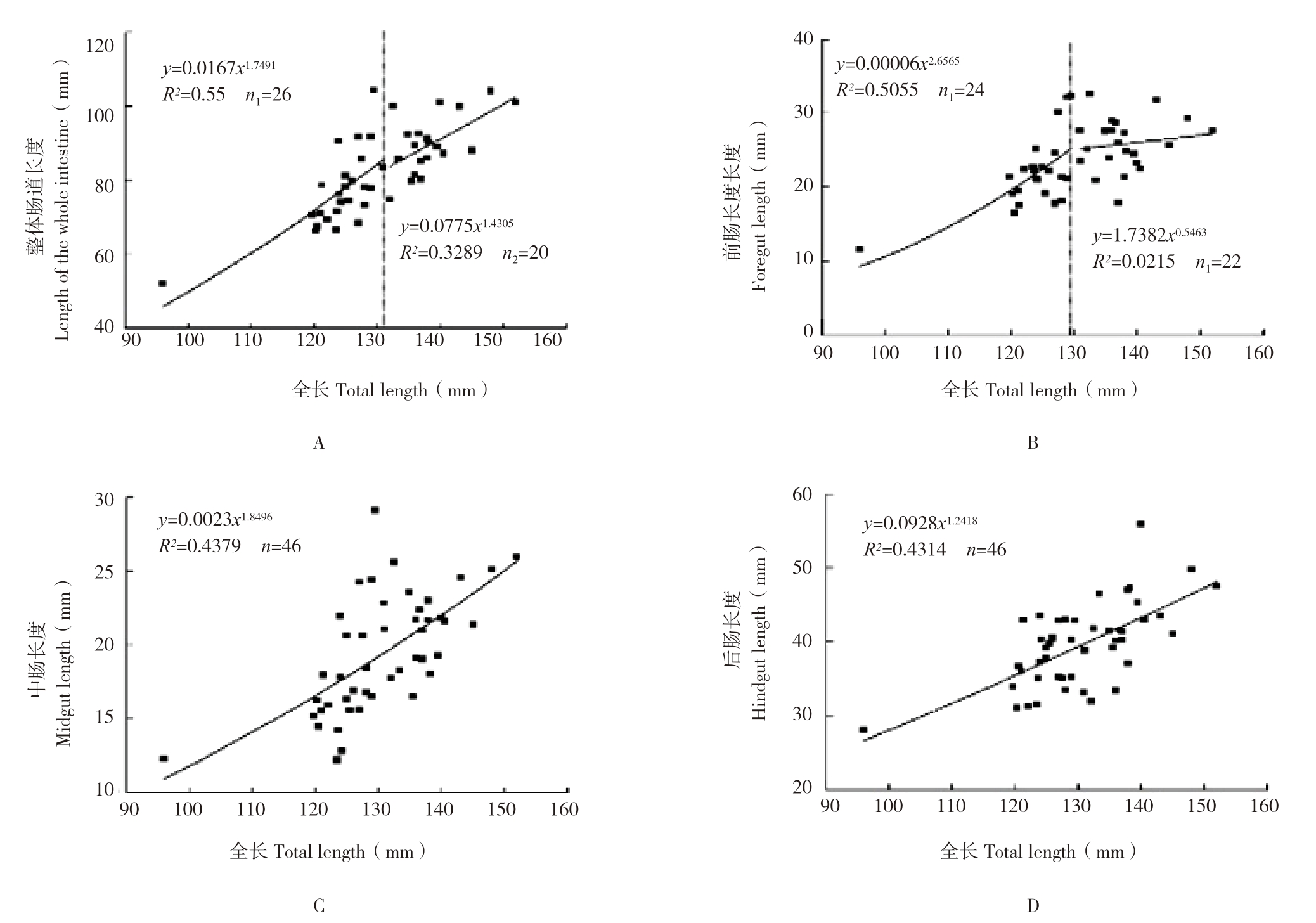
图2 银鮈整体肠道及肠道各分区生长曲线
Fig.2 Growth curves of various partitions and the whole intestine of Squalidus argentatus
表3 银鮈肠道异速生长模式
Table 3 The allometric growth pattern of Squalidus argentatus
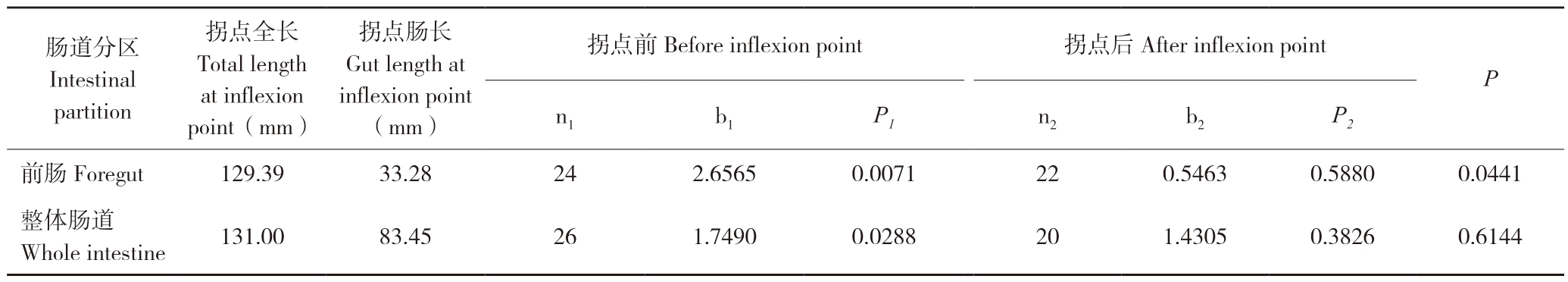
注:n1、n2,b1、b2,P1、P2分别表示拐点前与拐点后的样本量、异速生长指数、异速生长指数与1的差异显著性水平;P表示拐点前与拐点后异速生长指数的差异性水平。
Note: n1, n2, b1, b2, P1, P2 represent the sample size before inflexion point and after inflexion point, the allometric growth index, the significant difference level between allometric growth index and 1, respectively.P represents the difference level of the allometric growth index before inflexion point and after inflexion point.
肠道分区Intestinal partition拐点全长Total length at inflexion point (mm)拐点肠长Gut length at inflexion point(mm)拐点前Before inflexion point 拐点后After inflexion point P n1 b1 P1 n2 b2 P2前肠Foregut 129.39 33.28 24 2.6565 0.0071 22 0.5463 0.5880 0.0441整体肠道Whole intestine 131.00 83.45 26 1.7490 0.0288 20 1.4305 0.3826 0.6144
表4 拐点前银鮈食物种类组成
Table 4 Food composition of Squalidus argentatus before the inflection point
相对重要指数百分比Percentage of the index of relative importance(%)蓝藻门Cyanophyta门Phylum种类Spices出现率(%)Frequency of occurrence数量百分比(%)Percentage of number质量百分比(%)Percentage of weight相对重要指数Index of relative importance微囊藻 Microcystis sp.18.75 0.12 0.04 2.94 0.02平裂藻 Merismopedia sp.6.25 0.04 0.00 0.25 0.00硅藻门Bacillariophyta针杆藻 Synedra sp.6.25 0.20 0.00 1.25 0.01脆杆藻 Fragilaria sp.56.25 1.61 0.07 94.66 0.71平板藻 Tabellaria sp.62.50 8.48 0.31 549.42 4.10舟形藻 Navivula sp.62.50 24.43 0.31 1546.09 11.52羽纹藻 Pinnularia sp.56.25 24.86 0.27 1413.96 10.54曲壳藻 Achnanthes sp.12.50 0.24 0.00 2.99 0.02桥弯藻 Cymbella sp.18.75 0.63 0.01 11.97 0.09卵形藻 Cocconeis sp.50.00 15.28 0.57 792.62 5.91菱形藻 Nitzschia sp.50.00 7.19 0.10 364.29 2.72异极藻 Gomphonema sp.18.75 0.51 0.02 9.86 0.07小环藻 Cyclotella sp.18.75 1.30 0.11 26.34 0.20直链藻属 Melosira sp.12.50 0.08 0.00 1.03 0.01绿藻门Chlorophyta小球藻 Chlorella sp.25.00 1.81 0.03 45.82 0.34月牙藻属 Selenastrum sp.6.25 0.04 0.00 0.25 0.00纤维藻 Ankistrodesmus sp.6.25 0.47 0.01 2.99 0.02胶囊藻 Gloeocystis sp.18.75 0.20 0.03 4.17 0.03黄藻门Xanthophyta黄丝藻 Tribonema sp.6.25 0.04 0.13 1.07 0.01节肢动物门Arthropoda摇蚊幼虫 Chironomus larvae 37.50 1.30 21.16 841.97 6.28有机碎屑Organic detritus 87.50 11.19 76.84 7702.61 57.41
拐点后,银鮈的食性包括藻类、原生动物、软体动物、节肢动物以及有机碎屑,其中藻类包括硅藻、蓝藻、绿藻、甲藻以及黄藻。从出现率来看,拐点后有机碎屑最高(64.29%),其次是菱形藻、卵形藻、脆杆藻、小环藻(均为42.86%);从数量百分比来看,拐点后羽纹藻最高(40.30%),其次是舟形藻(29.15%)和有机碎屑(12.60%);从质量百分比来看,拐点后有机碎屑最高(90.41%),其次是淡水壳菜(6.64%)以及摇蚊幼虫和变形虫(均为0.51%);从相对重要指数百分比来看,拐点后有机碎屑最高(80.30%),其次是羽纹藻(10.57%)和舟形藻(2.55%)(表5)。总体而言,拐点后,有机碎屑、硅藻以及淡水壳菜是银鮈的主要食物组成,相较于拐点前,拐点后银鮈摄入的肉食性饵料有所减少。
综上所述,嘉陵江中游苍溪江段的银鮈食物来源广泛,属于杂食性鱼类。通过比较银鮈拐点前和拐点后的食性可以发现,拐点后银鮈摄入的食物种类和类群更加丰富,包括软体动物以及原生动物,有机碎屑对拐点后的银鮈食性贡献增加,达80.30%。
3 讨论
3.1 银鮈肠道特征
鱼类消化道的形态结构与其食性具有很大相关性。比肠长(RGL)一般可视为形态结构的指标[30],RGL值较低的多为典型的肉食性鱼类,RGL值较高的多为典型的植食性鱼类,RGL值介于二者之间的通常为杂食性鱼类。杂食性鱼类的RGL值往往与饵料中植物与动物的比例有关。例如,研究发现哲罗鱼的RGL为0.47,肠道一般没有折叠盘旋,属于典型的肉食性鱼类[31];而华鲮的RGL为11.10,肠道高度盘曲,属于典型的植食性鱼类[32]。本研究结果表明,银鮈整体肠道的RGL为0.7735,而食性鉴定结果显示,其食物主要由有机碎屑、硅藻、摇蚊幼虫、淡水壳菜组成,食物种类繁多,属于杂食性鱼类。
表5 拐点后银鮈食物种类组成
Table 5 Food composition of Squalidus argentatus after the inflection point
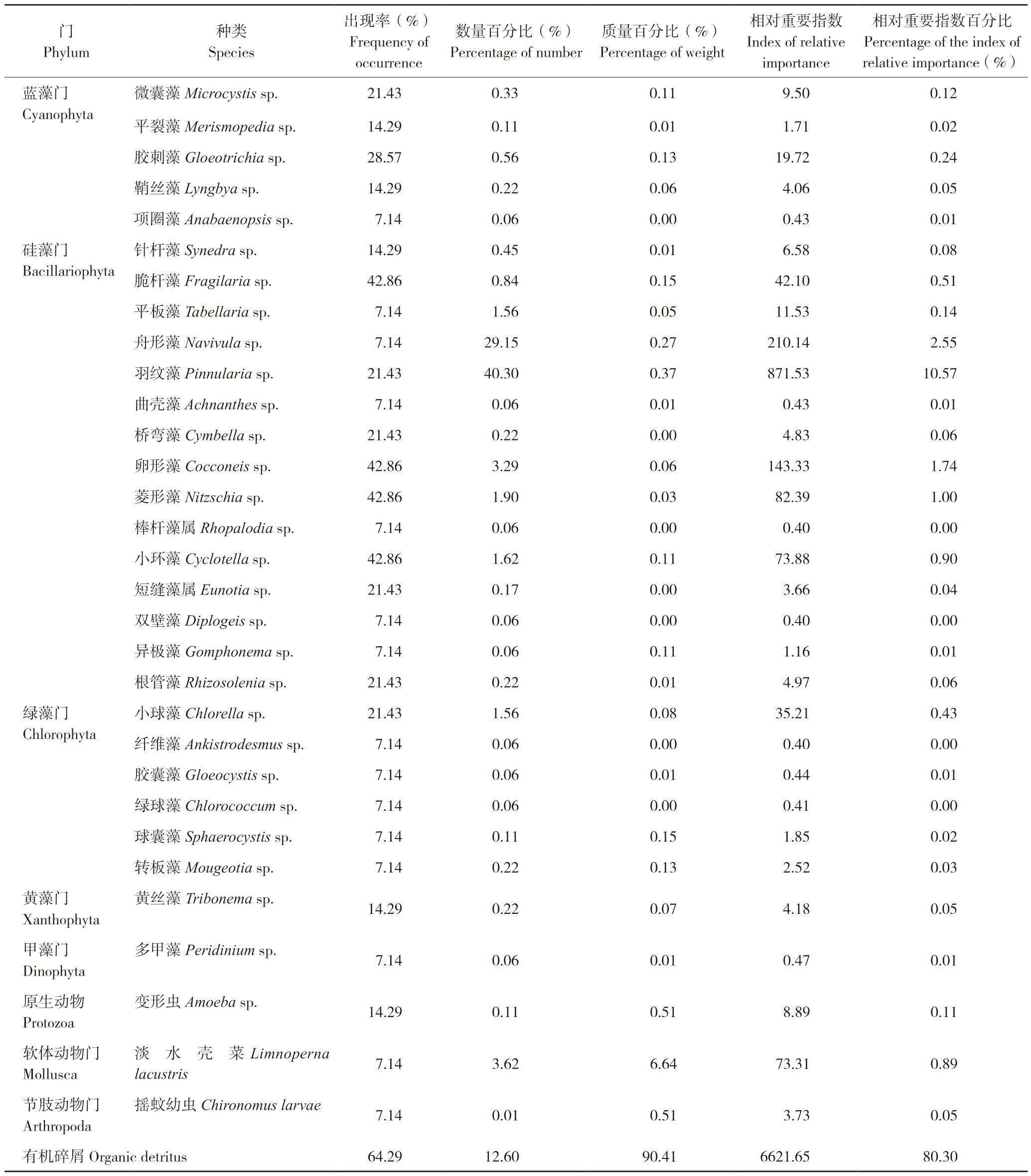
相对重要指数百分比Percentage of the index of relative importance(%)蓝藻门Cyanophyta门Phylum种类Species出现率(%)Frequency of occurrence数量百分比(%)Percentage of number质量百分比(%)Percentage of weight相对重要指数Index of relative importance微囊藻 Microcystis sp.21.43 0.33 0.11 9.50 0.12平裂藻 Merismopedia sp.14.29 0.11 0.01 1.71 0.02胶刺藻 Gloeotrichia sp.28.57 0.56 0.13 19.72 0.24鞘丝藻 Lyngbya sp.14.29 0.22 0.06 4.06 0.05项圈藻 Anabaenopsis sp.7.14 0.06 0.00 0.43 0.01硅藻门Bacillariophyta针杆藻 Synedra sp.14.29 0.45 0.01 6.58 0.08脆杆藻 Fragilaria sp.42.86 0.84 0.15 42.10 0.51平板藻 Tabellaria sp.7.14 1.56 0.05 11.53 0.14舟形藻 Navivula sp.7.14 29.15 0.27 210.14 2.55羽纹藻 Pinnularia sp.21.43 40.30 0.37 871.53 10.57曲壳藻 Achnanthes sp.7.14 0.06 0.01 0.43 0.01桥弯藻 Cymbella sp.21.43 0.22 0.00 4.83 0.06卵形藻 Cocconeis sp.42.86 3.29 0.06 143.33 1.74菱形藻 Nitzschia sp.42.86 1.90 0.03 82.39 1.00棒杆藻属 Rhopalodia sp.7.14 0.06 0.00 0.40 0.00小环藻 Cyclotella sp.42.86 1.62 0.11 73.88 0.90短缝藻属 Eunotia sp.21.43 0.17 0.00 3.66 0.04双壁藻 Diplogeis sp.7.14 0.06 0.00 0.40 0.00异极藻 Gomphonema sp.7.14 0.06 0.11 1.16 0.01根管藻 Rhizosolenia sp.21.43 0.22 0.01 4.97 0.06绿藻门Chlorophyta小球藻 Chlorella sp.21.43 1.56 0.08 35.21 0.43纤维藻 Ankistrodesmus sp.7.14 0.06 0.00 0.40 0.00胶囊藻 Gloeocystis sp.7.14 0.06 0.01 0.44 0.01绿球藻 Chlorococcum sp.7.14 0.06 0.00 0.41 0.00球囊藻 Sphaerocystis sp.7.14 0.11 0.15 1.85 0.02转板藻 Mougeotia sp.7.14 0.22 0.13 2.52 0.03黄藻门Xanthophyta黄丝藻 Tribonema sp.14.29 0.22 0.07 4.18 0.05甲藻门Dinophyta原生动物Protozoa软体动物门Mollusca节肢动物门Arthropoda多甲藻 Peridinium sp.7.14 0.06 0.01 0.47 0.01变形虫 Amoeba sp.14.29 0.11 0.51 8.89 0.11淡水壳菜 Limnoperna lacustris 7.14 3.62 6.64 73.31 0.89摇蚊幼虫 Chironomus larvae 7.14 0.01 0.51 3.73 0.05有机碎屑Organic detritus 64.29 12.60 90.41 6621.65 80.30
3.2 银鮈肠道形态和异速生长特征
银鮈属无胃鲤科鱼类,其进化程度不如高等脊椎动物。因此,肠道并没有严格意义上的分区。本研究采用大部分学者意见,将其肠道划分成前、中、后三部分[33-34]。从形态学指数来看,银鮈前肠最重且最发达,中肠和后肠差异不显著。李茜[35]研究表明,异育银鲫肠道前部的横截面积较大且管径较粗,中肠与后肠部分横截面积变小,以至于很难区分二者的分界线。本研究结果发现,银鮈中肠和后肠也存在相似特征,这与李茜[35]的研究结果基本一致。
在鱼类中,重要器官优先发育,次要器官延缓发育,这是生物体适应环境的表现[36]。鱼类异速生长的发育模式提高了仔鱼逃避天敌和觅食的能力,从而帮助鱼类更好地适应复杂生境,保证其存活率[11]。本研究结果显示,银鮈的肠道存在异速生长模式,其前肠和整体肠道在幼鱼阶段快速生长,到后期变为等速生长。无胃鱼类,前肠是其最重要的食物消化场所,也是其摄取营养物质的重要场所。本研究发现,银鮈前肠在幼鱼时为快速生长,这一策略能够帮助银鮈幼鱼最大限度地快速消化食物,获取自身生长发育所需的营养,促进其在幼鱼时期较快速生长发育,以尽快适应复杂环境,同时也可以提高存活率。总体而言,银鮈肠道的异速生长模式可能与其对生活环境的适应息息相关,这可能也是其能广泛分布的原因之一。本研究仅对银鮈肠道的生长模式进行了探讨,后续有待开展更多相关研究以期更好地了解其生长模式与生境适应关系。
3.3 银鮈异速生长和食物组成变化间关系及生物学意义
研究表明,肠道的异速生长可能与其功能分化以及能量摄入相适应[5]。本研究中,银鮈前肠的快速生长可以有效提高银鮈对饵料的消化能力,促进摄食频率的提高,从而满足鱼体快速生长所需的大量能量。而银鮈中肠粘膜层上的细胞表面具有密集的微绒毛,且粘膜压缩形成许多皱褶。这种组织结构的分化使饵料在中肠的停留时间延长,同时增大了饵料与消化液的接触面积,通过中肠的快速生长,饵料被吸收更加充分,从而提高了能量的吸收效率。银鮈后肠发达程度最低,管径最小,长度最长,维持等速生长使食物残渣排出体外。在银鮈肠道发育过程中,拐点后食物出现了变形虫、淡水壳菜,且藻类种类增多。据此我们推测,由于银鮈在拐点后已为成体,其消化能力和对环境的适应能力均有所增强,使得银鮈前肠生长速度变慢,此后银鮈通过改变食物类型,一定程度上可以减少了种内食物竞争;此外,在拐点前,银鮈摄入更多的肉质饵料(摇蚊幼虫,质量百分比21.16%),小个体鱼类摄入更多优质饵料能够快速生长,从而更快适应环境,这一策略有助于该物种种群的壮大,这与异齿裂腹鱼(Schizothorax oconnori)[21]和拉萨裸裂尻鱼(Schizopygopsis younghusbandi younghusbandi)[37]的生长策略相同。上述现象可能是银鮈肠道自身发育及长期与环境适应的结果。
4 结论
嘉陵江中游银鮈前肠、中肠、后肠在其长度、质量、发达程度等方面均存在显著差异。其中,银鮈前肠和整体肠道存在异速生长,中肠保持快速生长,后肠保持等速生长。其前肠与整体肠道表现出异速生长模式,这可能与肠道各分区功能密切相关,这一结果应是其对环境长期适应的结果。食性分析结果表明,嘉陵江中游银鮈食物来源广泛,属于杂食性鱼类,主要摄食有机碎屑、藻类、软体动物、水生昆虫。在前肠拐点前,银鮈(全长<129.39 mm)摄入更多肉食性饵料(质量百分比21.16%),而拐点后(全长≥129.39 mm),肉食性饵料比例降低,这可能是银鮈肠道发育及长期与环境适应的结果。
[1] 张守栋,杨传华,林恭华,张同作,苏建平.高寒草甸3种啮齿类动物消化道器官形态的比较研究[J].四川动物,2014, 33(6):868-873.doi: 10.3969 /j.issn.1000-7083.2014.06.011.ZHANG S D, YANG C H, LIN G H, ZHANG T Z, SU J P.Comparative studies on the alimentary tract of three herbivorous rodents in alpine meadow[J].Sichuan Journal of Zoology, 2014, 33(6):868-873.doi:10.3969/j.issn.1000-7083.2014.06.011.
[2] 杜佳,徐革锋,韩英,牟振波.鱼类消化道组织学研究进展[J].水产学杂志,2009, 22(4):56-64.DU J, XU G F, HAN Y, MU Z B.Research progress in the histology of the digestive tract of fish[J].Chinese Journal of Fisheries, 2009, 22(4):56-64
[3] 何敏,张宇,方静.重口裂腹鱼消化道黏液细胞类型及分布研究[J].淡水渔业,2007, 37(2):24-26.HE M, ZHANG Y, FANG J.The study of the mucous cells in the digestive of Schizothorax davidi [J].Freshwater Fisheries, 2007, 37(2):24-26.
[4] GANGULY A P,谭情,肖光明,肖克宇.鱼消化道微生物在消化和代谢中的作用[J].中国水产,2012(8):68-69.GANGULY A P, TAN Q, XIAO G M, XIAO K Y.The role of fish digestive tract microorganisms in digestion and metabolism[J].China Fisheries, 2012(8):68-69.
[5] 张臣,曾燏,彭艳,蒋朝明,胡月,龚建涵,杨少荣.嘉陵江下游蛇鮈肠道形态结构及其异速生长模式[J].水产学报,2018, 42(4):503-512.doi: 10.11964/jfc.20170410803.ZHANG C, ZENG Y, PENG Y, JIANG C M, HU Y, GONG J H,YANG S R.Morphological structure and allometric growth pattern of Saurogobio dabryi intestine in the lower reaches of Jialing River[J].Journal of Fisheries of China, 2018, 42(4):503-512.doi: 10.11964/jfc.20170410803.
[6] 贾瑞锦,陈超,李炎璐,孙曙光,王鲁,于欢欢,孔祥迪,吴坚,曲江波,赵从明.条纹锯鮨(Centropristis striata)仔、稚、幼鱼形态发育的异速生长模式[J].渔业科学进展,2014, 35(5):128-133.doi:10.11758/yykxjz.20140519.JIA R J, CHEN C, LI Y L, SUN S G, WANG L, YU H H, KONG X D, WU J, QU J B, ZHAO C M.Early development and the allometric growth pattern of Centropristis striata[J].Progress in Fishery Sciences, 2014, 35(5):128-133.doi: 10.11758/yykxjz.20140519.
[7] HUXLEY J S,TEISSIER G.Terminology of relative growth [J].Nature, 1936,137:780-781.doi: 10.1038/137780b0.
[8] 张强.植物光合-呼吸速率与个体大小以及氮元素含量间异速生长规律研究[D].兰州:兰州大学,2011.ZHANG Q.A study of the allometric scaling law on the plant photosynthetic and respiratory rates, in relation to plant body size and nitrogen content[D].Lanzhou:Lanzhou University, 2011.
[9] 李军,韩英伦,徐磊,马庆华,宋涛,董彦娇,刘欣,逄越,李庆伟.日本七鳃鳗胚胎发育及卵黄囊期仔鱼的异速生长[J].水生生物学报,2017, 41(6):1207-1217.doi: 10.7541/2017.150.LI J, HAN Y L, XU L, MA Q H, SONG T, DONG Y J, LIU X, PANG Y, LI Q W.Embryological stages and allometric growth during yolksac larvae of Lampetra japonica (Martens)[J].Acta Hydrobiologica Sinica, 2017, 41(6):1207-1217.doi: 10.7541/2017.150.
[10] 程大川,马振华,江世贵.红鳍笛鲷仔、稚鱼异速生长[J].水生生物学报,2017, 41(1):206-213.doi: 10.7541/2017.26.CHENG D C, MA Z H, JIANG S G.Allometric growth in larval and juvenile crimson snapper Lutjanus erythopterus[J].Acta Hydrobiologica Sinica, 2017, 41(1):206-213.doi: 10.7541/2017.26.
[11] 宋洪建,刘伟,王继隆,唐富江.大麻哈鱼卵黄囊期仔鱼异速生长及其生态学意义[J].水生生物学报,2013, 37(2):329-335.doi:10.7541/2013.23.SONG H J, LIU W, WANG J L, TANG F J.Allometric growth during yolk-sac larvae of chum salmon (Oncorhynchus keta Walbaum) and consequent ecological sigificance[J].Acta Hydrobiologica Sinica,2013, 37(2):329-335.doi: 10.7541/2013.23.
[12] 吴水清,李加儿,区又君,吕国敏,刘江华.斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代仔、稚鱼的异速生长[J].中国水产科学,2014, 21(3):503-510.doi: 10.3724/SP.J.1118.2014.00503.WU S Q, LI J E, OU Y J, LYU G M, LIU J H.Allometric growth of hybrid grouper (Epinephelus coioides ♀×E.lanceolatus ♂) larvae and juveniles[J].Journal of Fishery Sciences of China, 2014, 21(3):503-510.doi: 10.3724/SP.J.1118.2014.00503.
[13] 丁瑞华.四川鱼类志[M].成都:四川科学技术出版社,1994.DING R H.The fishes of Sichuan[M].Chengdu: Sichuan Science and Technology Press, 1994.
[14] 孟庆闻,苏锦祥,缪学祖.鱼类分类学[M].北京:中国农业出版社,1995.MENG Q W, SU J X, MIU X Z.Ichthyology[M].Beijing: China Agriculture Press, 1995.
[15] 曹文宣.长江鱼类早期资源[M].北京:中国水利水电出版社,2008.CAO W X.The early life history of fish in the Yangtze River[M].Beijing: China Water Power Press, 2008.
[16] 李修峰.汉江中游银鮈的繁殖生物学和早期发育研究[D].武汉:华中农业大学,2008.LI X F.The reproductive bionomics and early development of Squalidus argentatus in the middle reaches of the Hanjiang River[D].Wuhan:Huazhong Agriculture University, 2008.
[17] 李修峰,黄道明,谢文星,杨汉运,常秀岭.汉江中游银鮈的胚胎发育[J].大连海洋大学学报,2005, 20(3):181-185.doi: 10.16535/j.cnki.dlhyxb.2005.03.003.LI X F, HUANG D M, XIE W X, YANG H Y, CHANG X L.The embryonic development of Squalidus argentatus in the middle reaches of Hanjiang River[J].Journal of Dalian Ocean University, 2005, 20(3):181-185.doi: 10.16535/j.cnki.dlhyxb.2005.03.003.
[18] 王海生,沈建忠,李霄,胡少迪,龚成,孙广文,黄丹.长江天鹅洲故道银鮈的年龄、生长和死亡率研究[J].水生态学杂志,2013, 34(2):7-13.doi:10.15928/j.1674-3075.2013.02.012.WANG H S, SHEN J Z, LI X, HU S D, GONG C, SUN G W, HUANG D.A study of the age, growth and mortality of Squalidus argentatus in Tian-e-zhou oxbow of Yangtze River[J].Journal of Hydroecology,2013, 34(2):7-13.doi:10.15928/j.1674-3075.2013.02.012.
[19] 青弘.嘉陵江流域鱼类多样性格局及中下游渔业资源变迁分析[D].重庆:西南大学,2010.QING H.Patterns of fishes diversity in Jialing River and resources vicissitude in the Middle and Lower Basin[D].Chongqing: Southwest University, 2010.
[20] 张富斌,王燕,肖瑾,曾燏.嘉陵江有毒鱼类的分布研究[J].长江流域资源与环境,2019, 28(12):2901-2909.doi: 10.11870/cjlyzyyhj201912011.ZHANG F B, WANG Y, XIAO J, ZENG Y.Study on distribution of ichthyotoxic fish in the Jialing River[J].Resources and Environment in the Yangtze Basin, 2019, 28(12):2901-2909.doi: 10.11870/cjlyzyyhj201912011.
[21] MA B S, XIE C X, HUO B, YANG X F.Feeding habits of Schizothorax oconnori Lloyd, 1908 in the Yarlung Zangbo River, Tibet[J].Journal of Applied Ichthyology, 2014, 30(2):286-293.doi: 10.1111/jai.12283.
[22] 张富斌.赤水河鱼类群落结构及主要鱼类营养关系研究[D].北京:中国科学院大学,2018.ZHANG F B.Fish community structure and trophic relationship of the dominant fish species in the Chishui River[D].Beijing:University of Chinese Academy of Sciences, 2018.
[23] ZHANG F B, LIU F, QIN Q, LIU H Z, CAO W X, GAO X.Diet composition and trophic guild structure of fish assemblage in headwaters of the Chishui River, a tributary of the upper Yangtze River,China[J].Environmental Biology of Fishes, 2018, 101(8):1235-1248.doi: 10.1007/s10641-018-0771-x.
[24] 胡鸿钧,魏印心.中国淡水藻类——系统、分类及生态[M].北京:科学出版社,2006.HU H J, WEI Y X.The freshwater algae of China-systematics,taxonomy and ecology[M].Beijing: Science Press, 2006.
[25] MORSE J, YANG L F, TIAN L X.Aquatic insects of China useful for monitoring water quality[M].Nanjing: Hohai University Press, 1994.
[26] 周凤霞,陈剑虹.淡水微型生物与底栖动物图谱[M].北京:化学工业出版社,2010.ZHOU F X, CHEN J H.The atlas of freshwater microbiome and benthic fauna[M].Beijng: Chemical Industry Press, 2010.
[27] 赵文.水生生物学[M].北京:中国农业出版社,2016.ZHAO W.Hydrobiology[M].Beijing: China Agriculture Press, 2016.
[28] KARACHLE P, STERGIOU K.Gut length for several marine fish: relationships with body length and trophic implications[J].Marine Biodiversity Records, 2010, 3(e106):1-10.doi: 10.1017/S1755267210000904.
[29] MUGGEO V.Segmented: an R package to fit regression models with broken-line relationships[J]. R News, 2008, 8(1):20-25.doi:10.1159/000323281.
[30] 熊冬梅.黑斑原鮡消化生理的研究[D].武汉:华中农业大学,2010.XIONG D M.The study of digestive physiology on Glyptosternum maculatum (Regan)[D].Wuhan:Huazhong Agriculture University,2010.
[31] 关海红,匡友谊,徐伟,尹家胜.哲罗鱼消化系统形态学和组织学观察[J].中国水产科学,2008, 15(5):873-879.GUAN H H, KUANG Y Y, XU W, YIN J S.Morphological and histological observations of digestive system in Hucho taimen[J].Journal of Fishery Sciences of China, 2008, 15(5):873-879.
[32] 殷红霞,张耀光,李萍,庹云.华鲮消化道组织学与组织化学的初步研究[J].淡水渔业,2005, 35(6):7-10.YIN H X, ZHANG Y G, LI P, TUO Y.Preliminary study on histology and histochemistry of Sinilabeo rendahli digestive tract[J].Freshwater Fisheries, 2005, 35(6):7-10.
[33] 倪达书,洪雪峯.草鱼消化道组织学的研究[J].水生生物学集刊,1963, 12(3):1-25.NI D S, HONG X F.Study on histology of grass carp digestive tract[J].Collected Papers of Hydrobiology, 1963, 12(3):1-25.
[34] 倪寿文,桂远明,刘焕亮.草鱼、鲤、鲢、鳙和尼罗罗非鱼肝胰脏和肠道蛋白酶活性的初步探讨[J].动物学报,1993, 39(2):160-168.NI S W, GUI Y M, LIU H L.Investigation on the comparison of protease activities in grass carp, common carp, silver carp, big head carp and Tilapia nilotica [J].Acta Zoologica Sinica, 1993, 39(2):160-168.
[35] 李茜.异育银鲫肠道组织形态学分析及肠道发育的营养调控[D].南京:南京农业大学,2007.LI Q.The study on intestinal histology and developing regulation of nutrients of Alogynogenetic crucian[D].Nanjing:Nanjing Agriculture University, 2007.
[36] 廖文波.两栖动物脑形态大小的进化权衡与生态适应研究进展[J].西华师范大学学报(自然科学版),2018, 39(1):1-5.doi: 10.16246/j.issn.1673-5072.2018.01.001.LIAO W B.The research progress of evolutionary tradeoff and ecological adaptation of anurans brain size[J].Journal of China west Normal University (Natural Science), 2018, 39(1):1-5.doi:10.16246/j.issn.1673-5072.2018.01.001.
[37] 杨雪峰,谢从新,马宝珊,霍斌,黄海平,张惠娟,许静.拉萨裸裂尻鱼的食性[J].淡水渔业,2011, 41(4):40-49.YANG X F, XIE C X, MA B S, HUO B, HUANG H P, ZHANG H J, XU J.Feeding habits of Schizopygopsis younghusbandi younghusbandi[J].Freshwater Fisheries, 2011, 41(4): 40-49.