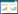文章信息
基金项目
- 国家重点研发计划项目(2018YFD0500300);国家农业行业标准制定与修订项目(农财发【2018】46号);国家农产品质量安全风险评估项目(GJFP201700702);广东省现代农业产业技术体系创新团队项目(2019KJ130)
作者简介
- 丁晨红(1982—),女,实验师,研究方向为畜产品检测,E-mail:54443166@qq.com.
通讯作者
- 李亚菲(1987—),女,博士,副研究员,研究方向为畜禽产品质量安全监测,E-mail:yafei.lee@163.com.
文章历史
- 收稿日期:2020-09-01
【研究意义】青霉素类药物属于β-内酰胺类抗生素,是兽医临床最常用的抗生素,被广泛应用于畜牧养殖业[1]。根据《饲料药物添加剂使用使用规范》及其补充说明,饲料中不得添加青霉素类药物。由于抗生素药渣中含有丰富的蛋白质和微量抗生素成分,在饲料和饲养过程中使用对动物有一定的促生长作用。2002年农业部176号公告明确禁止在饲料和动物饮用水中使用抗生素滤渣。我国农业农村部公告第194号规定,自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料。而近年来,在养殖饲料中违规添加使用阿莫西林等青霉素类药物以及青霉素药渣的情况屡见不鲜。青霉素及青霉素药渣的滥用会在动物体内产生药物残留,导致细菌产生耐药性,对养殖业造成严重危害,也会严重危害人体健康、破坏环境[2-4]。许多国家和地区对青霉素类药物在动物源性食品中的残留进行了严格限制,我国农业部公告第235号中规定动物肌肉中阿莫西林、氨苄西林、青霉素G、氯唑西林、苯唑西林的最高残留限量分别为50、50、50、300、300 μg/kg;欧盟指令No.2377/90/EEC规定动物肌肉中阿莫西林、氨苄西林、青霉素G、苯唑西林、氯唑西林、双氯西林、萘夫西林的最高残留限量分别为50、50、50、300、300、300、300 μg/kg。我国已制定动物源食品中青霉素类药物残留量的多个检测标准,研究饲料中青霉素类药物残留量检测方法对从饲料源头控制青霉素类药物的滥用和乱用具有重要现实意义。
【前人研究进展】目前对青霉素类药物残留的检测方法已有较多报道,包括免疫分析法[5-6]、毛细管电泳法[7-8]、微生物测定法[9]、高效液相色谱法[10-16]、液相色谱-串联质谱法[17-20]、电化学法[21]等;其中高效液相色谱法和液相色谱-串联质谱法具有操作简单、分离快、效率高等特点,是青霉素类药物残留检测的主流分析方法;而液相色谱-串联质谱法对仪器设备要求高,普通实验室的配置难以达到要求。相较而言,液相色谱法具有更好的实际应用前景。
【本研究切入点】青霉素类药物检测方法研究大多集中于动物体及蛋、奶中的残留,对于饲料样品中青霉素类药物含量检测的相关研究很少。饲料样品种类繁多、成分复杂、基质干扰强,高效液相色谱法测定青霉素类药物的应用受到一定制约,同时测定饲料中7种青霉素类药物含量的方法更鲜见报道。【拟解决的关键问题】本试验拟通过柱前衍生增强样品中青霉素类药物的紫外吸收,提高检测灵敏度,从而建立饲料中7种青霉素类药物的高效液相色谱检测方法,为饲料中青霉素类药物的测定提供支撑。
1 材料与方法 1.1 试验材料主要试剂:乙腈、甲醇(色谱纯,Merk公司);氢氧化钠、柠檬酸钠、磷酸氢二钠、乙二胺四乙酸二钠、苯甲酸酐、氯化汞、1, 2, 4-三氮唑、五水硫代硫酸钠、二水磷酸二氢钠、无水磷酸氢二钠、四丁基硫酸氢铵(分析纯,广州化学试剂厂);青霉素类药物标准品:阿莫西林、青霉素G、青霉素V、氨苄西林、苯唑西林、氯唑西林、双氯西林(纯度≥ 90.0%,德国Dr.Ehrenstrofer GmbH公司);亲水亲脂平衡型(HLB)固相萃取柱(200 mg/6 mL,Waters);0.22 μm微孔尼龙滤膜(津腾)。供试的配合饲料、浓缩料、精料补充料以及添加剂预混料为市售。
主要仪器:LC-30A高效液相色谱仪(日本岛津公司)、恒温水浴锅(上海一恒科技有限公司)、调速振荡器(上海比朗仪器制造有限公司)、5804R台式高速冷冻离心机(德国Eppendorf公司)、涡旋仪(美国Labnet公司)。
1.2 溶液配制1.2.1 标准储备溶液(1 000 μ g/mL)配置 称取适量青霉素类药物标准对照品(精确至0.01 mg),置于10 mL棕色容量瓶中,用50% 乙腈溶液溶解并定容至刻度,摇匀,于-20℃储藏,有效期1个月。
1.2.2 混合标准系列工作溶液(100 μ g/mL)配置 准确量取阿莫西林、青霉素G、青霉素V、氨苄西林、苯唑西林、氯唑西林、双氯西林标准储备液(1.2.1)各1 mL,置于同一10 mL容量瓶中,用50% 乙腈溶液稀释至刻度,-20℃储藏,有效期1个月。
1.2.3 EDTA-Mcllvaine缓冲溶液 分别称取柠檬酸钠0.96 g、磷酸氢二钠70.0 g、乙二胺四乙酸二钠37.2 g,加水溶解,定容至1 000 mL,用5 mol/L氢氧化钠溶液调节pH至8.0,混匀,临用现配。
1.2.4 衍生化溶液配置 称取1, 2, 4-三氮唑13.78 g于100 mL棕色瓶中,用60 mL水溶解,加入10 mL现配制的0.1 mol/L氯化汞溶液,用5 mol/L氢氧化钠溶液调节pH至9.0(±0.5),用水稀释至100 mL,溶液为浑浊状态。4℃避光保存,有效期3个月。
1.2.5 磷酸盐缓冲溶液配置 取五水硫代硫酸钠2.00 g,用水溶解,再加入二水磷酸二氢钠5.00 g、无水磷酸氢二钠2.50 g和四丁基硫酸氢铵3.25 g,用适量水溶解稀释到1 000 mL,过0.22 μm微孔尼龙滤膜。
1.3 样品前处理1.3.1 配合饲料、浓缩饲料、精料补充料 称取试样2 g于50 mL离心管中,加入20 mL 20%乙腈溶液,漩涡混合30 s,振荡20 min。10 000 r/min离心5 min,取500 μL上清液待衍生化。
1.3.2 添加剂预混合饲料 称取试样2 g于50 mL离心管中,加入20 mL EDTA-Mcllvaine缓冲液,漩涡混合30 s,超声10 min,10 000 r/min离心5 min,取上清液待净化。HLB固相萃取小柱依次用甲醇、水各5 mL活化,取5.0 mL样液过柱,先用3 mL水淋洗,抽干,加入5.0 mL乙腈洗脱,收集洗脱液,涡旋混匀后取500 μL待衍生化。
1.3.3 衍生化 向所得待衍生化试液中加入50 μL 0.01 mol/L苯甲酸酐溶液,涡旋混匀后50℃水浴反应5 min,冰浴快速冷却至室温后加入450 μL衍生化溶液,再次涡旋混匀后65℃水浴反应10 min,冰浴快速冷却至室温;4℃下10 000 r/min离心3 min,取上层清液过微孔滤膜,6 h内上机测定。
1.4 基质匹配标准工作溶液的制备取空白试样,按1.3.1或1.3.2处理得到空白基质溶液。在空白基质溶液中加入适量混合标准工作溶液(1.2.2),配制成浓度为0.50、0.75、1.00、2.00、5.00、10.00、20.00 μg/mL的基质匹配标准系列溶液。取该标准系列溶液各500 μL,按1.3.3步骤进行衍生化处理,所得基质匹配标准工作液衍生物,所得最终浓度分别为0.25、0.375、0.50、1.00、2.50、5.00、10.00 μg/mL,供上机测定。
1.5 色谱条件色谱柱:Agilent Symmetry Shield C18(250 mm ×4.6 mm,i.d 5μm);柱温:30℃;检测波长:325 nm;进样量:50 μL;流动相:A:磷酸盐缓冲溶液,B:乙腈;梯度洗脱:0~0.5 min 35%B,0.5 ~1.0 min B由35% 升至40%,1.0~6.0 min B由40% 升至50%,6.0~10 min B由50% 升至60% 并保持到12 min,12~13 mim B由60% 降至35% 并保持至16 min结束。
2 结果与分析 2.1 前处理方法优化本试验对配合饲料、浓缩饲料、精料补充料和添加剂预混合饲料采取两种方法进行前处理。对于配合饲料、浓缩饲料和精料补充料,分别选择水、20% 乙腈、50% 乙腈、80% 乙腈以及纯乙腈作为提取剂,对添加浓度10 mg/kg的样品进行回收试验。结果表明,20% 乙腈水溶液作为提取剂时,目标化合物的回收率高、杂质干扰少。对于添加剂预混合饲料,以EDTA-Mcllvaine缓冲溶液作为提取剂,通过HLB固相萃取小柱净化后,再进行衍生化反应。试验比较了震荡提取10、20、30 min和超声波提取10 min的提取效果差异,表明超声震荡提取10 min为最优提取方式,青霉素类药物的回收率范围在78.5%~103.3% 之间。
2.2 标准溶液及其衍生物的稳定性取7种青霉素混合标准溶液(10 μg/mL)于-20℃保存,考察阿莫西林、青霉素G、青霉素V、氨苄西林、苯唑西林、氯唑西林、双氯西林的稳定性,于第0、7、15、30天连续监测目标化合物浓度的变化,结果表明,目标化合物在-20℃条件下,1个月内稳定。将衍生后的7种青霉素类药物混合溶液(浓度为1.25 μg/mL)分别置于室温、4℃、-20℃保存,放置不同时间后,测定浓度变化,结果表明,7种青霉素类衍生物在室温下至少可保存6 h,在4℃至少可保存48 h,在-20℃至少可保存6 d。
2.3 方法专属性考察以β-内酰胺类抗生素(头孢曲松和羧苄西林)和喹诺酮类抗生素(氧氟沙星、达氟沙星、恩诺沙星、沙拉沙星)作为青霉素类药物检测的干扰物质,考察方法的专属性。7种青霉素类药物以及干扰物质经衍生化后的标准溶液色谱图见图 1,以上两类干扰物质均能与目标化合物有效分离。取空白饲料样品,加入7种青霉素类药物标准溶液(添加浓度为1.25 μg/mL)以及两类干扰物质(添加浓度为2.5 μg/mL)进行加标回收试验,结果表明,青霉素类药物目标峰附近无干扰峰出现,目标化合物加标回收率无明显区别,能达到检测要求,该方法专属性较好。
|
| 图 1 7种青霉素类药物和干扰物质标准溶液经衍生化后的液相色谱 Fig. 1 Chromatograms of seven penicillins and interfering substances standard solutions after derivatization |
2.4 线性范围、检出限与定量下限
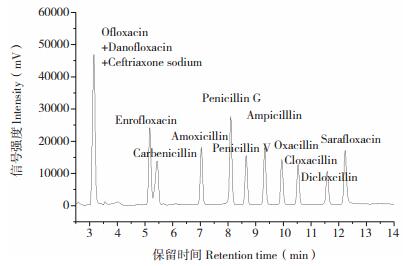
按照1.3制备基质匹配标准工作液衍生物,对于配合饲料、浓缩饲料和精料补充料使其浓度为0.25、0.375、0.50、1.00、2.50、5.00、10.00 μg/mL,对于添加剂预混料使其浓度为0.1、0.25、0.50、1.00、2.50、5.00、10.00 μg/mL。在优化试验条件下,以青霉素类药物衍生物的峰面积为纵坐标,浓度为横坐标,绘制标准曲线,结果表明:配合饲料、浓缩饲料和精料补充料中7种青霉素类药物在0.25~10 μg/mL范围内,添加剂预混合饲料中7种青霉素类药物在0.10~10 μg/mL范围内具有良好的线性关系,相关系数(r2)均在0. 99以上。在空白饲料中添加青霉素类药物标准品,按优化方法进行检测,以信噪比S/N ≥ 3计算方法的检出限(LOD);以S/N ≥ 10计算方法的定量限(LOQ)。结果测得7种青霉素类药物在配合饲料、浓缩饲料、精料补充料中的检出限为2.5 mg/kg,定量限为5.0 mg/kg;在添加剂预混合饲料中的LOD为1.0 mg/kg,LOD为2.0 mg/kg。7种青霉素类药物在4种饲料中定量添加浓度水平的信噪比见表 1。
|
2.5 添加回收和精密度实验
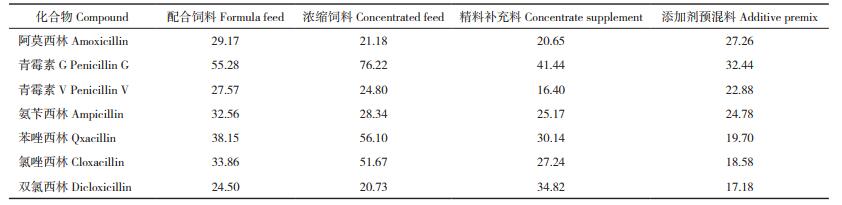
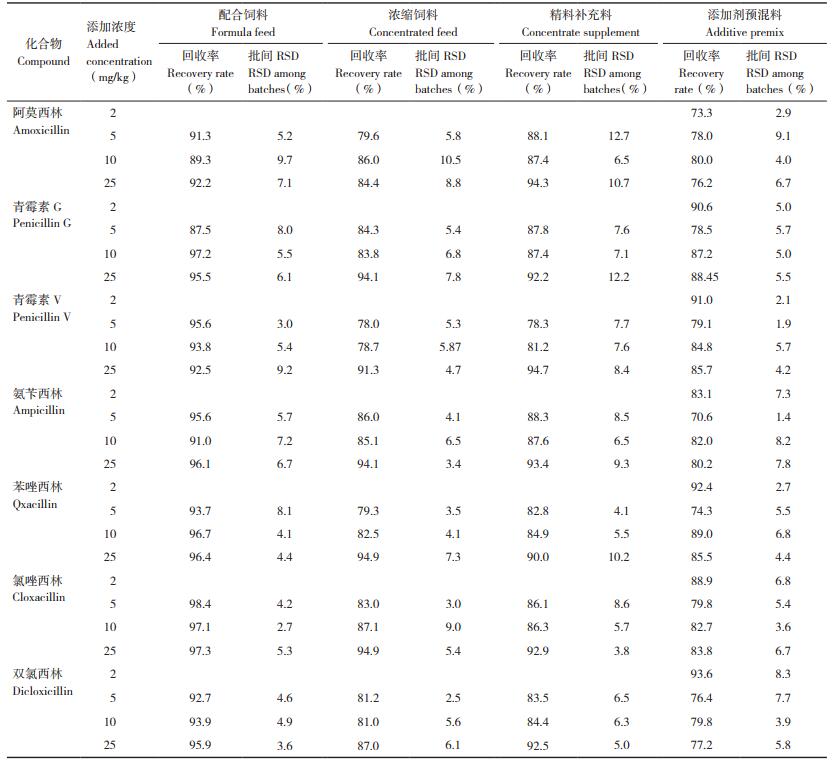
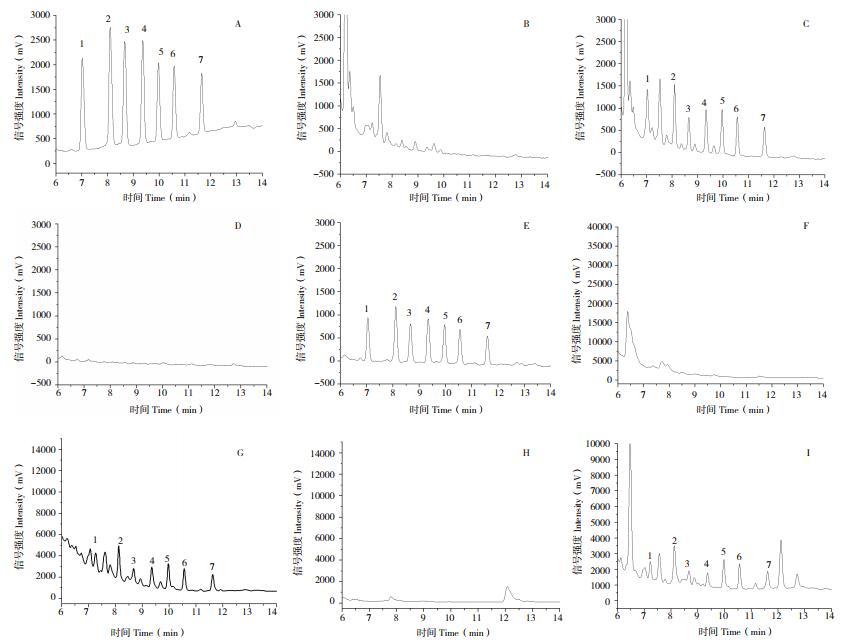
分别选取空白配合饲料、浓缩料、精料补充料添加5、10、25 mg/kg 3个不同浓度,空白添加剂预混料添加2、5、10、25 mg/kg 4个不同浓度进行添加回收试验,各浓度5个平行样品进行三批次测定,结果表明,7种青霉素类药物批内平均添加回收率在69.6%~103.9%,3批次总平均添加回收率在70.6%~98.4% 范围,批内及批间RSD均 < 15%。4种饲料中7种青霉素类药物3批次总平均添加回收率和批间RSD值见表 2。青霉素类药物标准溶液(0.5 μg/mL)、空白配合饲料、空白添加剂预混合饲料、空白精料补充料、空白浓缩料及其添加青霉素类药物标准品(添加剂预混料添加浓度为2 mg/kg,其他饲料添加浓度为5 mg/kg)的液相色谱图见图 2。
|
|
| 图 2 7种青霉素类药物衍生物的高效液相色谱 Fig. 2 HPLC Chromatograms of the derivatives of seven penicillin antibiotics A: 标准溶液standard solution;B: 空白配合饲料blank formula feed;C: 配合饲料加标standard addition of formula feed;D:空白添加剂预混料blank additive premix;E: 添加剂预混料加标standard addition of additive premix;F: 空白精料补充料blank concentrate supplement;G: 精料补充料加标standard addition of concentrate supplement;H: 空白浓缩饲料blank concentrated feed; I: 浓缩饲料加标standard addition of concentrated feed1:阿莫西林Amoxicillin;2:青霉素G Penicillin G;3:青霉素V Penicillin V;4:氨苄西林Ampicilllin;5:苯唑西林Oxacillin;6:氯唑西林Cloxacillin;7:双氯西林Dicloxcillin |
2.6 实际样品测定
随机抽取40批配合饲料、浓缩饲料、精料补充料和添加剂预混合饲料,用上述确立的方法进行测定,阿莫西林、青霉素G、青霉素V、氨苄西林、苯唑西林、氯唑西林和双氯西林均未检出。
3 讨论 3.1 检测波长的选择本研究选择将青霉素类药物通过衍生化生成特异性的青霉酸硫醇汞盐,在325 nm波长下进行检测。由于多数青霉素类化合物无专一的紫外吸收团,其最大吸收值一般都在200 ~ 235 nm之间,而样品基质在此紫外吸收区域存在很高的背景干扰,另外青霉素类药物的稳定性也很差[22]。参考农业部781号公告-11-2006《牛奶中青霉素类药物残留量的测定高效液相色谱法》及其他相关文献[10-16],先采用苯甲酸酐溶液将阿莫西林和氨苄西林的氨基发生酰基化反应,再利用青霉素类药物的β-内酰胺在1, 2, 4-三氮唑作用下发生开环反应并与三氮唑结合,最后与氯化汞作用生成特异性的青霉酸硫醇汞盐,其最大紫外吸收波长为325 nm。通过衍生化反应大大减少了基质对目标峰的干扰,从而提高了检测方法的灵敏度和专属性。
3.2 样品提取剂的选择对于配合饲料、浓缩饲料和精料补充料,采用20% 乙腈水溶液作为提取剂时,目标化合物的回收率高,杂质干扰小。而对于添加剂预混合饲料,在用20% 乙腈水溶液提取时,目标化合物阿莫西林和氨苄西林的回收率近乎为零,其他5种药物回收率也无法满足要求,推测添加剂预混合饲料中的重金属、吸附剂等物质会影响青霉素类药物的提取率以及稳定性。采用EDTA-Mcllvaine缓冲溶液(pH=8.0)作为提取液时各药物回收率有显著提高。这可能与EDTA与添加剂预混合饲料中的金属离子形成络合物,从而改善提取与净化效果有关。然而,当提取液直接进行衍生化时,目标化合物的回收率仍为零,推测青霉素类药物在水相中衍生化过程发生了降解;当添加一定比例的乙腈,预期达到稳定目标化合物的目的时,由于提取液中盐含量较高,乙腈与水相发生了分层现象。因此,我们通过HLB固相萃取小柱将提取液切换成乙腈溶液,提高目标化合物在衍生化过程中的稳定性,从而达到检测要求。
4 结论本研究建立了饲料中阿莫西林、氨苄西林、青霉素G、青霉素V、苯唑西林、氯唑西林、双氯西林7种青霉素药物含量的柱前衍生高效液相色谱方法。配合饲料、浓缩饲料、精料补充料的检测限为2.5 mg/kg,定量限为5 mg/kg;添加剂预混合饲料的检测限为1.0 mg/kg,定量限为2.0 mg/kg;7种青霉素类药物线性关系良好,平均加标回收率在69.6%~103.9% 范围。该方法快速、准确、专属性及重现性好,适合日常饲料样品中7种青霉素类药物含量的测定。
| [1] |
陈杖榴, 曾振灵. 兽医药理学(第四版)[M]. 北京: 中国农业出版社, 2017. CHEN Z L, ZENG Z L. Veterinary Pharmacology(4th Edition)[M]. Beijing: China Agricultural Press, 2017. |
| [2] |
PHILIPPE, LAGACÉ-WIENS, ETHAN, RUBINSTEIN. Adverse reactions to β-lactamantimicrobials[J]. Expert Opinion on Drug Safety, 2012, 11(3): 381-399. DOI:10.1517/14710338.2012.643866 |
| [3] |
李振, 王云建. 畜禽养殖中抗生素使用的现状、问题及对策[J]. 中国动物保健, 2009, 11(7): 55-57. DOI:10.3969/j.issn.1008-4754.2009.07.013 LI Z, WANG Y J. Current situation, problems and countermeasures of antibiotic use in livestock and poultry breeding[J]. China Animal Health, 2009, 11(7): 55-57. DOI:10.3969/j.issn.1008-4754.2009.07.013 |
| [4] |
徐文豪. 畜牧业中青霉素类抗生素的兴衰引发的思考[J]. 养殖与饲料, 2019(9): 130-132. DOI:10.13300/j.cnki.cn42-1648/s.2019.09.056 XU W H. The rise and fall of penicillin antibiotics in animal husbandry[J]. Animals Breeding and Feed, 2019(9): 130-132. DOI:10.13300/j.cnki.cn42-1648/s.2019.09.056 |
| [5] |
尹致丹. 量子点荧光免疫法测定牛奶中氨苄青霉素残留的研究[D]. 北京: 中国农业科学院, 2019. YIN Z D. Quantum dots fluorescence immunoassay for ampicillin residue in milk[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. |
| [6] |
鞠守勇, 陈其国, 李莉. 利用青霉素结合蛋白检测青霉素类抗生素残留[J]. 食品研究与开发, 2018, 39(15): 144-148. DOI:10.3969/j.cnki.issn1005-6521.2018.15.028 JU S Y, CHEN Q G, LI L. Detection of penicillin antibiotic residues using penicillin binding protein[J]. Food Research and Development, 2018, 39(15): 144-148. DOI:10.3969/j.cnki.issn1005-6521.2018.15.028 |
| [7] |
孟欢欢. 青霉素类抗生素残留分析的前处理及HPCE检测方法研究[D]. 合肥: 安徽农业大学, 2008. DOI: 10.7666/d.y1394187. MENG H H. Studies on the pretreatment and determination method of HPCE in residues analysis of penicillin antibiotics[D]. Hefei: Anhui Agricultural University, 2008. DOI: 10.7666/d.y1394187 |
| [8] |
田春秋, 檀华蓉, 高丽萍, 沈虎琴, 祁克宗. 高效毛细管电泳法检测牛奶中的青霉素中间体以及3种青霉素类药物[J]. 色谱, 2011, 29(11): 1128-1132. DOI:10.3724/sp.j.1123.2011.01128 TIAN C Q, TAN H R, GAO L P, SHEN H Q, QI K Z. Determination of penicillin intermediate and three penicillins in milk by high performance capillary electrophoresis[J]. Chinese Jurnal of Chromatog raphy, 2011, 29(11): 1128-1132. DOI:10.3724/sp.j.1123.2011.01128 |
| [9] |
颜喜亚. 微生物法测定青霉素残留量的研究[J]. 河北省科学院学报, 2006(2): 84-86. DOI:10.16191/j.cnki.hbkx.2006.02.024 YAN X Y. Study on Deter mination of penicillin residue by microbiological method[J]. Journal of Hebei Academy of Sciences, 2006(2): 84-86. DOI:10.16191/j.cnki.hbkx.2006.02.024 |
| [10] |
ALAMPANOS V, KABIR A, FURTON K G, SAMANIDOU V, PAPADOYANNIS I. Fabric phase sorptive extraction for simultaneous observation of four penicillin antibiotics from human blood serum prior to high performance liquid chromatography and photo-diode array detection[J]. Microchemical Journal, 2019, 149. DOI:10.1016/j.microc.2019.103964 |
| [11] |
李雷霆, 刘均华, 刘宝涛, 付红蕾, 邹明. 高效液相色谱紫外法同时检测鸡蛋中5种青霉素类药物残留的研究[J]. 中国畜牧兽医, 2017, 44(8): 2483-2488. DOI:10.16431/j.cnki.1671-7236.2017.08.037 LI L T, LIU J H, LIU B T, FU H L, ZOU M. Residue analysis of five kinds of penicillins in eggs by high performance liquid chromatography-ultraviolet detection[J]. China animal Husbandry & Veterinary Medicine, 2017, 44(8): 2483-2488. DOI:10.16431/j.cnki.1671-7236.2017.08.037 |
| [12] |
HSIEH S H, HUANGH Y, LEE S. Determination of eight penicillin antibiotics in pharmaceuticals, milk and porcine tissues by nanoliquid chromatography[J]. Journal of Chromatography A, 2009, 1216(43): 7186-7194. DOI:10.1016/j.chroma.2009.05.080 |
| [13] |
王超, 李淑娟. 测定牛奶中5种青霉素残留量的高效液相色谱柱前衍生法[J]. 分析测试学报, 2000, 19(6): 72-74. DOI:10.3969/j.issn.1004-4957.2000.06.02 WANG C, LI S J. Deter mination of 5 penicillin residues in milk by HPLC with pre-column derivatization[J]. Journal of Instrumental Analysis, 2000, 19(6): 72-74. DOI:10.3969/j.issn.1004-4957.2000.06.02 |
| [14] |
刘建宇, 高强, 谢恺舟, 崔璐璐, 刘亚楠, 王波, 张扬扬, 张跟喜, 戴国俊, 王金玉. 鸡排泄物中阿莫西林和氨苄西林残留同时检测的高效液相色谱荧光法[J]. 扬州大学学报(农业与生命科学版), 2015, 36(3): 36-40. DOI:10.16872/j.cnki.1671-4652.2015.03.009 LIU J Y, GAO Q, XIE K Z, CUI L L, LIU Y N, WANG B, ZHANG Y Y, ZHANG G X, DAI G J, WANG J Y. Simultaneous determination of residues of amoxicillin and ampicillin in chicken excrement by HPLC with fluorescence detection[J]. Journal of Yangzhou University (Agricultural and Life Sciences Edition), 2015, 36(3): 36-40. DOI:10.16872/j.cnki.1671-4652.2015.03.009 |
| [15] |
国家质量监督检验检疫总局, 国家标准化管理委员会. 饲料中氨苄青霉素的测定高效液相色谱法GB/T 23385-2009[S]. 北京: 中国标准出版社, 2009. General Administration of quality supervision, inspection and Quarantine of the people's Republic of China, State Administration of standardization. Determination of ampicillin in feed-High performance liquid chromatography GB/T 23385-2009[S]. Beijing: China Standard Press, 2009. |
| [16] |
张小燕. 液相色谱法检测饲料中青霉素类残留量[J]. 轻工标准与质量, 2015(1): 53-54. DOI:10.19541/j.cnki.issn1004-4108.2015.01.026 ZHANG X Y. Determination of penicillin residues in feed by liquid chromatography[J]. Light Industry Standard and Quality, 2015(1): 53-54. DOI:10.19541/j.cnki.issn1004-4108.2015.01.026 |
| [17] |
GOTO T, ITOY, SYAMADAS, MATSUMOTO H, OKA H. Highthroughput analysis of tetracycline and penicillin antibiotics in animal tissues using electrospray tandem mass spectrometry with selected reaction monitoring transition[J]. Journal of Chromatography A, 2005, 1100(2): 193-199. DOI:10.1016/j.chroma.2005.09.056 |
| [18] |
刘楚君, 郭亚文, 卜晓娜, 王雅娟, 赵霞, 王波, 谢恺舟. 动物性食品中青霉素类药物残留色谱与质谱检测技术研究进展[J]. 中国兽医学报, 2019, 39(4): 800-807. DOI:10.16303/j.cnki.1005-4545.2019.04.33 LIU C J, GUO Y W, BU X N, WANG Y J, ZHAO X, WANG B, XIE K Z. Research progress in chromatographic and mass spectrometry detection of penicillin residues in animal derived foods[J]. Chinese Journal of Veterinary Science, 2019, 39(4): 800-807. DOI:10.16303/j.cnki.1005-4545.2019.04.33 |
| [19] |
陈瑞春, 贾海涛, 艾连峰, 郭春海. 高效液相色谱-串联质谱法测定牛奶和奶粉中9种青霉素类药物残留量[J]. 食品科学, 2011, 32(18): 249-252. CHEN R C, JIA H T, AI L F, GUO C H. Determination of nine penicillin residues in milk and milk powder by HPLC-MS/MS[J]. Food Science, 2011, 32(18): 249-252. |
| [20] |
陈娟, 翟纹静. 高效液相-串联质谱法测定猪肉中7种青霉素残留量[J]. 肉类工业, 2019(10): 47-51. CHEN J, ZHAI W J. Determination of seven kinds of penicillin residues in pork by high performance liquid chromatography-mass spectrometry[J]. Meat Industry, 2019(10): 47-51. |
| [21] |
YU Z G, CUI P, XIANG Y K J, LI B, ZHANG G. Developing a fast electrochemical aptasensor method for the quantitative detection of penicillin G residue in milk with high sensitivity and good anti-fouling ability[J]. Microchemical Journal, 2020, 157. DOI:10.1016/j.microc.2020.105077 |
| [22] |
姜力群, 嵇元欣, 刘晶锦, 李倩, 胡育筑. 青霉素类抗生素稳定性的影响因素及有关物质测定方法[J]. 药学进展, 2008, 32(2): 62-68. JIANG L Q, JI Y X, LIU J J, LI Q, HU Y Z. Affecting factors of penicillins' stability and determination of related substances[J]. Progress in Pharmaceutical Sciences, 2008, 32(2): 62-68. |
 2021, Vol. 48
2021, Vol. 48