文章信息
基金项目
- 广东省乡村振兴战略专项(2021KJ382);广东省自然科学基金(2018A0303130310,2021A1515011107);广东省农作物种质资源专项(省长专项2018-2019);广东省重点实验室运行费专项(2020B1212060047)
作者简介
- 丁杰荣(1993—),男,硕士,研究方向为水稻种质资源优异基因挖掘,E-mail:995267470@qq.com; 刘清,博士,副研究员,硕士生导师,现任广东省农业科学院水稻研究所遗传资源研究室副主任。主要从事水稻耐热及稻瘟病相关基因的挖掘与功能研究,主持国家重点研发计划子课题1项、国家青年基金1项、广东省自然科学基金2项,参与多项国家自然科学基金、国际合作重大项目、广东省自然科学基金、广东省科技计划重大项目和重点项目等研究。以第一作者或通信作者(含共同)在Biotechnology Advances、Journal of Integrative Plant Biology、Molecular Plant Microbe Interactions、Plant Molecular Biology、Frontiers in Plant Science、BMC Plant Biology、The Crop Journal、Rice、Febs Letters、Biochemical Biophysical Research Communications等期刊发表SCI论文15篇,获得授权发明专利3项.
通讯作者
- 刘清(1985—),女,博士,副研究员,研究方向为水稻种质资源优异基因挖掘,E-mail:liuqing@gdaas.cn.
文章历史
- 收稿日期:2021-08-04
2. 广州国家现代农业产业科技创新中心,广东 广州 510520
2. National Modern Agricultural Industry Science and Technology Innovation Center of Guangzhou, Guangzhou 510520, China
水稻起源于低纬度的热带地区,形成了适应高温和短日照生态环境的生长习性。但水稻生长发育受温度影响较大,以孕穗至抽穗扬花期对温度最敏感,此阶段水稻的最适温度为25~30℃,如遇日均温度高于32℃或日最高温度高于35℃,水稻会出现花器官发育不全、花粉发育不良且活力下降,同时开花散粉和花粉管伸长也会受阻,导致大量空秕粒形成,从而造成严重的产量损失和品质下降[1-6]。
随着全球工业化进程的加速,全球温室效应日益加剧。自1880—2012年,全球气温上升了0.85 ℃,预计到21世纪末将增加1.5~4.5 ℃,极端高温出现频率将大幅提高[7]。Peng等[8] 20多年跟踪研究发现,全球气温每升高1 ℃,水稻产量将下降10%。异常高温已对我国的水稻生产造成了严重影响。2010年和2013年,我国长江中下游地区发生了大范围的持续高温,2013年江苏省许多地区甚至出现长达45 d的持续高温天气,导致该地区水稻严重减产[9-10]。高温热害天气越来越频繁,已成为水稻生产的主要灾害性气候之一[6, 11-12],解决水稻热害问题刻不容缓。
目前,培育耐热水稻品种被认为是解决热害问题最经济、最有效的途径。然而,利用常规方法开展水稻耐热性育种非常困难,一是水稻热害研究的条件(尤其是自然条件下的环境温度)难以控制;二是水稻的耐热性是由多个基因控制的数量性状,遗传机理较为复杂[13]。深入了解水稻耐热的分子机理,开展高效准确的分子育种,水稻耐热问题将有望解决。近年来,随着测序技术的迅猛发展和功能基因组学研究的不断进步,水稻耐热性的相关研究取得了较大进展,定位了一些与水稻耐热性相关的QTL,部分相关功能基因被成功克隆。此外,水稻耐热分子机理的研究也取得了一定进展。本文就水稻耐热性相关QTL的鉴定、功能基因的克隆及分子机理研究等方面进行综述,以期为水稻耐热分子育种的开展提供理论参考。
1 水稻耐热相关QTL的鉴定近年来,随着分子标记技术的发展以及对水稻热害的高度重视,水稻耐热性分子机理的研究已取得了一定进展。国内外迄今已定位80个以上水稻耐热QTL,这些QTL分布于12条染色体上[13-27]。
1.1 耐热QTL的定位水稻在孕穗和抽穗灌浆期对高温比较敏感,目前定位的耐热QTL大部分是孕穗、抽穗开花和灌浆结实期相关的QTL,只有少数是苗期相关的QTL。耐热和热敏感亲本杂交后代的重组自交系是定位耐热QTL的重要材料。陈庆全等[14]利用T219和T226构建的重组自交系,两年间共定位了6个抽穗开花期耐热性主效应QTL,分别位于第2、3、8、9、12号染色体上,qHt2、qHt3、qHt8和qHt12来自T226,qHt9a和qHt9b来自T219,其中qHt3在两年实验中都被定位到,有潜在的分子育种应用价值[14]。Jagadish等[15]利用Bala和Azucena构建的重组自交系定位了分布在第1、2、3、8、10、11号染色体上的8个耐热QTL,其中1个QTL对表型贡献率高达18%。Tazib等[16]利用Nipponbare和Kasalath构建的回交重组自交系,以花药长度等作为性状指标,共定位了12个耐热QTL。盘毅等[17]利用996和4628构建的重组自交系,定位了2个花粉育性相关的耐热QTL,其中qPF4可使水稻在高温下花粉可育率提高7.15%,qPF6同样能提高水稻在高温下的花粉可育率。Ps等[18]利用N22和IR64构建的重组自交系也定位了5个耐热QTL,分别位于第3、5、9、12染色体上,其中一个主效QTL与前期定位的QTL重叠(qSTIY5.1/qSSIY5.2),另一个主效QTL(qSTIPSS9.1)为新定位的耐热QTL。
除重组自交系外,研究人员构建的近等基因系、染色体片段代换系和渗入系也是定位水稻耐热QTL的重要材料。曹志斌等[19]利用元江普通野生稻荷花塘3号为供体、籼稻恢复系蜀恢527为轮回亲本构建的种间近等基因系成功定位到qHTH5,其在F2和F3代的表型贡献率分别为8.6% 和19.4%。Li等[20]利用Liaoyan241和IAPAR-9构建的近等基因系,以水稻结实率为性状指标,定位了11个耐热QTL,其中qNS1、qNS4、qNS6和qRRS4等4个主效QTL能稳定地在不同年份或环境中被定位到。张昌全等[21]利用以日本晴和9311构建的染色体片段代换系定位了3个耐热性QTL。奎丽梅等[22]利用遗传背景为特青的云南元江野生稻渗入系材料,在第1、3、8、10号染色体上各定位了1个抽穗开花期耐热相关QTL。
上述是孕穗、抽穗开花和灌浆结实期的水稻耐热QTL,而有关苗期耐热QTL报道较少。Kilasi等[23]利用N22和IR64构建的近等基因系对水稻幼苗进行热害处理,以根长和株高为性状指标,共定位到10个耐热QTL,其中rlht5.1、slht6.1/slpc6.1、slpc2.1、slpc10.2和slpc10.3的表型贡献率都超过10%。而Lei等[24]利用与奎丽梅相同的材料[22],也定位到5个苗期耐热性相关QTL,其中位于3号染色体的耐热性QTL与奎丽梅等[22]定位的qHT3位置相近,说明苗期耐热性与抽穗开花期耐热性具有一定的相关性。
1.2 耐热QTL间的互作水稻耐热性是由多基因控制的数量性状,单个耐热QTL起作用的同时,不同耐热QTL间的互作也对水稻耐热性起重要作用。赵志刚等[25]定位的7个耐热QTL分布在4条染色体上,它们的表型贡献率为6.4%~19.7%,加性效应为-21.3%~20.9%。曹立勇等[26]利用IR64和Azucena花药培养的DH群体定位到6个开花结实相关的具有加性效应的耐热QTL,这6个QTL能提高结实率4.33%~10.37%;此外,在第1、2、3、4、5、7、8、11等8条染色体间还检测到8对加性×加性上位性效应,其贡献率为2.27%~8.13%。陈庆全等[14]在定位水稻耐热QTL时也检测到7对上位性QTL,位于第1、2、4、11、12染色体上的4对QTL间,以及位于第2、3、4、7、8、9染色体上的3对QTL间分别存在互作效应。朱昌兰等[27]定位到3个灌浆期耐热性主效QTL,并检测到8对上位性互作QTL位点,它们对粒重变化的贡献率为2.45%~5.29%。不同耐热QTL表型贡献率差异较大,主效QTL的定位及对应基因的克隆对水稻耐热品种的选育意义重大。但不同QTL之间错综复杂的互作使水稻耐热QTL的定位困难重重,水稻耐热基因的克隆难度很大。
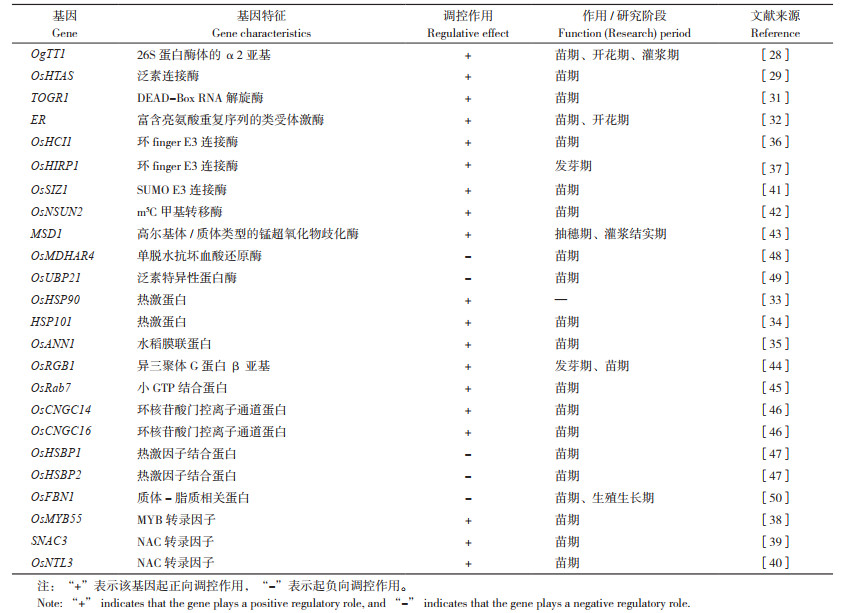
2 水稻耐热相关功能基因的克隆水稻耐热性是由多基因控制的复杂性状,且难以准确进行表型鉴定,因此水稻耐热功能基因的克隆鉴定显得尤为困难。目前,仅有不到30个水稻耐热相关基因被克隆鉴定,其中多数基因是通过反向遗传学方式克隆鉴定得到,仅有少数几个基因由正向遗传学手段克隆鉴定得到。克隆鉴定所得的水稻耐热相关基因多数编码蛋白质,其中11个基因编码蛋白酶类,10个基因编码热激蛋白等其他蛋白质,3个基因是转录因子(表 1)。
2.1 通过正向遗传学方式克隆功能基因
通过正向遗传学手段克隆的水稻耐热基因对水稻耐热性均起正向调控作用。Li等[28]以生长于热带的非洲稻为材料,通过与亚洲栽培稻杂交构建遗传群体,并进一步进行遗传分析和定位克隆,成功分离克隆了控制非洲稻的一个耐高温主效QTL的功能基因OgTT1(Oryza glaberrima Thermo-tolerance 1)。OgTT1编码一个26S蛋白酶体的α2亚基,在泛素化介导的蛋白降解通路中发挥重要作用。过表达OgTT1能够显著增强水稻在苗期、开花期和灌浆期的耐热性[28]。Wei等[30]以耐热水稻品系HT54(源自广陆矮4号)与热敏感品系HT13(源自籼稻05- 占)构建遗传群体,定位了调控水稻苗期耐热的主效位点OsHTAS(Oryza sativa Heat Tolerance at Seeding Stage)。进一步研究表明,OsHTAS编码一个泛素连接酶,过表达OsHTAS能显著增强水稻的苗期耐热性[23]。Wang等[31]从籼稻品种中籼3037自然突变体中克隆到耐热功能基因TOGR1(Thermotolerant Growth Required 1),该基因编码一个DEAD-Box RNA解旋酶,其表达同时受到温度和昼夜节律的调控,且与日常温度的波动紧密相关,温度升高会直接增强其解旋酶活性,TOGR1转录水平的变化还与株高呈正相关,过表达TOGR1会使水稻在高温条件下生长更好。此外,Shen等[32]从拟南芥中分离得到了1个富含亮氨酸重复序列的类受体激酶基因ER(Receptor-like Kinase ERECTA),在水稻中过表达ER基因能显著增强水稻的耐热性。“高ER水稻”与野生型植株相比,在高温条件下的结实率显著增加;反之,在水稻中功能性突变ER的同源基因会显著降低植株的耐热性[32]。
2.2 通过反向遗传学方式克隆功能基因目前通过反向遗传学手段克隆鉴定的水稻耐热基因有20多个,其中多数基因起正向调控作用,仅有几个基因起负向调控作用(表 1)。
2.2.1 发挥正向调控作用的功能基因 热激蛋白(Heat Shock Protein,HSP)是植物热信号传导通路中的重要组成部分。在酵母细胞中过表达水稻OsHSP90基因能显著增强细胞在42、50、70 ℃下的耐热能力[33]。此外,Lin等[34]研究发现,HSP101通过与热相关蛋白HSA32(Heat Stressassociated 32-kd Protein)的互作,在水稻苗期的基础耐热性和后天长期的耐热性驯化中发挥了重要的调控作用。OsANN1是水稻膜联蛋白家族中的一个成员,其表达受高温处理显著诱导[35]。过表达OsANN1能显著改善水稻在高温条件下的生长,而OsANN1的基因敲除株对高温热害更加敏感[29]。OsHCI1(Oryza sativa Heat and Cold Induced 1)编码一个环finger E3连接酶,也受高温诱导[36]。在正常生长条件下,该基因定位于高尔基体中,且能够沿着细胞骨架快速移动,但是在受到高温处理后,OsHCI1可能累积在细胞核中[36]。在拟南芥中过表达OsHCI1能显著增加植株在高温下的存活率[36]。与OsHCI1基因相似,OsHIRP1(Oryza sativa Heat-induced RING Finger Protein 1)也编码一个环finger E3连接酶,经45 ℃高温处理后,OsHIRP1主要在细胞核中富集,在拟南芥中过表达OsHIRP1能显著提高种子的发芽率[37]。此外,OsMYB55、SNAC3和OsNTL3基因的表达也受到高温热害的显著诱导。过表达OsMYB55显著改善水稻在高温条件下的生长,同时减小高温对产量的影响[38]。过表达SNAC3和OsNTL3的水稻植株耐热性显著增强,反之,SNAC3的基因沉默植株和OsNTL3的基因编辑植株对热害更加敏感[39-40]。
SUMO(Small Ubiquitin-related Modifier)化修饰是一个类泛素化的过程,在高等植物的生命活动中发挥重要作用。在匍匐翦股颖(Agrostis stolonifera L.)中过表达编码SUMO E3连接酶的OsSIZ1基因会使植株在高温条件下的耐热性显著增强[41]。转录后RNA修饰也广泛存在于活体生物中,其中一种丰富的mRNA转录后修饰方式就是胞嘧啶的5'端甲基化(m5C)修饰。编码m5C甲基转移酶的OsNSUN2基因在水稻耐热性中也发挥了重要调控作用,osnsun2突变植株的苗期耐热性显著降低[42]。Shiraya等[43]研究表明,高尔基体/ 质体类型的锰超氧化物歧化酶(Manganese SOD 1,MSD1)在耐热水稻品种中的表达量显著高于耐热性较低的水稻品种,持续高表达MSD1的植株在高温条件下的籽粒品质显著优于野生型植株的籽粒品质,反之,msd1敲除的水稻植株对热胁迫的反应更加敏感。此外,过表达编码水稻异三聚体G蛋白β亚基的OsRGB1显著增强转基因植株的发芽期和苗期耐热性[44]。过表达编码小GTP结合蛋白的OsRab7也使转基因水稻植株的苗期耐热性显著增强[45]。此外,已有研究表明钙信号在植物响应非生物胁迫过程中也发挥重要作用。Cui等[46]研究发现,OsCNGC14(Oryza sativa Cyclic Nucleotide-gated Ion Channel 14)和OsCNGC16(Oryza sativa Cyclic Nucleotide-gated Ion Channel 16)这两个环核苷酸门控离子通道蛋白正向调控水稻植株的耐热性。oscngc14/16双突变植株的苗期耐热性显著降低,且突变这两个蛋白的任何一个都可降低或者消除热胁迫诱导的胞质钙信号[46]。
2.2.2 发挥负向调控的功能基因 OsHSBP1(Oryza sativa Heat Shock Factor Binding Protein 1)、OsHSBP2(Oryza sativa Heat Shock Factor Binding Protein 2)、OsMDHAR4(Oryza sativa Monodehydroascorbate Reductase 4)、OsFBN1(Oryza sativa Fibrillin 1)和OsUBP21(Oryza sativa Ubiquitin-Specific Protease 21)在水稻耐热性中起负向调控作用。OsHSBP1和OsHSBP2编码HSF(Heat Shock Factor)结合蛋白,正常生长条件下它们广泛表达于各个组织,且在高温处理后的恢复期表达水平急剧上调[47]。过表达OsHSBP1或OsHSBP2的水稻植株对高温热害更加敏感,而OsHSBP1或OsHSBP2的基因沉默株系在高温条件下幼苗的存活率显著增加[47]。过表达编码一个单脱水抗坏血酸还原酶的OsMDHAR4会显著降低水稻植株在苗期的耐热性,而osmdhar4突变体植株的苗期耐热性显著增强[48]。此外,过表达编码质体- 脂质相关蛋白的OsFBN1显著降低水稻植株在苗期以及生殖生长期的耐热性[49],而基因敲除或者降低编码泛素特异性蛋白酶的OsUBP21的表达,可明显增强转基因植株的苗期耐热性[50]。
3 水稻耐热分子机制研究目前水稻耐热基因介导的耐热分子机制研究主要集中在以下方面:维持植物体内蛋白及rRNA的正常水平及稳定性、维持细胞膜的完整性和维持细胞内正常的活性氧(Reactive Oxygen Species,ROS)水平(图 1)[27-28, 31-32, 35, 39, 41, 43, 45]。
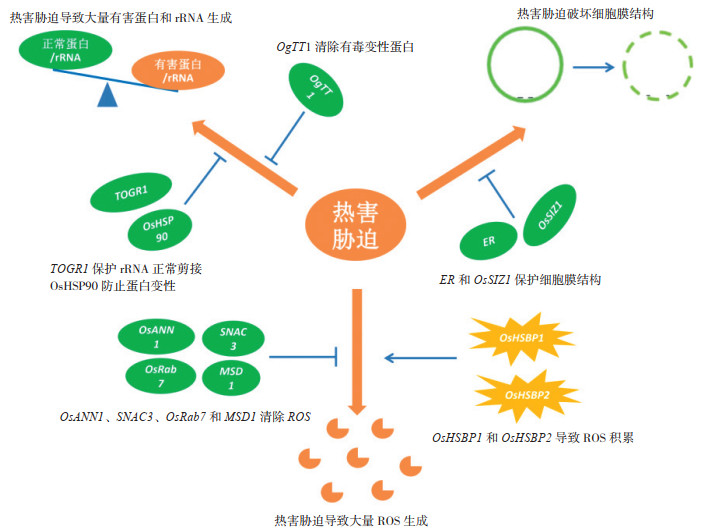
|
| 图 1 水稻耐热相关基因介导的分子机制 Fig. 1 Molecular mechanism mediated by heat tolerance related genes in rice 热害胁迫破坏细胞结构,导致大量有害蛋白/rRNA和ROS生成,ER/OsSIZ1通过保护细胞膜结构、TOGR1保护rRNA正常剪接、HSP70通过防止蛋白变性、OsANN1/SNAC3/OsRab7/MSD1通过清除ROS提高水稻的耐热性;而OsHSBP1/OsHSBP2导致ROS积累,减弱水稻的耐热性 Heat stress destroys the cell membrane structure and leads to the production of a large number of harmful proteins/rRNA and ROS. ER/OsSIZ1 protect the cell membrane structure, TOGR1 protects the normal splicing of rRNA, HSP70 prevents protein denaturation and OsANN1/SNAC3/OsRab7/MSD1 scavenge ROS to improve the heat tolerance of rice, while OsHSBP1/OsHSBP2 lead to the accumulation of ROS and weakens the heat tolerance of rice |
3.1 维持植物体内蛋白及rRNA的正常水平及稳定性
植物细胞在高温逆境下积累大量的变性蛋白,这些错误折叠的蛋白会对细胞产生毒性[51]。OsHSP90介导的耐热性与在高温条件下预防蛋白变性密切相关,而且温度越高,这种预防蛋白变性能力越强[27]。与热激蛋白预防蛋白变性不同,对OgTT1控制水稻高温抗性的机理研究表明,OgTT1在转录水平上对高温的响应更有效,而且其编码的蛋白使细胞中的蛋白酶体在高温下对泛素化底物的降解速率更快,促使水稻细胞中积累的有毒变性蛋白的种类和数量均显著降低,进而保护水稻细胞。该研究也揭示了植物细胞响应高温的新机制,即及时有效清除变性蛋白,对维持高温下胞内蛋白平衡至关重要;尤其在极端高温时,清除变性蛋白比复性变性蛋白的效率更高[28]。除了高温条件下维持蛋白的平衡外,水稻的耐热性与rRNA稳定性也密切相关。TOGR1作用于小亚基(SSU)rRNA前体的加工,即使在高温热害的条件下也能保证rRNA前体的正常剪切,因而能保持植物体内正常的rRNA水平[31]。
3.2 维持细胞膜的完整性非生物胁迫条件下,细胞膜的完整性与植物耐热性密切相关。对ER基因介导的耐热性机理研究表明,ER基因表达水平提高后,植物细胞膜在逆境下更完整,细胞不易死亡。细胞增多变大,组织器官与生物量也随之变大,使植株总体壮实得以增产[32]。高温胁迫下,过表达OsSIZ1的转基因匍匐翦股颖植株比无OsSIZ1的对照植物表现出更完整的细胞膜、更强的保水性,所受的热害也更轻微[41]。在番茄中的研究也发现,SlSIZ1的干扰株系比其野生型株系对热更敏感,SlSIZ1的过表达株系则更耐热[52]。进一步研究发现,热胁迫下SlSIZ1过表达株系中的HSP70、HSP90和HsfA2的表达量显著增加,而SlSIZ1可与SlHsfA1互作并介导SlHsfA1的SUMO化[52]。由此可见,SlSIZ1可能是通过调控HSP70和HsfA2等下游基因的表达对某些蛋白起保护作用或介导其SUMO化以保护细胞膜结构。
3.3 维持细胞内正常的ROS水平ROS的积累影响耐热性,而植物细胞在遭受高温热害后,体内会富集过多的ROS,从而危害细胞内的膜脂、蛋白和核酸等生物分子,造成植物细胞死亡[53]。已有研究表明,OsANN1、SNAC3、OsRab7和MSD1介导的耐热性是通过降低热害产生的ROS水平来实现的[35, 39, 43, 45]。过表达SNAC3基因,显著降低了植株体内的H 2O2水平,表现出更好的耐热性[39]。与SNAC3基因相反,OsHSBP1或OsHSBP2介导的热敏性是由体内过多的ROS导致的[47]。OsNSUN2突变导致的耐热性降低也与植株体内积累了过多的ROS密切相关[41]。
4 展望目前尽管水稻育种学家已鉴定出众多水稻耐热相关QTL,但是水稻耐热功能基因的分离克隆还较少,应用分子标记辅助选择培育耐热水稻品种也暂未见成功报道[28-29]。这主要有以下原因:一是水稻耐热性为多基因控制的数量性状,且一般单个QTL的表型贡献率较低,不同QTL之间经常会有互作;二是水稻耐热性的表型鉴定较为困难,难以控制田间实验处理的环境和温度;三是水稻耐热性相关基因表达受环境影响较大,有些基因只在特定时期才表达发挥功能,因此难以准确鉴定。
目前已克隆鉴定的水稻耐热相关功能基因还较少,所开展的研究也主要集中在水稻苗期进行,目前对苗期外的水稻耐热性相关功能基因克隆鉴定仅有个别报道。但是水稻从孕穗期开始,对热害的敏感度明显高于苗期,遇热害时产量受损更严重,而且不同生育期可能有不同的耐热分子机制。因此,克隆鉴定水稻生殖生长期耐热性相关的功能基因将是水稻耐热性研究的侧重点。克隆鉴定目标功能基因的同时,还需要深入研究它们所介导的水稻耐热性相关分子机制,以期为培育耐热且高产优质的水稻品种奠定理论基础。
| [1] |
李成德. 高温导致水稻出现大量空壳分析[J]. 陕西农业科学, 2003(5): 45-47. DOI:10.3969/j.issn.0488-5368.2003.05.018 LI C D. Analysis of the large number of rice husks caused by high temperature[J]. Shaanxi Journal of Agricultural Sciences, 2003(5): 45-47. DOI:10.3969/j.issn.0488-5368.2003.05.018 |
| [2] |
盛婧, 陶红娟, 陈留根. 灌浆结实期不同时段温度对水稻结实与稻米品质的影响[J]. 中国水稻科学, 2007, 21(4): 396-402. DOI:10.3321/j.issn:1001-7216.2007.04.012 SHENG Q, TAO H J, CHEN L G. Response of seed-setting and grain quality of rice to temperature at different time during grain filling period[J]. Chinese Journal of Rice Science, 2007, 21(4): 396-402. DOI:10.3321/j.issn:1001-7216.2007.04.012 |
| [3] |
MATSUI T, OMASA K. Rice(Oryza sativa L.)cultivars tolerant to high temperature at flowering: anther characteristics[J]. Annals of Botany, 2020, 89(6): 683-687. DOI:10.1093/aob/mcf112 |
| [4] |
PRASAD P V V, BOOTE K J, ALLEN L H JR, SHEEHY J E.THOMAS J M G. Species, ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature stress[J]. Field Crops Research, 2006, 95(2/3): 398-411. DOI:10.1016/j.fcr.2005.04.008 |
| [5] |
张桂莲, 陈立云, 张顺堂, 黄明, 唐文邦, 雷东阳, 李梅华, 贺治洲. 高温胁迫对水稻花器官和产量构成要素及稻米品质的影响[J]. 湖南农业大学学报(自然科学版), 2007, 33(20): 132-136. DOI:10.3321/j.issn:1007-1032.2007.02.002 ZHANG G L, CHEN L Y, ZHANG S T, HUANG M, TANG W B, LEI D Y, LI M H, HE Z Z. Effects of high temperature stress on rice flower organ and yield components and grain quality[J]. Journal of Hunan Agricultural University(Natural Sciences), 2007, 33(20): 132-136. DOI:10.3321/j.issn:1007-1032.2007.02.002 |
| [6] |
杨永杰, 符冠富, 熊杰, 乐明凯, 陶龙兴. 高温对水稻的影响及水稻耐热性测评方法研究[J]. 中国稻米, 2012, 18(1): 39-40. DOI:10.3969/j.issn.1006-8082.2012.01.008.j.issn.1006-8082.2012.01.008 YANG Y J, FU G F, XIONG J, LE M K, TAO L X. Study on the effect of high temperature on rice and the evaluation method of heat tolerance of rice[J]. China Rice, 2012, 18(1): 39-40. DOI:10.3969/j.issn.1006-8082.2012.01.008.j.issn.1006-8082.2012.01.008 |
| [7] |
PACHAURI K, MEYER A. Climate change 2014: synthesis report[J]. Environmental Policy Collection, 2014, 27(2): 408. DOI:10.1111/j.1728-4457.2001.00203.x |
| [8] |
PENG S, HUANG J, SHEEHY J E, LAZA R C, VISPERAS R M, ZHONG X, CENTENO GS, KHUSH G S, CASSMAN K G. Rice yields decline with high temperature from global warming[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(27): 9971-9975. DOI:10.1073/pnas.0403720101 |
| [9] |
孙正玉, 霍金兰, 孙明, 黄成裕, 张云书, 王明锋, 孙莹. 2013年夏季高温对盐城水稻生产的影响[J]. 大麦与谷类科学, 2014(3): 12-14. DOI:10.3969/j.issn.1673-6486.2014.03.004 SUN Z Y, HUO J L, SUN M, HUANG C Y, ZHANG Y S, WANG M F, SUN Y. Effect of high temperature in summer of 2013 on rice production in Yancheng[J]. Barley and Cereal Sciences, 2014(3): 12-14. DOI:10.3969/j.issn.1673-6486.2014.03.004 |
| [10] |
骆宗强, 石春林, 江敏. 水稻高温热害预警监测与定量评估研究进展[J]. 江苏农业科学, 2016, 44(4): 12-15. DOI:10.15889/j.issn.1002-1302.2016.04.004 LUO Z Q, SHI C L, JIANG M. Research progress on early warning, monitoring and quantitative assessment of high temperature heat damage in rice[J]. Jiangsu Agricultural Sciences, 2016, 44(4): 12-15. DOI:10.15889/j.issn.1002-1302.2016.04.004 |
| [11] |
MAESTRI E, KLUEVA N, PERROTTA C, GULLI M, NGUYEN H T, MARMIROLI N. Molecular genetics of heat tolerance and heat shock proteins in cereals[J]. Plant Molecular Biology, 2002, 48(5/6): 667-681. DOI:10.1023/A:1014826730024 |
| [12] |
BATTISTIL D S, NAYLOR R L. Historical warnings of future food insecurity with unprecedented seasonal heat[J]. Science, 2009, 323(5911): 240-244. DOI:10.1126/science.1164363 |
| [13] |
杨梯丰, 刘斌. 水稻耐热性QTL鉴定的研究进展[J]. 广东农业科学院, 2009(6): 16-20. DOI:10.3969/j.issn.1004-874X.2009.06.004 YANG T F, LIU B. Progress on the identification of QTL for heat tolerance in rice(Oryza sativa L.)[J]. Guangdong Agricultural Sciences, 2009(6): 16-20. DOI:10.3969/j.issn.1004-874X.2009.06.004 |
| [14] |
陈庆全, 余四斌, 李春海, 牟同敏. 水稻抽穗开花期耐热性QTLs的定位分析[J]. 中国农业科学, 2008, 41(2): 315-321. DOI:10.3864/j.issn.0578-1752.2008.02.001 CHEN Q Q, YU S B, LI C H, MOU T M. Identification of QTLs for heat tolerance at flowering stage in rice[J]. Scientia Agricultura Sinica, 2008, 41(2): 315-321. DOI:10.3864/j.issn.0578-1752.2008.02.001 |
| [15] |
JAGADISH SVK, MUTHURAJAN R, OANE R, WHEELER TR, HEUER S, BENNETT J, CRAUFURD PQ. Physiological and proteomicapproaches to address heat tolerance during anthesis in rice(Oryza sativa L.)[J]. Journal of Experimental Botany, 2010, 16: 143-156. DOI:10.1093/jxb/erp289 |
| [16] |
TAZIB T, KOBAYASHI Y, KOYAMA H, MATSUI T. QTL analyses for anther length and dehiscence at flowering as traits for the tolerance of extreme temperatures in rice(Oryza sativa L.)[J]. Euphytica, 2015, 203: 629-642. DOI:10.1007/s10681-014-1291-1 |
| [17] |
盘毅, 罗丽华, 邓化冰, 张桂莲, 唐文邦, 陈立云, 肖应辉. 水稻开花期高温胁迫下的花粉育性QTL定位[J]. 中国水稻科学, 2011, 25(1): 99-102. DOI:10.3969/j.issn.1001-7216.2011.01.01.j.issn.1001-7216.2011.01.01 PAN Y, LUO L H, DENG H B, ZHANG G L, TANG W B, CHEN L Y, XIAO Y H. Quantitative trait loci associated with pollen fertility under high temperature stress at flowering stage in rice[J]. Chinese Journal of Rice Science, 2011, 25(1): 99-102. DOI:10.3969/j.issn.1001-7216.2011.01.01.j.issn.1001-7216.2011.01.01 |
| [18] |
PS S, Mithra S V A, PRAKASH C, Ramkumar M K, SINGH N K. High resolution mapping of QTLs for heat tolerance in rice using a 5K SNP array[J]. Rice, 2017, 10: 28. DOI:10.1186/s12284-017-0167-0 |
| [19] |
曹志斌, 谢红卫, 聂元元, 毛凌华, 李永辉, 蔡耀辉. 水稻抽穗扬花期耐热QTL(qHTH5)定位及其遗传效应分析[J]. 中国水稻科学, 2015, 29(2): 119-125. CAO Z B, XIE H W, NIE Y Y, MAO L H, LI Y H, CAI Y H. Mapping a QTL(qHTH5)for heat tolerance at heading stage on rice chromosome 5 and its genetic effect analasis[J]. Chinese Journal of Rice Science, 2015, 29(2): 119-125. |
| [20] |
LI M, LI X, YU L, WU J, LI H, LIU J, MA X, JO S, PARK D, SONG Y C, SHIN D J, HAN L. Identification of QTLs associated with heat tolerance at the heading and flowering stage in rice(Oryza sativa L.)[J]. Euphytica, 2018, 214: 70. DOI:10.1007/s10681-018-2136-0 |
| [21] |
张昌泉, 陈飞, 洪燃, 李钱峰, 顾铭洪, 刘巧泉. 利用染色体片段代换系定位水稻抽穗开花期耐热性QTL[J]. 江苏农业科学, 2016, 44(12): 120-123. DOI:10.15889/j.issn.1002-1302.2016.12.033.j.issn.1002-1302.2016.12.033 ZHANG C Q, CHEN F, HONG R, LI Q F, GU M H, LIU Q Q. Mapping QTL for heat tolerance at heading and anthesis stage in rice using chromosome segment substitution lines[J]. Jiangsu Agricultural Sciences, 2016, 44(12): 120-123. DOI:10.15889/j.issn.1002-1302.2016.12.033.j.issn.1002-1302.2016.12.033 |
| [22] |
奎丽梅, 谭禄宾, 涂建, 卢义宣, 孙传清. 云南元江野生稻抽穗开花期耐热QTL定位[J]. 农业生物技术学报, 2008, 16(3): 461-464. DOI:10.3969/j.issn.1674-7968.2008.03.018.j.issn.1674-7968.2008.03.018 KUI L M, TAN L B, TU J, LU Y X, SUN C Q. Identification of QTLs associated with heat tolerance of Yuanjiang common wild rice(Oryza rufipogon Griff.)at flowering stage[J]. Journal of Agricultural Biotechnology, 2008, 16(3): 461-464. DOI:10.3969/j.issn.1674-7968.2008.03.018.j.issn.1674-7968.2008.03.018 |
| [23] |
KILASI N L, SINGH J, VALLEJOS C E, YE C, JAGADISH S V K, KUSOLWA P, RATHINASABAPATHI B. Heat stress tolerance in rice(Oryza sativa L.): identification of quantitative trait loci and candidate genes for seedling growth under heat stress[J]. Frontiers in Plant Science, 2018, 9: 1578. DOI:10.3389/fpls.2018.01578 |
| [24] |
LEI D Y, TAN L B, LIU F X, SUN C Q. Identification of heatsensitive QTL derived from common wild rice(Oryza rufipogon Griff.)[J]. Plant Science, 2013, 201(3): 121-127. DOI:10.1016/j.plantsci.2012.12.001 |
| [25] |
赵志刚, 江玲, 肖应辉, 张文伟, 翟虎渠, 万建民. 水稻孕穗期耐热性QTLs分析[J]. 作物学报, 2006, 32(5): 640-644. DOI:10.3321/j.issn:0496-3490.2006.05.002 ZHAO Z G, JIANG L, XIAO Y H, ZHANG W W, ZHAI H Q, WAN J M. Identification of QTLs for heat tolerance at the booting stage in rice (Oryza sativa L.)[J]. Acta Agronomica Sinica, 2006, 32(5): 640-644. DOI:10.3321/j.issn:0496-3490.2006.05.002 |
| [26] |
曹立勇, 朱军, 赵松涛, 何立斌, 颜启传. 水稻籼粳交DH群体耐热性的QTLs定位[J]. 农业生物技术学报, 2003, 17(3): 223-227. DOI:10.3969/j.issn.1674-7968.2002.03.002 CAO L Y, ZHU J, ZHAO S T, HE L B, YAN Q C. Mapping QTLs for heat tolerance in a DH population from indica-japonica cross of rice (Oryza sativa)[J]. Journal of Agricultural Biotechnology, 2003, 17(3): 223-227. DOI:10.3969/j.issn.1674-7968.2002.03.002 |
| [27] |
朱昌兰, 江玲, 张文伟, 王春明, 翟虎渠, 万建民. 稻米直链淀粉含量和胶稠度对高温耐性的QTL分析[J]. 中国水稻科学, 2006, 20 (3): 248-252. DOI: 10.3321/j.issn:1001-7216.2006.03.004. ZHU C L, JIANG L, ZHANG W W, WANG C M, WAN J M. Identifying QTLs for thermo-tolerance of amylose content and gel consistency in rice[J]. Chinese Journal of Rice Science, 2006. 20(3): 248-252. DOI: 10.3321/j.issn:1001-7216.2006.03.004. |
| [28] |
LI X M, CHAO D Y, WU Y, HUANG X, CHEN K, CUI L G, SU L, YE W W, CHEN H, CHEN H C, DONG N Q, GUO T, SHI M, FENG Q, ZHANG P, HAN B, SHAN J X, GAO J P, LIN H X. Natural alleles of a proteasome α2 subunit gene contribute to thermotolerance and adaptation of African rice[J]. Nature Genetics, 2015, 47(7): 827-833. DOI:10.1038/ng.3305 |
| [29] |
LIU J, ZHANG C, WEI C, LIU X, WANG M, YU F, XIE Q, TU J. The RING finger ubiquitin E3 ligase OsHTAS enhances heat tolerance by promoting H 2O2-induced stomatal closure in rice[J]. Plant Physiology, 2016, 170(1): 429-443. DOI:10.1104/pp.15.00879 |
| [30] |
WEI H, LIU J, WANG Y, HUANG N, ZHANG X, WANG L, ZHANG J, TU J, ZHONG X. A dominant major locus in chromosome 9 of rice(Oryza sativa L.)confers tolerance to 48℃ high temperature at seedling stage[J]. The Journal of heredity, 2013, 101(2): 287-294. DOI:10.1093/jhered/ess103 |
| [31] |
WANG D, QIN B, LI X, TANG D, ZHANG Y, CHENG Z, XUE Y. Nucleolar DEAD-box RNA helicase TOGR1 regulates thermotolerant growth as a pre-rRNA chaperone in rice[J]. PLOS Genetics, 2016, 12(2): e1005844. DOI:10.1371/journal.pgen.1005844 |
| [32] |
SHEN H, ZHONG X, ZHAO F, WANG Y, YAN B, LI Q, CHEN G, MAO B, WANG J, LI Y, XIAO G, HE Y, XIAO H, LI J, HE Z. Overexpression of receptor-like kinase ERECTA improves thermotolerance in rice and tomato[J]. Nature Biotechnology, 2015, 33(9): 996-1003. DOI:10.1038/nbt.3321 |
| [33] |
LIU D, LU Z, MAO Z, LIU S. Enhanced thermotolerance of E. coli by expressed OsHsp90 from rice(Oryza sativa L.)[J]. Current Microbiology, 2009, 58(2): 129-133. DOI:10.1007/s00284-008-9288-4 |
| [34] |
LIN M Y, CHAI K H, KO S S, KUANG L Y, LUR H S, CHARNG Y Y. A positive feedback loop between HEAT SHOCK PROTEIN101 and HEAT STRESS-ASSOCIATED 32-KDPROTEIN modulates longterm acquired thermotolerance illustrating diverse heat stress responses in rice varieties[J]. Plant Physiology, 2014, 164(4): 2045-2053. DOI:10.1104/pp.113.229609 |
| [35] |
QIAO B, ZHANG Q, LIU D, WANG H, YIN J, WANG R, HE M, CUI M, SHANG Z, WANG D, ZHU Z. A calcium-binding protein, rice annexin OsANN1, enhances heat stress tolerance by modulating the production of H 2O2[J]. Journal of Experimental Botany, 2015, 66(19): 5853-5866. DOI:10.1093/jxb/erv294 |
| [36] |
LIM S D, CHO H Y, PARK Y C, HAM D J, LEE J K, JANG C S. The rice RING finger E3 ligase, OsHCI1, drives nuclear export of multiple substrate proteins and its heterogeneous overexpression enhances acquired thermotolerance[J]. Journal of Experimental Botany, 2013, 64(10): 2899-2914. DOI:10.1093/jxb/ert143 |
| [37] |
KIM J H, LIM S D, JANG C S. Oryza sativa heat-induced RING finger protein 1(OsHIRP1)positively regulates plant response to heat stress[J]. Plant Molecular Biology, 2019, 99(6): 545-559. DOI:10.1007/s11103-019-00835-9 |
| [38] |
EL-KEREAMY A, BI Y M, RANATHUNGE K, BEATTY P H, GOOD A G, ROTHSTEIN S J. The rice R2R3-MYB transcription factor OsMYB55 is involved in the tolerance to high temperature and modulates amino acid metabolism[J]. PLOS ONE, 2012, 7(12): e52030. DOI:10.1371/journal.pone.0052030 |
| [39] |
FANG Y, LIAO K, DU H, XU Y, SONG H, LI X, XIONG L. A stressresponsive NAC transcription factor SNAC3 confers heat and drought tolerance through modulation of reactive oxygen species in rice[J]. Journal of Experimental Botany, 2015, 66(21): 6803-6817. DOI:10.1093/jxb/erv386 |
| [40] |
LIU X H, LYU Y S, YANG W, YANG Z T, LU S J, LIU J X. A membrane-associated NAC transcription factor OsNTL3 is involved in thermotolerance in rice[J]. Plant Biotechnology Journal, 2020, 18(5): 1317-1329. DOI:10.1111/pbi.13297 |
| [41] |
LI Z, HU Q, ZHOU M, VANDENBRINK J, LI D, MENCHYK N, REIGHARD S, NORRIS A, LIU H, SUN D, LUO H. Heterologous expression of OsSIZ1, a rice SUMO E3 ligase, enhances broad abiotic stress tolerance in transgenic creeping bentgrass[J]. Plant Biotechnology Journal, 2013, 11(4): 432-445. DOI:10.1111/pbi.12030 |
| [42] |
TANG Y, GAO C C, GAO Y, YANG Y, SHI B, YU J L, LYU C, SUN B F, WANG H L, XU Y, YANG Y G, CHONG K. OsNSUN2-mediated 5-methylcytosine mRNA modification enhances rice adaptation to high temperature[J]. Developmental Cell, 2020, 53(3): 272-286. DOI:10.1016/j.devcel.2020.03.009 |
| [43] |
SHIRAYA T, MORI T, MARUYAMA T, SASAKI M, TAKAMATSU T, OIKAWA K, ITOH K, KANEKO K, ICHIKAWA H, MITSUI T. Golgi/ plastid-type manganese superoxide dismutase involved in heat-stress tolerance during grain filling of rice[J]. Plant Biotechnology Journal, 2015, 13(9): 1251-1263. DOI:10.1111/pbi.12314 |
| [44] |
BISWAS S, ISLAM M N, SARKER S, TUTEJA N, SERAJ Z I. Overexpression of heterotrimeric G protein beta subunit gene(OsRGB1) confers both heat and salinity stress tolerance in rice[J]. Plant Physiology and Biochemistry, 2019, 144: 334-344. DOI:10.1016/j.plaphy.2019.10.005 |
| [45] |
EL-ESAWI M A, ALAYAFI A A. Overexpression of rice Rab7 gene improves drought and heat tolerance and increases grain yield in rice (Oryza sativa L.)[J]. Genes(Basel), 2019, 10(1): 56. DOI:10.3390/genes10010056.DOI:10.3390/genes10010056 |
| [46] |
CUI Y, LU S, LI Z, CHENG J, HU P, ZHU T, WANG X, JIN M, WANG X, LI L, HUANG S, ZOU B, HUA J. CYCLIC NUCLEOTIDE-GATED ION CHANNELs 14 and 16 promote tolerance to heat and chilling in rice[J]. Plant Physiology, 2020, 183(4): 1794-1808. DOI:10.1104/pp.20.00591 |
| [47] |
RANA R M, DONG S, TANG H, AHMAD F, ZHANG H. Functional analysis of OsHSBP1 and OsHSBP2 revealed their involvement in the heat shock response in rice(Oryza sativa L.)[J]. Journal of Experimental Botany, 2012, 63(16): 6003-6016. DOI:10.1093/jxb/ers245 |
| [48] |
LIU J, SUN X, XU F, ZHANG Y, ZHANG Q, MIAO R, ZHANG J, LIANG J, XU W. Suppression of OsMDHAR4 enhances heat tolerance by mediating H2O2-induced stomatal closure in rice plants[J]. Rice, 2018, 11(1): 38. DOI:10.1186/s12284-018-0230-5 |
| [49] |
LI J, YANG J, ZHU B, XIE G. Overexpressing OsFBN1 enhances plastoglobule formation, reduces grain-filling percent and jasmonate levels under heat stress in rice[J]. Plant Science, 2019, 285: 230-238. DOI:10.1016/j.plantsci.2019.05.007 |
| [50] |
ZHOU H, WANG X, HUO C, WANG H, AN Z, SUN D, LIU J, TANG W, ZHANG B. A quantitative proteomics study of early heat-regulated proteins by two-dimensional difference gel electrophoresis identified OsUBP21 as a negative regulator of heat stress responses in rice[J]. Proteomics, 2019, 19(20): e1900153. DOI:10.1002/pmic.201900153 |
| [51] |
HUO L Q, SUN X, GUO Z J, JIA X, CHE Y M, SUN Y M, ZHU Y F, WANG P, GONG X Q, MA F W. MdATG18a overexpression improves basal thermotolerance in transgenic apple by decreasing damage to chloroplasts[J]. Horticulture Research, 2020, 7: 21. DOI:10.1038/s41438-020-0243-2 |
| [52] |
ZHANG S, WANG S J, LV J L, LIU Z B, WANG Y, MA N N, MENG Q W. SUMO E3 ligase SlSIZ1 facilitates heat tolerance in tomato[J]. Plant & Cell Physiology, 2017(1): 1-14. DOI:10.1093/pcp/pcx160 |
| [53] |
SUNKAR R, CHINNUSAMY V, ZHU J, ZHU J K. Small RNAs as big players in plant abiotic stress responses and nutrient deprivation[J]. Trends in Plant Science, 2007, 12(7): 301-309. DOI:10.1016/j.tplants.2007.05.001 |
(责任编辑 崔建勋)
 2021, Vol. 48
2021, Vol. 48