文章信息
基金项目
- 广东省基础与应用基础研究基金(2020A1515010506,2021A1515012502)
作者简介
- 邵雪花(1983—),女,博士,助理研究员,研究方向为病虫害生物防治,E-mail:sxh19831017@163.com.
通讯作者
- 匡石滋(1963—),男,研究员,研究方向为果树病虫害防治,E-mail:kuangshizi@126.com.
文章历史
- 收稿日期:2021-08-15
【研究意义】印楝素(azadirachtin, AZA)作为植物源杀虫剂的典型代表,可抑制多种害虫的生长发育,已被广泛应用到害虫防制中[1]。草地贪夜蛾是农业生产中的重要害虫[2],也是对印楝素最为敏感的害虫之一。研究表明,对FOXO基因是调控昆虫生长发育的关键转录因子[3],但该基因如何调控印楝素所诱导的昆虫细胞凋亡却未见报道,这在一定程度上制约了印楝素的科学使用。【前人研究进展】印楝素是从印楝树(Azadirachta indica A. Juss)的种子、叶子和其他部分中分离出来的柠檬苦素类化合物,几十年来一直在害虫综合治理中用作拒食剂和害虫生长调节剂[4]。AZA被认为是最有效生物农药之一,最适合于商品化开发的植物源杀虫剂[5-7]。草地贪夜蛾(Spodoptera frugiperda)是起源于美洲大陆的一种跨国界迁飞性农业重大害虫,具有繁殖能力强、迁飞扩散快和防控难度大等特点[8-10]。其寄主范围广,幼虫可取食禾本科、菊科、豆科和苋菜科等76科353种植物,给生产带来巨大威胁[11]。前人研究表明,AZA可以诱导粉纹夜蛾(Cabbage looper Hi-5)、斜纹夜蛾(Spodoptera litura SL-1)和草地贪夜蛾(Spdoptera frugiperda sf9)等多种昆虫细胞凋亡,进而抑制细胞增殖[12-14]。此外,AZA已被证明可激活癌细胞中的多种凋亡信号通路,如受体通路、AIF介导通路、ROS依赖性、p38和JNK1/2通路以及MAPK通路[15-16]。细胞凋亡(Apoptosis)又称程序性细胞死亡(Programmed cell death,PCD),是一种特殊的细胞死亡方式,是为维持内环境稳定,由基因控制的细胞自主有序的主动死亡过程[17]。当细胞凋亡调控失衡时,可引起细胞过度增殖或过度凋亡,导致细胞死亡和相关疾病的发生[18]。FOXO基因作用广泛,参与调控生长、抗肿瘤、细胞分化、新陈代谢及细胞凋亡等多种过程[19]。FOXO不仅可调控幼虫的生长发育,还能通过胰岛素受体InR对胰岛素信号通路进行反馈调节[20]。【本研究切入点】我们之前的研究表明AZA可通过溶酶体释放组织蛋白酶而诱导中肠细胞凋亡[21],FOXO基因位于溶酶体信号通路的上游,可参与调控凋亡信号的转导通路,那么该基因是如何调控印楝素诱导的昆虫细胞凋亡呢?本研究从转录因子FOXO出发,结合细胞生物学、分子生物学等技术手段,研究FOXO基因在印楝素诱导sf9细胞凋亡中的作用。【拟解决的关键问题】本研究以印楝素和草地贪夜蛾卵巢细胞为研究对象,探讨印楝素通过FOXO转录因子调控sf9细胞的增殖和凋亡的作用机理,为探索印楝素分子机制提供理论依据。
1 材料与方法 1.1 试验材料药物及试剂:草地贪夜蛾卵巢细胞sf9(C0004)购自于深圳市百恩生物科技有限公司,印楝素(A115081)购于上海晶纯生化科技股份有限公司,SFM(12682-019)购于赛默飞世尔科技公司,小牛血清(11011-8611)购自于杭州四季青生物工程材料有限公司,Phospho- FOXO(#84192)、Cleaved Caspase-3(#9661)、Bim(#2933)均购自Cell signaling公司,小鼠单克隆抗体,HRP标记的山羊抗小鼠IgG(D110087)购自生工生物工程(上海)股份有限公司,HRP标记羊抗兔IgG(#A0208)购自碧云天生物技术有限公司,ECL显色试剂盒(#1705060)购自Bio-Rad公司,BCA定量试剂盒(#PA115)购自于天根生化科技(北京)有限公司。
细胞培养:将复苏后稳定生长的sf9细胞置于培养基中,加入含有10%小牛血清的SFX,在27 ℃细胞培养箱中孵育,传代至对数生长期的细胞用于后续实验。
1.2 CCK-8法检测细胞增殖将传代至对数生长期的sf9细胞悬浮液(100~500 CFU/μL)接种到96孔板(100 μL/ 孔)中。待细胞贴壁后,吸弃培养基,加入不同浓度的AZA培养液,设置AZA 0.625、1.25、2.5、5.0、10.0、20、40、80 mmol/L 8个浓度处理,另设细胞对照和溶剂对照(1‰ DMSO),27 ℃孵育48 h,向各孔加入10 μL CCK-8溶液,继续孵育3 h,于450 nm处测定吸光度。每个浓度设置8个重复孔,并取每组中3次实验的平均值,计算细胞活力:
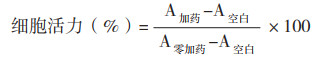
|
式中,A 加药为含有细胞、CCK-8和AZA的孔内OD值,A 空白为只含CCK-8、不含细胞和AZA的孔内OD值,A 零加药为含细胞、CCK-8不含AZA的孔内OD值。
1.3 透射电镜观察sf9细胞5 mmol/L AZA分别作用于细胞24、48、72 h,对照加入1‰ DMSO细胞培养液,每隔2 d重新更换培养液并重新给药。反复吹打后收集细胞悬浮液,室温800 r/ min离心5 min,弃去上清液。用PBS溶液(pH7.4)洗涤3次,800 r/ min离心5 min后用2.5%戊二醛吹散并置于4 ℃过夜。第2天室温800 r/ min离心5 min,收集细胞沉淀,用PBS溶液(pH7.4)洗涤3次,800 r/ min离心min。使用2% 琼脂粉包埋细胞沉淀,修切包埋块后用PBS清洗3次,800 r/ min离心5 min。用1%锇酸固定2 h,每次PBS洗涤3次,每次洗涤30 min;用不同浓度梯度的乙醇进行脱水处理,每次脱水20 min。脱水后的样品用树脂与丙酮渗透4 h,然后在纯树脂中渗透过夜;将样品在聚合反应器中聚合,重新包埋后用LKB-V超薄切片进行切片,后将超薄切片用乙酸双氧铀- 柠檬酸铅染色,自然干燥后在透射电子显微镜下观察、拍照。
1.4 流式细胞仪分拣Annexin V-FITC/PI染色的凋亡细胞将sf9细胞铺满6孔板的90 %,用AZA处理细胞处理方式同透射电镜检测;使用细胞刮刀轻轻刮取细胞,800 r/min离心5 min收集细胞沉淀;用预冷的PBS洗涤细胞沉淀2次,800 r/min4 ℃离心5 min,弃上清。使用500 μL的Binding Buffer悬浮细胞,用5 μL Annexin V-FITC和5μL PI混匀后轻轻吹打细胞后避光,室温反应10 min。最后使用流式细胞仪检测Annexin V- FITC的绿色荧光和PI的红色荧光。
1.5 Western blot检测蛋白表达5 mmol/L AZA处理sf9细胞48 h后,对照加入1‰ DMSO的细胞培养液,用PBS洗涤3次,用RIPA提取总细胞蛋白,BCA试剂盒进行蛋白定量,加入4×蛋白质上样缓冲液。煮沸5 min,分装后于- 20 ℃冰箱保存待用。将约20 μg蛋白质进行SDS-PAGE电泳,并将蛋白质转移至PVDF膜。将10%脱脂奶粉封闭2 h后,将一抗于4 ℃摇床上孵育过夜,用PBS洗涤膜,加入辣根过氧化物酶标记的二抗,并用ECL发光试剂盒测试。使用Image Pro4.5图像分析软件进行灰度扫描,分析每个条带的灰度值,以β-Tubulin作为内部参考。分别以Phospho-FOXO、Cleaved Caspase-3、Bim和β- Tubulin进行灰度比值计算作半定量分析。
1.6 RNA提取和qRT-PCR用TRIzol试剂提取sf9细胞的总RNA,通过试剂盒合成cDNA。使用SYBR Green Master MixqPCR定量试剂盒测定FOXO和α-tubulin的mRNA表达水平。引物序列如下:FOXO(F: 5'- GGATGTGCATTCTATGGTGTACC -3';R: 5'-TTTCGGGATTGCTTTATCTCAGAC -3'), α-tubulin(F: 5'- CGCATTCATGGTTGATAACG-3'; R: 5'- GGGCACCAAGTTAGTCTGGA -3'),基因相对表达量采用2-ΔΔCt法测定[22],重复3次。
1.7 双链RNA合成及Caspase-3酶活检测通过T7 RNAi系统(RiboMAXTM)合成dsRNA FOXO,用LipofectamineTM 2000转染sf9细胞。转染dsRNA FOXO后,收集AZA处理的sf9细胞利用Caspase-3酶活检测试剂盒测定其活性。800 r/min离心5 min收集细胞,PBS洗涤细胞3次,加入RIPA裂解缓冲液提取细胞总蛋白。随后使用BCA试剂盒测定蛋白浓度,将蛋白溶液与Caspase-3的特异性发光底物在37 ℃避光孵育4 h,在405 nm处测定光密度。
试验数据使用SPSS 19.0单因素方差分析(SPSS,Chicago,USA)进行差异显著性测验。
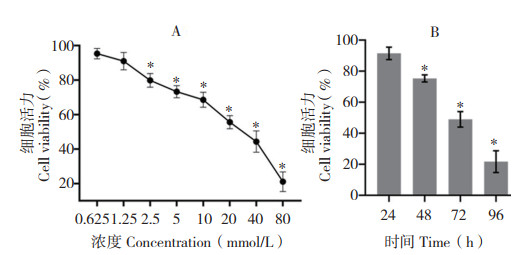
2 结果与分析 2.1 印楝素抑制sf9细胞增殖CCK-8法检测结果表明,AZA在体外对草地贪夜蛾卵巢细胞的增殖有明显的抑制作用。作用48 h后,细胞活力随AZA浓度的增加而显著降低(图 1A),呈明显的浓度依赖性。当AZA在较低浓度0.625 mmol/L时,细胞活力为95.32%;当AZA处理浓度为5 mmol/L时,细胞存活率为67.31%,将该浓度用作后续试验的处理浓度。进一步用5 mmol/L的AZA处理sf9细胞24、48、72、96 h后发现,细胞活力随处理时间的延长而呈下降趋势(图 1B)。由此可见,AZA对sf9细胞的抑制作用呈明显的时间和浓度依赖性。
|
| A:CCK8测定不同浓度AZA对sf9活力的影响;B:CCK-8测定5 mmol/L AZA处理sf9细胞不同时间活力的影响(* P<0.05,n=3) A: Treatment with different AZA concentrations the survival rates of sf9 cells were determined by CCK8 method. B: SF9 cells were treated with AZA at the concentration of 5 mmol/L for differernt time, respectively, and the cell viability was evaluated by CCK-8(* P < 0.05, n=3) 图 1 印楝素对草地贪夜蛾卵巢细胞sf9的活力 Fig. 1 Determination of viability inhibition on sf9 cells by AZA |
2.2 印楝素破坏sf9细胞的微观结构
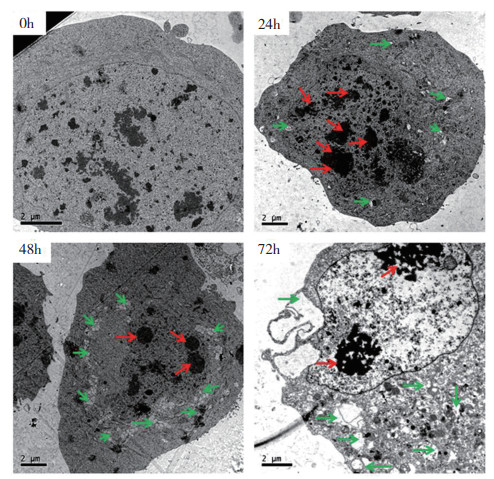
用5 mmol/L AZA分别处理sf9细胞0、24、48、72 h,从结果(图 2)可以看出,AZA处理0 h细胞结构完整,细胞核较大核膜清晰可见,染色质分布均匀,可见明显的细胞器。当AZA处理24 h后,细胞核收缩,染色质聚集,细胞质呈空泡状;处理48 h后,细胞空泡化增加,细胞膜收缩,染色质聚集更严重,细胞变形; 处理72 h后,细胞核的染色质聚集成大颗粒并沿核膜分布,细胞骨架破损,细胞变形不能维持正常的稳态,细胞崩解逐级走向死亡。表明印楝素可破坏草地贪夜蛾卵巢细胞的超微结构。
|
| 红色箭头代表染色质聚集,绿色箭头代表细胞空泡化 The red arrows represent chromatin and the green arrows represent cell vacuoles 图 2 透射电镜观察AZA诱导sf9细胞的微观结构变化 Fig. 2 Changes in microstructure of sf9 cells treated with AZA observed by TEM |
2.3 印楝素诱导sf9细胞凋亡
根据Annexin V- FITC/ PI联用的流式细胞分拣原理,其检测能够将样本中的正常细胞(图 3A左下)、死亡细胞(图 3A左上),早期凋亡细胞(图 3A右上)和中晚期凋亡细胞(图 3A右下)分类和统计,获得的结果可以更好地计算细胞凋亡率。根据统计结果(图 3B),可看出随AZA处理时间延长,早期凋亡细胞比率增加。处理0 h为1.09%,处理24 h为14.83%,处理48 h为23.81%,处理72 h为46.94%,不同处理间差异显著,即AZA诱导的sf9细胞凋亡率与时间呈正相关。

|
|
柱上小写英文字母不同者表示差异显著 A:流式细胞仪分拣AZA诱导sf9细胞的凋亡率;B:AZA诱导sf9细胞凋亡率统计分析(* P<0.05,n=3) Different lowercase letters on the bar chart represent significant differences A: Flow cytometric sorting apoptotic cells in AZA induced sf9 cell lines. B: Statistical analysis of AZA induced apoptosis rate in sf9 cells(* P < 0.05, n=3) 图 3 流式细胞仪分拣AZA诱导sf9细胞的凋亡率 Fig. 3 Flow cytometric sorting apoptotic cells after AZA treatment on sf9 cells |
2.4 印楝素通过上调FOXO基因诱导sf9细胞凋亡
用5 mmol/L AZA处理sf9细胞48 h后,与对照相比凋亡蛋白Bim和Cleaved-Caspase-3的表达水平显著增加(图 4A、B)。FOXO总蛋白表达无明显差异,但P-FOXO蛋白表达显著低于对照。表明AZA可抑制sf9细胞中FOXO蛋白的磷酸化水平,从而诱导凋亡。进一步利用qRT-PCR检测发现,FOXO基因的表达量与AZA处理时间呈正相关,在此基础上通过RNAi技术降低FOXO基因在sf9细胞中的表达量,经AZA处理后发现Caspase-3的酶活性显著降低。表明AZA可通过上调转录因子FOXO的表达而诱导sf9细胞凋亡。
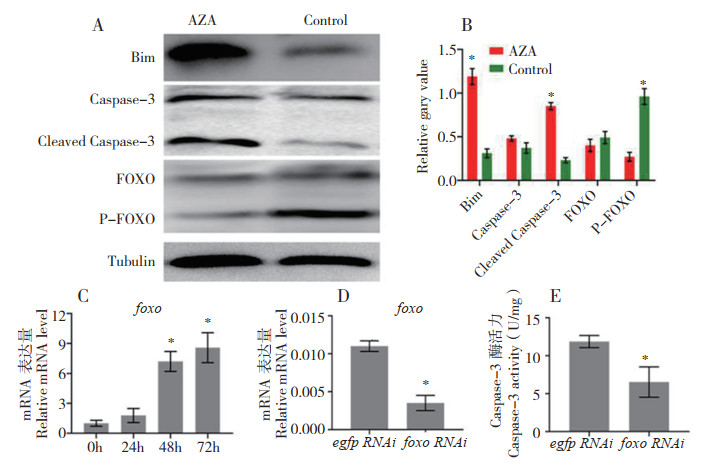
|
| A: Bim、Caspase-3、Cleaved Caspase-3、FOXO和P-FOXO的Western blot检测;B:WB的灰度统计分析;C:qRT-PCR检测FOXO基因表达量变化;D:qRT-PCR检测FOXO基因的干扰效应;E:dsRNA FOXO转染sf9细胞后,经AZA处理48 h检测Caspase-3酶活(* P<0.05,n=3) A: Western blots of Bim, Caspase-3, Cleaved Caspase-3, FOXO and P-FOXO. B: Densitometry of Western blots was quantified by the ratios to Tubulin. C: The expression level of FOXO gene was detected by qRT-PCR. D: qRT-PCR was used to detect the interference effect of FOXO gene. E: dsRNA FOXO was transfected into sf9 cells and treated with AZA for 48h to detect Caspase-3-like proteolytic activity(* P < 0.05, n=3) 图 4 AZA通过FOXO诱导sf9细胞凋亡 Fig. 4 AZA induces apoptosis of sf9 cells through FOXO |
3 讨论
印楝素是目前世界公认的活性最强的拒食剂和昆虫生长调节剂,是最优秀的生物农药之一。印楝素处理后,昆虫不能正常蜕皮,停滞在幼虫- 蛹中间体或永久幼虫状态[13]。大量实验证明,印楝素可导致草地贪夜蛾、斜纹夜蛾和粉纹夜蛾等昆虫离体细胞的线粒体膜电位降低,引起细胞凋亡[23-24]。早在1993年,Rembold和Annadurai曾报道印楝素可影响草地贪夜蛾卵巢细胞sf9的增殖和蛋白合成[25]。本研究采用CCK-8方法证实了AZA可抑制草地贪夜蛾卵巢细胞的增殖,且呈现时间和浓度的依赖性。透射电镜发现sf9细胞的微观结构发生明显变化,即细胞核发生变形和皱缩,染色质聚集,细胞质空泡化;流式细胞凋亡率检测表明,凋亡细胞与处理时间呈正相关,提示AZA抑制sf9细胞增殖,促进细胞凋亡,与前期研究结果一致。
细胞凋亡受细胞内各种分子调节,FOXO属于叉头转录因子家族,在细胞凋亡中起重要作用[26],可被PI3K/Akt信号通路调控,该通路与细胞生存密切相关。FOXO为Akt的下游底物,激活Akt使FOXO的Thr32、Ser253及Ser315三个位点发生磷酸化,并从细胞核转运至细胞质,不发挥其转录因子的作用;反之,当Akt的活性下降时,FOXO的磷酸化水平下降,非磷酸化的FOXO可移位进入细胞核,发挥其转录活性,诱导靶基因的转录[27]。Bim蛋白是Bcl-2凋亡相关蛋白家族中仅含有BH3结构域的促凋亡蛋白,是FOXO诱导的重要靶基因,转录因子FOXO可结合于Bim的启动子上调控Bim的表达。Bim表达上调促进线粒体释放细胞色素c及Caspase的激活,从而导致细胞凋亡[28-29]。本研究显示,AZA作用sf9细胞后,FOXO总蛋白水平没有显著变化,但磷酸化水平降低,靶基因Bim的蛋白表达量增加,Cleaved Caspase-3蛋白的表达水平上升,说明印楝素通过降低sf9细胞中FOXO基因的磷酸化水平,使其发挥其转录因子活性,进而诱导FOXO的靶基因促凋亡蛋白Bim表达量升高,该蛋白表达量升高导致Caspase-3的激活。为验证这一结论,本研究在此基础上,利用RNAi技术降低sf9细胞中FOXO基因表达,AZA处理后发现Caspase-3活性显着降低,证实转录因子FOXO可调控AZA诱导的sf9细胞凋亡。然而,由AZA控制的细胞的凋亡过程非常复杂,涉及多个信号通路和生物过程,其分子机制仍需进一步研究。
4 结论本研究以草地贪夜蛾卵巢细胞sf9为研究对象,探讨了印楝素对sf9细胞增殖的影响及其作用机理。结果表明,印楝素对sf9细胞有明显的增殖抑制作用,且呈明显的时间和浓度依赖性。透射电镜观察到5 mmol/L AZA可破坏sf9细胞的微观结构,导致细胞核收缩,染色质聚集,细胞质空泡状;进一步通过流式细胞仪检测发现,AZA可诱导sf9细胞凋亡并与处理时间呈正相关;分子生物学实验发现AZA可使sf9细胞中FOXO蛋白的磷酸化水平降低,靶基因促凋亡Bim和Cleaved Caspase-3的表达量增加;进一步利用RNAi技术沉默FOXO后,经AZA处理发现Caspase-3的酶活性显著降低。表明印楝素可通过上调FOXO的表达而诱导草地贪夜蛾卵巢细胞凋亡。
| [1] |
徐汉虹, 赖多, 张志祥. 植物源农药印楝素的研究与应用[J]. 华南农业大学学报, 2017, 38(4): 1-11. DOI:10.7671/j.issn.1001-411X.2017.04.001 XU H H, LAI D, ZHANG Z X. Research and application of botanical pesticide azadirachtin[J]. Journal of South China Agricultural University, 2017, 38(4): 1-11. DOI:10.7671/j.issn.1001-411X.2017.04.001 |
| [2] |
HARRISON R D, THIERFELDER C, BAUDRON F, CHINWADA P, MIDEGA C, SCHAFFNER U, BERG J V D. Agro-ecological options for fall armyworm(Spodoptera frugiperda JE Smith)management: Providing low-cost, smallholder friendly solutions to an invasive pest[J]. Journal of Environmental Management, 2019, 243(8): 318-330. DOI:10.1016/j.jenvman.2019.05.011 |
| [3] |
ZENG B, HUAND Y, XU J, SHIOTSUKI T, BAI H, PALLI S R, HUANG Y P, TAN A. The FOXO transcription factor controls insect growth and development by regulating juvenile hormone degradation in the silkworm, Bombyx mori[J]. Journal of Biological Chemistry, 2017, 292(28): 11659-11669. DOI:10.1074/jbc.M117.777797 |
| [4] |
ARⅡBI N, DENIS B, KILANI M S, JOLY D. Azadirachtin, a natural pesticide with multiple effects[J]. Médecine/sciences, 2020, 36(1): 44-49. DOI:10.1051/medsci/2019268 |
| [5] |
QIN D Q, ZHANG P, ZHOU Y, LIU B J, ZHANG Z X. Antifeeding effects of azadirachtin on the fifth instar Spodoptera litura larvae and the analysis of azadirachtin on target sensilla around mouthparts[J]. Archives of Insect Biochemistry and Physiology, 2020, 103(5318). DOI:10.1002/arch.21646 |
| [6] |
DAWKA R V V, BARAGE S H, BARBOLE R S, FATANGARE A, GIRI A P. Azadirachtin-A from azadirachta indica impacts multiple biological targets in cotton bollworm Helicoverpa armigera[J]. Acs Omega, 2019, 4(5): 9531-9541. DOI:10.1021/acsomega.8b03479 |
| [7] |
林素坤, 刘凯鸿, 王瑞飞, 刘本菊, 张悦, 吴吉英子, 程东美, 徐汉虹, 张志祥. 印楝素对草地贪夜蛾的毒力测定及田间防效[J]. 华南农业大学学报, 2020, 41(1): 25-30. LIN S K, LIU K H, WANG R F, LIU B J, ZHANG Y, WU J Y Z, CHENG D M, XU H H, ZHANG Z X. Toxicity determination of azadirachtin on Spodoptera frugiperda and its field control effect[J]. Journal of South China Agricultural University, 2020, 41(1): 25-30. |
| [8] |
BINNING R R, JOEL C, KONG X, HELLMICH R L. Susceptibility and aversion of Spodoptera frugiperda(Lepidoptera: Noctuidae)to Cry1F Bt maize and considerations for insect resistance management[J]. Journal of economic entomology, 2019, 107(1): 368-74. DOI:10.1603/EC13352 |
| [9] |
DUTTA T K, SANTHOSHKUMAR C M, MANDAL A, SAGAR D. A Photorhabdus akhurstii toxin altered gut homeostasis prior conferring cytotoxicity in Spodoptera frugiperda, S. litura and Helicoverpa armigera[J]. Phytoparasitica, 2021, 1-16. DOI:10.1007/s12600-021-00941-9 |
| [10] |
徐蓬军, 张丹丹, 王杰, 吴孔明, 王新伟, 王秀芳, 任广伟. 草地贪夜蛾对玉米和烟草的偏好性研究[J]. 植物保护, 2019, 45(4): 61-64, 90. DOI:10.16688/j.zwbh.2019299.zwbh.2019299 XU P J, ZHANG D D, WANG J, WU K M, WANG X W, WANG X F, REN G W. Study on the preference of Spodoptera frugiperda for corn and tobacco[J]. Plant Protection, 2019, 45(4): 61-64, 90. DOI:10.16688/j.zwbh.2019299.zwbh.2019299 |
| [11] |
徐艳玲, 李昭原, 陈杰, 李志红, 秦誉嘉. 草地贪夜蛾对我国小麦产业造成的潜在经济损失评估[J]. 植物保护学报, 2020(4): 69-73. DOI:10.16688/j.zwbh.2019528 XU Y L, LI Z Y, CHEN J, LI Z H, QIN Y J. Assessment of potential economic losses caused by Spodoptera frugiperda to the wheat industry in my country[J]. Acta Plant Protection, 2020(4): 69-73. DOI:10.16688/j.zwbh.2019528 |
| [12] |
李文欧, 徐汉虹, 张志祥, 廖绍裕. 印楝素A对粉纹夜蛾Hi-5细胞的毒性机理[J]. 昆虫学报, 2008, 51(8): 824-829. DOI:10.3321/j.issn:0454-6296.2008.08.007 LI W O, XU H H, ZHANG Z X, LIAO S Y. Toxicity mechanism of azadirachtin A on Hi-5 cells of Trichoderma spp.[J]. Acta Entomologica Sinica, 2008, 51(8): 824-829. DOI:10.3321/j.issn:0454-6296.2008.08.007 |
| [13] |
HUANG J F, SHUI K J, LI H Y, HU M Y, ZHONG G H. Antiproliferative effect of azadirachtin A on Spodoptera litura Sl-1 cell line through cell cycle arrest and apoptosis induced by up-regulation of p53[J]. Pesticide Biochemistry & Physiology, 2011, 99(1): 16-24. DOI:10.1016/j.pestbp.2010.08.002 |
| [14] |
SHAO X H, LAI D, ZHANG L, XU H H. Induction of autophagy and apoptosis via PI3K/AKT/TOR Pathways by azadirachtin A in Spodoptera litura Cells[J]. Rep, 2016, 6: 35482. DOI:10.1038/srep35482 |
| [15] |
PHILIPPE J B, MITTERMEIER A, LAWRENCE N, HUANG Y H, HENRIQUES S T. Angler peptides: Macrocyclic conjugates inhibit p53:MDM2/X interactions and activate apoptosis in cancer cells[J]. ACS Chemical Biology, 2021. DOI:10.1021/acschembio.0c00988 |
| [16] |
SRIVASTAVA P, YADAV R, LELLA R, SCHNEIDER A, CHANDRA D. Neem oil limonoids induces p53-independent apoptosis and autophagy[J]. Carcinogenesis, 2012, 33(11): 2199. DOI:10.1093/carcin/bgs269 |
| [17] |
BRENNER C, KROEMER G. Apoptosis. Mitochondria——the death signal integrators[J]. Science, 2019, 289(5482): 1150. DOI:10.1126/science.289.5482.1150 |
| [18] |
JUNNA H, XIANG J Z. miR-668 inhibitor attenuates mitochondrial membrane potential and protects against neuronal apoptosis in cerebral ischemic stroke[J]. Folia Neuropathologica, 2020, 58(1): 22-29. DOI:10.5114/fn.2020.94003 |
| [19] |
RONNEBAUM S M, PATTERSON C. The FoxO family in cardiac function and dysfunction[J]. Annual Review of Physiology, 2010, 72(1): 81-94. DOI:10.1146/annurev-physiol-021909-135931 |
| [20] |
宋茜. FoxO基因在昆虫蜕皮中的功能研究[D]. 济南: 山东大学, 2013. DOI: 10.7666/d.Y2331386. SONG Q. Study on the function of FoxO gene in insect molting[D]. Jinan: Shandong University, 2013. DOI: 10.7666/d.Y2331386. |
| [21] |
ZHAO TY, LAI D, ZHOU Y, XU H H, ZHANG Z X, KUANG S Z, SHAO X H. Azadirachtin A inhibits the growth and development of Bactrocera dorsalis larvae by releasing cathepsin in the midgut[J]. Ecotoxicology and Environmental Safety, 2019, 183: 109512. DOI:10.1016/j.ecoenv.2019.109512 |
| [22] |
KENNETH J L, THOMAS D S. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2002, 25: 402-408. |
| [23] |
邵雪花, 赖多, 毛根林, 徐汉虹. 印楝素对小菜蛾胚胎细胞增殖和凋亡的影响[J]. 华南农业大学学报, 2017, 38(4): 19-24. DOI:10.7671/j.issn.1001-411X.2017.04.003 SHAO X H, LAI D, MAO G L, XU H H. Effects of azadirachtin on the proliferation and apoptosis of Plutella xylostella embryo cells[J]. Journal of South China Agricultural University, 2017, 38(4): 19-24. DOI:10.7671/j.issn.1001-411X.2017.04.003 |
| [24] |
YAN C, ZHANG Z X, XU H H. An SSH library responsive to azadirachtin A constructed in Spodoptera litura Fabricius cell lines[J]. Journal of Biotechnology, 2012, 159(1/2): 115-120. DOI:10.1016/j.jbiotec.2012.02.017 |
| [25] |
REMBOLD H, ANNADURIA R S. Azadirachtin inhibits proliferation of Sf9 cells in monolayer culture[J]. Zeitschrift fur Naturforschung C, 1993, 48(5/6): 495-499. DOI:10.1515/znc-1993-5-615 |
| [26] |
SANDRI M, SANDIR C, GILBERT A, SKURK C, CALABRIA E, PICARD A, WALSH K, SCHIAFFINO S, LECKER S H, GOLDBERG A L. Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy[J]. Cell, 2004, 117(3): 399-412. DOI:10.1016/S0092-8674(04)00400-3 |
| [27] |
MAMMUCARI C, SCHIAFFINO S, SANDRI M. Downstream of Akt: FoxO3 and mTOR in the regulation of autophagy in skeletal muscle[J]. Autophagy, 2008, 4(4): 524-526. DOI:10.4161/auto.5905 |
| [28] |
GUERTIN D A, STEVENS D M, THOREEN C C, BURDS A A, KALAANY N Y, MOFFAT J, MICHAEL B, FITZGERALD K J, SABATINI A M. Ablation in mice of the mTORC components raptor, rictor, or mLST8 reveals that mTORC2 is required for signaling to Akt-FOXO and PKCalpha, but not S6K1[J]. Developmental Cell, 2006, 11(6): 859-871. DOI:10.1016/j.devcel.2006.10.007 |
| [29] |
SI Y, HUANG J, LI X, CHENG J. AKT/FOXO1 axis links cross-talking of endothelial cell and pericyte in TIE2-mutated venous malformations[J]. Cell Communication and Signaling, 2020. DOI:10.1186/s12964-020-00606-w |
(责任编辑 杨贤智)
 2021, Vol. 48
2021, Vol. 48