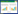文章信息
基金项目
- 国家重点研发计划项目(2019YFD0900101);广东省基础与应用基础研究基金(2020A1515010327);广东省现代农业产业技术体系创新团队建设专项(2021KJ119);国家大宗淡水鱼产业技术体系(CARS-45)
作者简介
- 王雅慧(1995—),女,在读硕士生,研究方向为水生动物病害及其防控,E-mail:1904028156@stu.tjau.edu.cn.
通讯作者
- 曾伟伟(1981—),男,博士,研究方向为水生动物病害及其防控,E-mail:zww8810303@163.com.
文章历史
- 收稿日期:2021-08-17
2. 中国水产科学研究院珠江水产研究所 / 农业农村部渔药创制重点实验室 / 广东省水产动物免疫技术重点实验室,广东 广州 510385;
3. 佛山科学技术学院生命科学与工程学院 / 广东省动物分子设计与精准育种重点实验室 / 普通高校动物分子设计与精准育种重点实验室,广东 佛山 440605
2. Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences/ Key Laboratory of Fishery Drug Development, Ministry of Agriculture and Rural Affairs/ Guangdong Key Laboratory of Aquatic Animal Immune Technology, Guangzhou 510385, China;
3. School of Life Science and Engineering, Foshan University/ Guangdong Key Laboratory of Animal Molecular Design and Precise Breeding/ Key Laboratory of Animal Molecular Design and Precision Breeding in Universities, Foshan 440605, China
【研究意义】罗非鱼因生长快、食性杂、病害少、肉质好、产量高等优点,已被引入中国、印度尼西亚和埃及等90多个国家并被广泛养殖。预计2021年全球罗非鱼产量将达到729万t,为仅次于鲤科鱼类的全球第二大养殖鱼类[1]。中国是罗非鱼的主要养殖和生产基地,养殖量约占全球30%[2]。罗非鱼具有较强的抗病性和抗逆性,适合集约化养殖系统,是一种廉价的蛋白质来源。但近年来罗非鱼病害频生,给全球罗非鱼养殖产业造成了巨大的经济损失,严重制约罗非鱼产业的可持续发展。其中,自2009年开始,在以色列、厄瓜多尔、埃及、泰国、印度等多国相继暴发的一种新发疫病——罗非鱼湖病毒病(Tilapia Lake Virus Disease,TiLVD),给全球罗非鱼养殖业带来巨大威胁和严峻挑战[3]。该病病原为一种新型RNA病毒——罗非鱼湖病毒(Tilapia Lake Virus,TiLV)。目前,对于TiLV致病机制、TiLV基因组中各节段基因功能均不清楚,对TiLVD尚无有效的防控措施。因此,针对TiLV的单抗抗体制备对于TiLV病原学研究及TiLVD防控均具有重要意义。
【前人研究进展】TiLV是一种包膜病毒[4-5],其基因组由10个单股负链RNA片段组成,共编码14个功能蛋白[6-7]。目前,国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICVT)将TiLV作为一个新种,单独列为罗非鱼湖病毒属、罗非鱼病毒新科[8]。Til-4-2011是第一个完成全基因组测序的TiLV分离株[3],其S1节段包含1个与正粘病毒科C型流感病毒(ICV)PB1亚基具有序列同源性的开放读码框,最初将TiLV确定为一种新型正粘病毒样病毒[5]。后续研究表明,S1、S2、S4和S5节段与Dhori病毒有很强的同源性,S6、S7和S8与流感病毒进化上接近,而S3节段与传染性鲑鱼贫血病毒有较弱的同源性[6]。TiLV各基因节段编码的蛋白功能均未知。生物信息学分析和预测表明,TiLV S10基因节段编码的蛋白含有一个溴结构域。溴结构域是一类保守的蛋白质结构域,能特异性识别乙酰化赖氨酸并形成驱动活性转录的蛋白质复合物,从而调节基因转录[9]。相比于其他9种蛋白,TiLV S10编码蛋白具有更丰富的抗原表位[10],提示S10编码蛋白具有更强的免疫原性。
【本研究切入点】罗非鱼对TiLV高度敏感,在各个养殖阶段都能受TiLV感染,以早期发育阶段的发病率和死亡率相对更高,死亡率在20%~90% 之间[11]。水平传播是罗湖病毒重要的传播途径之一[4],健康鱼可通过受TiLV污染的水和设备感染TiLV[12]。感染鱼的肠道中和粪便中均可检测到TiLV基因组RNA,表明极有可能存在粪口传播途径。近年来的研究表明,在2日龄鱼苗中检测到TiLV,在病鱼生殖器官中也能检出TiLV基因组RNA和活病毒,表明TiLV可能存在垂直传播途径[13]。迄今为止,针对TiLV的感染尚无有效的防治办法。加强TiLV病原学基础研究、开发高效的疫苗和有效的防治药物是当前TiLVD防控研究的热点和重点。
【拟解决的关键问题】TiLV基因组S10基因节段编码的蛋白具有较强的免疫原性和重要的生物学功能。本研究利用原核表达系统获得S10重组蛋白,并将纯化的重组蛋白免疫小鼠,经融合和筛选获得阳性杂交瘤细胞株,然后制备抗S10蛋白的MAb,并对MAb的生物学特性进行鉴定,为后续深入研究S10蛋白的功能、TiLV病原学以及疫苗和药物的开发奠定基础。
1 材料与方法 1.1 试验材料pET-32a(+)载体、小鼠骨髓瘤细胞(SP2/0)均为中国水产科学研究院珠江水产研究所病害防控与免疫实验室保存;用于增殖TiLV的TiB细胞系由该实验室建立并保存[14],Escherichia coli DH5α和E.coli BL21感受态细胞购自北京康为世纪生物科技有限公司,6周龄SPF雌性BALB/c小鼠购自广东省实验动物中心,异丙基硫代半乳糖苷(IPTG)、异硫氰酸荧光素(FITC)标记的羊抗兔IgG、FITC标记的羊抗鼠IgG、HRP标记羊抗鼠IgG、HT、HAT、弗氏完全佐剂、弗氏不完全佐剂和PEG3350均购自Sigma-aldrich西格玛奥德里奇(上海)贸易有限公司,RPMI-1640培养基、胎牛血清、DMEM-20完全培养基、蛋白质Marker、RIPA裂解液、限制性核酸内切酶(BamH Ⅰ和Hind Ⅲ)和T4 DNA连接酶购自赛默飞世尔科技(中国)有限公司,MiniBEST DNA Fragment Purification Kit、Prime STAR Max DNA Polymerase购自宝生物工程(大连)有限公司,质粒提取试剂盒、胶回收试剂盒均购自广州飞扬生物工程有限公司,SDS-PAGE试剂盒、超敏化学发光显色液购自新赛美生物科技有限公司,小鼠单克隆抗体亚型鉴定试剂盒购自武汉三鹰生物技术有限公司。
1.2 试验方法1.2.1 重组表达质粒pET32a-S10的构建 根据TiLV S10全长基因序列(GenBank登录号:KU751823.1)设计PCR引物,S10-F序列:5'GCT GGA TCC ATG AGT GTG GCA GAT TAT 3'(下划线为BamH Ⅰ酶切位点),S10-R序列:5' GCG AAG CTT ACG TCA AGA GAC TTC TTC C 3'(下划线为Hind Ⅲ酶切位点)。以中国水产科学研究院珠江水产研究所病害防控与免疫实验室保存的TiLV cDNA为模板,使用引物组S10 F/R扩增目的基因片段,PCR反应程序为95 ℃预变性3 min;95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,共35个循环;72 ℃后延伸10 min。PCR扩增产物经琼脂糖凝胶回收后与pET32a载体分别用BamH Ⅰ和Hind Ⅲ限制性内切酶在37 ℃下双酶切20 min,然后分别进行纯化回收。回收产物按比例配置好连接体系后,在T4 DNA连接酶作用下22 ℃连接20 min,然后转化E.coli DH5α感受态细胞。挑取单菌落进行酶切验证,验证正确后送至上海生工生物工程(上海)股份有限公司进行测序鉴定,鉴定正确的质粒即为pET32a-S10,扩大培养后于-20 ℃保存备用。
1.2.2 S10重组蛋白的表达及纯化 将重组质粒pET32a-S10转化至E.coli BL21(DE3)感受态细胞,挑取单菌落于含氨苄青霉素的LB液体培养基中培养至菌液OD600值为0.6左右时,添加终浓度为0.1 mmol/L的IPTG于28 ℃条件下诱导表达(未诱导组不加IPTG)。将诱导表达后的重组菌液于10 000 r/min、4 ℃离心8 min收集菌体,按100 mL裂解缓冲液(500 mmol/L NaCl,20 mmol/L Tris,5% 甘油,1 %Triton 100,pH值8.0)与1 L重组菌液的体积比进行重悬,冰浴条件下以超声波破碎30 min,10 000 r/min、4 ℃离心30 min,分别收集上清及沉淀,将收集的上清用镍柱进行纯化。收集不同浓度咪唑洗脱的洗脱产物进行SDS-PAGE检测,分析蛋白纯化效果并利用BCA法测定目的蛋白浓度。将纯化好的S10重组蛋白分装后置于-80 ℃保存备用。
1.2.3 小鼠免疫 用纯化的S10重组蛋白与等体积的弗氏完全佐剂混合乳化完全后,皮下注射BALB/c小鼠,每只小鼠的免疫剂量为100 μg重组蛋白。2周后进行第2次免疫,取等体积的弗氏不完全佐剂与纯化的S10重组蛋白均匀乳化后进行皮下注射,免疫剂量与第1次免疫相同。二免后2周和4周分别进行第3、4次免疫,方法和剂量与第2次免疫相同。第4次免疫1周后,尾静脉采血测定抗血清效价,效价达到1 ∶ 10 000以上时用100 μg S10重组蛋白直接腹腔注射BALB/c小鼠加强免疫。
1.2.4 杂交瘤细胞株的克隆与筛选 参照文献[15-16]建立杂交瘤细胞株的方法,细胞融合前,在无菌条件下制备小鼠脾细胞悬液。骨髓瘤细胞SP2/0与免疫小鼠脾细胞按比例进行细胞融合。待融合细胞生长至96孔板培养面积的1/4~1/3时,取100 μL细胞培养上清用间接ELISA方法进行检测,筛选出阳性且效价较高的细胞进行克隆纯化,将可以稳定分泌抗体的杂交瘤细胞扩大培养并于液氮中长期保存。
1.2.5 MAb纯化和亚型鉴定 将阳性的杂交瘤细胞经BALB/c小鼠腹腔注射,待小鼠腹腔膨大时收集并纯化腹水,得到纯化的MAb,于-80 ℃保存。使用小鼠单克隆抗体亚型鉴定试剂盒对筛选后的MAb进行鉴定,按照试剂盒说明书进行操作。结果可通过酶标仪读取450 nm波长的OD值或直接观察判读,OD值最高或颜色最深孔对应的即为相应亚型。
1.2.6 间接ELISA检测MAb效价 在酶联板中包被抗原,4 ℃放置过夜,PBST洗板3次,吸水纸上拍干,用5% 脱脂奶37 ℃封闭2 h,洗板,每孔加入MAb 100 μL,加盖在37 ℃孵育1~2 h,每个样品平行做2~3份,PBS作为阴性对照,已知样品作为阳性对照。洗板,每孔加酶标抗抗体100 μL,加盖在37 ℃孵育1 h,洗板后每孔加入辣根过氧化物酶反应的显色液100 μL,显色5 min,每孔加入2 mol/L硫酸终止液50 μL,终止反应。用酶标仪测定450 nm波长各待测孔的OD值,若样品OD值和阴性对照OD值之比大于2.1(P/N>2.1),则结果判为阳性。
1.2.7 Western-blot鉴定MAb特异性 用S10重组蛋白、感染TiLV的TiB细胞及未感染病毒的TiB细胞对MAb进行特异性分析。将S10重组蛋白、TiLV感染和未感染的TiB细胞进行SDS-PAGE分析,电转印于硝酸纤维素膜(NC膜)上,NC膜于5% 的脱脂奶粉溶液下37 ℃孵育2 h,PBST洗涤后加入1 ∶ 100稀释的MAb 4 ℃封闭过夜,PBST洗涤,加入1 ∶ 1 000稀释的羊抗鼠IgG-HRP标记抗体,室温下温和振荡结合1 h,PBST洗涤,加入超敏化学发光显色液避光显色,于化学发光成像系统(BIO-RAD,Gel Doc XR +system)观察结果。
1.2.8 IFA鉴定MAb特异性 在24孔板中培养单层的TiB细胞,TiLV接毒96 h后,参照文献[17]的IFA操作步骤,结果于荧光倒置显微镜(Nikon,EclipseTi-S)下观察,阴性抗原对照为正常TiB细胞。
2 结果与分析 2.1 S10基因的扩增及重组表达质粒的构建以S10基因序列为模板进行PCR扩增,产物经1.5% 琼脂糖凝胶电泳,结果(图 1)显示,在300~400 bp之间可见一条特异性条带,与预期目的片段314 bp结果相符。BamH Ⅰ和Hind Ⅲ双酶切后也出现约314 bp的条带,与预期结果相符。测序结果进一步证实扩增片段与S10基因序列一致,说明重组质粒构建成功,并将其命名为pET32a- S10。
|
| M:DNA Marker;1:阴性对照;2:S10基因扩增产物;3:pET32a-S10酶切产物 M: DNA Marker; 1: Negative control; 2: S10 gene amplification products; 3: Restriction enzyme digestion products of pET32a-S10 图 1 TiLV S10基因PCR扩增产物及pET32a-S10酶切鉴定结果 Fig. 1 PCR amplification products of TiLV S10 gene and restriction enzyme identification result of pET32a-S10 |
2.2 S10重组蛋白的表达与纯化
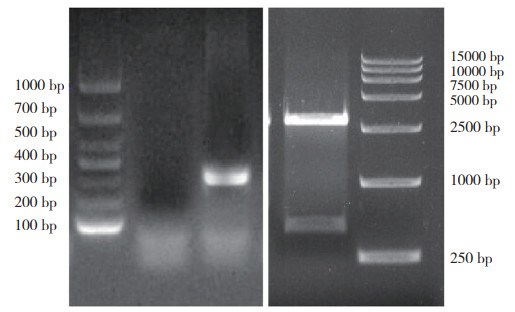
将重组质粒pET32a - S10转化E.coli BL21(DE3)感受态细胞内,在28 ℃条件下IPTG诱导表达12 h后,经SDS-PAGE电泳,结果(图 2)显示,与未诱导组相比,诱导组在40 ku与30 ku之间有一条特异的蛋白条带,与预期的蛋白分子质量大小一致,且蛋白在上清和包涵体中均获得表达。经镍柱纯化后的目的蛋白纯度较高,条带单一无明显杂带。

|
| M:蛋白分子量标准;1:未诱导上清;2:诱导沉淀;3~8:诱导上清;9:未纯化蛋白;10:纯化后蛋白 M: Protein marker; 1: Uninduced supernatant; 2: Induced precipitation; 3-8: Induced supernatant; 9: Unpurified protein; 10: Purified protein 图 2 重组S10蛋白表达与纯化结果 Fig. 2 Expression and purification results of recombinant S10 protein |
2.3 MAb筛选和亚型鉴定
将骨髓瘤细胞SP2/0与免疫小鼠脾细胞融合后经过4次亚克隆,利用间接ELISA方法对上清进行检测,筛选出2株可稳定分泌抗TiLV- S10蛋白的MAb杂交瘤细胞株,分别命名为2C3和2E3。用小鼠单克隆抗体亚型鉴定试剂盒对其分泌的抗体进行亚型鉴定,结果显示,2C3抗体为IgG1/к型,2E3抗体为IgG2a/к型。
2.4 MAb效价2C3和2E3腹水抗体纯化后浓度分别为1.05、1.14 mg/mL,抗体稀释200倍后进一步倍比稀释,用间接ELISA法测定制备的杂交瘤细胞株效价,空白对照OD450值为0.114,结合酶联结果阳性判断标准,得出2C3和2E3腹水抗体效价分别为1 ∶ 12 800、1 ∶ 51 200。
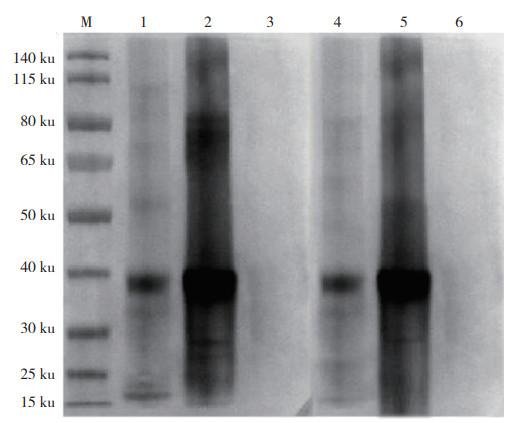
2.5 Western-blot鉴定MAb特异性以空载蛋白为阴性对照,S10重组蛋白以及纯化的TiLV经由SDS-PAGE后转印至NC膜上,以纯化后的2C3和2E3 MAb为一抗,HRP标记的羊抗鼠IgG为二抗。结果(图 3)显示,2C3和2E3 MAb均能与S10蛋白和纯化的TiLV发生反应,目的条带约为38 ku,与预期结果相符,表明制备的2C3和2E3 MAb均可特异性识别TiLV。
|
| M:蛋白分子量标准;1:2C3抗体识别TiLV纯化病毒;2:2C3抗体识别S10蛋白;3:2C3抗体的阴性对照;4:2E3抗体识别TiLV纯化病毒;5:2E3抗体识别S10蛋白;6:2E3抗体的阴性对照 M: Protein marker; 1: Purified TiLV is recognized by 2C3 antibody; 2: S10 protein is recognized by 2C3 antibody; 3: Negative control of 2C3 antibody; 4: Purified TiLV is recognized by 2E3 antibody; 5: S10 protein is recognized by 2E3 antibody; 6: Negative control of 2E3 antibody 图 3 Western blot分析两种MAbs的特异性结果 Fig. 3 Western blot analysis of the specificity of two MAbs |
2.6 间接免疫荧光鉴定MAb特异性
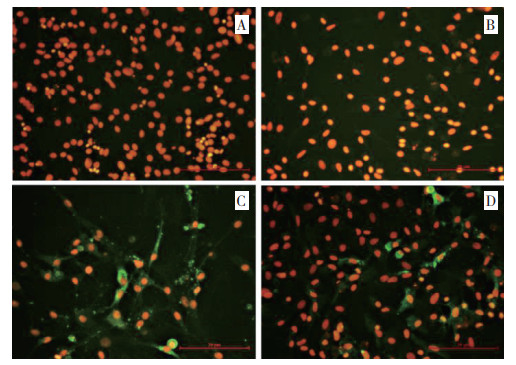
以制备的2C3和2E3 MAb作为一抗,与感染TiLV的TiB细胞和未感染TiLV的TiB细胞进行IFA试验鉴定,结果(图 4)显示,2C3和2E3能对病毒感染的TiB细胞产生特异性的绿色荧光,与未感染病毒的TiB细胞呈现阴性反应,说明制备的2C3和2E3两株抗S10蛋白MAb具有良好的特异性。
|
| A:2E3与未感染TiB细胞;B:2C3与未感染TiB细胞;C:2E3与已感染TiLV的TiB细胞;D:2C3与已感染TiLV的TiB细胞 A: 2E3 and uninfected TiB cells; B: 2C3 and uninfected TiB cells; C: 2E3 and TiB cells infected with TiLV; D: 2C3 and TiB cells infected with TiLV 图 4 IFA反应特性鉴定(400×) Fig. 4 Reactivity identification of IFA(400×) |
3 讨论
TiLV从2009年发现至今,有关其病原学和基因功能研究鲜有报道,病毒基因组各节段基因编码蛋白的功能和特征尚未明确,对其结构蛋白与非结构蛋白之间的相互作用、病毒增殖的调控及致病机理等方面,还有待全面研究和深入探索。通过对TiLV各蛋白的功能研究和了解,有助于更深入了解该病毒的复制过程以及病毒感染过程中的分子机制。MAb在病毒的病原学基础研究、诊断技术和疫苗开发以及基因功能研究等方面均具有重要作用[18]。由于目前还没有针对TiLV的防治方案,早期监控和免疫预防将成为防控该疾病的主要手段。此外,MAb对于病毒感染具有巨大治疗潜力,具有中和活性的MAb可以直接中和病毒,从而阻止病毒的扩散和增殖。随着MAb技术的发展,其在治疗感染性疾病中占据不可替代的地位[19]。
溴结构域广泛存在于真核细胞中,可以识别乙酰化赖氨酸残基的一类保守蛋白结构域[9]。研究表明,许多与转录有关的转录因子以及与染色质有关的蛋白质都存在溴结构域,根据结构序列,可以把含溴结构域蛋白(BCPs)划分为八大家族,目前研究较为深入的是具有表观遗传学靶点,与多种疾病关系紧密,并在介导基因转录和调控细胞周期中发挥重要作用的第Ⅱ家族溴结构域与超末端结构域[20-21]。目前,还有许多溴结构域的功能尚未明确,在水生动物上的研究与应用更是如此。通过TiLV S10序列分析发现,该蛋白中含有1个溴结构域,可能与TiLV的基因转录有关,但由于S10蛋白相关研究较少,其潜在的结构与功能未知,针对S10蛋白的重组表达和单抗制备可为该蛋白的功能研究和TiLV免疫学诊断奠定基础。
本研究通过构建载体pET32a-S10,并对其进行诱导表达,SDS-PAGE分析显示表达的蛋白大小约为38 ku。通过Western blot分析证实该蛋白质具有良好的反应原性。以纯化的S10重组蛋白为免疫原,制备并筛选出2株能够稳定高效分泌抗TiLV MAb的杂交瘤细胞株,间接ELISA分析结果显示,2株细胞株制备的MAb效价分别为1 ∶ 12 800、1 ∶ 51 200。Western blot和IFA证实,2种MAb均能特异性识别S10蛋白和TiLV。2种MAb均可识别TiLV病毒S10蛋白上的某一抗原表位,而该抗原表位的具体结构特征,则有待进一步深入探究。
4 结论本研究成功构建了含有TiLV基因组S10节段的原核表达载体pET32a-S10,经IPTG诱导可表达出大小约为38 ku的目的重组蛋白。利用纯化的重组蛋白免疫小鼠,经多轮筛选和鉴定,最终获得2株能够分泌抗S10编码蛋白MAb的杂交瘤细胞株,其编号分别为2C3、2E3。其中2C3细胞株分泌的抗体为IgG1/к型,2E3分泌的抗体为IgG2a/к型,2株细胞株经注射小鼠制备的MAb效价分别为1 ∶ 12 800和1 ∶ 51 200。经Western blot和IFA分析证实,2种MAb均能与TiLV特异性反应。本研究制备的MAb特异性好,抗体效价高,可为后续TiLV S10蛋白结构功能研究、TiLV疫苗研发、治疗手段以及诊断试剂的开发提供重要基础材料。
| [1] |
NICHOLSON P, FATHI M A, FISCHER A, MOHAN C, SCHIECK E, MISHRA N, JORES J. Detection of Tilapia Lake Virus in Egyptian fish farms experiencing high mortalities in 2015[J]. Journal of Fish Diseases, 2017, 40(12): 1925-1928. DOI:10.1111/jfd.12650 |
| [2] |
BEHERA B K, PRADHAN P K, SWAMINATHAN T R, SOOD N, PARIA P, DAS A, JENA J K. Emergence of Tilapia Lake Virus associated with mortalities of farmed Nile Tilapia Oreochromis niloticus(Linnaeus 1758)in India[J]. Aquaculture, 2018, 484: 168-174. DOI:10.1016/j.aquaculture.2017.11.025 |
| [3] |
NILAV A, ANIRBAN P, TANMOY G C, HIMADRI S. Tilapia Lake Virus(TiLV)disease: Current status of understanding[J]. Aquaculture and Fisheries, 2021. DOI:10.1016/j.aaf.2021.04.007 |
| [4] |
EYNGOR M, ZAMOSTIANO R, KEMBOU T J E, BERKOWITZ A, BERCOVIER H, TINMAN S, ELDAR A. Identification of a novel RNA virus lethal to tilapia[J]. Journal of Clinical Microbiology, 2014, 52(12): 4137-4146. DOI:10.1128/JCM.00827-14 |
| [5] |
BACHARACH E, MISHRA N, BRIESE T, ZODY M C, KEMBOU T J E, ZAMOSTIANO R, LIPKIN W I. Characterization of a novel orthomyxo-like virus causing mass die-offs of tilapia[J]. mBio, 2016, 7(2): e00431-00416. DOI:10.1128/mBio.00431-16 |
| [6] |
ACHARYA V, CHAKRABORTY H J, ROUT A K, BALABANTARAY S, BEHERA B K, DAS B K. Structural characterization of open reading frame-encoded functional genes from Tilapia Lake Virus(TiLV)[J]. Molecular Biotechnology, 2019, 61: 945-957. DOI:10.1007/s12033-019-00217-y |
| [7] |
WIN S, TAVEESAK J, NUTTHAWAN N, PUNTANAT T, KWANRAWEE S, ALONGKORN A. Outbreaks of Tilapia Lake Virus Infection, Thailand, 2015-2016[J]. Emerging Infectious Diseases, 2017, 23: 1031-1033. DOI:10.3201/eid2306.161278 |
| [8] |
ICTV. Virus Taxonomy: 2018b Release[Z]. International Committee on Taxonomy of Viruses, 2018.
|
| [9] |
陈建业, 张晛, 陈俊杰, 李瑞 祥". 溴"结构域(bromodomain)简介[J]. 生物化学与生物物理进展, 2001(6): 801. DOI:10.3321/j.issn:1000-3282.2001.06.037 CHEN J Y, ZHANG X, CHEN J J, LI R X. Introduction to bromodomain[J]. Progress in Biochemistry and Biophysics, 2001(6): 801. DOI:10.3321/j.issn:1000-3282.2001.06.037 |
| [10] |
YU N T, ZENG W W, WANG J H, ZHANG Y L, ZHANG X C, LIU Z X. A high efficacy DNA vaccine against Tilapia Lake Virus in Nile Tilapia (Oreochromis niloticus)[J]. Preprints, 2021. DOI:10.20944/preprints202107.0626.v1 |
| [11] |
JAEMWIMOL P, RAWIWAN P, TATTIYAPONG P, SAENGNUAL P, KAMLANGDEE A, SURACHETPONG W. Susceptibility of important warm water fish species to Tilapia Lake Virus(TiLV)infection[J]. Aquaculture, 2018, 497: 462-468. DOI:10.1016/j.aquaculture.2018.08.028 |
| [12] |
LIAMNIMITR P, THAMMATORN W, SONICHA U, TATTIYAPONG P, SURACHETPONG W. Non-lethal sampling for Tilapia Lake Virus detection by RT-qPCR and cell culture[J]. Aquaculture, 2018, 486: 75-80. DOI:10.1016/j.aquaculture.2017.12.015 |
| [13] |
YAMKASEM J, TATTIYAPONG P, KAMLANGDEE A, SURACHETPONG W. Evidence of potential vertical transmission of Tilapia Lake Virus[J]. Journal of Fish Diseases, 2019, 42: 1293-1300. DOI:10.1111/jfd.13050 |
| [14] |
WANG Y Y, WANG Q, ZENG W W, YIN J Y, LI Y Y, REN Y, SHI C B, BERGMANN S M, ZHU X. Establishment and characterization of a cell line from tilapia brain for detection of Tilapia Lake Virus[J]. Journal of Fish Diseases, 2018, 41(12): 1803-1809. DOI:10.1111/jfd.12889 |
| [15] |
王俊, 杜红丽, 凌飞, 钱莉, 申磊. 莱克多巴胺单克隆抗体的制备及特性鉴定[J]. 广东农业科学, 2008(12): 143-144. DOI:10.16768/j.issn.1004-874X.2008.12.056 WANG J, DU H L, LING F, QIAN L, SHEN L. Preparation and characterization of monoclonal antibodies against ractopamine[J]. Guangdong Agricultural Sciences, 2008(12): 143-144. DOI:10.16768/j.issn.1004-874X.2008.12.056 |
| [16] |
张春红, 伍惠卿, 杜伟贤, 黄忠, 赵心贤, 林惠婵. 抗鸡IgG单克隆抗体杂交瘤细胞株的建立[J]. 广东农业科学, 1996(1): 39-41. DOI:10.16768/j.issn.1004-874X.1996.01.015 ZHANG C H, WU H Q, DU W X, HUANG Z, ZHAO X X, LIN H C. Establishment of hybridoma cell line against chicken IgG monoclonal antibody[J]. Guangdong Agricultural Sciences, 1996(1): 39-41. DOI:10.16768/j.issn.1004-874X.1996.01.015 |
| [17] |
何静怡, 舒鼎铭, 林楚晓, 李莹, 王艳, 罗成龙. 鸡树突状细胞的间接免疫荧光制片方法比较[J]. 广东农业科学, 2020, 47(10): 126-131. DOI:10.16768/j.issn.1004-874X.2020.10.016 HE J Y, SHU D M, LIN C X, LI Y, WANG Y, LUO C L. Comparison of slide-preparing methods of chicken bone marrow dendritic cells by indirect immunofluorescence[J]. Guangdong Agricultural Sciences, 2020, 47(10): 126-131. DOI:10.16768/j.issn.1004-874X.2020.10.016 |
| [18] |
杨松鑫, 冯建远, 郭旋, 韦柳源, 梁翼莹, 严昊, 张子仪, 陈海兰. 小分子化合物单克隆抗体的制备及其在动物医学领域的应用[J]. 中国畜牧兽医, 2021, 48(3): 1121-1131. DOI:10.16431/j.cnki.1671-7236.2021.03.037 YANG S X, FENG J Y, GUO X, WEI L Y, LIANG Y Y, YAN H, ZHANG Z Y, CHEN H L. Preparation of monoclonal antibodies for small molecular compounds and their applications in the field of veterinary medicine[J]. Chinese Journal of Animal Science and Veterinary Medicine, 2021, 48(3): 1121-1131. DOI:10.16431/j.cnki.1671-7236.2021.03.037 |
| [19] |
白君, 陈继军. 感染性疾病单克隆抗体的研究进展[J]. 微生物学免疫学进展, 2021, 49(1): 65-72. DOI:10.13309/j.cnki.pmi.2021.01.011 BAI J, CHEN J J. Advances in monoclonal antibodies against infectious diseases[J]. Advances in Microbiology Immunology, 2021, 49(1): 65-72. DOI:10.13309/j.cnki.pmi.2021.01.011 |
| [20] |
曹冉, 李煜, 朱启华, 徐云根. BET溴结构域抑制剂的研究进展[J]. 中国药物化学杂志, 2020, 30(6): 347-358. DOI:10.14142/j.cnki.cn21-1313/r.2020.06.005 CAO R, LI Y, ZHU Q H, XU Y G. Research progress of BET bromine domain inhibitors[J]. Chinese Journal of Pharmaceutical Chemistry, 2020, 30(6): 347-358. DOI:10.14142/j.cnki.cn21-1313/r.2020.06.005 |
| [21] |
周磊, 韩一帆, 段志强. 含溴结构域蛋白2结构与功能的研究进展[J]. 中国细胞生物学学报, 2021, 43(4): 856-865. ZHOU L, HAN Y F, DUAN Z Q. Research progress on structure and function of bromo-containing domain protein 2[J]. Chinese Journal of Cell Biology, 2021, 43(4): 856-865. |
(责任编辑 崔建勋)
 2021, Vol. 48
2021, Vol. 48