文章信息
基金项目
- 农业农村部“科技助力经济2020”重点专项(SQ2020YFF0426352);佛山市深入推进创新驱动助力工程项目(2021045)
作者简介
- 李红胜(1983—),男,硕士,研究方向为生物发酵饲料,E-mail:hyczgd@163.com.
通讯作者
- 许赣荣(1957—),男,博士,教授,研究方向为发酵工程,E-mail:xugr@boencorp.com.
文章历史
- 收稿日期:2021-07-21
2. 农业农村部生物饲料国家重点实验室,江西 赣州 341000
2. State Key Laboratory of Biological Feed, Ministry of Agriculture and Rural Affairs, Ganzhou 341000, China
【研究意义】红曲菌(Monascus)又称红曲霉,是一类小型丝状腐生真菌。在我国,由红曲菌发酵制得的红曲在食品着色和药用方面已有1000多年使用历史[1]。红曲具有活血化瘀、健脾消食、降血脂、降血压等功效。红曲的药用价值与红曲菌固态发酵所产生的红曲色素、莫纳可林K(Monacolin K)、麦角固醇、γ- 氨基丁酸以及各种酶类、有机酸等次级代谢产物有着密切关系,红曲菌消化酶就是其中具有应用价值的成分之一。目前,饲料工业用酶制剂主要由芽孢杆菌类、曲霉类等菌株生产,已工业化生产并运用的有植酸酶、木聚糖酶、甘露聚糖酶、蛋白酶、淀粉酶、脂肪酶、糖化酶等。红曲菌在生长代谢过程中会产生多种酶类物质,对其合理利用能有效促进动物消化吸收、提高饲料利用率、促进动物生长、预防疾病等[2-5]。【前人研究进展】已有研究表明,大部分红曲菌都可以产生活性较高的蛋白酶,蛋白酶能将蛋白质水解成氨基酸、多肽等小分子化合物,利用这一特性,红曲菌在腌渍鱼肉、豆腐乳等高蛋白食品的生产加工中运用较为广泛。我国民间用红糟(红曲菌培养物)腌渍后的肉制品颜色鲜艳、肉质鲜嫩且风味独特[6]。红曲中的淀粉酶及糖化酶几乎能将淀粉完全水解成葡萄糖,利用红曲菌这一特性生产葡萄糖,比采用酸水解法生产葡萄糖具有原料利用率高、成本降低、成品质量高等优点。我国浙江、福建和台湾等省利用红曲中的淀粉酶、糖化酶作为糖化发酵剂酿制的红曲酒远近驰名。目前红曲消化酶主要用于肉制品行业和酿造行业,产品有红曲酒、红曲酱油、红曲醋、红曲腐乳等[7-9]。【本研究切入点】常规单因素试验优化发酵条件费时耗力,且未考虑变量间的交互作用。响应面分析采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析寻求最优工艺参数,能够综合评价一组变量与响应值(因变量)的关系,可用于优化发酵条件。【拟解决的关键问题】本试验对红曲菌产消化酶类的生产工艺进行研究,利用响应面法优化红曲菌产液化酶、糖化酶、蛋白酶的发酵条件,为红曲菌在饲料工业的运用提供参考。
1 材料与方法 1.1 试验材料供试7株红曲菌为实验室保存菌株,包括红色红曲菌9901、丛毛红曲菌9908、红色红曲菌9909、紫色红曲菌W1、紫色红曲菌ZH2、紫色红曲菌ZH6和紫色红曲菌SJS-6。
PDA琼脂斜面培养基:去皮土豆200 g,切块,加水800 mL煮沸30 min,经8层纱布过滤,用双蒸水定容至1 000 mL,向滤液中加入20 g葡萄糖、20 g琼脂,融化后倒入试管。115℃灭菌15 min,灭菌后放置斜面。
种子培养基:葡萄糖60 g/L,蛋白胨25 g/L,NaNO3 2 g/L,MgSO4·7H2O 1 g/L,K2HPO4·3H2O 1g/L,玉米浆粉6 g/L。121℃灭菌20 min。
发酵培养基:广西籼米50 g,加适量双蒸水灭菌冷却。
1.2 试验方法1.2.1 菌种斜面制备 将在4 ℃冰箱保藏的菌种置于30 ℃恒温箱中活化24 h,在超净工作台中将菌种转接至新鲜PDA斜面上,然后放入30℃恒温箱中培养8 d。
1.2.2 孢子悬浮液制备 在超净工作台中用无菌水将菌种孢子从斜面洗脱下来,制成孢子浓度为1×106个/mL的孢子悬液,用于接种。
1.2.3 液态种子培养 取上述孢子悬液按一定比例接种至装有100 mL种子培养基的三角瓶中,在30 ℃、170 r/min的旋转式摇床中培养48 h。
1.2.4 固态发酵培养 将培养好的液态种子按一定比例(最佳为25%)接种至装有50 g发酵培养基的三角瓶中,于生化培养箱30 ℃培养7 d。
1.2.5 单因素试验 分别对发酵时间(2、4、6、8、10 d)、加水量(30、35、40、45、50 mL)、接种量(15%、20%、25%、30%、35%)、发酵温度(25、27.5、30、32.5、35 ℃)进行红曲菌发酵产消化酶试验,以发酵产物中糖化酶、液化酶及蛋白酶的活性为指标,确定各因素的最佳发酵条件。
1.2.6 响应面优化试验 利用统计分析软件Minitab 15版进行试验设计和数据分析。在单因素试验基础上,分别以加水量、接种量、发酵温度为自变量,以红曲菌ZH6固态发酵产物中糖化酶、液化酶、蛋白酶的活性为因变量进行响应面优化。
1.3 消化酶活性检测1.3.1 液化酶 取1.000 g烘干后粉碎的红曲米加水18 mL、pH 4.6的乙酸- 乙酸钠缓冲液2 mL,于40 ℃恒温水浴1 h,期间20 min震荡1次,用慢性滤纸过滤备用。液化酶活力的测定采用分光光度法[10]。1 mL酶液在40 ℃下1 h水解1 mg淀粉为1个活力单位。
1.3.2 糖化酶 取1.000 g烘干后粉碎的红曲米加水18 mL、pH 4.6的乙酸- 乙酸钠缓冲液2 mL,于40 ℃恒温水浴1 h,期间20 min震荡1次,用慢性滤纸过滤备用。糖化酶活力的测定采用DSN法[11]。1 mL酶液在40 ℃下水解可溶性淀粉生成1 mg葡萄糖为1个活力单位。
1.3.3 蛋白酶 参照国家标准GB/T 23527-2009蛋白酶制剂,采用福林- 酚试剂法[12]测定蛋白酶活性。1 mL酶液在40 ℃下水解酪蛋白生成1 μg酪氨酸为1个活力单位。
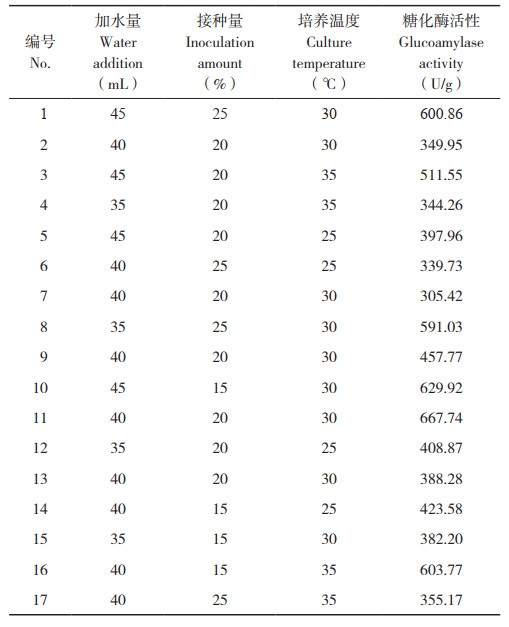
2 结果与分析 2.1 7株红曲菌固态发酵产物中消化酶活性比较从图 1可以看出,不同菌株的代谢产物中液化酶、糖化酶、蛋白酶活性存在较大差异,这可能与不同菌株代谢途径存在一定差异有关。7株红曲菌中液化酶、糖化酶、蛋白酶活性最高的菌株均为紫色红曲菌ZH6。蛋白酶又分为酸性蛋白酶、中性蛋白酶及碱性蛋白酶。从图 1可知,7株红曲菌所产生的蛋白酶均在酸性条件下活性最高。这可能与红曲菌嗜酸特性有一定关系,在碱性条件下蛋白酶受到一定损伤,因此红曲菌产生的蛋白酶活性在酸性条件下最高[13]。因此后续试验选取紫色红曲菌ZH6分别对红曲发酵产物中液化酶、糖化酶及酸性蛋白酶活性作进一步研究。
|
| A:液化酶;B:糖化酶;C:蛋白酶 A: Liquefaction enzyme, B: Glucoamylase, C: Protease 图 1 不同红曲菌固态发酵产物中消化酶活性比较 Fig. 1 Comparison of digestive enzyme activities in solid-state fermentation product of different Monascus strains |
2.2 紫色红曲菌ZH6固态发酵产消化酶单因素试验结果
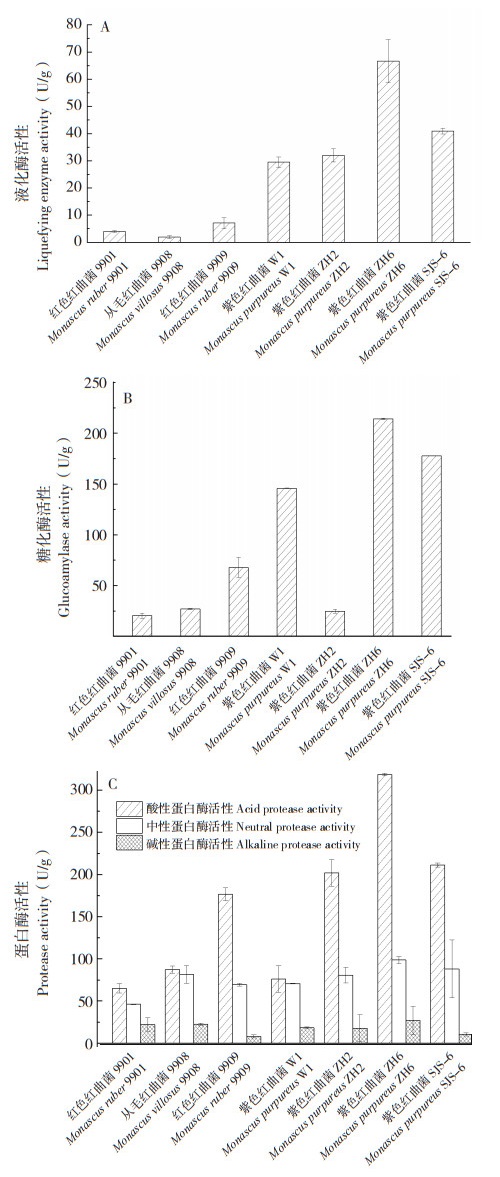
2.2.1 发酵时间对发酵产物中消化酶活性的影响 固定加水量为40 mL、培养温度为30 ℃、接种量为20%,研究发酵时间对紫色红曲菌ZH6固态发酵产物中液化酶、糖化酶、蛋白酶活性的影响。从图 2可以看出,发酵时间对紫色红曲菌ZH6发酵产物中液化酶、糖化酶及蛋白酶活性均有较大影响。随着发酵时间的增加,代谢产物中液化酶、糖化酶及蛋白酶活性先增高后降低,这可能是由于在发酵前期菌体大量繁殖同时需要较多营养物质,底物消耗较快,因此随着菌体生长繁殖产生大量消化酶,但发酵后期由于底物大量消耗已不能满足菌体生长需要而进入衰亡期,导致酶活降低且底物消耗速率减缓。紫色红曲菌ZH6液化酶的最适发酵周期为6 d,而糖化酶的最适发酵周期为10 d,这可能是由于淀粉在酶解过程中分为糖化和液化两个过程,在淀粉酶解过程中液化酶通过酶解将淀粉分解为糊精及低聚糖,而后由糖化酶将其水解为葡萄糖。酸性蛋白酶在发酵8 d时酶活达到最高。
|
| A:液化酶;B:糖化酶;C:蛋白酶 A: liquefaction enzymes, B: glucoamylase, C: protease 图 2 发酵时间对紫色红曲菌ZH6固态发酵产物中消化酶活性的影响 Fig. 2 Effects of fermentation time on digestive enzyme activity in solid-state fermentation product of Monascus purpureus ZH6 |
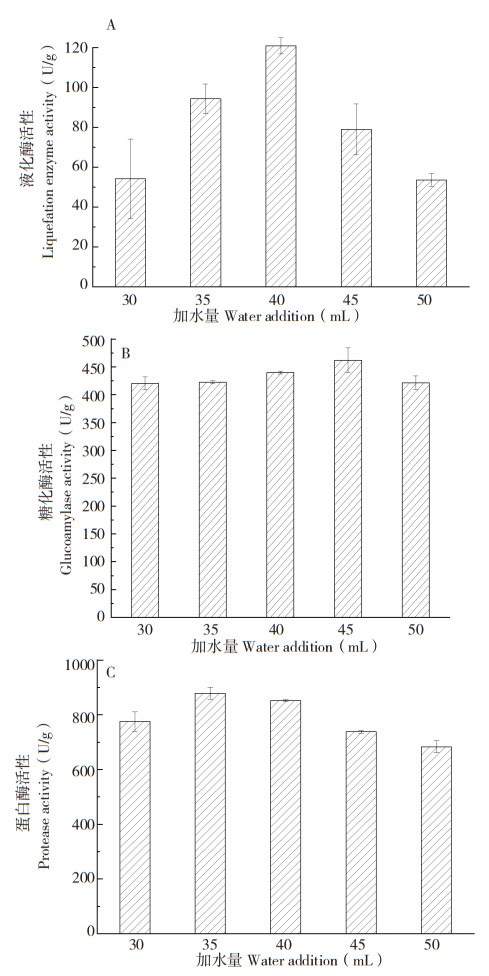
2.2.2 加水量对发酵产物中消化酶活性的影响 选用水分含量为8.8% 的大米作为固态发酵基质,固定接种量为20%、培养温度为30℃、发酵时间为7 d,分别加水30、35、40、45、50 mL,研究加水量对紫色红曲菌ZH6固态发酵产物中液化酶、糖化酶、蛋白酶活性的影响。从图 3可以看出,固态发酵基质的加水量对红曲菌固态发酵产物中液化酶、糖化酶及蛋白酶活性具有一定影响。当红曲菌固态发酵基质中加水40 mL(即初始水分含量为49.33%)时,液化酶活性达到最高;当加水45 mL(即初始水分含量为52%)时,糖化酶活性达到最高;当加水35 mL(即初始水分含量为46.35%)时,酸性蛋白酶活性达到最高。因此,同一菌株对不同代谢产物的最适水分含量也不同。
|
| A:液化酶;B:糖化酶;C:蛋白酶 A: Liquefaction enzymes; B: Glucoamylase; C: Protease 图 3 加水量对紫色红曲菌ZH6固态发酵产物中消化酶活性的影响 Fig. 3 Effect of water addition on digestive enzyme activity in solid-state fermentation product of Monascus purpureus ZH6 |
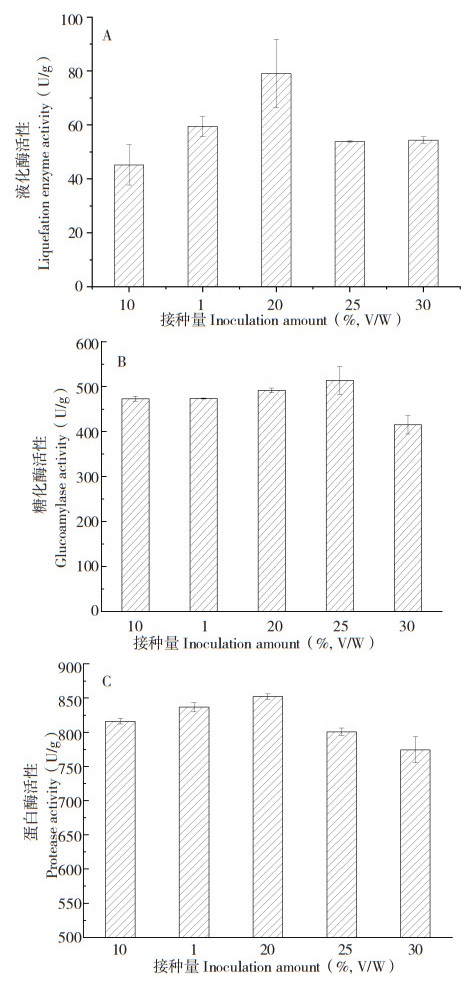
2.2.3 接种量对发酵产物中消化酶活性的影响 固定加水量为40 mL、培养温度为30 ℃、发酵时间为7 d,分别接种15%、20%、25%、30%、35% 研究接种量对紫色红曲菌ZH6固态发酵产物中液化酶、糖化酶、蛋白酶活性的影响。从图 4可以看出,接种量对紫色红曲菌ZH6固态发酵产物中液化酶、糖化酶、酸性蛋白酶的活性均有一定影响,随着接种量的增加,各酶活性先增加后降低,当接种量为20% 时,液化酶及酸性蛋白酶活性达到最高;当接种量为25% 时,糖化酶活性达到最高。
|
| A:液化酶;B:糖化酶;C:蛋白酶 A: Liquefaction enzymes; B: Glucoamylase; C: Protease 图 4 接种量对紫色红曲菌ZH6固态发酵产物中消化酶活性的影响 Fig. 4 Effect of inoculation amount on digestive enzyme activity in solid-state fermentation product of Monascus purpureus ZH6 |
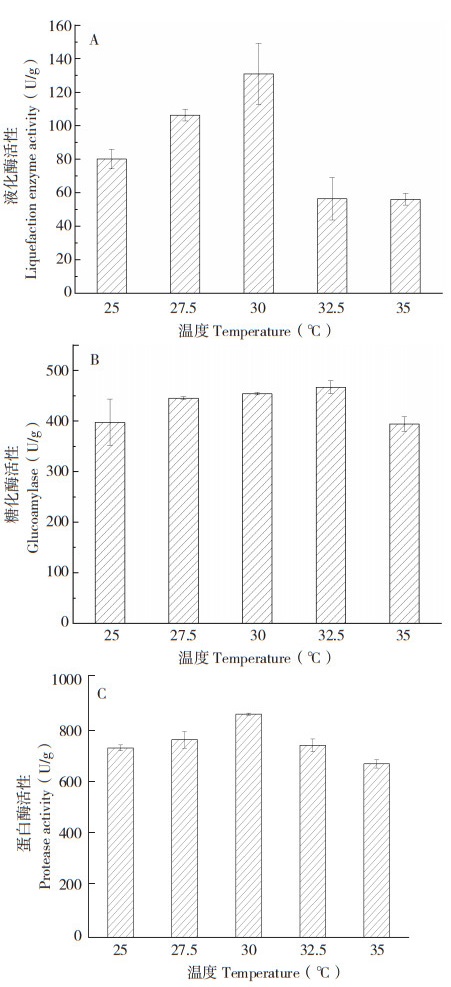
2.2.4 培养温度对发酵产物中消化酶活性的影响 红曲菌生长适宜的温度范围较广,可在15~42 ℃生长。固定加水量为40 mL、接种量为20%、发酵时间为7 d,分别在25、27.5、30、32.5、35 ℃培养,研究培养温度对紫色红曲菌ZH6固态发酵产物中液化酶、糖化酶、蛋白酶活性的影响。从图 5可以看出,发酵温度对红曲菌固态发酵产物中液化酶、糖化酶及酸性蛋白酶的活性均有一定影响。25~30 ℃时,随着温度升高酶活性升高;30~35 ℃时,随着温度继续升高酶活性反而降低。这可能是由于随着温度升高酶活性相对较高,菌体生长较快,从而产生大量酶;但超出一定温度范围后,生长过快的菌体在发酵后期营养物质可能已经大量消耗而提前到达衰亡期;而到发酵结束酶已经大量失活。当培养温度为30 ℃时,紫色红曲菌ZH6固态发酵产物中液化酶活性达到最高;当培养温度为32.5 ℃时,糖化酶活性达到最高;当培养温度为30 ℃时,酸性蛋白酶活性达到最高。
|
| A:液化酶;B:糖化酶;C:蛋白酶 A: Liquefaction enzymes; B: Glucoamylase; C: Protease 图 5 培养温度对紫色红曲菌ZH6固态发酵产物中消化酶活性的影响 Fig. 5 Effect of culture temperature on digestive enzyme activity in solid-state fermentation product of Monascus purpureus ZH6 |
2.3 响应面优化试验结果
紫色红曲菌ZH6固态发酵生产糖化酶、液化酶及酸性蛋白酶的最适发酵周期、最适加水量最适接种量及最适培养温度并不相同。由于种子液中水分含量约为90% 左右,因此接种量会对加水量造成较大影响,温度高低不仅影响菌体生长也对微生物体内酶活有较大影响。利用响应面试验设计,选用加水量、接种量及培养温度作为自变量,分别以液化酶、糖化酶及酸性蛋白酶活性作为因变量,对3种消化酶发酵工艺进行优化。
2.3.1 基于液化酶活性的响应面优化 为进一步研究加水量(A)、接种量(B)及培养温度(C)对液化酶活性的交互影响,在前期单因素试验基础上设计3因素3水平试验(表 1)。
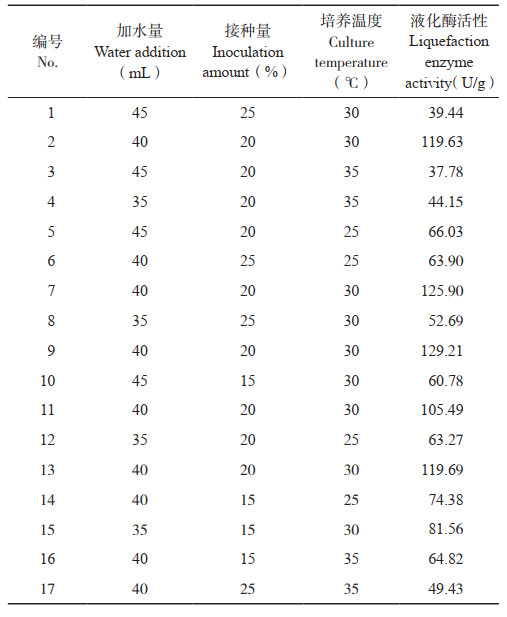
|
对结果进行二次回归拟合,得到液化酶活性的回归方程为:
液化酶活性(U/g)=119.98-4.70A-9.51B-8.93C+1.88AB-2.28AC-1.23BC-35.85A2-25.52B2-31.33C2
回归模型P=0.0003(<0.01),说明该模型极显著;失拟项P=0.4653(>0.05),说明该模型没有失拟,因此该模型可信度较高。因变量与自变量之间的线性关系显著,R2=0.9629,RAdj2=0.9153,说明该模型能解释96.29% 相应值变化,总变异中有3.71% 不能由该模型解释。可见,该模型与试验拟合良好,该回归方程能用于描述各因素与响应值之间的关系。
从图 6可以看出,曲面最高点均在响应面上,故各因素最优水平在所选范围内;用Design-Expert 8.0.1以紫色红曲菌ZH6固态发酵的液化酶活性最高为目的对模型进行优化,当加水量为39.67 mL、接种量为19.08%、培养温度为29.32℃时,液化酶活性可达121.63 U/g。为方便生产ZH6固态发酵生产的液化酶活性为119.27 U/g,控制,设加水量40 mL、接种量20%、培养温与预测结果差异较小,说明该模型预测值与试验度30 ℃、发酵培养6 d,在此条件下紫色红曲菌值具有良好的拟合性。
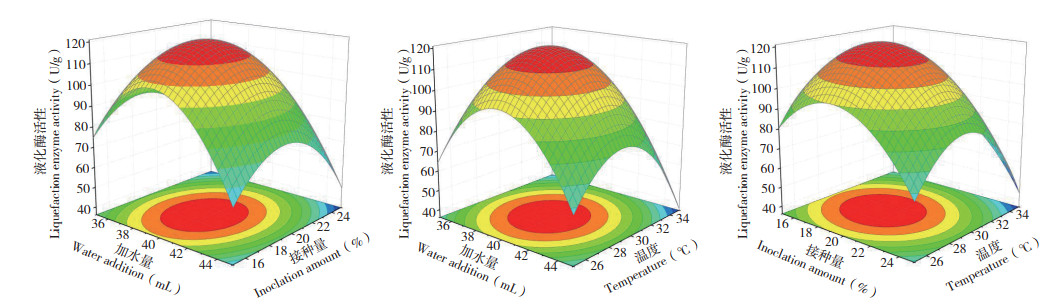
|
| 图 6 加水量、接种量、培养温度交互影响对液化酶活性的响应面结果 Fig. 6 Response surface results of the interaction of water addition, inoculation amount and temperature on liquefaction enzyme activity |
2.3.2 基于糖化酶活性的响应面优化 为进一步研究加水量、接种量及培养温度对糖化酶活性的交互影响,在前期单因素试验基础上设计3因素3水平试验,结果见表 2。对结果进行二次回归拟合,得到糖化酶活性的回归方程为:
糖化酶活性(U/g)=618.66-32.36A-24.07B+1.56C+4.62AB-9.22AC+20.41BC-76.94A2-96.43B2-171.53C2
回归模型P=0.0001(<0.01),说明该模型极显著;失拟项P=0.9156(>0.05),说明该模型没有失拟,因此该模型可信度较高。因变量与自变量之间的线性关系显著,R2=0.9809,RAdj2=0.9564,说明该模型能解释98.09% 相应值变化,总变异中有1.91% 不能由该模型解释。可见该模型与试验拟合良好,该回归方程能用于描述各因素与响应值之间的关系。
从图 7可以看出,曲面最高点均在响应面上,故各因素最优水平在所选范围内;用Design-Expert 8.0.1以紫色红曲菌ZH6固态发酵的糖化酶活性最高为目的对模型进行优化,当加水量为38.93 mL、接种量为19.35%、培养温度为30.02 ℃时,糖化酶活性可达623.693 U/g。为方便生产控制,设加水量38 mL、接种量20%、培养温度30 ℃、发酵培养10 d,在此条件下紫色红曲菌ZH6固态发酵生产的糖化酶活性为614.32 U/g,与预测结果差异较小,说明该模型预测值与试验值具有良好的拟合性。
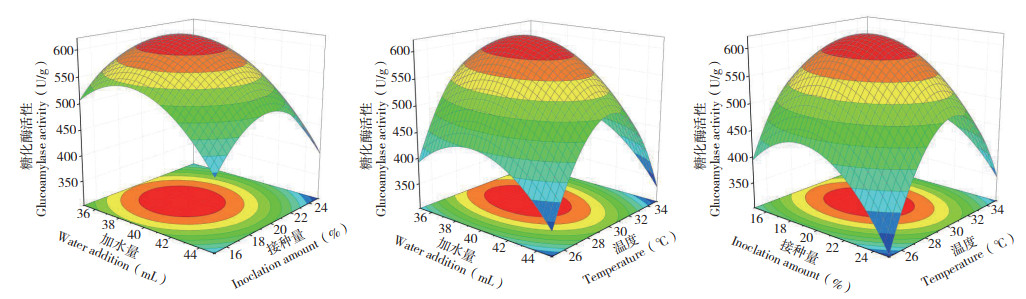
|
| 图 7 加水量、接种量、培养温度交互影响对糖化酶活性的响应面结果 Fig. 7 Response surface results of the interaction of water addition, inoculation amount and temperature on glucoamylase activity |
2.3.3 基于酸性蛋白酶活性的响应面优化 为进一步研究加水量、接种量及培养温度对酸性蛋白酶活性的交互影响,在前期单因素试验基础上设计3因素3水平试验,结果见表 3。对结果进行二次回归拟合,得到糖化酶酶活的回归方程为:
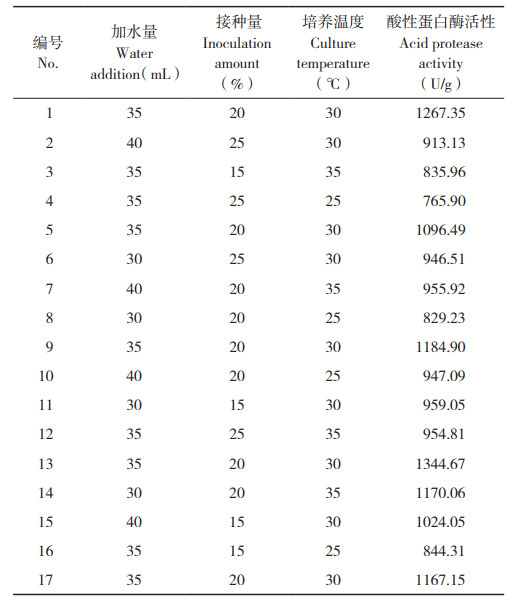
|
糖化酶活性(U/g)=1212.11-8.08A-10.38B+66. 28C-24.60AB-83.00AC+49.32BC-63.05A2-188.38B2-173.49C2
回归模型P=0.0099(<0.01),说明该模型极显著;失拟项P=0.8082(>0.05),说明该模型没有失拟,因此该模型可信度较高。因变量与自变量之间的线性关系显著,R2=0.8967,RAdj2=0.7639,说明该模型能解释89.67% 相应值变化,总变异中有10.33% 不能由该模型解释。可见该模型与试验拟合良好,该回归方程能用于描述各因素与响应值之间的关系。
从图 8可以看出,曲面最高点均在响应面上,故各因素最优水平在所选范围内;用Design-Expert 8.0.1以紫色红曲菌ZH6固态发酵的酸性蛋白酶活性最高为目的对模型进行优化,当加水量为33.83 mL、接种量为20.10%、培养温度为31.25 ℃时,酸性蛋白酶活性可达到1 221.21 U/ g。为方便生产控制,设加水量35 mL、接种量20%、培养温度31 ℃、发酵培养7 d,在此条件下紫色红曲菌ZH6固态发酵生产的酸性蛋白酶活性为1 194.21 U/g,与预测结果差异较小,说明该模型预测值与试验值具有良好的拟合性。
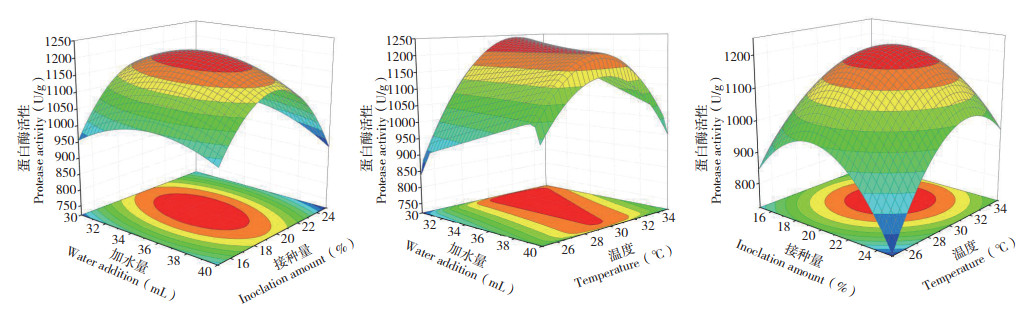
|
| 图 8 加水量、接种量、培养温度交互影响对蛋白酶活性的响应面结果 Fig. 8 Response surface results of the interaction of water addition, inoculation amount and temperature on protease activity |
3 讨论
从菌株选育和发酵条件优化两个方面进行研究突破,是获得高活性酶并走向工业化生产的必由之路。菌株选育一般采用诱变育种,通过该路径获得的有益突变率低,变异的方向和性质难以掌控,但如果选育成功则生产性能有较大突破。影响酶产量的因素很多,各因素之间相互联系。响应面分析是一种最优化方法,其将体系响应作为一个或多个因素的函数,运用图形技术将这种函数关系显示出来,从而确定试验设计中的最优化条件。利用响应面分析法优化菌株的最适产酶条件,是一种快捷充分发挥菌株性能的方法。通过对红曲菌发酵过程中各种条件进行优化,可以促进消化酶产量的增加。国内外学者在这方面做了较多研究,从发酵过程中的培养基组成到培养条件均有相关报道。在培养条件的优化上,从发酵时间、初始pH、摇瓶转数、装液量等因素进行研究。戴德慧等[13]在籼米基础上添加一定比例的豆粕,优化后培养的红曲菌产糖化酶活性达883.7 U/g,蛋白酶活性为462.3 U/g;刘波等[14]用响应面试验设计对红曲菌固态发酵产生淀粉酶的培养基进行优化,糖化酶活性为662.2 U/g;薛英丽等[15]筛选出一株产木聚糖酶较高的紫色红曲菌株,木聚糖酶活性达807.9 U/g。本研究试验菌株紫色红曲菌ZH6经响应面优化所产生的液化酶、糖化酶及蛋白酶同时具有较高活性,这在饲料工业中运用具有积极意义。由于本试验并未研究该菌株产纤维素酶、木聚糖酶、β- 葡聚糖酶等消化酶的特性,因此对其综合产消化酶能力尚需进一步研究。
红曲菌及其制剂运用于动物生产有较好效果。高凯等[4]研究表明,0.5% 红曲合生元酵母硒锗复合制剂可预防断奶仔猪腹泻,同时有效促进断奶仔猪生长发育,该复合制剂可替代日粮中25 mg/kg硫酸黏杆菌素和45 mg/kg金霉素。付兴周等[16]发现,添加红曲复合添加剂能显著降低料肉比,显著提高肉鸡的肌肉红度和黄度,显著降低滴水损失。红曲酒糟是一种优质蛋白饲料,在蛋鸡饲粮中可代替豆粕使用,对蛋鸡生产性能无显著影响,可提高蛋黄色泽,一定程度上改善蛋品质[17]。饲粮中添加一定量(10%~30%)的红曲酒糟对山羊的生长性能没有负面影响,并能有效改善脂质代谢[18]。本研究中紫色红曲菌ZH6有较高消化酶活性,但在畜禽生产上的运用还需进一步研究。
4 结论利用紫色红曲菌ZH6菌株,以大米为固态发酵基质对红曲菌固态发酵产液化酶、糖化酶和酸性蛋白酶的生产工艺进行优化,当加水量为42 mL、接种量为20%、培养温度为33 ℃、发酵培养6 d时,紫色红曲菌ZH6固态发酵生产的液化酶活性达119.27 U/g;当加水量为38 mL、接种量为20%、培养温度为30 ℃、发酵培养10 d时,紫色红曲菌ZH6固态发酵生产的糖化酶活性为614.32 U/g;当加水量为35 mL、接种量为20%、培养温度为31 ℃、发酵培养7 d时,紫色红曲菌ZH6固态发酵生产的酸性蛋白酶活性为1 194.21 U/g。
| [1] |
陈彬. 高产Monacolins红曲菌菌学及深层发酵工艺之研究[D]. 杭州: 浙江工业大学, 2011. DOI: 10.7666/d.y1958345. CHEN B. Study on bacteriology and submerged fermentation of Monascus producing monacolins[D]. Hangzhou: Zhejiang University of Technology, 2011. DOI: 10.7666/d.y1958345. |
| [2] |
刘超. 红曲霉素中药合生元对京红鸡生长性能及免疫功能的影响[D]. 延吉: 延边大学, 2015. DOI: 10.7666/d.D01169501. LIU C. Effects of monascus traditional chinese medicine synbiotics on growth performance and immune function of Jinghong chicken[D]. Yanji: Yanbian University, 2015. DOI: 10.7666/d.D01169501. |
| [3] |
简仕燕, 王菲, 郭子義, 马政发, 陈祥, 吴文旋, 陈鑫珠, 刘景, 吴佳海, 牟琼. 瘤胃体外发酵评价红曲米酒糟作为山羊饲料原料的可行性[J]. 动物营养学报, 2020, 32(8): 3780-3788. DOI:10.3969/j.issn.1006-267x.2020.08.037.j.issn.1006-267x.2020.08.037 JIAN S Y, WANG F, GUO Z X, MA Z F, CHEN X, WU W X, CHEN X Z, LIU J, WU J H, MU Q. Evaluation of red yeast rice distillers' grains used as feed for goats by rumen fermentation in vitro[J]. Journal of Animal Nutrition, 2020, 32(8): 3780-3788. DOI:10.3969/j.issn.1006-267x.2020.08.037.j.issn.1006-267x.2020.08.037 |
| [4] |
高凯, 菅芯蕊, 耿春银, 张敏. 红曲合生元、酵母硒锗及其组合对断奶仔猪生长性能、养分表观消化率、血清生化指标的影响[J]. 中国畜牧兽医, 2019, 46(9): 2583-2591. DOI:10.16431/j.cnki.1671-7236.2019.09.011 GAO K, JIAN X R, GENG C Y, ZHANG M. Effect of monascus synbiotic, yeast-selenium-germanium culture and their compound preparation on growth performance, apparent digestibility and serum biochemistry of weaned piglets[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(9): 2583-2591. DOI:10.16431/j.cnki.1671-7236.2019.09.011 |
| [5] |
KOLI S H, SURYAWANSHI R K, PATIL C D, PATIL S V. Fluconazole treatment enhances extracellular release of red pigments in the fungus Monascus purpureus[J]. FEMS Microbiol Lett, 2017(8): 3-10. DOI:10.1093/femsle/fnx058 |
| [6] |
余翔. 红曲菌肉品发酵菌株筛选、鉴定及其酸性蛋白酶功能特性研究[D]. 南京: 南京农业大学, 2015. DOI: 10.7666/d.Y3184315. YU X. Screening and identification of Monascus meat fermentation strains and functional characteristics of acid protease[D]. Nanjing: Nanjing Agricultural University, 2015. DOI: 10.7666/d.Y3184315. |
| [7] |
魏明英, 邬应龙. 大米蛋白的研究进展[J]. 粮食与饲料工业, 2003(3): 44-45. DOI:10.3969/j.issn.1003-6202.2003.03.013 WEI M Y, WU Y L. Progress in rice protein study[J]. Cereal & Feed Industry, 2003(3): 44-45. DOI:10.3969/j.issn.1003-6202.2003.03.013 |
| [8] |
吴衍庸. 红曲酯化酶新技术及在中国白酒上的应用[J]. 食品科学, 2004, 25(1): 29-32. DOI:10.3321/j.issn:1002-6630.2004.z1.061 WU Y Y. Monascus esterified enzyme new techniques and Its application in Liquor production in China[J]. Food Science, 2004, 25(1): 29-32. DOI:10.3321/j.issn:1002-6630.2004.z1.061 |
| [9] |
蒋冬花, 后家衡, 李杰, 赵进成, 杨宝峰. 红腐乳中高产γ-氨基丁酸红曲霉菌株的筛选[J]. 浙江师范大学学报(自然科学版), 2007, 30(4): 447-452. DOI:10.3969/j.issn.1001-5051.2007.04.018 JIANG D H, HOU J H, LI J, ZHAO J C, YANG B F. Screening of a high γ-aminobutyric acid-producing Monascus spp. from red preserved beancurd[J]. Journal of Zhejiang Normal University (Natural Sciencees), 2007, 30(4): 447-452. DOI:10.3969/j.issn.1001-5051.2007.04.018 |
| [10] |
沙均响, 郑冬梅, 刘建芝, 宁明理. 分光光度法检测大曲液化力[J]. 酿酒, 2015(6): 96-99. SHA J X, ZHENG D M, LIU J Z, NING M L. Detection thedaqu liquefying power by spectrophotometry[J]. Liquor Making, 2015(6): 96-99. |
| [11] |
崔敬爱, 戴碧玮, 邵智韬, 徐岩, 庄若岩, 曹勇, 陈海燕, 陈晓平. 黑曲霉突变菌株产糖化酶的酶学特性表征[J]. 食品工业科技, 2018, 39(21): 124-128, 133. DOI:10.13386/j.issn1002-0306.2018.21.023 CUI J A, DAI B W, SHAO Z T, XU Y, ZHUANG R Y, CAO Y, CHEN H Y, CHEN X P. Enzymatic characterization of glucoamylase from Aspergillus niger mutant[J]. Science and Technology of Food Industry, 2018, 39(21): 124-128, 133. DOI:10.13386/j.issn1002-0306.2018.21.023 |
| [12] |
GB/T 23527-2009蛋白酶制剂[S]. 北京: 中国标准出版社, 2009. GB/T 23527-2009 Protease preparation[S]. Beijing: China Standards Press, 2009. |
| [13] |
戴德慧, 郭爱莲, 蒋家新. 红曲米豆的培养及酶学研究[J]. 食品科学, 2003, 24(4): 102-104. DOI:10.3321/j.issn:1002-6630.2003.04.024 DAI D H, GUO A L, JIANG J X. Study on culture and enzyme characteristics of monascus ruber on rice and soybean chips[J]. Food Science, 2003, 24(4): 102-104. DOI:10.3321/j.issn:1002-6630.2003.04.024 |
| [14] |
刘波, 曾丽萍, 邬应龙. 红曲霉固态发酵产生淀粉酶培养基的优化[J]. 食品科学, 2014, 35(7): 181-186. DOI:10.7506/spkx1002-6630-201407036 LIU B, ZENG L P, WU Y L. Optimization of medium components for the production of raw-starch-digesting amylase by Monascus M2 in solid state fermentation[J]. Food Science, 2014, 35(7): 181-186. DOI:10.7506/spkx1002-6630-201407036 |
| [15] |
薛英丽, 邬应龙. 高产木聚糖酶的紫色红曲霉菌株筛选及酶学性质研究[J]. 安徽农业科学, 2011, 39(20): 11993-11995. DOI:10.3969/j.issn.0517-6611.2011.20.004 XUE Y L, WU Y L. Selection of high xylanase yielding monascus pupureus bacterium strain and its properties of enzyme[J]. Journal of Anhui Agricultural Sciences, 2011, 39(20): 11993-11995. DOI:10.3969/j.issn.0517-6611.2011.20.004 |
| [16] |
付兴周, 路志芳, 李东. 红曲复合添加剂对肉鸡生长性能及肉质性状的影响[J]. 中国畜牧兽医, 2016, 43(11): 2951-2955. DOI:10.16431/j.cnki.1671-7236.2016.11.021 FU X Z, LU Z F, LI D. Effect of Monascus compound additive on growth performance and meat quality of broiler[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(11): 2951-2955. DOI:10.16431/j.cnki.1671-7236.2016.11.021 |
| [17] |
李忠荣, 陈鑫珠, 邱华玲, 缪伏荣, 方桂友, 刘锦. 饲粮中添加红曲酒糟对蛋鸡生产性能和蛋品质的影响[J]. 福建农业学报, 2021, 36(3): 319-325. DOI:10.19303/j.issn.1008-0384.2021.03.010 LI Z R, CHEN X Z, QIU H L, MIAO F R, FANG G Y, LIU J. Effects of feeding hongqu glutinous rice wine grains diets on performance and egg quality in laying hens[J]. Fujian Journal of Agricultural Sciences, 2021, 36(3): 319-325. DOI:10.19303/j.issn.1008-0384.2021.03.010 |
| [18] |
简仕燕, 吴文海, 王菲, 郭子義, 马政发, 陈祥, 吴文旋, 陈鑫珠, 刘景, 吴佳海, 牟琼, 赵鹏. 红曲米酒糟对山羊生长性能与脂质代谢的影响[J]. 动物营养学报, 2021, 33(2): 1184-1190. DOI:10.3969/j.issn.1006-267x.2021.02.059 JIAN S Y, WU W H, WANG F, GUO Z Y, MA Z F, CHEN X, WU W X, CHEN X Z, LIU J, WU J H, MOU Q, ZHAO P. Effects of red yeast rice distillers' grains on growth performance and lipid metabolism of goats[J]. Chinese Journal Of Animal Nutrition, 2021, 33(2): 1184-1190. DOI:10.3969/j.issn.1006-267x.2021.02.059 |
(责任编辑 崔建勋)
 2021, Vol. 48
2021, Vol. 48