文章信息
基金项目
- 广东省自然科学基金(2016A030313781);广东省烟草专卖局(公司)重大专项(粤烟科项专201701);广东省烟草专卖局(公司)科技项目(粤烟科项201702,粤烟科项201908,粤烟科项201911)
作者简介
-
马柱文(1985—),男,硕士,高级农艺师,研究方向为烟草种质资源及新品种选育,E-mail:conghuama@163.com
马柱文,高级农艺师,主要从事烟草种质资源繁种更新及新品种选育研究。主持或参与承担农业部、国家烟草专卖局、广东省科技厅、广东省农业厅、广东省烟草专卖局、广东省农业科学院等科研项目10余项。参与选育烤烟新品种粤烟208,申请授权烟草植物新品种权4项;在Theoretical & Applied Genetics、《中国烟草科学》《广东农业科学》等期刊发表学术论文10余篇(其中SCI论文2篇);参编著作《广东烟草种质资源(卷一)》,获得国家发明专利5项、广东省烟草专卖局(公司)科技进步奖3项.
通讯作者
- 袁清华(1978—),女,博士,副研究员,研究方向为烟草蛋白组学及新品种选育,E-mail:qinghua654321@126.com.
文章历史
- 收稿日期:2021-10-29
【研究意义】烟草青枯病是由雷尔氏菌(Ralstonia solanacearum)引起的一种土传细菌性病害,常暴发流行于热带和亚热带地区[1]。病菌通常由开放性伤口入侵,有些情况下也从主根发生侧根时产生的自然开口入侵,入侵后病菌进入木质部,迅速耗尽木质部的氧气并堵塞导管使水分运输受阻[2],维管组织及木质部变色,叶片枯萎,烟株凋亡[3]。该菌宿主范围极广,除烟草外,茄子、番茄、马铃薯等其他茄科作物均可侵染为害[4-5]。【前人研究进展】随着分子生物学的发展,尤其是转录组和蛋白组学等技术的广泛应用,人们对植物响应病原菌的入侵有了更深入的了解[6]。Chen等[7]对抗、感两个茄子品种接种青枯病菌后的转录组分析显示,大部分差异表达基因属于生物过程类别,其中代谢过程和细胞过程的基因数目最多。接种青枯病菌后抗、感两个品种的差异表达蛋白中有85个属于免疫应答蛋白。Prasath等[8]对抗、感两个生姜品种接种青枯病菌后的转录组分析鉴定出抗性品种105个基因在接种之后表达量上调,其中包含直接参与通过水杨酸(SA)介导的超敏反应、系统性获得和细胞凋亡反应抵御病原菌的重要基因。利用双向电泳和质谱分析技术,Park等[9]发现马铃薯青枯病抗性品种CT206-10中富甘氨酸RNA结合蛋白(Glycine-rich RNA binding protein,GRP)、番茄胁迫诱导-1蛋白(Tomato stress induced-1 protein,TSI-1)、发病相关(Pathogenesis-related,STH-2)蛋白等8个响应青枯病菌入侵的差异蛋白。利用相同技术,Afroz等[10]从青枯病菌接种番茄抗、感两个品种中鉴定出9个差异表达蛋白,与感病品种相比,其中的60 ku伴侣蛋白和Rubisco活化酶在抗性品种中显著上调。【本研究切入点】大叶密合是广东封开县主栽晒烟品种,为名优晾晒烟品种之一,对青枯病具有较强且稳定的抗性[11-13]。SSR遗传图谱分析显示大叶密合的6个QTL不同于已经发现的抗源[14]。【拟解决的关键问题】利用同位素相对和绝对定量标记(Isobaric tags for relative and absolute quantitation,iTRAQ)方法研究大叶密合接种青枯病菌后的蛋白质表达量变化,旨在探寻与抗青枯病相关的功能蛋白及代谢途径,为烟草抗青枯病分子机制的研究提供理论依据。
1 材料与方法 1.1 试验材料供试品种为大叶密合、D101(抗病对照品种)和长脖黄(感病对照品种),均来源于广东省农业科学院作物研究所。
1.2 试验方法1.2.1 样品处理及采集 2019年7月15日播种,人工气候箱中培养,培养条件为温度27 ℃、湿度80%、光照强度12 000 lx。烟苗生长至具有6片真叶成苗期时,采用伤根灌菌法接种青枯病菌。试验设置高致病力菌株203(生化型Ⅲ)、低致病力菌株204(生化型亚型Ⅲ-1)[15]以及无菌水处理3个处理,每个处理3个重复,每个重复种植12株,每株淋灌150 mL细菌悬浮液,浓度为3.9×108 CFU/mL,分别在接菌处理0、3、6、9、12 h取新鲜叶片用于RNA表达量分析,取样部位为成苗期最长叶(第5片叶)。感病对照品种长脖黄茎基部出现发病症状时,剪取新鲜叶片用于差异蛋白分析,接菌后5、10、15、20 d调查发病率及病情指数。
1.2.2 差异表达蛋白分析 将新鲜烟叶样品用酚抽提法提取蛋白,用裂解液溶解蛋白后再进行超声裂解,蛋白裂解液用DTT还原处理后进行半胱氨酸的烷基化封闭,再加入丙酮-20℃过夜沉淀蛋白,蛋白沉淀在TEAB中再次超声裂解后取上清用于定量。定量的蛋白加入胰蛋白酶消化后真空离心干燥,进行iRATQ标记,每组样品对应一个分子质量(iTRAQ113- 大叶密合接种后、iTRAQ114- 大叶密合接种前)。标记后各组肽段混合,用SCX进行液相分离,MS/MS鉴定。每个样本设定两次上机重复。蛋白鉴定结果经MASCOTT2.2搜索Nicotiana benthamiana、Nicotiana sylvestris、Nicotiana tabacum等3个物种的整合数据库进行统计分析,当蛋白丰度比(即差异倍数)达到1.5倍以上且经统计检验其P值小于0.05时,视该蛋白为不同样品间的差异蛋白,差异蛋白进行GO分析和Pathway富集分析。
1.2.3 烟草凝集素基因转录水平分析 采用Trizol法提取新鲜烟草叶片RNA,采用微量紫外分光光度计测定RNA浓度,采用琼脂糖电泳技术测定RNA纯度和完整度,用反转录试剂盒(Invitrogen公司)进行cDNA合成,反转录引物混合使用随机引物和Oligo(dT)。使用Fast SYBR® Green MasterMix Bulk Pack试剂盒公司荧光定量扩增烟草凝集素基因Nictaba,以actin为内参。actin引物序列:actinf:5'-AAGGGATGCGAGGATGGA-3';actinr:5'-CAAGGAAATCACCGCTTTGG-3',Nictaba引物序列:Nictabaf:5'-AGGGTAGCTTGGCTTGAC-3';nictabar:5'-TCTTAGCGATGCTGTGGC-3',扩增产物进行琼脂糖电泳确认。以2-∆∆CT法计算基因的相对表达量。
2 结果与分析 2.1 病情指数分析由表 1可知,接入高致病力菌株203(生化型Ⅲ)后,感病对照品种长脖黄最先出现植株枯萎症状,抗病对照品种D101于接菌后5 d出现植株枯萎症状,大叶密合于接菌后10 d出现植株枯萎症状。大叶密合的青枯病抗性表现优于抗病对照品种D101。参试品种接入低致病力菌株204(生化型亚型Ⅲ-1),植株发病程度有所减缓,这与菌株致病力高度相关。接菌处理20 d后,参试品种发病率均达75% 以上,感病对照品种长脖黄发病率接近100%。

|
2.2 蛋白质信息鉴定
由图 1可知,成功鉴定的有定量信息的蛋白共有1 312个,其中共有蛋白1 277个。GO注释包含描述基因的分子功能(Molecular function)、所处的细胞位置(Cellular component)、参与的生物过程(Biological process)。对总蛋白进行GO注释,鉴定到的蛋白在生物过程中占比较大条目为代谢过程(Metabolic process,26.55%)和细胞过程(Cellular process,24.09%),在分子功能中催化(Catalytic,41.03%)和结合(Binding,46.4%)占多数,而细胞组分中主要条目为细胞(Cell,25.51%)和细胞部分(Cell part,25.51%)。

|
| 图 1 GO注释分析 Fig. 1 GO annotation analysis |
2.3 COG功能分析
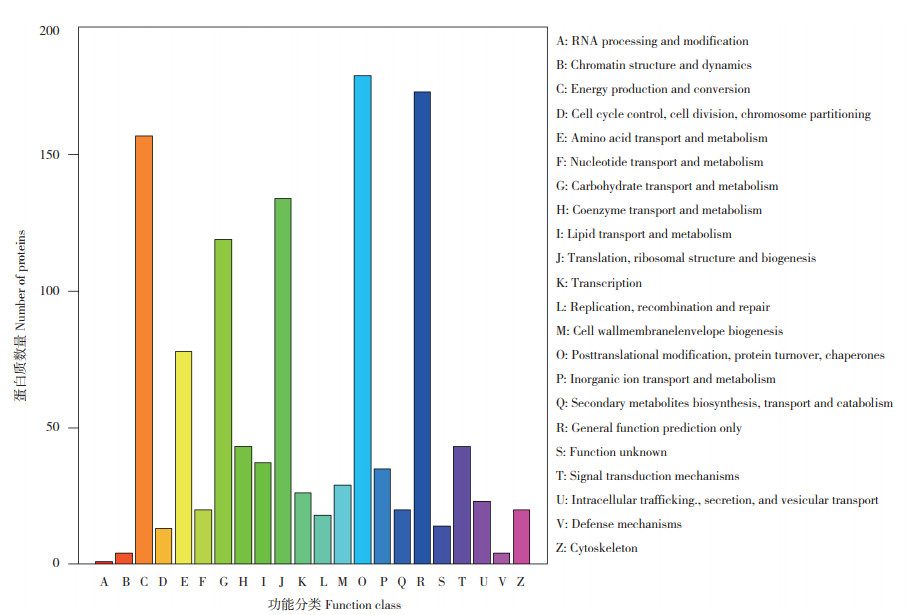
蛋白相邻类的聚簇(Cluster of Orthologous Groups of proteins,COG)是对蛋白质进行直系同源分类的数据库。构成每个COG的蛋白均被假定为来自同一个祖先蛋白,且为Orthologs或Paralogs。Orthologs指来自于不同物种的由垂直家系(物种形成)进化而来的蛋白,且特异地保留与原始蛋白相同的功能。Paralogs指在一定物种中的来源于基因复制的蛋白,可能会进化出新的与原来有关的功能。对鉴定蛋白进行分类,翻译后的修饰、蛋白周转、分子伴侣(Posttranslational modification, protein turnover, chaperones)蛋白数量最多,其次是整体功能类(General function prediction only),RNA加工与修饰类(RNA processing and modification)数量最少,具体如图 2所示。
|
| 图 2 表达蛋白COG功能分类 Fig. 2 Classification of COG function of expressed proteins |
2.4 接种青枯病菌后差异表达蛋白分析
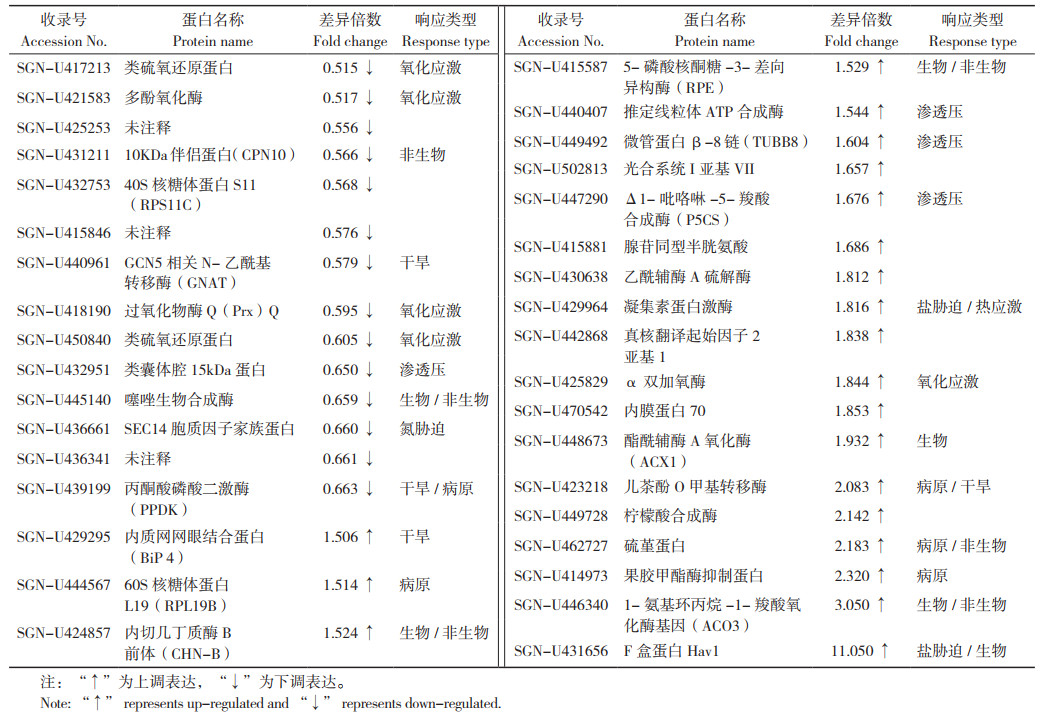
通过蛋白质组学分析,对比接种青枯病菌前后的烟草叶片蛋白表达量,发现35个差异表达蛋白,其中21个下调表达、14个上调表达,共有25个蛋白参与到植物应对外界刺激反应过程中(表 2)。上调程度最大的蛋白为Hav1,属于烟草凝集素家族。现已在普通烟草不同品种中发现Hav1的同源基因有sam1、sam2、sam3、sam4、hav1、hav2、wis、xan和by-2。这些凝集素基因高度保守,由165个氨基酸编码的蛋白在7类氨基酸的位置上有差异。
|
2.5 接种青枯病菌后烟草凝集素表达量变化
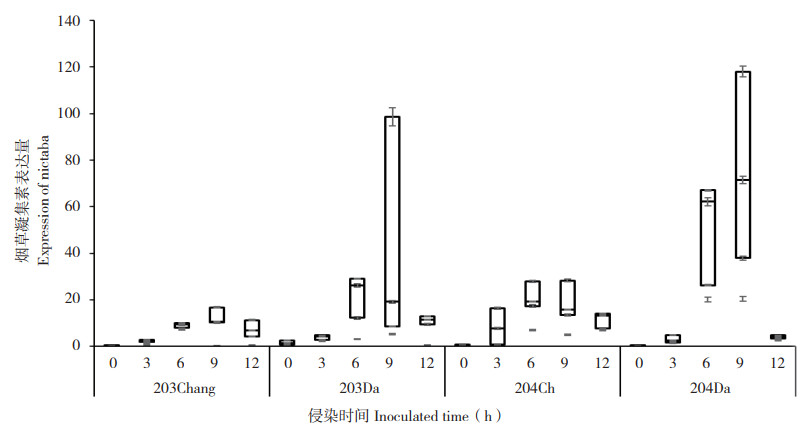
以烟草actin为内参基因,采用实时荧光定量PCR检测烟草凝集素基因在抗病和感病两个烟草品种分别接种致病和低致病青枯病菌后的相对表达量。由于烟草凝集素家族基因的高度保守性,扩增片段包括该家族中的所有基因。接种致病与非致病青枯病菌后烟草凝集素在两个烟草品种中的表达量均呈现先上升后下降的趋势(图 3),其中大叶密合烟草凝集素表达量的上升程度较长脖黄更高。长脖黄烟草凝集素的表达量在接种非致病菌后6 h达到最高值,其余处理烟草凝集素表达量均在接菌后9 h达到最高,接菌后12 h的表达量较接菌后6 h和9 h下降。
|
| 图 3 参试品种接种青枯病菌后烟草凝集素的表达量 Fig. 3 Expression of nictaba in tested varietiesafter inoculation with Ralstonia solanacearum |
3 讨论
植物免疫激活的两个平行的信号转导途径之一位于叶绿体。叶绿体介导的免疫信号传导会导致叶绿体源的活性氧(ROS)及抵御相关激素(如水杨酸SA、茉莉酸JA)的产生[16]。植物受到胁迫的反应之一是生成ROS,但是大量ROS会损伤细胞结构,因此ROS的生成和代谢需要依靠氧化还原反应维持在稳定状态。本研究在抗性品种大叶密合中鉴定到在氧化还原平衡调控中起重要作用的5个蛋白,包括多酚氧化酶、过氧化物酶、α双加氧酶和2个硫氧还原蛋白。位于叶绿体中的6个蛋白在接菌前后发生差异表达:2个硫氧还原蛋白、类囊体腔15 ku蛋白及丙酮酸磷酸二激酶(PPDK)表达量降低,5- 磷酸核酮糖-3- 差向异构酶和光合系统Ⅰ亚基Ⅶ蛋白表达量升高。由于光合系统的蛋白通常协同表达,呈现相似的表达趋势。Cheng等[17]发现野火病菌(Pseudomonas syringae pv. tabaci)感染后烟草光合系统Ⅰ的活性下降,同时PsbO蛋白、D1蛋白和PsaA蛋白发生降解。沈喜等[18]调查抗病品种小麦感染条锈病菌后叶绿素含量在0~12 d内的变化,发现叶绿素在0~3 d下降,之后呈上升趋势。叶绿体中的PPDK在接菌后表达量下降,该酶也在光合作用中发挥作用,研究发现该酶活性在烟草受到马铃薯病毒Y侵染或干旱胁迫时提高。酶活性受翻译后加工的影响,并不一定与酶的丰度直接相关[19]。由于植物受病菌感染后,参与免疫反应的蛋白和RNA的表达量也处于动态变化中,取样时机对差异蛋白的鉴定及表达丰度有较大影响。茉莉酸及其衍生物在植物多个生物过程尤其是生物胁迫(如病原菌入侵、咀嚼式口器昆虫取食)中发挥作用[20-21]。本研究鉴定到的差异蛋白中上调幅度最大的是凝集素家族成员之一的Hav1。凝集素广泛存在于动物、植物和微生物中,具有至少1个可以可逆结合特定单糖或寡糖的非催化结构域[22]。凝集素蛋白由于具有细胞与蛋白或细胞与细胞之间的识别特性而参与到多种生物过程中,尤其是在免疫防御中发挥作用[23-24]。本研究调查了烟草凝集素在参试品种接菌后0~ 12 h的转录,发现烟草凝集素在接菌处理后9 h达到最高值后开始下降。斜纹夜蛾幼虫对烟草的取食实验表明,烟草凝集素的RNA在取食10 h后表达量最高,之后略有下降,而蛋白表达量从开始取食后逐步升高,到取食后15 h达到峰值,之后维持该水平到36 h调查结束[25-26],该研究中烟草凝集素的RNA随时间变化趋势与本研究结果类似。
4 结论广东晾晒烟品种大叶密合具有良好的青枯病抗性。蛋白质组学分析显示,青枯病菌接种后大叶密合21个蛋白表达量下调,14个蛋白表达量上调。其中烟草凝集素蛋白Hav1上调表达量最大,烟草凝集素的转录在接菌后6 h和9 h达到最高值。鉴定到的差异蛋白中,上调幅度最大的是凝集素家族成员之一的Hav1,接种强致病力和无致病力菌株后烟草凝集素呈现类似的表达模式,表明凝集素蛋白可能在对病菌入侵后的上游反应过程中发挥作用。
| [1] |
LOWE-POWER T M, KHOKHANI D, ALLEN C. How Ralstonia solanacearum exploits and thrives in the flowing plant xylem environment[J]. Trends Microbiol, 2018, 26(11): 929-942. DOI:10.1016/j.tim.2018.06.002 |
| [2] |
DALSING B L, TRUCHON A N, GONZALEZ-ORTA E T, MILLING A S, ALLEN C. Ralstonia solanacearum uses inorganic nitrogen metabolism for virulence, ATP production, and detoxification in the oxygen-limited host xylem environment[J]. MBio, 2015, 6(2): e02471. DOI:10.1128/mBio.02471-14 |
| [3] |
GENIN S. Molecular traits controlling host range and adaptation to plants in Ralstonia solanacearum[J]. New Phytol, 2010, 187(4): 920-928. DOI:10.1111/j.1469-8137.2010.03397.x |
| [4] |
FOSTER MANSFIELD J, GENIN S, MAGORI S, CITOVSKY V, SRIARIYANUM M, RONALD P, DOW M, VERDIER V, MARCOS A, TOTH I, SALMOND G, GARY D. Top 10 plant pathogenic bacteria in molecular plant pathology[J]. Mol Plant Pathol, 2012, 13(6): 614-629. DOI:10.1111/j.1364-3703.2012.00804.x |
| [5] |
刘开, 余炳伟, 李丹丹, 陈娜, 曹必好. 茄子SmWRKY65基因克隆及其对青枯病的抗性分析[J]. 广东农业科学, 2021, 48(3): 42-52. DOI:10.16768/j.issn.1004-874X.2021.03.006 LIU K, YU B W, LI D D, CHEN N, CAO B H. Cloning of SmWRKY65 gene and its resistance to bacterial wilt in eggplant[J]. Guangdong Agricultural Sciences, 2021, 48(3): 42-52. DOI:10.16768/j.issn.1004-874X.2021.03.006 |
| [6] |
HACQUARD S, SPAEPEN S, GARRIDO-OTER R, SCHULZE-LEFERT P. Interplay between innate immunity and the plant microbiota[J]. Annu Rev Phytopathol, 2017, 2016, 55(1): 565-589. DOI:10.1146/annurev-phyto-080516-035623 |
| [7] |
CHEN N, YU B, DONG R, LEI J, CHENG C, CAO B. RNA-Seq-derived identification of differential transcription in the eggplant (Solanum melongena)following inoculation with bacterial wilt[J]. Gene, 2018, 644: 137-147. DOI:10.1016/j.gene.2017.11.003 |
| [8] |
PRASATH D, KARTHIKA R, HABEEBA N T. Comparison of the transcriptomes of ginger(Zingiber officinale Rosc.)and mango ginger (Curcuma amada Roxb.)in response to the bacterial wilt infection[J]. PLOS ONE, 2014, 9(6): e9973. DOI:10.1371/journal.pone.0099731 |
| [9] |
PARK S, GUPTA R, KRISHNA R. Proteome analysis of disease resistance against Ralstonia solanacearum in potato cultivar CT206-10[J]. Plant Pathol J, 2016, 32(1): 25-32. DOI:10.5423/PPJ.OA.05.2015.0076 |
| [10] |
AFROZ A, KHAN M R, AHSAN N. Comparative proteomic analysis of bacterial wilt susceptible and resistant tomato cultivars[J]. Peptides, 2009, 30(9): 1600-1607. DOI:10.1016/j.peptides.2009.06.005 |
| [11] |
马柱文, 陈俊标, 袁清华, 黄振瑞. 广东烟草种质资源创新与利用研究进展[J]. 广东农业科学, 2021, 48(1): 1-8. DOI:10.16768/j.issn.1004-874X.2021.01.001 MA Z W, CHEN J B, YUAN Q H, HUANG Z R. Research progress in innovation and utilization of Guangdong tobacco germplasm resources[J]. Guangdong Agricultural Sciences, 2021, 48(1): 1-8. DOI:10.16768/j.issn.1004-874X.2021.01.001 |
| [12] |
张振臣, 吕永华, 马柱文, 谢锐鸿, 李集勤, 袁清华, 李淑玲, 吕锦津, 陈俊标. 烟草品种GDSY-1的青枯病抗性与遗传分析[J]. 中国烟草科学, 2017, 38(4): 9-16. DOI:10.13496/j.issn.1007-5119.2017.04.002 ZHANG Z C, LYU Y H, MA Z W, XIE R H, LI J Q, YUAN Q H, LI S L, LYU J J, CHEN J B. Inheritance of resistance to bacterial wilt in chinese domestic tobacco cultivar GDSY-1[J]. Chinese Tobacco Science, 2017, 38(4): 9-16. DOI:10.13496/j.issn.1007-5119.2017.04.002 |
| [13] |
张振臣, 邓海滨, 刘琼光, 马柱文, 袁清华, 谢锐鸿, 李集勤, 陈俊标. 广东抗青枯病烟草资源筛选[J]. 广东农业科学, 2014, 41(7): 27-29. DOI:10.3969/j.issn.1004-874X.2014.07.008 ZHANG Z C, DENG H B, LIU Q G, MA Z W, YUAN Q H, XIE R H, LI J Q, CHEN J B. Screening of tobacco germplasm resistant to bacterial wilt in Guangdong[J]. Guangdong Agricultural Sciences, 2014, 41(7): 27-29. DOI:10.3969/j.issn.1004-874X.2014.07.008 |
| [14] |
袁清华, 马柱文, 张振臣, 李集勤, 李淑玲, 郭培国, 邱妙文, 李荣华, 赵伟才, 陈俊标. 烟草品种大叶密合抗青枯病相关QTL的检测[J]. 中国烟草学报, 2018, 24(3): 77-81. DOI:10.16472/j.chinatobacco.2016.106 YUAN Q H, MA Z W, ZHANG Z C, LI J Q, LI S L, GUO P G, QIU M W, LI Y H, ZHAO W C, CHEN J B. Detection of QTL associated with tobacco bacterial wilt resistance in local variety Dayemihe[J]. Acta Tabacaria Sinica, 2018, 24(3): 77-81. DOI:10.16472/j.chinatobacco.2016.106 |
| [15] |
谢锐鸿, 巫升鑫, 罗正友, 马柱文, 李集勤, 张振臣, 罗静, 张维祥, 陈远平. 粤、闽、贵烟草青枯病菌分离株及其致病力[J]. 微生物学通报, 2014, 41(9): 1800-1806. DOI:10.13344/j.microbiol.j.microbiol.china.130652 XIE R H, WU S X, LUO Z Y, MA Z W, LI J Q, ZHANG Z C, LUO J, ZHANG W X, CHEN Y P. Pathogenicity of Ralstonia solanacearum isolated from tobacco in Guangdong, Fujian and Guizhou Province[J]. Microbiology China, 2014, 41(9): 1800-1806. DOI:10.13344/j.microbiol.j.microbiol.china.130652 |
| [16] |
GRANT M R, JONES J D. Hormone(dis)harmony moulds plant health and disease[J]. Science, 2009, 324(5928): 750-752. DOI:10.1126/science.1173771 |
| [17] |
CHENG D D, ZH ANG Z S, SUN X B. Photoinhibition and photoinhibition-like damage to the photosynthetic apparatus in tobacco leaves induced by Pseudomonas syringae pv. Tabaci under light and dark conditions[J]. Bmc Plant Biology, 2016, 16(1): 1-11. DOI:10.1371/journal.pone.0089067 |
| [18] |
沈喜, 李红玉, 贾秋珍, 冯汉青, 李敏权, 粱厚果. 条锈病对小麦(Triticum aestivum L.)叶片光合功能及光合功能蛋白D1表达的影响[J]. 生态学报, 2008, 28(2): 669-676. DOI:10.3321/j.issn:1000-0933.2008.02.027 SHEN X, LI H Y, JIA Q Z, FENG H Q, LI M Q, LIANG H G. Influence of wheat(Triticum aestivum L.)strip rust infection on photosynthetic function and expression protein D1 of wheat leaves[J]. Acta Ecologica Sinica, 2008, 28(2): 669-676. DOI:10.3321/j.issn:1000-0933.2008.02.027 |
| [19] |
DOUBNEROVA HYSKOVA V, MIEDZINSKA L, DOBRA J. Phosphoenolpyruvate carboxylase, NADP-malic enzyme, and pyruvate, phosphate dikinase are involved in the acclimation of Nicotiana tabacum L. to drought stress[J]. J Plant Physiol, 2014, 171(5): 19-25. DOI:10.1016/j.jplph.2013.10.017 |
| [20] |
OGAWA S, KAWAHARA-MIKI R, MIYAMOTO K, YAMANE H, NOJIRI H, TSUJⅡ Y OKADA K. OsMYC2 mediates numerous defence-related transcriptional changes via jasmonic acid signalling in rice[J]. Biochem Biophys Res Commun,, 2017, 486(3): 796-803. DOI:10.1016/j.bbrc.2017.03.125 |
| [21] |
REHRIG E M, APPEL H M, JONES A D, JACK C. Roles for jasmonate- and ethylene-induced transcription factors in the ability of Arabidopsis to respond differentially to damage caused by two insect herbivores[J]. Front Plant Sci, 2014(5): 407-411. DOI:10.3389/fpls.2014.00407 |
| [22] |
PEUMANS W J, VAN DAMME E J. Lectins as plant defense proteins[J]. Plant Physiol, 1995, 109(2): 347-352. DOI:10.1104/pp.109.2.347 |
| [23] |
ESCH L, SCHAFFRATH U. An update on jacalin-like lectins and their role in plant defense[J]. International Journal of Molecular Sciences, 2017, 18: 1962-1973. |
| [24] |
GASMI L, JAKUBOWSKA A K, FERRE J. Characterization of two groups of Spodoptera exigua Hübner(Lepidoptera: Noctuidae) C-type lectins and insights into their role in defense against the densovirus JcDV[J]. Archives of Insect Biochemistry and Physiology, 2018, e21432. DOI:10.1002/arch.21432 |
| [25] |
VANDENBORRE G, DAMME E J M V, SMAGGHE G. Natural products: plant lectins as important tools in controlling pest insects[J]. Springer Verlag, 2009, 24(7): 163-187. DOI:10.1007/978-90-481-2316-27 |
| [26] |
VANDENBORRE G, MIERSCH O, HAUSE B. Spodoptera littoralis-induced lectin expression in tobacco[J]. Plant Cell Physiol, 2009, 50(6): 1142-1155. DOI:10.1093/pcp/pcp065 |
(责任编辑 张辉玲)
 2021, Vol. 48
2021, Vol. 48