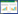文章信息
基金项目
- 广东省农业科学院作物研究所所长基金(202002);广东省烟草专卖局(公司)科技项目(粤烟科项201910)
作者简介
-
邵秀红(1983—),女,博士,助理研究员,研究方向为烟草功能成分与综合利用,E-mail:xhshao2007@126.com; 黄振瑞,博士,研究员,现任广东省农业科学院作物研究所副所长。中国科学技术协会“九大”代表,广东烟草商业系统科学技术委员会委员,广东甘蔗学会副理事长,广东省烟草学会理事,广东省国际生命科学基金会副秘书长,中国作物学会甘蔗专业委员会副秘书长,仲恺农业工程学院硕士研究生导师,广东海洋大学硕士研究生导师,福建农林大学客座教授
主要从事作物养分资源管理、绿色生产技术、农业资源利用研究。先后主持和参与完成国家和省部级项目26项,主持委托开发项目12项,鉴定和登记科技成果7项,发表文章90多篇(第一作者和通信作者23篇),通过审定作物品种2个,授权专利9项,主编专著2部,获广东省科学技术奖三等奖2项(排名第1、2)、中国轻工业联合会科技进步二等奖3项(排名第1、3、7)、全国农牧渔业丰收奖二等奖1项(排名第3)、中华农业科技奖1项(排名第4)、广东省农业技术推广奖二等奖5项(排名第1、3、4、7、9)、三等奖1项(排名第7)。2013、2015年连续两届被授予“广东省科协省级学会优秀秘书长”称号,2018年被评为广东省科学院首届优秀青年科技工作者,2018年荣获第六届广东省科学技术协会荣誉奖,2021年荣获广东省农业科学院2018、2019、2020年度“优秀党务工作者”称号.
通讯作者
- 黄振瑞(1980—),男,博士,研究员,研究方向为烟草功能成分与综合利用,E-mail:fjsi@163.com.
文章历史
- 收稿日期:2021-10-30
【研究意义】烟草(Nicotiana tabacum L.)是世界上重要的经济作物,作为卷烟工业原料的同时,其药用价值备受关注。烟草中含有绿原酸、芦丁(亦称芸香苷)、茄尼醇等多种活性成分,其中绿原酸具有抗肺炎链球菌、金葡球菌和痢疾志贺氏菌等细菌,抗艾滋病、甲型流感、乙型肝炎等病毒,抗肝癌、肺癌、乳腺癌和胶质瘤等肿瘤,治疗血脂异常、糖尿病、高血压等代谢性疾病等多种药理作用[1-2];芦丁可以有效清除自由基、抗脂质过氧化、抗病毒、拮抗血小板活化因子、抗急性胰腺炎等;茄尼醇是合成辅酶Q10和维生素K2的主要中间体,还可以作为抗溃疡药物、抗癌药物的合成原料[3-4]。广东省农业科学院作物研究所于20世纪50年代开始烟草种质资源的收集工作,目前保存各类烟草资源约1 300份,其中包括广东地方特有资源300多份,这些烟草资源在本地保存后绿原酸、芦丁、茄尼醇等重要活性成分的含量变化尚不清晰。因此,明确各活性成分的含量差异,对于开发利用这些烟草资源具有重要的现实意义。【前人研究进展】绿原酸和芦丁都是多酚类化合物,在烟草中的含量较高,占烟草中植物多酚含量的80% 以上[5]。植物中广泛存在的绿原酸类物质有6种异构体,即绿原酸、隐绿原酸、新绿原酸、异绿原酸A、异绿原酸B和异绿原酸C,这些异构体都具有一定的生物活性[6]。史春云等[7]测定了不同产地上部烟叶中8种多酚物质的含量,结果表明烟叶中含量较高的是绿原酸和芸香苷,且不同产地的多酚含量差异较大,其中以河南襄县的绿原酸含量最高。李力等[8]分析了不同来源的18个烤烟样品中6种多酚的含量,发现从高到低依次为绿原酸、芸香苷、隐绿原酸、新绿原酸、莰菲醇基-3- 芸香糖苷、莨菪亭。万诚等[9]的研究结果显示,在烟草整个生育期,烟叶中绿原酸呈4种变化趋势,分别为上升、上升-下降-上升、“M”和“W”型变化趋势;其中在烟叶成熟采收时,烤烟类与香料烟类品种的绿原酸含量最高、为2.3%,其次是晾晒烟,白肋烟最低、为1.4%。这些研究表明,在不同产地、不同类型、不同生育期的烟草中,绿原酸、芦丁等的含量有较大差异。茄尼醇是一种萜烯类化合物,在烟叶、马铃薯叶和桑叶中含量突出,尤其在烟叶中茄尼醇含量可高达0.3%~3%[10]。Kotipalli等[11]对茄科植物中提取的茄尼醇进行测定,证实了烟草是茄尼醇最丰富的来源(0.85%~3.75%)。刘宇欣等[12]的研究表明,白肋烟及烤烟中茄尼醇含量较高,香料烟其次,而雪茄烟含量最低。同一类型烟草品种在不同的取样时期,茄尼醇的含量均以叶中最高,其次是茎,根中最低[13],且烟草不同叶位茄尼醇含量的顺序为上部叶>中部叶>下部叶[14-15]。不同生长期的云烟85和漂河1号烟叶中茄尼醇含量随着烟株苗龄的增加而逐渐上升,现蕾时叶中的茄尼醇含量达到最大值,此后逐渐下降,并趋于平缓[16]。也有一些关于不同产区烟草茄尼醇含量变化的报道[12, 15, 17-18]。以上研究表明,茄尼醇在烟草中的含量最高,不同类型、不同组织、不同叶位、不同生育期以及不同产区的烟草中,茄尼醇的含量也有较大差异。【本研究切入点】广东省农业科学院作物研究所目前保存烟草种质资源约1 300份,是我国烟草资源的主要保存单位[19],由于烟草资源主要以种子形态在特定环境中进行保存,一定时间后种子发芽率逐渐下降,因此需要按计划分年度进行繁种更新,以保证烟草种质的长期保存[20]。繁种用烟草种质资源中各活性成分含量亟需明确,而前人的研究多是检测打顶后烟草各成分的含量[21-23],不打顶条件下含量变化尚未见相关报道。【拟解决的关键问题】利用HPLC方法检测繁种用烟草种质资源中绿原酸、芦丁、茄尼醇等重要活性成分的含量,以期为所保存烟草种质资源的有效开发利用提供参考。
1 材料与方法 1.1 试验材料试验在广东省农业科学院白云基地进行,试验地肥力中等,前作为水稻。供试17份烟草种质资源材料包括K326、云烟87、翠碧一号、广烟125、广烟127、NC82、NC347、CV099、SR1307、黄坑7号-1、黄坑片坑3号等11份烤烟和S20大牛舌、S19大肩叶、S18大幅烟、S21大秋根-2、S17大都青梗、S16打宾柳叶烟等6份晒烟,于2020年7月10日播种育苗,9月1日移栽,采用大田常规栽培管理,烟株现蕾后不打顶,在叶片成熟期采收上二棚叶片,每份资源采收3株,每株采1~2片叶,105 ℃杀青30 min,然后去掉各叶片的主脉,再于55 ℃烘箱中烘干备用。
仪器:高效液相色谱仪(Agilent 1260,美国),超声波清洗器(KQ-250DE,江苏昆山),电子天平(Mettler Toledo EL204,德国),高速冷冻离心机(Thermo Scientific SL16R,美国),超纯水器(Millipore Direct-Q,美国),多功能粉碎机(FW100,天津)。
试剂:甲醇、乙醇、乙腈、甲酸和磷酸二氢钠均为Sigma Aldrich品牌,HPLC级别。绿原酸(Chlorogenic acid)、新绿原酸(Neochlorogenic acid)、隐绿原酸(Cryptochlorogenic acid)、异绿原酸A(Isochlorogenic acid A)、异绿原酸B(Isochlorogenic acid B)、异绿原酸C(Isochlorogenic acid C)、芦丁(Rutin)和茄尼醇(Solanesol)等分析标准品,纯度均≥ 98 %,购自上海源叶生物科技有限公司。
1.2 试验方法1.2.1 溶液配制 分别精确称取绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C标准品各10 mg,分别定容于200 mL容量瓶中,配制成50 μg/mL的母液,然后等梯度分别稀释成50、25、12.5、6.25、3.125、1.56、0.78、0.39 μg/mL标准品溶液,测定分析曲线。
准确称量芦丁和茄尼醇标准品各10 mg,分别定容于10 mL容量瓶中,配制成1 mg/mL的母液,然后等梯度分别稀释成1、0.5、0.25、0.125、0.0625和0.03125 mg/mL的标准品溶液,测定分析曲线。
1.2.2 样品制备 将烘干的烟叶用多功能粉碎机进行粉碎,过孔径0.425 mm筛备用。称取0.1 g左右的烟末样品于2 mL离心管,加入1.0 mL提取液,在30 ℃、超声提取20 min,重复3次;浸提液以10 000 r/min离心10 min,将上清液用0.22 μm微孔滤膜过滤,然后将稀释后的样品进行HPLC分析。6种绿原酸异构体的提取液为50% 的甲醇,芦丁和茄尼醇的提取液为纯甲醇。
1.2.3 HPLC分析 色谱条件:色谱柱为VPODS(Shim-pack,5 μm,4.6 mm×250 mm),柱温为35 ℃,紫外检测器为Agilent 1260 VWD。
(1)6种绿原酸异构体的测定。流动相A(0.1% 甲酸):B(乙腈),流速1.0 mL/min,进样量5 μL,检测波长327 nm。梯度洗脱程序见表 1。
(2)芦丁的测定。流动相A(0.1% 磷酸二氢钠):B(乙腈)= 68 : 32,流速1.0 mL/min,进样量5 μL,检测波长275 nm。
(3)茄尼醇的测定。流动相A(乙醇):B(甲醇)= 72 : 28,流速1.0 mL/min,进样量5 μL,检测波长215 nm。
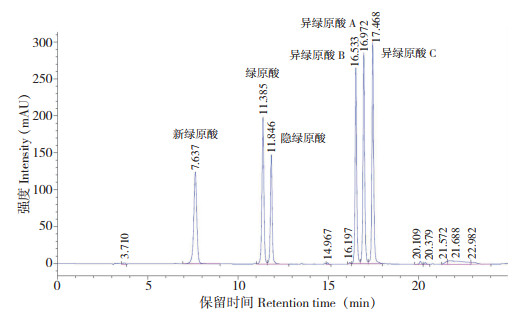
2 结果与分析 2.1 色谱条件确定为了准确区分6种绿原酸异构体,利用HPLC法进行检测,并参照董珊等[24]的方法,以0.1% 甲酸和乙腈为流动相,进行梯度洗脱,利用1260 VWD检测器,检测波长选择327 nm,6种化合物可得到良好的分离(图 1)。芦丁的检测以0.1% 磷酸二氢钠和乙腈为流动相,检测波长选择275 nm。茄尼醇检测的流动相是乙醇和甲醇,检测波长为215 nm。柱温选择35 ℃,该温度下8种化合物的分离效果良好。
|
| 图 1 6种绿原酸异构体标准品的HPLC色谱图 Fig. 1 HPLC chromatogram of six chlorogenic acid isomer standards |
2.2 线性关系分析
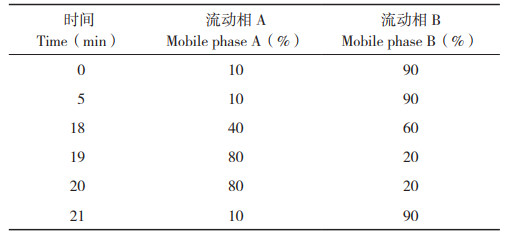
以峰面积为纵坐标、质量浓度为横坐标进行线性回归,得回归方程,结果(表 2)显示,6种绿原酸异构体在12.5~0.40 μg/mL范围内线性关系良好,检出限为1.1~1.5 mg/kg,定量限为3.7~5.0 mg/kg;芦丁、茄尼醇分别在1.0~0.03125、0.5~0.03125 mg/mL范围内线性关系良好。图 1~ 图 3分别为6种绿原酸异构体、芦丁和茄尼醇标准品的HPLC色谱图,其中6种绿原酸异构体的保留时间为7.637~17.468 min,芦丁、茄尼醇的保留时间分别为7.289和7.370 min。
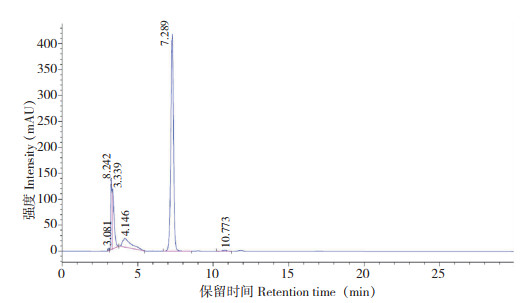
|
| 图 2 芦丁标准品的HPLC色谱图 Fig. 2 HPLC chromatogram of rutin standard |
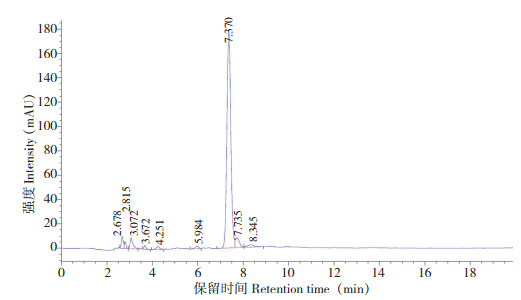
|
| 图 3 茄尼醇标准品的HPLC色谱图 Fig. 3 HPLC chromatogram of solanesol standard |
2.3 6种绿原酸异构体含量分析
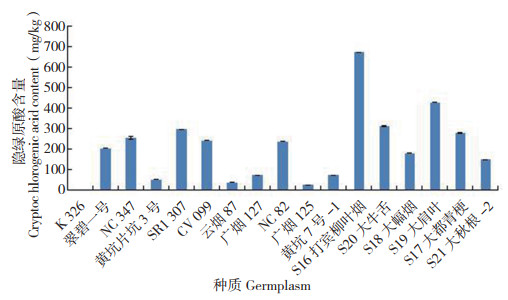
从图 4可以看出,6种绿原酸异构体中,新绿原酸以S16打宾柳叶烟的含量最高(215.91 mg/ kg),其次是NC347、NC82(分别为189.96、162.18 mg/kg),而K326最低(未检测到);含量高于100 mg/kg的种质有8份,其中烤烟和晒烟种质各4份,分别占所测种质的36.4% 和66.7%。绿原酸的含量如图 5所示,以S16打宾柳叶烟最高(4 813.41 mg/kg),其次是S20大牛舌、S19大肩叶(分别为2 475.67、2 081.68 mg/ kg),而K326最低(47.43 mg/kg);含量高于1 000 mg/kg的种质有9份,其中烤烟5份,晒烟4份,分别占所测种质的45.5% 和66.7%。隐绿原酸的含量如图 6所示,也是以S16打宾柳叶烟最高(670.13 mg/kg),其次是S19大肩叶、S20大牛舌(分别为425.63、311.53 mg/kg),而K326最低(未检测到);含量高于200 mg/kg的种质有9份,其中烤烟5份,晒烟4份,分别占所测种质的45.5% 和66.7%。以上结果表明,新绿原酸、绿原酸和隐绿原酸含量较高的晒烟类烟草种质数占比均较高,烤烟类不同烟草种质中这3种活性成分的含量差异较大。
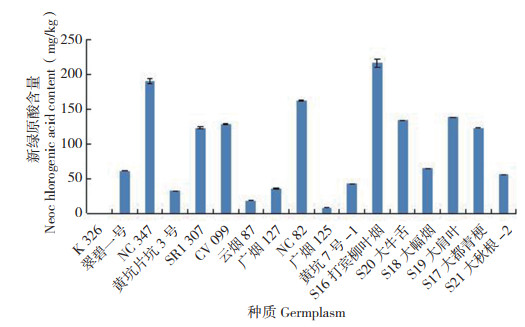
|
| 图 4 17份烟草种质的新绿原酸含量 Fig. 4 Content of neochlorogenic acid in 17 tobacco germplasms |
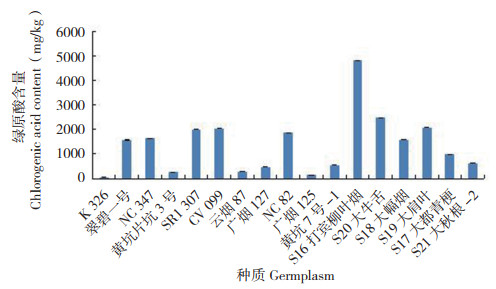
|
| 图 5 17份烟草种质的绿原酸含量 Fig. 5 Content of chlorogenic acid in 17 tobacco germplasms |
|
| 图 6 17份烟草种质的隐绿原酸含量 Fig. 6 Content of cryptochlorogenic acid in 17 tobacco germplasms |
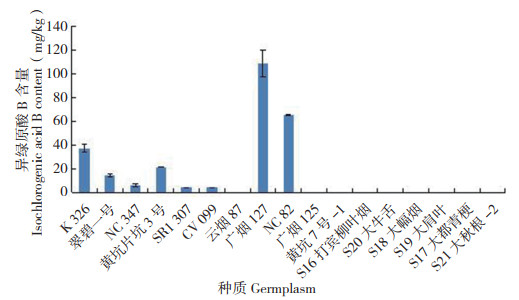
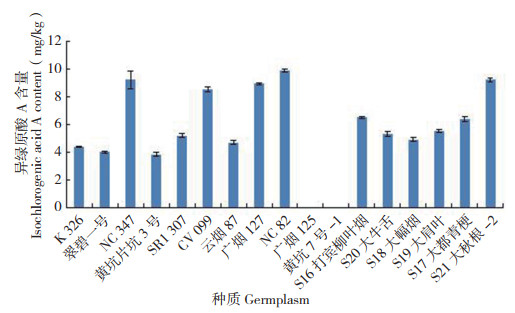
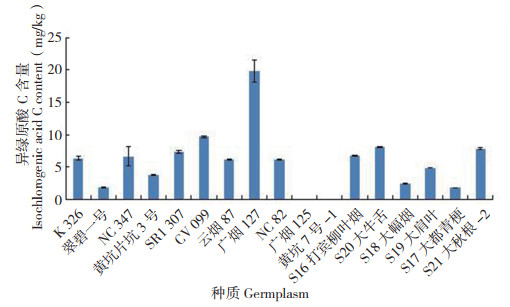
异绿原酸B的含量如图 7所示,在8份烟草种质中检测到,均为烤烟,占所测种质的72.7%,以广烟127的含量最高(108.68 mg/kg),其次是NC82、K326,均低于100 mg/kg,另外9份种质中未检测到,其中包括3份烤烟和6份晒烟;异绿原酸A的含量如图 8所示,17份烟草种质的含量均低于10 mg/kg,其中以NC82最高(9.89 mg/ kg),其次是NC347、S21大秋根-2,除广烟125和黄坑7号-1烤烟种质中未检测到外,全部晒烟以及9份烤烟种质中均有检测到;异绿原酸C的含量如图 9所示,17份烟草种质的含量均低于20 mg/ kg,以广烟127含量最高(19.80 mg/kg),其次是CV099、S20大牛舌,全部晒烟以及9份烤烟种质中均有检测到,与异绿原酸A相似,只有广烟125和黄坑7号-1烤烟种质中未检测到。以上结果表明,异绿原酸B在所选6份晒烟烟草种质中均未检测到,广烟125和黄坑7号-1烤烟中均未检测到异绿原酸B、异绿原酸A和异绿原酸C,17份烟草种质中这3种活性成分的含量与前3种相比,大多较低。
|
| 图 7 17份烟草种质的异绿原酸B含量 Fig. 7 Content of isochlorogenic acid B in 17 tobacco germplasms |
|
| 图 8 17份烟草种质的异绿原酸A含量 Fig. 8 Content of isochlorogenic acid A in 17 tobacco germplasms |
|
| 图 9 17份烟草种质的异绿原酸C含量 Fig. 9 Content of isochlorogenic acid C in 17 tobacco germplasms |
综上可以看出,绿原酸是6种异构体中含量最高的,在17份烟草种质中均有检测到,其次是隐绿原酸和新绿原酸,而异绿原酸A、异绿原酸B和异绿原酸C的含量总体偏低,其中异绿原酸A和异绿原酸C在15份种质中均有检测到,异绿原酸B在多数烤烟种质中检测到,但在全部晒烟中均未检测到。
2.4 芦丁含量分析如图 10所示,芦丁以NC347烤烟的含量最高(46.456 g/kg),其次是S19大肩叶(7.782 g/ kg)和S17大都青梗晒烟(6.250 g/kg),而云烟87烤烟最低(1.206 g/kg);含量高于3 g/kg的烤烟和晒烟种质分别有3份和6份,分别占27.3% 和100%。可见,不同烤烟种质中芦丁的含量差异较大,含量范围为1.206~46.456 g/kg,而不同晒烟种质中芦丁的含量差异比烤烟稍小,为3.269~7.782 g/kg。
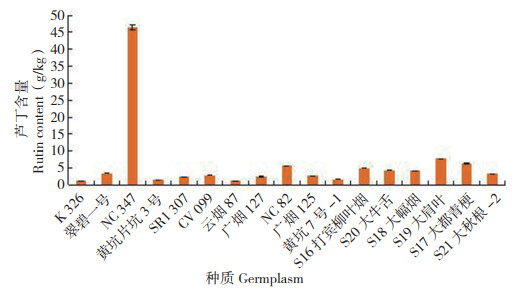
|
| 图 10 17份烟草种质的芦丁含量 Fig. 10 Content of rutin in 17 tobacco germplasms |
2.5 茄尼醇含量分析
如图 11所示,茄尼醇以NC347烤烟中的含量最高(44.913 g/kg),其次是K326烤烟(11.140 g/kg)、S17大都青梗晒烟(9.844 g/kg),而黄坑7号-1烤烟中最低(2.793 g/kg)。含量高于3 g/kg的烤烟和晒烟种质分别有9份和5份,分别占所测资源的81.8% 和83.3%。可见,不同烤烟种质中茄尼醇的含量差异较大,含量范围为2.793~44.913 g/kg,而不同晒烟资源中茄尼醇的含量差异也相对较小,为2.857~9.844 g/kg。
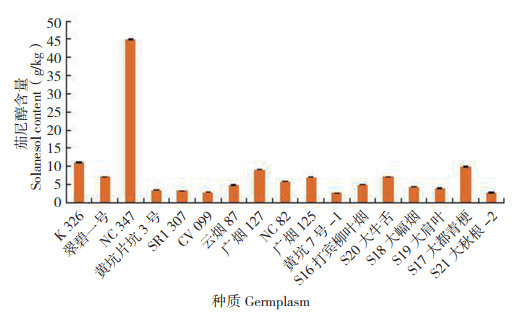
|
| 图 11 17份烟草种质的茄尼醇含量 Fig. 11 Content of solanesol in 17 tobacco germplasms |
3 讨论 3.1 绿原酸、芦丁的含量差异
绿原酸是由咖啡酸和奎宁酸生成的缩酚酸,在6种绿原酸异构体中,绿原酸、新绿原酸和隐绿原酸均为单咖啡酰奎宁酸,异绿原酸A、异绿原酸B和异绿原酸C均为二咖啡酰奎宁酸。Meinhart等[25]分析了巴西100种商业化种植植物中6种绿原酸异构体的含量,其中绿原酸、新绿原酸和隐绿原酸分别在66、63、52种植物中检测出,而异绿原酸A、异绿原酸B和异绿原酸C分别在55、48、48种植物中检测出。该研究表明,绿原酸、新绿原酸和隐绿原酸在多数植物中都能检测到,但也有多种植物检测不到异绿原酸B和异绿原酸C,与本研究结果相似。在咖啡中,3种单咖啡酰奎宁酸的浓度相对较高[26],单咖啡酰奎宁酸约占生咖啡豆质量的10%[27],其中以绿原酸的含量最为丰富[6]。咖啡和金银花是绿原酸异构体含量均较高的两种植物。董珊等[24]的研究表明,咖啡和金银花中6种绿原酸异构体的含量均相对较高,其中金银花以绿原酸含量最高、为1.94×104 mg/kg,其次是异绿原酸A和异绿原酸C,分别为6.42×103、2.00×103 mg/kg;咖啡中绿原酸和隐绿原酸含量接近,分别为8.34×103和8.48×103 mg/kg,其次是新绿原酸、为4.99×103 mg/kg。马跃新等[28]发现滇金银花中绿原酸含量为24.79~34.01 mg/g。在烟草中,绿原酸含量与烟草的香气密切相关,因而与烟草及其制品的等级呈正相关,绿原酸含量高的烟叶及卷烟质量越好;绿原酸还对烟草的生长发育、烟叶颜色以及烟株抗病虫害、抗寒及其他逆境等方面有着重要影响[9, 29]。欧阳璐斯等[30]研究发现,烟草中14种多酚类化合物的含量差异较大,以绿原酸的含量最高、为3 828.3~9 251.6 mg/kg,新绿原酸、隐绿原酸含量分别为794.8~1 628.9、1 215.7~2 505.2 mg/kg。本研究结果表明,绿原酸在其6种异构体中含量最高,这与史春云等[7]、李力等[8]、Magaña等[6]、欧阳璐斯等[30]的研究结果一致;其次是隐绿原酸和新绿原酸,与李力等[8]的研究结果一致。本研究中,17份烟草种质中K326烤烟的绿原酸含量最低,这与万诚等[9]的研究结果即烤烟类型品种K326的绿原酸含量最高(28.544 mg/g)相差较大,这种差异可能主要与各烟草种质在现蕾后未打顶有关,烟草在现蕾后转入生殖生长,消耗较多的营养,造成烟叶品质下降,而绿原酸含量与改善烟叶等级密切相关[31]。
芦丁和绿原酸同属于多酚类化合物,前人的研究中通常同时检测两种化合物。史春云等[7]、李力等[8]和欧阳璐斯等[30]的研究结果显示,烟草多酚类物质中,芦丁的含量仅次于绿原酸,含量范围分别为5.73~14.88、2.61~7.87、2 825.9~ 6 412.6 mg/kg。本研究中,NC347烤烟中芦丁的含量最高,比史春云等[7]报道的最高含量高约32 g/kg,其他16份烟草种质的含量范围与欧阳璐斯等[30]和李力等[8]的结果趋于一致。然而,本研究中芦丁与绿原酸的含量相比整体偏高,这与前人研究报道有较大差异。也有其他作物中芦丁含量比较高的报道,如Vollmannová等[32]研究了不同荞麦品种叶片中芦丁、牡荆素、槲皮素、山奈酚等化合物的含量,其中芦丁的含量最高,为17.742~31.069 mg/g,含量最高的荞麦品种Kasho-2与NC347烤烟较接近。
3.2 茄尼醇的含量差异茄尼醇是烟草石油醚、环己烷提取物的主要组成成分。烟草石油醚、环己烷提取物被认为是烟草香气成分的重要来源,也是烟气有害成分的贡献者,是烟叶质量评价的主要指标[15]。根据前人的研究报道,烟草中茄尼醇的含量为0.3%~4.13%[10-11, 18]。本研究中,NC347烤烟中茄尼醇的含量最高,质量分数为4.49%,比前人报道的4.13% 高0.36%,该种质在资源鉴评方面值得深入研究;其他16份烟草种质的质量分数为0.28%~1.11%,与前人的结果基本一致。本研究11份烤烟和6份晒烟种质中,茄尼醇含量高于5 g/kg的分别有6份和3份,说明所测烤烟类种质的茄尼醇含量较高,与刘宇欣等[12]的结果类似,而且与所测种质绿原酸的含量相比也整体偏高。
4 结论本研究17份繁种用烟草种质资源中,芦丁和茄尼醇的含量与绿原酸相比总体较高,且均以NC347烤烟的含量最高,质量分数分别为4.65% 和4.49%,该种质值得进一步研究,可以作为芦丁和茄尼醇开发利用的候选种质。绿原酸在其6种异构体中含量最高,且以S16打宾柳叶烟晒烟最高、为0.48 %,但17份烟草种质的绿原酸含量与前人报道的结果相差较大,由于这些种质在现蕾后未打顶,可能对绿原酸有较大的影响,下一步需要明确打顶与不打顶条件下各种质中绿原酸的差异。
| [1] |
王庆华, 杜婷婷, 张智慧, 季鸣, 胡海宇, 陈晓光. 绿原酸的药理作用及机制研究进展[J]. 药学学报, 2020, 55(10): 2273-2280. DOI:10.16438/j.0513-4870.2020-0423 WANG Q H, DU T T, ZHANG Z H, JI M, HU H Y, CHEN X G. Advances in research on the pharmacological effects and mechanism of action of chlorogenic acid[J]. Acta Pharmaceutica Sinica, 2020, 55(10): 2273-2280. DOI:10.16438/j.0513-4870.2020-0423 |
| [2] |
HODAEI M, RAHIMMALEK M, BEHBAHANI M. Anticancer drug discovery from Iranian Chrysanthemum cultivars through system pharmacology exploration and experimental validation[J]. Scientific Reports, 2021, 11: 11767. DOI:10.1038/s41598-021-91010-y |
| [3] |
HUANG W, LI Z S, NIU H, WANG J W, QIN Y. Bioactivity of solanesol extracted from tobacco leaves with carbon dioxide-ethanol fluids[J]. Biochemical Engineering Journal, 2008, 42(1): 92-96. DOI:10.1016/j.bej.2008.06.002 |
| [4] |
舒俊生, 陈开波, 徐志强, 毛健. 反相高效液相色谱法测定烟草中的茄尼醇[J]. 现代食品科技, 2013, 29(4): 894-897. DOI:10.13982/j.mfst.1673-9078.2013.04.018 SHU J S, CHEN K B, XU Z Q, MAO J. Determination of solanesol in tobacco by RP-HPLC[J]. Modern Food Science and Technology, 2013, 29(4): 894-897. DOI:10.13982/j.mfst.1673-9078.2013.04.018 |
| [5] |
逄涛, 林茜, 李勇, 师君丽, 邓建华, 卢秀萍. 云南烟区烤烟多酚含量特点分析[J]. 西南农业学报, 2017, 30(1): 72-77. DOI:10.16213/j.cnki.scjas.2017.1.014 PANG T, LIN Q, LI Y, SHI J L, DENG J H, LU X P. Characteristics analysis of Yunnan flue-cured tobacco leaf on polyphenol content[J]. Southwest China Journal of Agricultural Sciences, 2017, 30(1): 72-77. DOI:10.16213/j.cnki.scjas.2017.1.014 |
| [6] |
MAGAÑA A A, KAMIMURA N, SOUMYANATH A, STEVENS J F, MAIER C S. Caffeoylquinic acids: chemistry, biosynthesis, occurrence, analytical challenges, and bioactivity[J]. The Plant Journal, 2021, 107(5): 1299-1219. DOI:10.1111/tpj.15390 |
| [7] |
史春云, 袁凯龙, 肖卫强, 卢昕博, 戴路. 超高效液相色谱法快速检测烟叶中8种多酚类化合物[J]. 西南农业学报, 2015, 28(3): 1322-1327. DOI:10.16213/j.cnki.scjas.2015.03.075 SHI C Y, YUAN K L, XIAO W Q, LU X B, DAI L. Fast determination of eight kinds of polyphenols in tobacco leaf with UPLC[J]. Southwest China Journal of Agricultural Sciences, 2015, 28(3): 1322-1327. DOI:10.16213/j.cnki.scjas.2015.03.075 |
| [8] |
李力, 李东亮, 邓发达, 罗诚, 沈怡, 薛芳. UPLC法同时测定烤烟中6种多酚的研究[J]. 中国农学通报, 2018, 34(10): 131-137. LI L, LI D L, DENG F D, LUO C, SHEN Y, XUE F. Analysis of 6 polyphenols in flue-cured tobacco by UPLC[J]. Chinese Agricultural Science Bulletin, 2018, 34(10): 131-137. |
| [9] |
万诚, 刘仁祥, 聂琼, 龙丽, 徐如宏. 不同烟草品种绿原酸含量变化研究[J]. 山地农业生物学报, 2016, 32(2): 25-28. DOI:10.15958/j.cnki.sdnyswxb.2016.02.005 WAN C, LIU R X, NIE Q, LONG L, XU R H. Dynamic changes of chlorogenic acid content in different types of tobacco cultivars[J]. Journal of Mountain Agriculture and Biology, 2016, 32(2): 25-28. DOI:10.15958/j.cnki.sdnyswxb.2016.02.005 |
| [10] |
陈爱国, 申国明, 梁晓芳, 刘光亮, 裴军, 李峰, 吕士芳, 王文杰, 岳永兴, 王先伟. 茄尼醇的研究进展与展望[J]. 中国烟草科学, 2007, 28(6): 44-48. DOI:10.3969/j.issn.1007-5119.2007.06.011 CHEN A G, SHEN G M, LIANG X F, LIU G L, PEI J, LI F, LYÜ S F, WANG W J, YUE Y X, WANG X W. Research advances and prospects of solanesol[J]. Chinese Tobacco Science, 2007, 28(6): 44-48. DOI:10.3969/j.issn.1007-5119.2007.06.011 |
| [11] |
KOTIPALLI K P, RAO N C V, RAJ K. Estimation of solanesol in tobacco and nontobacco plants from Solanaceae family[J]. Journal of Medicinal and Aromatic Plant Sciences, 2008, 30(1): 65-68. |
| [12] |
刘宇欣, 张健, 闫向阳, 韩芳, 徐业平, 刘少民. 烟草中高级烷醇·植物甾醇和茄尼醇含量及形态分布研究[J]. 安徽农业科学, 2013, 41(26): 10835-10838, 10896. DOI:10.13989/j.cnki.0517-6611.2013.26.089 LIU Y X, ZHANG J, YAN X Y, HAN F, XU Y P, LIU S M. State and distribution research of fatty alcohols, phytosterols and solanesol in tobacco[J]. Journal of Anhui Agricultural Sciences, 2013, 41(26): 10835-10838, 10896. DOI:10.13989/j.cnki.0517-6611.2013.26.089 |
| [13] |
盖小雷. 烟草茄尼醇合成关键酶基因表达模式分析及NtSPS基因的功能研究[D]. 北京: 中国农业科学院, 2017. GAI X L. Analysis of key enzyme gene expression patterns in tobacco solanesol synthesis and function research of NtSPS gene[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. |
| [14] |
ZHAO C J, ZU Y G, LI C Y, TIAN C Y. Distribution of solanesol in Nicotiana tabacum[J]. Journal of Forestry Research, 2007, 18(1): 69-72. DOI:10.1007/s11676-007-0013-0 |
| [15] |
杜咏梅, 张怀宝, 张忠锋, 马雁军, 侯小东, 王晓婷, 蒯雁, 李丹丹. 我国烤烟茄尼醇含量及其与烟草和烟气主要化学成分的相关性[J]. 中国烟草科学, 2014, 35(6): 54-58. DOI:10.13496/j.issn.1007-5119.2014.06.011 DU Y M, ZHANG H B, ZHANG Z F, MA Y J, HOU X D, WANG X T, KUAI Y, LI D D. Solanesol content in flue-cured tobacco leaves and its correlations with main chemical components of leaf and mainstream smoking[J]. Chinese Tobacco Science, 2014, 35(6): 54-58. DOI:10.13496/j.issn.1007-5119.2014.06.011 |
| [16] |
赵春建, 李春英, 祖元刚. 烟草茄尼醇含量的品种间差异及其在生长期内的变化[J]. 植物生理学通讯, 2007, 43(2): 298-300. DOI:10.13592/j.cnki.ppj.2007.02.020 ZHAO C J, LI C Y, ZU Y G. Different solanesol contents in leaves of several tobacco varieties and their changes during seedling growth[J]. Plant Physiology Communications, 2007, 43(2): 298-300. DOI:10.13592/j.cnki.ppj.2007.02.020 |
| [17] |
ZHOU H Y, LIU C Z. Rapid determination of solanesol in tobacco by high-performance liquid chromatography with evaporative light scattering detection following microwave-assisted extraction[J]. Journal of Chromatography B, 2006, 835: 119-122. DOI:10.1016/j.jchromb.2006.02.055 |
| [18] |
XIANG D H, YAO Z M, LIU Y H, GAI X L, DU Y M, ZHANG Z F, YAN N, WANG A H, FU Q J. Analysis on solanesol content and genetic diversity of Chinese flue-cured tobacco(Nicotiana tabacum L.)[J]. Crop Science, 2017, 57: 847-855. DOI:10.2135/cropsci2016.07.0568 |
| [19] |
马柱文, 陈俊标, 袁清华, 黄振瑞. 广东烟草种质资源创新与利用研究进展[J]. 广东农业科学, 2021, 48(1): 1-8. DOI:10.16768/j.issn.1004-874X.2021.01.001 MA Z W, CHEN J B, YUAN Q H, HUANG Z R. Research progress in innovation and utilization of Guangdong tobacco germplasm resources[J]. Guangdong Agricultural Sciences, 2021, 48(1): 1-8. DOI:10.16768/j.issn.1004-874X.2021.01.001 |
| [20] |
马柱文, 李香荷, 黄振瑞, 袁清华, 张振臣, 李集勤, 李淑玲, 陈俊标. 广东烟草种质资源田间鉴定及繁种更新试验[J]. 安徽农业科学, 2019, 47(16): 33-36, 42. DOI:10.3969/j.issn.0517-6611.2019.16.011 MA Z W, LI X H, HUANG Z R, YUAN Q H, ZHANG Z C, LI J Q, LI S L, CHEN J B. Propagating and identification for tobacco germplasm resources in Guangdong province[J]. Journal of Anhui Agricultural Sciences, 2019, 47(16): 33-36, 42. DOI:10.3969/j.issn.0517-6611.2019.16.011 |
| [21] |
苑举民, 丁永亮, 张启明, 何宽信, 赵涛, 黄锡春, 谌剑, 石屹. 有机无机肥对烤烟光合特性和烟叶质量的影响[J]. 广东农业科学, 2018, 45(4): 14-21. DOI:10.16768/j.issn.1004-874X.2018.04.003 YUAN J M, DING Y L, ZHANG Q M, HE K X, ZHAO T, HUANG X C, CHEN J, SHI Y. Effects of organic and inorganic fertilizers on photosynthetic characteristics and quality of flue-cured tobacco leaves[J]. Guangdong Agricultural Sciences, 2018, 45(4): 14-21. DOI:10.16768/j.issn.1004-874X.2018.04.003 |
| [22] |
马柱文, 张振臣, 袁清华, 屈玉娇, 李集勤, 李淑玲, 陈俊标. 烟叶钾含量种质间差异分析及其田间鉴定指标筛选[J]. 广东农业科学, 2019, 46(2): 16-22. DOI:10.16768/j.issn.1004-874X.2019.02.003 MA Z W, ZHANG Z C, YUAN Q H, QU Y J, LI J Q, LI S L, CHEN J B. Analysis of differences in potassium content among tobacco germplasm and screening of field identification indicators[J]. Guangdong Agricultural Sciences, 2019, 46(2): 16-22. DOI:10.16768/j.issn.1004-874X.2019.02.003 |
| [23] |
陈亚茹, 陈增敏, 赵正雄, 林云红, 熊茜, 甘影秋, 李丽华. 施用黄腐酸钾对打顶烤烟干物质和钾素累积的影响[J]. 广东农业科学, 2020, 47(2): 68-74. DOI:10.16768/j.issn.1004-874X.2020.02.010 CHEN Y R, CHEN Z M, ZHAO Z X, LIN Y H, XIONG Q, GAN Y Q, LI L H. Effects of fulvic acid potassium on dry matter and potassium accumulation in flue-cured tobacco during topping[J]. Guangdong Agricultural Sciences, 2020, 47(2): 68-74. DOI:10.16768/j.issn.1004-874X.2020.02.010 |
| [24] |
董珊, 肖伟敏, 彭祖茂, 刘永固, 张协光. HPLC法同时测定金银花等样品中6种绿原酸异构体的含量[J]. 食品科技, 2020, 45(3): 300-306. DOI:10.13684/j.cnki.spkj.2020.03.053 DONG S, XIAO W M, PENG Z M, LIU Y G, ZHANG X G. Determining of 6 chlorogenic acids in 5 samples by high performance liquid chromatography[J]. Food Science and Technology, 2020, 45(3): 300-306. DOI:10.13684/j.cnki.spkj.2020.03.053 |
| [25] |
MEINHART A D, DAMIN F M, CALDEIRÃO L, SILVEIRA T F F D, FILHO J T, GODOY H T. Chlorogenic acid isomer contents in 100 plants commercialized in Brazil[J]. Food Research International, 2017, 99: 522-530. DOI:10.1016/j.foodres.2017.06.017 |
| [26] |
MOEENFAR D M, ROCH A L, ALV ES A. Quantification of caffeoylquinic acids in coffee brews by HPLC-DAD[J]. Journal of Analytical Methods in Chemistry, 2014, 2014: 965353. DOI:10.1155/2014/965353 |
| [27] |
TAJIK N, TAJIK M, MACK I, ENCK P. The potential effects of chlorogenic acid, the main phenolic components in coffee, on health: a comprehensive review of the literature[J]. European Journal of Nutrition, 2017, 56: 2215-2244. DOI:10.1007/s00394-017-1379-1 |
| [28] |
马跃新, 聂根宇, 李维莉. RP-HPLC法测定滇金银花中绿原酸的含量[J]. 昆明学院学报, 2020, 42(6): 110-113. DOI:10.14091/j.cnki.kmxyxb.2020.06.024 MA Y X, NIE G Y, LI W L. Content determination of chlorogenic acid in Flora Lonicerae bournei by RP-HPLC[J]. Journal of Kunming University, 2020, 42(6): 110-113. DOI:10.14091/j.cnki.kmxyxb.2020.06.024 |
| [29] |
彭新辉, 易建华, 周清明, 杨丁秀. 烟草绿原酸的研究进展[J]. 中国烟草学报, 2006, 12(4): 52-57. DOI:10.3321/j.issn:1004-5708.2006.04.013 PENG X H, YI J H, ZHOU Q M, YANG D X. Recent advances in research on chlorogenic acid in tobacco[J]. Acta Tabacaria Sinica, 2006, 12(4): 52-57. DOI:10.3321/j.issn:1004-5708.2006.04.013 |
| [30] |
欧阳璐斯, 赖燕华, 王予, 陶红, 黄翼飞. 高效液相色谱-分段检测法同时测定烟草中14种多酚类化合物[J]. 分析测试学报, 2021, 40(3): 411-416. DOI:10.3969/j.issn.1004-4957.2021.03.018 OUYANG L S, LAI Y H, WANG Y, TAO H, HUANG Y F. Simultaneous determination of fourteen polyphenols in tobacco by piecewise detection based on liquid chromatography[J]. Journal of Instrumental Analysis, 2021, 40(3): 411-416. DOI:10.3969/j.issn.1004-4957.2021.03.018 |
| [31] |
杨银菊, 王树声, 刘光亮, 曾文龙, 陈志厚, 戴培刚, 李琦瑶, 陈爱国. 打顶后烟叶内源生长素含量的变化对绿原酸含量的影响[J]. 西南农业学报, 2019, 32(5): 1028-1033. DOI:10.16213/j.cnki.scjas.2019.5.013 YANG Y J, WANG S S, LIU G L, ZENG W L, CHEN Z H, DAI P G, LI Q Y, CHEN A G. Effect of endogenous auxin content on chlorogenic acid content in tobacco leaves after topping[J]. Southwest China Journal of Agricultural Sciences, 2019, 32(5): 1028-1033. DOI:10.16213/j.cnki.scjas.2019.5.013 |
| [32] |
VOLLMANNOVÁ A, MUSILOVÁ J, LIDIKOVÁ J, ÁRVAY J, ŠNIRC M, TÓTH T, BOJŇANSKÁ T, ČIČOVÁ I, KREFT I, GERM M. Concentrations of phenolic acids are differently genetically determined in leaves, flowers, and grain of common buckwheat(Fagopyrum esculentum Moench)[J]. Plants, 2021, 10: 1142. DOI:10.3390/plants10061142 |
(责任编辑 邹移光)
 2021, Vol. 48
2021, Vol. 48