文章信息
基金项目
- 广东省重点领域研发计划项目(2020B020219002);广东省现代农业产业技术体系创新团队项目(2021KJ111)
作者简介
-
索海翠(1982—),女,博士,助理研究员,研究方向为马铃薯分子育种,E-mail:suohaicui@163.com; 李小波,博士,研究员,广东省甘薯马铃薯产业技术体系创新团队马铃薯育种岗位专家,广东省农业科学院作物研究所马铃薯学科团队学术带头人,华中农业大学和湖南农业大学校外硕士生导师。广东省马铃薯产业技术创新联盟常务副理事长,中国作物学会马铃薯专业委员会委员
主要从事马铃薯遗传育种和节本增效栽培技术研究与应用。2009年到广东省农业科学院作物研究所工作,先后主持广东省基础研究重大项目子课题、广东省应用型研发专项、国家重点研发计划子课题、广东省马铃薯良种重大科研联合攻关等各级项目20多项;获广东省农业科学院科技二等奖1项,广东省农业技术推广奖一等奖2项、二等奖2项;制定地方标准2项;培育马铃薯品种6个,获得植物新品种保护权1项,培育的品种多次被列为广东省和广州市主导品种,推广面积达13.3万hm2以上,社会经济效益显著。主编书籍2部,发表科技论文40余篇;申请和获授权国家发明专利5件,实用新型专利6件,软件著作权4件.
通讯作者
- 李小波(1981—),男,博士,研究员,研究方向为马铃薯分子育种,E-mail:Lixiaobo1981@163.com.
文章历史
- 收稿日期:2021-10-29
类胡萝卜素是一类重要的脂溶性色素的总称,是由异戊二烯骨架构成的共轭双键长链为基础的C40或C30萜类化合物。天然类胡萝卜素种类繁多,超过750余种,广泛存在于动物、植物和微生物中[1]。按分子结构中是否含有氧原子,类胡萝卜素类物质可以分为两类:一类是不含氧元素、只含碳氢元素的类胡萝卜素类,如八氢番茄红素、番茄红素、α- 胡萝卜素、β- 胡萝卜素等;另一类是含甲氧基、羟基、酮基、羧基等含氧官能团的的叶黄素类,如玉米黄质、叶黄素、花药黄质、虾青素等[2]。在自然界中,类胡萝卜素作为天然着色剂,是形成黄色、橙色、红色的主要色素物质。此外,类胡萝卜素具有重要的生物学功能,它是植物光合系统中光吸收的辅助色素,赋予植物叶片、花朵和果实等组织美丽多彩的色泽[3],也是植物芳香类物质的前体,能更好地吸引昆虫等媒介传播花粉[4]。同时,类胡萝卜素衍生物脱辅基类胡萝卜素还可以为植物提供激素脱落酸和独角金内酯的合成前体[5-6]。对人类而言,类胡萝卜素的高抗氧化性可以促进人体清除自由基,提高机体免疫力,降低各种疾病的发生概率[7-9]。类胡萝卜素被人体吸收后可以转化为维生素A,能够有效维护眼睛的健康、促进人类视觉的形成[10]。
马铃薯作为重要的粮菜兼用和工业原料作物,是仅次于水稻、小麦和玉米之后的世界第四大粮食作物。我国马铃薯种植面积达469万hm2,居世界第1位,约占全世界总种植面积的27%;产量达到9 000万t,居世界第1位,约占全世界总产量的24%(农业农村部2020年数据)。2015年初,农业部(现农业农村部)提出马铃薯主粮(食)化战略,大大促进了我国马铃薯产业的飞速发展。马铃薯块茎中类胡萝卜素主要以叶黄素、玉米黄质、新黄质、堇菜黄质等形式存在,不仅对马铃薯生长发育过程中块茎的颜色变化产生重要作用,还会影响其营养品质和商品价值。目前,马铃薯遗传育种的目标正向着改善块茎的营养品质方向发展,高类胡萝卜素含量马铃薯品种逐渐成为育种的重要方向。鉴于此,本文从马铃薯种质(包括四倍体栽培种和二倍体野生种)中所含类胡萝卜素的种类和含量,类胡萝卜素合成代谢途径中关键基因〔β-胡萝卜素羟化酶Chy(β-carotene hydroxylase)、玉米黄质环氧化酶zep(Zeaxanthin epoxidas)、番茄红素ε-环化酶基因LCYe(lycopene ε-cyclase)〕的克隆、等位基因和单倍型的功能分析,利用常规育种和基因强化等手段提高马铃薯类胡萝卜素含量等方面进行综述,并从马铃薯类胡萝卜素合成途径调控基因的鉴定和野生型二倍体资源的利用方面,展望未来马铃薯类胡萝卜素的研究方向,为进一步研究马铃薯类胡萝卜素合成相关调控和基因表达调控等提供相关理论依据。
1 马铃薯种质中类胡萝卜素的种类及含量 1.1 马铃薯种质中类胡萝卜素的种类差异马铃薯种质资源极其丰富,现已经发现普通马铃薯共有235个亲缘种,包括7个四倍体栽培种和228个二倍体野生种,这些原始栽培种和野生种在南美洲、中美洲等原产地经过漫长的自然选择过程,含有各种抗病虫害、抗逆等极具利用价值的经济特性及营养特性[11]。自然界中,马铃薯的薯肉呈现出从白色到奶油色、黄色到橙色以及红色到紫色等的变化。研究表明,花青素等色素类物质的含量及种类决定薯肉的红色、蓝色和紫色;而类胡萝卜素的含量及种类决定薯肉的白色、黄色和橙色[12]。Mashaba等[13]测定产自南非的马铃薯、番茄、硬质小麦和面包小麦4种作物的类胡萝卜素含量,发现在马铃薯中类胡萝卜素主要以叶黄素和玉米黄质为主,如在马铃薯品种Mondial中玉米黄质含量占总类胡萝卜素含量的61%,而在另一个品种BPL中叶黄素含量占71%。实际上,无论是在二倍体野生种还是四倍体栽培种马铃薯中,最常见的类胡萝卜素类物质主要是叶黄素类,包括叶黄素、玉米黄质、新黄质、堇菜黄质、花药黄质和隐黄质等[12]。但各类物质含量有较大差异,如在野生种二倍体野生种Solanum phureja(DB375/1)中,玉米黄质含量占总类胡萝卜素含量的51%,花药黄质含量占总类胡萝卜素含量的25%;在四倍体栽培种中,堇菜黄质含量占总类胡萝卜素含量的51%,新黄质含量占总类胡萝卜素含量的20%[12, 14]。Wenhe等[15]研究二倍体野生种和四倍体栽培种杂交群体时发现,在两个群体中均鉴定到新黄质、堇菜黄质、黄体素5, 6环氧化物、黄体素和玉米黄质等6种类胡萝卜素物质;在二倍体野生种中,类胡萝卜素物质以黄体素5, 6环氧化物和黄体素为主;在栽培种四倍体中,主要类胡萝卜素物质为堇菜黄质,占总类胡萝卜素含量的40%。众所周知,β- 胡萝卜素是一种重要的类胡萝卜素类物质,是合成维生素A的前提,对人类视力具有重要作用,在其他物种如胡萝卜、甘薯中广泛存在,而在马铃薯中非常微量甚至很难检出,相反,马铃薯是叶黄素和玉米黄质的重要来源[13]。叶黄素和玉米黄质被认为对白内障和老年性黄斑变性具有保护作用,而这两种病变是导致不可逆视力丧失和失明的主要原因[16-17]。
1.2 马铃薯种质中类胡萝卜素的含量差异类胡萝卜素含量方面,在马铃薯四倍体栽培种中,黄肉品种类胡萝卜素含量范围在58~175 μg/100g,白肉品种类胡萝卜素含量低于黄肉品种、在38~62 μg/100g之间[18]。与四倍体栽培种相比,二倍体野生种的块茎则具有更高的类胡萝卜素含量,约为136~1 435 μg/100g,是四倍体黄肉品种的3~13倍、白肉品种的4~22倍[15]。Brown[19]研究发现,在商业化的马铃薯白肉品种和黄肉品种中,类胡萝卜素含量范围在50~350 μg/100g之间,而在短日照南美安第斯山区的二倍体野生种黄肉品种Papa Amarilla中,类胡萝卜素含量范围则在800~2 000 μg/100g之间,杂交组合后代中含量则高达2 600 μg/100g。Hejtmánková[20]研究也发现,橙色薯肉的野生种二倍体马铃薯品种Mayan Queen(S. phureja)含有更高的类胡萝卜素含量,主要物质为玉米黄质,含量高达1.29~2.26 mg/kg。此外,对马铃薯二倍体和四倍体块茎不同发育阶段的类胡萝卜素含量研究表明,类胡萝卜素在块茎成熟中期含量最高,几乎是块茎膨大初期的1倍,随后含量逐渐下降[21]。
2 马铃薯类胡萝卜素生物合成代谢的调控 2.1 植物类胡萝卜素的合成及代谢调控近年来,人们对类胡萝卜素的生物合成途径进行广泛研究,通过生化分析、经典遗传学和分子遗传学研究,已逐步阐明类胡萝卜合成的主要途径(图 1)[22]。
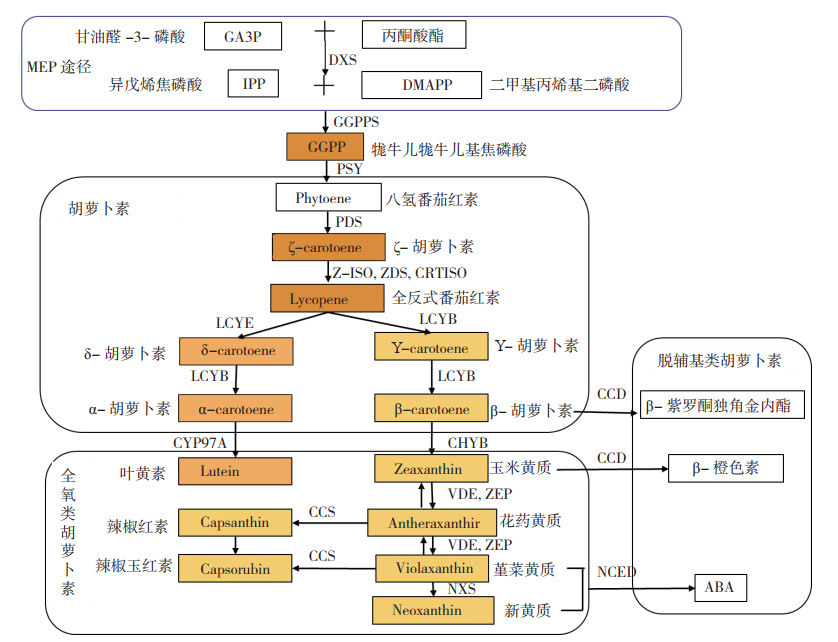
|
| DXS:1-脱氧-D-木酮糖-5-磷酸合成酶;PSY:八氢番茄红素合成酶;PDS:八氢番茄红素去饱和酶;ZISO:ζ- 胡萝卜素异构酶ZDS:ζ- 胡萝卜素去饱和酶;CRTISO:胡萝卜素异构酶;LCYB:番茄红素β环化酶;LCYE:番茄红素ε环化酶;VDE:堇菜黄素脱环氧酶;ZEP:玉米黄质环氧酶;NXS:新黄质合成酶;CCS:辣椒红素合成酶;CCD:类胡萝卜素裂解双加氧酶;NCED:9- 顺- 环氧类胡萝卜素双加氧酶 DXS: 1-deoxy-D-xylulose 5-phosphate synthase; PSY: Phytoene synthase; PDS: Phytoene desaturase; ZISO: ζ-carotene isomerase; ZDS: ζ-carotene desaturase; CRTISO: Carotene isomerase; LCYB: Lycopene β-cyclase; LCYE: Lycopene ε-cyclase; VDE: Violaxanthin de-epoxidase; ZEP: Zeaxanthin epoxidase; NXS: Neoxanthin synthase; CCS: Capsaicin synthase; CCD: Carotenoid cleavage oxygenases; NCED: 9-cis-epoxycarotenoid dioxygenase 图 1 植物类胡萝卜素的合成及代谢调控 Fig. 1 Synthesis and metabolism regulation of carotenoids in plants |
2.1.1 类胡萝卜素前体的合成 植物细胞类胡萝卜素前提的合成主要来自于2-C- 甲基-D- 赤藻糖醇-4- 磷酸MEP(2-C-Methyl-D-erythritol 4-phosphate)途径,即丙酮酸和3- 磷酸甘油醛通过缩合反应生成1- 脱氧- 木酮糖-5- 磷酸,并通过1- 脱氧-D- 木酮糖-5- 磷酸合酶和5- 磷酸脱氧木酮糖还原异构酶,催化反应生成控制牻牛儿牻牛儿基焦磷酸(GGPP)合成的前体异戊烯焦磷酸(IPP)和二甲基丙烯基二磷酸(DMAPP)。IPP和DMAPP通过缩合反应生成牻牛儿焦磷酸(C10),然后在牻牛儿牻牛儿基焦磷酸合成酶(GGPPS)的作用下生成GGPP。
2.1.2 胡萝卜素的合成 从GGPP生成第1个类胡萝卜素物质八氢番茄红素,再经脱氢、环化、羟基化、环氧化等转变为其他类胡萝卜素。其中,八氢番茄红素合成酶PSY(Phytoene synthase)是类胡萝卜素合成途径最重要的限速酶,能催化GGPP(Geranylgeranyl diphosphate)形成无色八氢番茄红素。八氢番茄红素脱氢酶PDS(Phytoene desaturase)参与线状类胡萝卜素的生物合成,是去饱和非常重要的一类酶,无色八氢番茄红素在PDS和其他酶的作用下,生成红色的全反式番茄红素。番茄红素β- 环化酶基因LCYB(Lycopene β-cyclase)和番茄红素ε- 环化酶LCYE(Lycopene ε-cyclase)是类胡萝卜素生物合成途径中的关键分支点,全反式番茄红素经LCYB和LCYE催化可分别形成α- 胡萝卜素和β- 胡萝卜素。
2.1.3 含氧类胡萝卜素的合成 α- 胡萝卜素通过细胞色素P450类型羟化酶的羟基化反应形成叶黄素,后者由β- 胡萝卜素羟化酶(CHY)羟基反应形成玉米黄质。玉米黄质在玉米黄质环氧化酶ZEP(Zeaxanthin epoxidas)作用下生成花药黄质,进而生成堇菜黄质。堇菜黄质在新黄质合成酶NSY(Neoxanthin synthase)的催化下生成新黄质,也是该支路上最后一个产物,堇菜黄质和新黄质被认为是ABA合成的前体物质[22]。
2.2 马铃薯类胡萝卜素生物合成的调控自20世纪80年代开始马铃薯控制薯肉颜色基因的研究以来,类胡萝卜素基因如Chy、zep、LCYe等已经被克隆,且相关等位基因也已被鉴定。
2.2.1 β- 胡萝卜素羟化酶基因(Chy) 早期研究表明,在马铃薯中,白肉对黄肉是由单基因Y/y控制的,并且定位于3号染色体上[23-24]。Brown等[25]在一个Stenotomum phureja-S杂交群体中观察到肉色为橙色、玉米黄质含量高的后代个体,认为橙色的表型是由马铃薯3号染色体上Y位点或接近Y位点的显性或等位基因OR引起的。但由于缺乏直接的Papa Amarilla基因库以外的遗传性证据,研究者否定OR表达与强显性单基因Y遗传一致的假设[26]。Brown[27]利用裂解扩增多态序列方法,对二倍体Papa Amarila衍生的两个高类胡萝卜素系杂交后代中β- 胡萝卜素羟化酶Chy等位基因进行鉴别,发现与黄肉共分离的高类胡萝卜素亲本中有一个Chy等位基因(记为B),而白肉中则存在b,证明β- 胡萝卜素羟化酶编码单基因Y或与Y位点紧密相连。Kloosterman等[28]使用44KPOCI阵列进行RNA表达分析鉴定到一个黄色薯肉的eQTL,位于3号染色体,与Chy2基因的位置相似。Wolters等[29]从单倍体基因型7322中克隆到Chy2基因,全长2 255 bp,包含7个外显子,并确认该基因的一个等位基因是控制白肉和黄肉的显性基因;进而选取4个单倍体、20个phureja和chaconese的单株、11个二倍体的单株对薯肉颜色和SNP位点进行关联分析,发现chy基因存在8个不同类型的单倍型,其中单倍型3和黄肉表型之间具有极强的相关性[29]。杂合单倍型3使马铃薯肉色呈黄色,表明黄色是由显性等位基因控制,推测可能是Brown报道中的B[27]。此外,在四倍体栽培种中,等位基因3的剂量效应平均值最高,而除等位基因3以外的几个等位基因,无论在白色还是黄色薯肉中,这些等位基因的存在均不影响肉色值,表明这几个等位基因与黄肉无关[29]。
2.2.2 玉米黄质环氧化酶基因(zep) zep是控制橙色薯肉的一个重要候选基因,参与玉米黄质向花药黄质、花药黄质向堇菜黄质的转变[30]。沉默马铃薯zep基因导致马铃薯块茎中玉米黄质和总类胡萝卜素含量增加[31],Morris在马铃薯资源中也发现zep转录水平与块茎类胡萝卜素含量呈相反趋势[12]。利用番茄BAC文库克隆马铃薯zep基因,通过对二倍体和单倍体进行序列分析,发现存在5个单倍型,其中纯和的单倍型1在5个无亲缘关系的橙肉二倍体中存在,表明单倍型1与橙色薯肉关联。在二倍体IvP92-030群体(二倍体G254与SUH2293杂交的后代)中也获得Zep等位基因1参与橙色肉色的遗传证据。亲本G254含有Chy2等位基因2和6,亲本SUH2293含有Chy2等位基因3和5,亲本G254和SUH2293均含有Zep等位基因1和2,只有子代IvP92-030-9和IvP92-030-11表现出橙肉表型,这两个子代均含有Chy2等位基因3和Zep等位基因1纯合。表明获得橙肉马铃薯需要显性的Chy2等位基因3和隐性的Zep等位基因1的纯合同时存在[29]。
对玉米黄质环氧化酶(Zep)等位基因的分析表明,所有具有橙色块茎果肉的(二倍体)基因型均与一个特定的表达水平降低的Zep等位基因1纯合。与其他Zep等位基因序列进行比较发现,隐性Zep等位基因1的第一个内含子中存在一个非LTR(长末端重复序列)逆转录转座子序列,在其他Zep等位基因中是不存在的[29]。而在四倍体中,只有极少数带有Stenotomum phureja血缘的个体存在纯合等位基因1,推测zep等位基因1可能是S. phureja所特有[29]。
2.2.3 番茄红素环化酶基因(LCYe) LCYe是叶黄素的前体α- 胡萝卜素合成的必需酶[30],沉默LCYe导致β- 胡萝卜素含量的升高[32],利用番茄BAC文库克隆LCYe,包含11个外显子,具有5个等位基因,尽管等位基因2和5中SNP的突变引起氨基酸的改变,但在C×E群体验证表明LCYe没有对马铃薯薯肉颜色产生影响[29]。
此外,Goo等[33]对5个马铃薯品种的类胡萝卜素合成基因表达模式进行分析,结果表明在深黄肉品种Golden Valley中,参与类胡萝卜素生物合成途径的大部分基因如psy1、psy2、pds和zds转录水平升高,尤其是编码胡萝卜素生成前3步酶的基因psy、pds和zds表达最为活跃,而 LCYe和zep的表达量则较低。Chy2基因在所有品种中均有较高水平表达,相反,几乎没有检测到胡萝卜素异构酶和Chy1的表达。
2.3 马铃薯类胡萝卜素的降解调控植物体内类胡萝卜素降解途径主要包括3条,即BCH(β-carotene hydroxylase)、LOX(Lipoxy genases)和类胡萝卜素裂解双加氧酶(CCD)途径。(1)BCH途径:β- 胡萝卜素在β- 胡萝卜素羟化酶作用下,将β- 胡萝卜素羟化生成β- 隐黄质,进而转化为玉米黄质,玉米黄质在玉米黄质环氧化酶的催化下环化形成环氧玉米黄素和全反式紫黄质,这一催化反应是可逆的,形成叶黄素循环[22]。(2)LOX途径:脂氧合酶是催化类胡萝卜素氧化降解的关键酶基因之一,是一种含血红素铁的蛋白质,广泛存在于自然界中,在脂质的氧化降解中发挥着重要作用[34]。类胡萝卜素经LOX酶氧化降解可产生香叶醇、紫黄素、β-大马酮、茄酮、甲基辛烯酮等香气物质。(3)CCDs途径:指植物体内的类胡萝卜素被类胡萝卜素裂解双加氧酶氧化裂解生成脱辅基类胡萝卜素,再经9- 顺- 环氧类胡萝卜素双加氧酶(NCED)裂解等步骤产生ABA[35]。类胡萝卜素裂解双加氧酶是一个小的基因家族,在拟南芥中发现9个不同成员,包括5个NCED和4个CCDs,不同基因家族成员所识别的底物、切割位点以及生成产物不尽相同。迄今为止,已从茶叶[36]、辣椒[37]、番茄[38]、谷子[39]等物种中克隆到CCD基因家族成员。
目前,在马铃薯中克隆到类胡萝卜素裂解双加氧酶CCD4,研究发现白肉块茎中CCD4基因的表达水平高于黄肉块茎。采用RNA干扰,下调马铃薯CCD4基因的表达水平,导致类胡萝卜素含量增加,是非转基因对照植株的2~5倍,类胡萝卜素含量的增加主要是由于紫黄质含量的增加,暗示紫黄质可能是体内类胡萝卜素裂解双加氧酶的底物[40]。
3 利用生物强化手段提高马铃薯类胡萝卜素含量 3.1 育种手段高类胡萝卜素马铃薯种植资源的筛选为高类胡萝卜素马铃薯育种的开展创造了条件。郝智勇等[41]对62份国家种质克山马铃薯试管苗保存库的马铃薯资源进行筛选,选出类胡萝卜素含量较高(高于60.38 μg/100g)的资源13份,以黄肉材料为主。其中,728-6、Kuroda、白头翁、орбита、米拉的类胡萝卜素含量分别为70.39、72.12、74.88、78.93、91.84 μg/100g,以米拉的类胡萝卜素含量为最高。由于马铃薯四倍体的类胡萝卜含量显著低于二倍体,通过育种手段创制高胡萝卜素品种主要集中在二倍体资源利用方面,成效显著。例如,Inca-no-mezame是具有phureja血缘的二倍体品种,2001年播种到田间,薯肉呈橙色,块茎类胡萝卜素含量极高(530~741 μg/100g, FW),主要为玉米黄质(占40%),具有极强抗氧化活性,深受市场喜欢,但缺点是块茎较小、产量低[42]。在Inca-no-mezame开放授粉的后代中,选育出一个同样橙色薯肉、高类胡萝卜素含量的品种Inca-no-hitomi,该品种类胡萝卜素含量最高达576 μg/100 g(FW),且块茎产量大于Inca-no-mezame[43]。Sakamoto等[44]利用母本Saikai 35和父本Saikai 33选育出Nagasaki Kogane,该品种的类胡萝卜素含量略低于Inca-no-mezame,但其对PCN、PVY和青枯病表现出较高抗性,块茎产量也明显大于Inca-no-mezame。
3.2 基因强化与传统杂交手段相比,通过分子育种手段可以定向调控马铃薯块茎中类胡萝卜素的种类和含量,具有传统育种方法无可比拟的优势。目前通过基因强化马铃薯块茎类胡萝卜素含量主要有两种方式:一是通过过量或沉默马铃薯类胡萝卜素合成途径的基因来实现。例如,通过抑制zep的表达,抑制玉米黄质向紫黄质转化,使转基因株系块茎中的玉米黄质含量提高4~130倍[31]。在马铃薯糖蛋白启动子的控制下,引入LCYe的反义片段沉默LCYe,导致马铃薯块茎类胡萝卜素含量显著增加,其中胡萝卜素含量增幅最大、高达14倍,总类胡萝卜素含量增加2.5倍[32]。通过沉默类胡萝卜素脱氢酶chy1和chy2,转基因块茎的β- 胡萝卜素含量高达38倍,总胡萝卜素含量上升4.5倍[45]。
二是通过引入外源基因来实现。将欧文氏菌的八氢番茄红素合成酶crtB(Bacterial phytoene synthase)导入马铃薯四倍体栽培种和二倍体野生种中,在获得的转基因四倍体栽培种块茎中,类胡萝卜素含量比非转基因对照提高7倍、叶黄素含量提高19倍,β- 胡萝卜素在对照植株中几乎检测不到,在转基因块茎中含量达11 μg/g(DW);而在野生种Mayan Gold中,转基因块茎的总类胡萝卜素含量提高近4倍[46]。在马铃薯中利用块茎特异性启动子同时导入欧文氏菌的番茄红素合成酶CrtB、番茄红素去饱和酶(CrtI)、番茄红素β环化酶(CrtY)等3个基因,块茎呈现金黄色表型,且未伴随叶片表型发生改变,类胡萝卜素含量增加约20倍,β- 胡萝卜素含量增加3 600倍。此外,有报道表明在其他主粮作物(如水稻)中通过生物强化获得最高类胡萝卜素含量的大米,超过黄金大米2号[47]。由此可知,通过转基因技术可提高马铃薯块茎类胡萝卜素含量,尤其是提高β- 胡萝卜素和玉米黄素含量,对满足人类膳食对类胡萝卜素的需求具有极大的现实意义。
4 展望 4.1 挖掘马铃薯类胡萝卜素合成调控相关基因目前,只在马铃薯类胡萝卜素合成通路的关键基因功能方面开展了相关研究。但实际上,类胡萝卜素调控可以分为基因型调控、表观调控、转录调控、储存调控和环境调控等[48]。例如,在拟南芥的组蛋白甲基转移酶SDG8(Set domain group 8)缺失突变体中,类胡萝卜素合成关键基因crtiso由于受其调控而导致染色质甲基化状态改变,基因表达水平降低,叶黄素合成减少[48-49]。在转录调控方面,目前已经发现很多转录因子直接或间接参与蔬菜中类胡萝卜素的相关合成与代谢,主要有MYB家族、BBX家族、NAC家族、MADS-box家族、AP2/ERF家族等。MYB家族、BBX家族和NAC家族中的一些转录因子通过调节或结合类胡萝卜素的相关合成基因直接调控作物中类胡萝卜素的积累;MADS-box家族、AP2/ ERF家族中的一些转录因子则是通过调节作物的成熟来间接影响类胡萝卜素的合成[50-51]。例如,在拟南芥中发现光敏色素互作因子PIF1(bHLH家族)[52],番茄种果实发育的核心调控因子RIN(Ripening Inhibitor,MADS-box家族)以及木瓜中发现的CpNAC1均调控类胡萝卜的合成[53]。在贮存调控方面,类胡萝卜素在植物体内的主要合成和贮藏场所是质体,因此质体发育和分化是调控类胡萝卜素代谢的重要机制[54]。在环境调控方面,由于植物所处的环境因素(如光照、温度等)发生改变,会使植物类胡萝卜素积累水平不同,Pola等[55]在不同温度下对辣椒进行处理发现,20℃下辣椒呈橙红色,30℃下辣椒中的叶绿素迅速降解并且变红,类胡萝卜素含量升高,与类胡萝卜素合成相关的基因(如psy、LCYb等)表达上调。Alba[56]发现红光处理可促进番茄果实中番茄红素含量的增加。60个马铃薯品种在黑暗条件下贮藏3~4个月,均未检测到玉米黄质,表明黑暗能影响类胡萝卜素物质转化[14]。因此,还需进一步挖掘和研究影响类胡萝卜素合成和转化调控途径的基因。
4.2 加强马铃薯二倍体野生种资源利用马铃薯二倍体野生种中具有很多高类胡萝卜素资源,且二倍体比四倍体更容易建立遗传群体开展相关类胡萝卜素合成代谢基因挖掘和机制解析。目前,Chy2和zep在二倍体橙色薯肉控制机制研究中已经取得良好进展,但对其他合成代谢途径基因的挖掘还有待加强。此外,由于有些调控高类胡萝卜的等位基因只存在于二倍体资源中、在栽培种四倍体资源中缺乏,而二倍体和四倍体杂交不亲和,如何利用中间媒介材料或利用其他生物学手段将这类基因导入栽培种中进而提高类胡萝卜素水平,也是未来的一个研究方向。
| [1] |
BRITTON G, LIAAEN-JENSEN S, PFANDER H, MERCADANTE A Z, EGELAND E S. Carotenoids Handbook[M]. Berlin, De: Birkhäuser Verlag, 2004.
|
| [2] |
方秋莹. 柑橘类胡萝卜素代谢调控的基因挖掘[D]. 武汉: 华中农业大学, 2020. FANG Q Y. Gene mining for regulation of carotenoid metabolism in Citrus[D]. Wuhan: Huazhong Agricultural University, 2020. |
| [3] |
MA Y Z, HOLT N E, LI X P, NIYOGI K K, FLEMING G R. Evidence for direct carotenoid involvement in the regulation of photosynthetic light harvesting[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(8): 4377-4382. DOI:10.1073/pnas.0736959100 |
| [4] |
LUAN Y, FU X, LU P, GRIERSON D, XU C. Molecular mechanisms determining the differential accumulation of carotenoids in plant species and varieties[J]. Critical Reviews in Plant Sciences, 2020, 39(2): 125-139. DOI:10.1080/07352689.2020.1768350 |
| [5] |
VELISEK J. The chemistry of food[M]. Oxford, UK: Wiley Blackwell, 2014.
|
| [6] |
SANDMANN G. Carotenoids of biotechnological importance[J]. Advances in Biochemical Engineering/Biotechnology, 2015, 148(277): 449-467. DOI:10.1007/10_2014_277 |
| [7] |
RODRIGUEZ-CONCEPCION M, AVALOS J, BONET M L, BORONAT A, GOMEZ-GOMEZ L, HORNERO-MENDEZ D, LIMON M C, MELÉNDEZ-MARTÍNEZ A J, OLMEDILLA-ALONSO B, PALOU A, RIBOT J, RODRIGO M J, ZACARIAS L, ZHU C F. A global perspective on carotenoids: Metabolism, biotechnology, and benefits for nutrition and health[J]. Progress in Lipid Research, 2018, 70: 62-93. DOI:10.1016/j.plipres.2018.04.004 |
| [8] |
FASSETT R G, COOMBES J S. Astaxanthin in cardiovascular health and disease[J]. Molecules, 2012, 17: 2030-2048. DOI:10.3390/molecules17022030 |
| [9] |
MORDENTE A, GUANTARIO B, MEUCCI E, SILVESTRINI A, LOMBARDI E, MARTORANA G E, GIARDINA B, BÖHM V. Lycopene and cardiovascular diseases: an update[J]. Current Medicinal Chemistry, 2011, 18(8): 1146-1163. DOI:10.2174/092986711795029717 |
| [10] |
SILVA J S, CHAVES G V, STENZEL A P, PEREIRA S E, SABOYA C J, A RAMALHO A. Improvement of anthropometric and biochemical, but not of vitamin A, status in adolescents who undergo roux-en-Y gastric bypass: a 1-year follow up study[J]. Surgery for Obesity and Related Diseases, 2017, 13(2): 227-233. DOI:10.1016/j.soard.2016.09.002 |
| [11] |
陈珏, 秦玉芝, 熊兴耀. 马铃薯种质资源的研究与利用[J]. 农产品加工(学刊), 2010(8): 70-73. DOI:10.3969/jissn.1671-9646(X).2010.08.019 CHEN J, QIN Y Z, XIONG X Y. Study on potato germplasm resources and utilization of agricultural products processing[J]. Academic Periodical of Farm Products Processing, 2010(8): 70-73. DOI:10.3969/jissn.1671-9646(X).2010.08.019 |
| [12] |
MORRIS W L. Carotenogenesis during tuber development and storage in potato[J]. Journal of Experimental Botany, 2004, 55(399): 975-982. DOI:10.1093/jxb/erh121 |
| [13] |
MASHABA C S, BARROS E. Screening South African potato, tomato and wheat cultivars for five carotenoids[J]. South African Jounal of Science, 2011, 107: 9-10. DOI:10.4102/sajs.v107i9/10.507 |
| [14] |
FERNANDEZ-OROZCO R, GALLARDO-GUERRERO L, HORNERO-MÉNDEZ D. Carotenoid profiling in tubers of different potato(Solanum sp.)cultivars: Accumulation of carotenoids mediated by xanthophyll esterification[J]. Food Chemistry, 2013, 141(3): 2864-2872. DOI:10.1016/j.foodchem.2013.05.016 |
| [15] |
WENHE L U, KATHLEEN H. Carotenoid content and color in diploid potatoes[J]. Journal of the American Society for Horticultural Science, 2001, 126(6): 722-726. DOI:10.21273/JASHS.126.6.722 |
| [16] |
LANDRUM J T, BONE R A. Lutein, zeaxanthin, and the macular pigment[J]. Archives of Biochemistry and Biophysics, 2001, 385(1): 28-40. DOI:10.1006/abbi.2000.2171 |
| [17] |
OLMEDILLA B, GRANADO F, BLANCO I, VAQUERO M, CAJIGAL C. Lutein in patients with cataracts and age-related macular degeneration: A long-term supplementation study[J]. Journal of The Science of Food and Agriculture, 2001, 81(9): 904-909. DOI:10.1002/jsfa.905 |
| [18] |
BREITHAUPT D E, BAMEDI A. Carotenoids and carotenoid esters in potatoes(Solanum tuberosum L.): New insights into an ancient vegetable[J]. Journal of Agricultural and Food Chemistry, 2002, 50(24): 7175-7181. DOI:10.1021/jf0257953 |
| [19] |
BROWN C R. Breeding for phytonutrient enhancement of potato[J]. American Journal of Potato Research, 2008, 85(4): 298-307. DOI:10.1007/s12230-008-9028-0 |
| [20] |
HEJTMÁNKOVÁ K, KOTÍKOVÁ Z, HAMOUZ K, PIVEC V, VACEK J, LACHMAN J. Influence of flesh colour, year and growing area on carotenoid and anthocyanin content in potato tubers[J]. Journal of Food Composition and Analysis, 2013, 32(1): 20-27. DOI:10.1016/j.jfca.2013.07.001 |
| [21] |
ŠULC M, KOTÍKOVÁ Z, PAZNOCHT L, LACHMAN J. Changes in carotenoid profile during potato(Solanum tuberosum L.)tuber maturation[J]. American Journal of Potato Research, 2021, 98(2): 85-92. DOI:10.1007/s12230-020-09805-0 |
| [22] |
陆晨飞, 刘钰婷. 类胡萝卜素代谢调控与植物颜色变异[J]. 北方园艺, 2016(16): 193-199. DOI:10.11937/bfyy.201616049 LU C F, LIU Y T. Regulation of carotenoid metabolism and color variation in plants[J]. The North Garden, 2016(16): 193-199. DOI:10.11937/bfyy.201616049 |
| [23] |
BONIERBALE M W, PLAISTED R L, TANKSLEY S D. RFLP maps based on a common set of clones reveal modes of chromosomal evolution in potato and tomato[J]. Genetics, 1988, 120(4): 1095-1103. DOI:10.1093/genetics/120.4.1095 |
| [24] |
GEBHARDT C, RITTER E, DEBENER T, SCHNACHTSCHABEL U, WALKEMEIER B, UHRIG H, SALAMINI F. RFLP analysis and linkage mapping in Solanum tuberosum[J]. Theoretical and Applied Genetics, 1989, 78: 65-75. DOI:10.1007/BF00299755 |
| [25] |
BROWN C R, EDWARDS C G, YANG C P, DEAN B B. Orange flesh trait in potato: Inheritance and carotenoid content[J]. Journal of the American Society for Horticultural Science, 1993, 118(1): 145-150. DOI:10.1007/BF00023087 |
| [26] |
BROWN C R. Breeding for phytonutrient enhancement of potato[J]. American Journal of Potato Research, 2008, 85: 298-307. DOI:10.1007/s12230-008-9028-0 |
| [27] |
BROWN C R., KIM T S, GANGA Z, HAYNES K, DE JONG D, JAHN M, DE JONG W. Segregation of total carotenoid in high level potato germplasm and its relationship to beta-carotene hydroxylase polymorphism[J]. American Journal of Potato Research, 2006, 83(5): 365-372. DOI:10.1007/bf02872013 |
| [28] |
KLOOSTERMAN B, DE KOEYER D, GRIFFITHS R, FLINN B, STEUERNAGEL B, SCHOLZ U, SONNEWALD S, SONNEWALD U, BRYAN G J, PRAT S, BA xNFALVI Z, HAMMOND J P, GEIGENBERGER P, NIELSEN K L, VISSERRGF, BACHEM C W B. Genes driving potato tuber initiation and growth: identification based on transcriptional changes using the POCI array[J]. Functional and Integrative Genomics, 2008, 8(4): 329-340. DOI:10.1007/s10142-008-0083-x |
| [29] |
WOLTERS A M A, UITDEWILLIGEN J G A M L, KLOOSTERMAN B A, HUTTEN R C B, VISSER R G F, VAN ECK H J. Identification of alleles of carotenoid pathway genes important for zeaxanthin accumulation in potato tubers[J]. Plant Molecular Biology, 2010, 73(6): 659-671. DOI:10.1007/s11103-010-9647-y |
| [30] |
TANAKA Y, SASAKI N, OHMIYA A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids[J]. The Plant Journal, 2008, 54(4): 733-749. DOI:10.1111/j.1365-313X.2008.03447.x |
| [31] |
RÖMER S, LÜBECK J, KAUDER F, STEIGER S, ADOMAT C, SANDMANN G. Genetic engineering of a zeaxanthin-rich potato by antisense inactivation and co-suppression of carotenoid epoxidation[J]. Metabolic Engineering, 2002, 4(4): 263-272. DOI:10.1006/mben.2002.0234 |
| [32] |
DIRETTO G, TAVAZZA R, WELSCH R, PIZZICHINI D, MOURGUES F, PAPACCHIOLI V, GIULIANO G. Metabolic engineering of potato tuber carotenoids through tuber-specific silencing of lycopene epsilon cyclase[J]. BMC Plant Biology, 2006, 6(1): 13. DOI:10.1186/1471-2229-6-13 |
| [33] |
GOO Y M, KIM T W, HA S H, BACK K W, BAE J M, SHIN Y W, LEE S W. Expression profiles of genes involved in the carotenoid biosynthetic pathway in yellow-fleshed potato cultivars(Solanum tuberosum L.) from South Korea[J]. Journal of Plant Biology, 2009, 52(1): 49-55. DOI:10.1007/s12374-008-9003-9 |
| [34] |
张瑛, 吴跃进, 吴进德, 童继平, 郑乐娅. 脂肪氧化酶与稻谷贮藏的陈化变质[J]. 安徽农业科学, 2001, 29(5): 565-566. DOI:10.3969/j.issn.0517-6611.2001.05.001 ZHANG Y, WU Y J, WU J D, TONG J P, ZHENG L Y. Lipoxygenase and the deterioration of rice grain in storage[J]. Journal of Anhui Agricultural Sciences, 2001, 29(5): 565-566. DOI:10.3969/j.issn.0517-6611.2001.05.001 |
| [35] |
ZHANG B, LIU C, WANG Y, YAO X, LIU K D. Disruption of a CAROTENOID CLEAVAGE DIOXYGENASE 4 gene converts flower colour from white to yellow in Brassica species[J]. New Phytologist, 2015, 206(4): 1513-1526. DOI:10.1111/nph.13335 |
| [36] |
傅秀敏, 唐劲驰, 杨子银. 茶叶类胡萝卜素合成, 代谢调控研究进展[J]. 广东农业科学, 2021, 48(5): 18-27. DOI:10.16768/j.issn.1004-874X.2021.05.003 FU X M, TANG J C, YANG Z Y. Research progress in biosynthesis and metabolism regulation of carotenoids in tea plants[J]. Guangdong Agricultural Sciences, 2021, 48(5): 18-27. DOI:10.16768/j.issn.1004-874X.2021.05.003 |
| [37] |
李全辉, 邵登魁, 李江, 王亚艺, 巩振辉. 辣椒果实类胡萝卜素生物合成研究进展[J]. 植物遗传资源学报, 2019, 20(2): 239-248. DOI:10.13430/j.cnki.jpgr.20180720002 LI Q H, SHAO D K, LI J, WANG Y Y, GONG Z H. Research progress of carotenoid biosynthesis in pepper fruit[J]. Journal of Plant Genetic Resources, 2019, 20(2): 239-248. DOI:10.13430/j.cnki.jpgr.20180720002 |
| [38] |
于菁文, 张奕, 胡鑫, 潘阳露, 潘宇, 张兴国, 苏承刚. 番茄果实中类胡萝卜素合成与调控的研究进展[J]. 中国蔬菜, 2019(7): 23-35. YU J W, ZHANG Y, HU X, PAN Y L, PAN Y, ZHANG X G, SU C G. Research progress on synthesis and regulation of carotenoids in tomato fruits[J]. China Vegetables, 2019(7): 23-35. |
| [39] |
刘晶. 谷子类胡萝卜素降解关键基因SiCCD1的克隆与功能分析[D]. 晋中: 山西农业大学, 2019. LIU J. Cloning and functional analysis of the key gene SiCCD1 of carotenoid degradation pathway in Foxtail Millet[D]. Jinzhong: Shanxi Agricultural University, 2019. |
| [40] |
CAMPBELL R, DUCREUX L J M, MORRIS W L, MORRIS J A, SUTTLE J C, RAMSAY G, TAYLOR M A. The metabolic and developmental roles of carotenoid cleavage dioxygenase 4 from potato[J]. Plant Physiology, 2010, 154(2): 656-664. DOI:10.1104/pp.110.158733 |
| [41] |
郝智勇, 杨广东, 邱广伟, 胡尊艳, 王立春, 王海艳. 马铃薯高类胡萝卜素资源材料筛选[J]. 作物杂志, 2019(2): 71-77. DOI:10.16035/j.issn.1001-7283.2019.02.010 HAO Z Y, YANAG G D, QIU G W, HU Z Y, WAGN L C, WANG H Y. Screening of high carotenoid resource materials in potato[J]. Crops, 2019(2): 71-77. DOI:10.16035/j.issn.1001-7283.2019.02.010 |
| [42] |
ISHⅡ G, MORI M, OHARA A, UMEMURA Y. Food chemical properties of a new potato with orange flesh //HäGG M, AHVENAINEN R, EVERS A M, TⅡLIKKALA K. In: Agri-food qualityⅱ: quality management of fruit and vegetables[M]. Cambridge, UK: Woodhead Publishing, 1999: 357-359.
|
| [43] |
KOBAYASHI A, OHARA-TAKADA A, TSUDA S, MATSUURA-ENDO C, TAKADA N, UMEMURA Y, MORI M. Breeding of potato variety"Inca-no-hitomi"with a very high carotenoid content[J]. Breeding Science, 2008, 58(1): 77-82. DOI:10.1270/jsbbs.58.77 |
| [44] |
SAKAMOTO Y, MORI K, MATSUO Y, MUKOJIMA N, WATANABE W, SOBARU N, CHAYA M. Breeding of a new potato variety"Nagasaki Kogane"with high eating quality, high carotenoid content, and resistance to diseases and pests[J]. Breeding Science, 2017, 67(3): 320-326. DOI:10.1270/jsbbs.16168 |
| [45] |
DIRETTO G, WELSCH R, TAVAZZA R, MOURGUES F, PIZZICHINI D, BEYER P, GIULIANO G. Silencing of beta-carotene hydroxylase increases total carotenoid and beta-carotene levels in potato tubers[J]. BMC Plant Biology, 2007, 7(1): 11. DOI:10.1186/1471-2229-7-11(a) |
| [46] |
DUCREUX L J, MORRIS W L, HEDLEY P E, SHEPHERD T, DAVIES H V, MILLAM S, TAYLOR M A. Metabolic engineering of high carotenoid potato tubers containing enhanced levels of carotene and lutein[J]. Journal of Experimental Botany, 2005, 56(409): 81-89. DOI:10.1093/jxb/eri016 |
| [47] |
DIRETTO G, AL-BABILI S, TAVAZZA R, PAPACCHIOLI V, BEYER P, GIULIANO G. Metabolic engineering of potato carotenoid content through tuber-specific overexpression of a bacterial mini-pathway[J]. PLoS ONE, 2007, 2(4): e350. DOI:10.1371/journal.pone.0000350(b) |
| [48] |
CAZZONELLI C I, POGSON B J. Source to sink: regulation of carotenoid biosynthesis in plants[J]. Trends in Plant Science, 2010, 15(5): 266-274. DOI:10.1016/j.tplants.2010.02.003 |
| [49] |
CAZZONELLI C I, CUTTRISS A J, COSSETTO S B, PYE W, CRISP P, WHELAN J, FINNEGAN E J, TURNBULL C, POGSON B J. Regulation of carotenoid composition and shoot branching in Arabidopsis by a chromatin modifying histone methyltransferase, SDG8[J]. Plant Cell, 2009, 21(4): 39-53. DOI:10.4161/psb.4.4.8193 |
| [50] |
刁卫楠, 朱红菊, 刘文革. 蔬菜作物中类胡萝卜素研究进展[J]. 中国瓜类, 2021, 34(1): 1-8. DOI:10.16861/j.cnki.zggc.2021.0001 DIAO W N, ZHU H J, LIU W G. Research progress on carotenoids in vegetable crops[J]. China Melon, 2021, 34(1): 1-8. DOI:10.16861/j.cnki.zggc.2021.0001 |
| [51] |
樊宝莲, 王晓云. 转录因子调控植物类胡萝卜素合成途径的研究进展[J]. 分子植物育种, 2021, 19(13): 4401-4408. DOI:10.13271/j.mpb.019.004401 FANB L, WANG X Y. Research progress of transcription factors regulating carotenoid synthesis pathway in plant[J]. Molecular Plant Breeding, 2021, 19(13): 4401-4408. DOI:10.13271/j.mpb.019.004401 |
| [52] |
TOLEDO-ORTIZ G, HUQ E, RODRÍGUEZ-CONCEPCIÓN M. Direct regulation of phytoene synthase gene expression and carotenoid biosynthesis by phytochrome-interacting factors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(25): 11626-11631. DOI:10.1073/pnas.0914428107 |
| [53] |
FU C C, HAN Y C, FAN Z Q, CHEN J Y, CHEN W X, LU W J, KUANG J F. The Papaya transcription factor CpNAC1 modulates carotenoid biosynthesis through activating phytoene desaturase genes CpPDS2/4 during fruit ripening[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 5454-5463. DOI:10.1021/acs.jafc.6b01020 |
| [54] |
SUN T H, YUAN H, CAO H B, YAZDANI M, TADMOR Y, LI L. Carotenoid metabolism in plants: The role of plastids[J]. Molecular Plant, 2018, 11(1): 58-74. DOI:10.1016/j.molp.2017.09.010 |
| [55] |
POLA W, SUGAYA S, PHOTCHANACHAI S. Influence of postharvest temperatures on carotenoid biosynthesis and phytochemicals in mature green chil(Capsicum annuum L.)[J]. Antioxidants(Basel), 2020, 9(3): 203-216. DOI:10.3390/antiox9030203 |
| [56] |
ALBA R. Fruit- localized phytochromes regulate lycopene accumulation independently of ethylene production in tomato[J]. Plant Physiology, 2000, 123(1): 363-370. DOI:10.1104/pp.123.1.363 |
(责任编辑 张辉玲)
 2021, Vol. 48
2021, Vol. 48