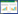文章信息
基金项目
- 广东省农业科学院创新基金(202109);广东省自然科学基金(2021A1515010778);广州市科技计划项目(202102020845);广东省现代农业产业技术体系创新团队项目(2021KJ111)
作者简介
-
刘计涛(1989—),男,博士,助理研究员,研究方向为马铃薯抗寒分子育种,E-mail:liu-j-t@163.com; 李小波,博士,研究员,广东省甘薯马铃薯产业技术体系创新团队马铃薯育种岗位专家,广东省农业科学院作物研究所马铃薯学科团队学术带头人,华中农业大学和湖南农业大学校外硕士生导师,兼任广东省马铃薯产业技术创新联盟常务副理事长,中国作物学会马铃薯专业委员会委员。
主要从事马铃薯遗传育种和节本增效栽培技术研究与应用。先后主持广东省基础研究重大项目子课题、广东省应用型研发专项、国家重点研发计划子课题、广东省马铃薯良种重大科研联合攻关等各级项目20多项;获广东省农业科学院科技奖二等奖1项,广东省农业技术推广奖一等奖2项、二等奖2项;制定地方标准2项;培育马铃薯品种6个;获得植物新品种保护权1项。培育的马铃薯品种多次被列为广东省和广州市主导品种,推广面积达13万hm2以上,社会经济效益显著。主编书籍2部,发表科技论文40余篇;申请和获授权国家发明专利5件,实用新型专利6件,软件著作权4件.
通讯作者
- 李小波(1981—),男,博士,研究员,研究方向为马铃薯育种与栽培,E-mail:Lixiaobo1981@163.com.
文章历史
- 收稿日期:2021-10-29
【研究意义】马铃薯(Solanum tuberosum) 是我国重要的粮菜兼用作物,总产量和种植面积均居世界首位,在保证国家粮食安全和蔬菜周年供应中发挥重要作用,是高效农业的重要组成部分。马铃薯为喜冷凉不耐低温作物,容易遭受冬春季自然寒害,严重影响产量。茉莉酸是重要的植物激素之一,在调节非生物胁迫和生物胁迫中发挥了重要的功能,但关于茉莉酸影响马铃薯抗寒性的研究还较少,因此,探索茉莉酸对马铃薯低温胁迫耐性的影响,有助于解析马铃薯抗寒生理机制,并为其在生产中推广应用提供参考。【前人研究进展】低温胁迫是威胁温带和热带植物的主要环境因素之一[1],会导致植物中活性氧(ROS)过度积累造成核酸、蛋白质和脂质等大分子物质的氧化损伤,最终破坏细胞功能,造成植物死亡[2][3]。茉莉酸(JA)是一种重要的植物激素,其参与调节许多生理进程,如根抑制[4]、花青素积累[5]、毛状体形成[6]、雄性发育[7-8]、叶片衰老[9-11]、生物和非生物胁迫响应等[12-16]。前人的研究表明,外源处理MeJA能够显著提升模式植物拟南芥在非冷驯化条件下的抗寒性[17],以及冷胁迫下水稻幼苗的存活率[18],在番茄中JA能够促进腐胺的合成降低氧化胁迫提高低温胁迫耐性[19]。外源JA处理能够通过缓解氧化胁迫,维持细胞稳态和提高抗氧化能力增强紫苏、颠茄、小麦的抗寒性[20-22]。ICE(Inducer of CBF expression)- CBF转录调节模块在植物低温胁迫响应中起着重要的作用[23],在拟南芥中低温胁迫能够激活ICE-CBF蛋白诱导大量的COR (Coldregulated)基因的表达,最终提升拟南芥的低温胁迫耐性[24]。有研究报道,JA能够正调节ICE-CBF通路,增强拟南芥的低温胁迫耐性[17]。这些研究表明,JA在调节植物低温胁迫耐性中发挥重要的功能。在马铃薯中,前人的研究发现JA能够提升马铃薯对晚疫病的抗性[25],影响块茎发育等[26],而关于JA调节马铃薯抗寒性的研究还较少。因此,探索JA调节马铃薯抗寒的机制对于马铃薯抗寒育种和栽培具有重要意义。【本研究切入点】以马铃薯冬作区主栽品种费乌瑞它为研究对象,针对冬作区寒害频发严重影响产量这一现状,以及农民对马铃薯抗寒栽培技术和品种的需求,利用外源JA处理并通过酶活性分析和抗寒相关基因CBF的表达模式确定马铃薯最适JA使用浓度。【拟解决的关键问题】探讨JA调节马铃薯低温胁迫耐性的最适浓度,以及其对马铃薯活性氧及其清除酶的影响,揭示JA影响马铃薯抗寒性的生理特性。
1 材料与方法 1.1 试验材料供试马铃薯品种为费乌瑞它,种薯购自天津市天兴佳业科技有限公司,保存于冷库中,试验前放置于室内待种薯发芽后切块,在实验室光照培养室进行盆栽;供试盆规格为盆底直径22 cm,高25 cm,盆口直径30 cm;基质为草炭土混合珍珠岩比例为2∶1。
茉莉酸购自上海麦克林生化科技有限公司,用适量无水乙醇彻底溶解后,再缓慢加入水定容至0.1 mol/L作为母液,然后根据试验所需浓度(50、100、200、400 μmol/L)进行稀释定容,以去离子水作对照。
1.2 试验方法1.2.1 样品处理与采集 试验于2021年9月11日在广东省农作物遗传改良重点实验室进行,马铃薯出苗2周的盆栽苗,每盆保留1~2棵长势一致的幼苗,继续在长日照(光照16 h)条件下培养2周后备用。选取25盆长势一致的马铃薯盆栽苗平均分为5组,每组5个生物学重复,分别用50、100、200、400 μmol/L茉莉酸和去离子水喷施叶片,24 h后放入低温光照培养箱(达斯卡特DGZC-P1000B),以-2 ℃低温胁迫处理5 h,分别选取处理0、5 h顶部生长第3~4片功能叶置于液氮中,用于下一步分析。
1.2.2 测定项目及方法 过氧化氢含量:采用过氧化氢含量检测试剂盒(BC3590,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g加入1 mL丙酮提取液并迅速涡旋震荡混匀,并置于冰上10 min充分反应,4 ℃、8 000 g离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,用分光光度计进行测定,调整波长至415 nm,记录吸光值,蒸馏水调零。计算公式为:
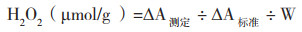
|
式中,∆A测定=A测定管-A空白管, ∆A标准=A标准管-A空白管, A为波长415 nm处吸光度OD415,W为样品质量(g)。
马铃薯过氧化氢酶(CAT)活性:采用过氧化氢酶活性检测试剂盒(BC0200,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g样本加入1 mL提取液并迅速涡旋震荡混匀,并置于冰上10 min,4 ℃、8 000 g离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,用分光光度计进行测定,调整波长至240 nm,记录吸光值,蒸馏水调零。取1 mL CAT检测工作液于1 mL石英比色皿中,再加入35 μL酶提取液,混匀5 s,室温下立即测定240 nm下的初始吸光值A1和1 min后的吸光值A2。
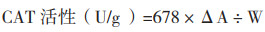
|
式中,ΔA=A1-A2,A为波长240 nm处吸光度OD240,W为样品质量(g)。
马铃薯过氧化物酶(POD)活性:采用过氧化物酶活性检测试剂盒(BC0090,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g样本加入1 mL提取液并迅速涡旋震荡混匀,并置于冰上10 min,4 ℃、8 000 g离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,用分光光度计进行测定,调整波长至470 nm,记录吸光值,蒸馏水调零。在1 mL玻璃比色皿中按顺序加入试剂盒试剂,立即混匀并计时,记录470 nm下30 s的吸光值A1和90 s后的吸光值A2。
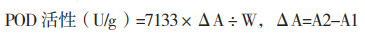
|
超氧化物歧化酶(SOD)活性:采用超氧化物歧化酶活性检测试剂盒(BC0170,北京索宝莱科技有限公司),将马铃薯叶片于液氮中研磨成粉末,称取0.1 g样本加入1 mL提取液并迅速涡旋震荡混匀,并置于冰上10 min,4 ℃、8 000 g离心10 min,取全部上清液,置冰上待测,然后参照试剂盒测定方法,加入测定试剂后充分混匀,37 ℃水浴30 min后,置于1 mL玻璃比色皿测定560 nm下的吸光度,蒸馏水调零。

|
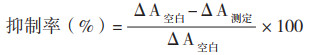
|
式中,ΔA测定=A测定-A对照,ΔA空白=A1空白-A2空白, A为波长560 nm处吸光度OD560,W为样品质量(g)。
1.2.3 基因表达分析 分别在Solanaceae Genomics Resource网站(www.spuddb.uga.edu/index.shtml)数据库获得MYC2和CBF1-3的序列,利用NCBI Primer Blast进行引物设计(表 1)和特异性比对分析。以JA处理马铃薯叶片提取的RNA,利用反转录试剂盒(擎科,Code No. TSK302M)得到cDNA模板,采用2×TSINGKE® Master qPCR Mix(SYBR Green I with UDG)(擎科,Code No. TSE203)进行实时荧光定量(QRT-PCR)分析,ef1a作为内参基因,获得不同基因的相对表达量,数据分析采用2-ΔΔCt法。每个样品3次生物学重复,3次技术重复。
2 结果与分析 2.1 JA对马铃薯活性氧含量的影响
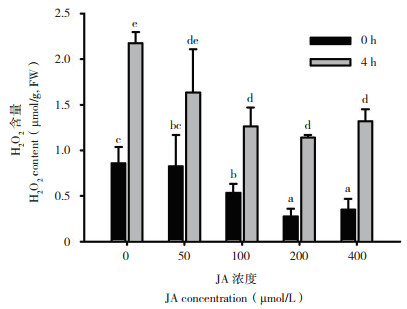
由图 1可知,JA处理24 h后马铃薯叶片过氧化氢的含量随着JA浓度的增加显著降低,对照过氧化氢含量最高为0.856 μmol/g,其中50 μmol/ L JA处理过氧化氢含量略有降低但不显著,100 μmol/L JA处理后开始显著降低,以200 μmol/L JA处理后达到最低点0.275 μmol/g,400 μmol/L JA处理比200 μmol/L JA处理略有升高但均比对照显著降低;经低温胁迫4 h后,与低温胁迫前相比过氧化氢含量均显著升高,且趋势与低温胁迫前一致,其中对照的过氧化氢含量仍是最高、为2.176 μmol/g,200 μmol/L JA处理最低、为1.139μmol/g。这表明JA浓度为200 μmol/L的处理效果最好,其次为400 μmol/L。
|
| 图 1 不同JA浓度处理对低温胁迫条件下过氧化氢含量的影响 Fig. 1 Effects of different JA concentrations on hydrogen peroxide content under cold stress |
2.2 JA对活性氧清除酶活性的影响
2.2.1 过氧化氢酶(CAT)活性 由图 2可知,JA处理24 h后,马铃薯叶片CAT活性总体随着JA浓度增加而增强,与蒸馏水对照相比,50 μmol/ L JA处理4 h后CAT活性由163.01 μmol/g增加至325.07 μmol/g,显著增强1.99倍,100、200、400 μmol/L JA处理的CAT活性比50 μmol/L JA处理略有升高但不显著,分别为对照的2.16、2.31、2.33倍;低温胁迫4 h后,与胁迫前(0 h)相比,蒸馏水对照的CAT活性由163.01 μmol/g增加至328.13 μmol/g,显著增强2.01倍,而50 μmol/L JA处理的CAT活性变化不明显,但100、200、400 μmol/L JA处理的CAT活性显著增强,分别为367.83、426.56、455.76 μmol/g,为对照的1.12、1.30、1.39倍。表明200 μmol/L JA处理效果最好,其次为100、400 μmol/L JA处理。

|
| A:低温胁迫前CAT活性变化;B:低温胁迫4 h后CAT活性变化 A: CAT activity changes before cold stress; B: CAT activity changes after 4 h of cold stress 图 2 不同JA浓度处理对低温胁迫条件下CAT活性的影响 Fig. 2 Effects of different JA concentrations on CAT activity under cold stress |
2.2.2 过氧化物酶(POD)活性 如图 3所示,与蒸馏水对照相比,50 μmol/L JA处理24 h后,马铃薯叶片POD活性变化不显著;当JA浓度增加至100 μmol/L时,POD活性由89.59 U/g显著增加至171.73 U/g,为对照的1.3倍;JA浓度继续增加至200、400 μmol/L时,POD活性分别为对照的2倍(181.24 U/g)和2.1倍(195.05 U/g)。低温胁迫4 h后POD活性比0 h显著增强,与蒸馏水对照相比,50 μmol/L JA处理的POD活性略有增强但不显著;JA浓度增加至100 μmol/L时,POD活性比对照增强1.81倍;200 μmol/L JA处理的POD活性显著提升,为对照的2.53倍;400 μmol/L JA处理与200 μmol/L JA处理效果相似,为对照的2.63倍。表明低温胁迫400 μmol/L JA处理的POD活性最强,其次为200、100 μmol/L JA处理。

|
| A:低温胁迫前POD活性变化;B:低温胁迫4 h后POD活性变化 A: POD activity changes before cold stress; B: POD activity changes after 4 h of cold stress 图 3 不同JA浓度处理对低温胁迫条件下POD活性的影响 Fig. 3 Effects of different JA concentrations on POD activity under cold stress |
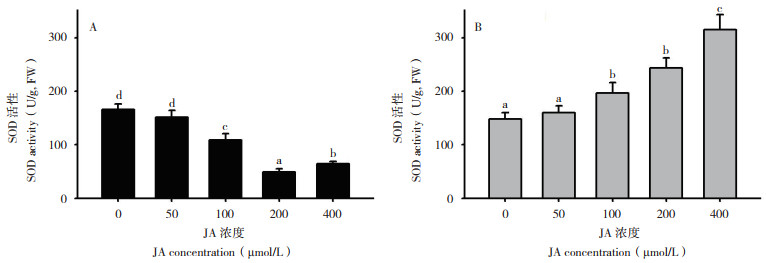
2.2.3 超氧化物歧化酶(SOD)活性 如图 4所示,将马铃薯植株进行JA处理24 h后,与蒸馏水对照(SOD活性为166.32 U/g)相比,50 μmol/ L JA处理的SOD活性(151.52 U/g)没有发生显著变化,而100 μmol/L JA处理后SOD活性(108.61 U/g)降低35%,200、400 μmol/L JA处理后SOD活性分别降低70.7%(SOD活性为48.67 U/g)和61.4%(SOD活性为64.12 U/g);低温胁迫处理4 h后,与对照相比,50 μmol/L JA处理的SOD活性没有发生显著变化,但100 μmol/L JA处理后SOD酶活性增强32.8%,200、400 μmol/L JA处理后SOD活性分别增强64.4% 和112.6%。表明在正常条件下JA处理抑制了SOD活性,且以200 μmol/L效果最显著,而在低温胁迫处理后,SOD活性随着JA浓度的增加而增强。
|
| A:低温胁迫前SOD活性变化;B:低温胁迫4 h后SOD活性变化 A: SOD activity changes before cold stress; B: SOD activity changes after 4 h of cold stress 图 4 不同JA浓度处理对低温胁迫条件下SOD活性的影响 Fig. 4 Effects of different JA concentrations on SOD activity under cold stress |
2.3 JA对马铃薯CBF基因表达的影响
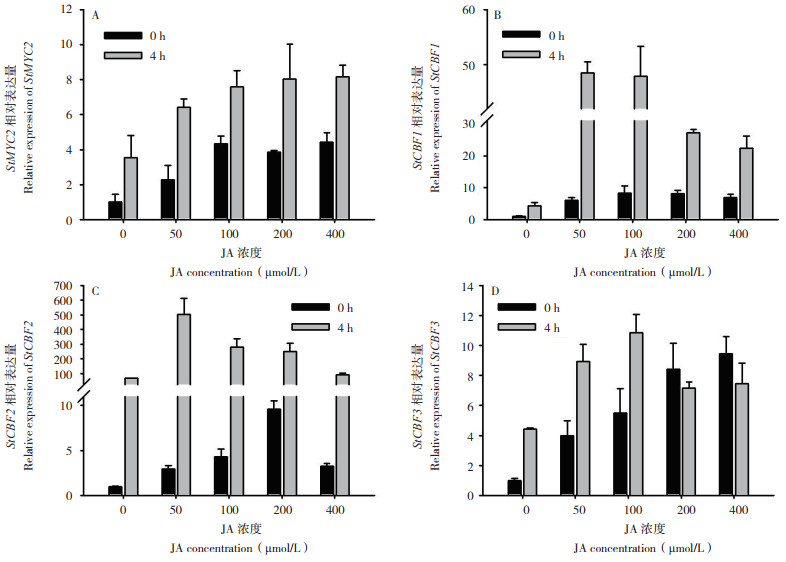
如图 5所示,马铃薯植株经JA和低温胁迫处理后,检测JA响应Marker基因MYC2的表达,结果发现,在正常条件下JA处理促进了MYC2基因的表达,并且在100 μmol/L JA处理后达到峰值,为对照的4.3倍;进一步进行低温胁迫处理4 h,MYC2的表达与0 h相比均有显著地增强,其中100、200、400 μmol/L JA处理分别比对照增强2.17、2.28、2.31倍,表明JA处理结果是可靠的。随后分别对马铃薯CBF1、CBF2和CBF3的表达进行分析,结果(图 5)显示,JA处理24 h后诱导3个CBF基因的表达,其中CBF1基因的表达在100 μmol/L JA处理后达到最强,CBF2基因的表达在200 μmol/L JA处理后最高,CBF3基因则在400 μmol/L JA处理后效果最好;进一步的低温胁迫处理4 h后,发现3个CBF基因的表达与0 h对比均有显著诱导,与对照相比,CBF1、CBF2、CBF3基因的表达在分别在50、100 μmol/L JA处理后效果最好。表明JA处理能够增强抗寒关键基因CBF的表达,进一步提升马铃薯的抗寒性。
|
| A:StMYC2相对表达量;B:StCBF1相对表达量;C:StCBF2相对表达量;D:StCBF3相对表达量 A: The relative expression of StMYC2;B: The relative expression of StCBF1; C: The relative expression of StCBF2; D: The relative expression of StCBF3 图 5 不同JA浓度处理及低温胁迫对StCBFs基因表达的影响 Fig. 5 Effects of different JA concentrations on the expression of StCBFs under cold stress |
3 讨论
低温是限制植物生长、种群地理分布和农艺性状的重要环境因子[27]。许多植物已经进化出适应低温气候的能力,并表现出局部的适应性状[28]。低温胁迫会诱导植物产生大量的活性氧(ROS),进而造成植物膜脂过氧化,细胞膜系统损伤,甚至细胞死亡,最终会影响植物的正常生长[29]。在许多植物中已经有研究表明,JA参与调节ROS的平衡机制,并且是通过影响ROS清除酶的活性实现的。本研究以马铃薯植株为研究对象,通过监测不同浓度JA对低温胁迫条件下马铃薯植株ROS清除酶活性的影响,筛选提升马铃薯植株抗寒性最适的JA浓度,旨在为实践生产中应用JA提供一定参考。本研究发现,随着JA处理浓度的提升,马铃薯叶片中过氧化氢的含量显著降低,并且以200 μmol/L JA处理效果最明显,而低温胁迫处理后各处理的过氧化氢含量均显著增加,但100、200、400 μmol/L JA处理的过氧化氢含量显著低于对照,表明JA能够显著抑制过氧化氢的积累。同样地,进一步分析ROS清除机制中的3种酶的活性,发现100、200 μmol/L JA处理后CAT、POD活性显著升高,表明JA通过调节CAT和POD活性[30]来调节马铃薯叶片细胞内ROS的平衡,进而影响抗寒性;然而,SOD活性在常温和低温胁迫条件下呈现出相反的趋势,这可能是由于常温条件下JA促进CAT和POD活性降低了过氧化氢的含量,进而导致SOD活性维持在较低水平,而在低温胁迫下过氧化氢含量显著升高,促进了SOD活性提升,且此时JA起着正调节的作用[30-31]。
CBF家族基因是植物响应低温胁迫的关键转录因子[23, 32-33]。研究发现,在许多植物中,低温胁迫能够激活CBF1-3的积累,并激活其下游COR(Cold-related)基因的表达,以提升植物的抗寒性[24, 34]。JA能够正调节ICE-CBF信号途径,增强植物的抗寒性[35]。本研究发现,在马铃薯中,JA处理能够诱导JA信号Marker基因MYC2的表达,表明JA处理结果可靠;进一步对CBF1-3的表达进行分析表明,JA处理能够促进CBF1-3的表达,以100、200 μmol/L JA处理效果最为显著。经低温胁迫处理后,与正常条件相比,3个CBF基因的表达均被诱导上调,以50、100 μmol/L JA处理表达最高,且CBF2变化倍数最高达500多倍,可能作为主效基因,其次为CBF1和CBF3。其原因可能是低温胁迫促进了内源JA的积累[29],从而促进了CBF1-3基因的表达。
4 结论本研究结果表明,低温胁迫条件下外源JA处理能够提升马铃薯叶片活性氧清除酶CAT、SOD和POD活性,抑制活性氧的积累,提升马铃薯的低温胁迫耐性,并且在一定范围内(0~400 μmol/L)随着JA浓度的增加ROS清除酶的活性呈现出增强的趋势;马铃薯适宜的茉莉酸处理浓度范围为100~400 μmol/L,其中以200 μmol/L效果最佳,此时能够将活性氧清除酶CAT、POD和SOD活性分别提升30%、153% 和64%,活性氧含量降低47.6%。此外,外源施加JA能够显著促进抗寒关键基因StCBFs的表达,提升马铃薯的抗寒性,在实际生产中遭遇低温寒潮时,可适当施用JA,减少损失。
| [1] |
ALLEN D J, ORT D R. Impacts of chilling temperatures on photosynthesis in warm-climate plants[J]. Trends in Plant Science, 2001, 6: 36-42. DOI:10.1016/S1360-1385(00)01808-2 |
| [2] |
APEL K, HIRT H. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55: 373-399. DOI:10.1146/annurev.arplant.55.031903.141701 |
| [3] |
DREYER A, DIETZ K J. Reactive oxygen species and the redoxregulatory network in cold stress acclimation[J]. Antioxidants, 2018, 7. DOI:10.3390/antiox7110169 |
| [4] |
STASWICK P E, SU W P, HOWELL S H. Methyl jasmonate inhibition of root growth and induction of a leaf protein are decreased in an Arabidopsis thaliana mutant[J]. Proceedings of the National Academy of Sciences, 1992, 89: 6837-6840. DOI:10.1073/pnas.89.15.6837 |
| [5] |
SHAN X, ZHANG Y, PENG W, WANG Z, XIE D. Molecular mechanism for jasmonate-induction of anthocyanin accumulation in Arabidopsis[J]. Journal of Experimental Botany, 2009, 60: 3849-3860. DOI:10.1093/jxb/erp223 |
| [6] |
ZHU Z, LEE B. Friends or foes: new insights in jasmonate and ethylene co-actions[J]. Plant & Cell Physiology, 2015, 56: 414-420. DOI:10.1093/pcp/pcu171 |
| [7] |
MCCONN M, BROWSE J. The critical requirement for linolenic acid is pollen development, not photosynthesis, in an Arabidopsis mutant[J]. The Plant Cell, 1996, 8: 403-416. DOI:10.2307/3870321 |
| [8] |
YUAN Z, ZHANG D. Roles of jasmonate signalling in plant inflorescence and flower development[J]. Current Opinion in Plant Biology, 2015, 27: 44-51. DOI:10.1016/j.pbi.2015.05.024 |
| [9] |
UEDA J, KATO J. Isolation and identification of a senescence promoting substance from wormwood(Artemisia absinthium L.)[J]. Plant Physiology, 1980, 66: 246-249. DOI:10.2307/4266374 |
| [10] |
CHINI A, GIMENEZ-IBANEZ S, GOOSSENS A, SOLANO R. Redundancy and specificity in jasmonate signalling[J]. Current Opinion in Plant Biology, 2016, 33: 147-156. DOI:10.1016/j.pbi.2016.07.005 |
| [11] |
ZHU Z. Molecular basis for jasmonate and ethylene signal interactions in Arabidopsis[J]. Journal of Experimental Botany, 2014, 65: 5743-5748. DOI:10.1093/jxb/eru349 |
| [12] |
严加坤, 严荣, 汪亚妮. 外源茉莉酸甲酯对盐胁迫下玉米根系吸水的影响[J]. 广东农业科学, 2019, 46(1): 1-6. DOI:10.16768/j.issn.1004-874X.2019.01.001 YAN J K, YAN R, WANG Y N. Impact of exogenous methyl jasmonate on water absorption of maize roots under salt stress[J]. Guangdong Agricultural Sciences, 2019, 46(1): 1-6. DOI:10.16768/j.issn.1004-874X.2019.01.001 |
| [13] |
KAZAN K. Diverse roles of jasmonates and ethylene in abiotic stress tolerance[J]. Trends in Plant Science, 2015, 20: 219-229. DOI:10.1016/j.tplants.2015.02.001 |
| [14] |
辛翠花, 郭江波. 接种晚疫病菌对马铃薯茉莉酸合成关键酶基因表达的影响[J]. 广东农业科学, 2012, 39(16): 152-153, 157. DOI:10.16768/j.issn.1004-874X.2012.16.048 XIN C H, GUO J B. Effects on gene expressions of key enzymes in jasmonic acid biosynthesis after infection of Phytophthora infestans in potato[J]. Guangdong Agricultural Sciences, 2012, 39(16): 152-153, 157. DOI:10.16768/j.issn.1004-874X.2012.16.048 |
| [15] |
SHARMA M, LAXMI A. Jasmonates: emerging players in controlling temperature stress tolerance[J]. Frontiers in Plant Science, 2016, 6: 1129. DOI:10.3389/fpls.2015.01129 |
| [16] |
VALENZUELA CE, ACEVEDO-ACEVEDO O, MIRANDA GS, VERGARA-BARROS P, HOLUIGUE L, FIGUEROA CR, FIGUEROA PM. Salt stress response triggers activation of the jasmonate signaling pathway leading to inhibition of cell elongation in Arabidopsis primary root[J]. Journal of Experimental Botany, 2016, 67: 4209-4220. DOI:10.1093/jxb/erw202 |
| [17] |
HU Y, JIANG L, WANG F, YU D. Jasmonate regulates the inducer of CBF expression-C-repeat binding factor/dre binding factor1 cascade and freezing tolerance in Arabidopsis[J]. The Plant Cell, 2013, 25: 2907-2924. DOI:10.1105/tpc.113.112631 |
| [18] |
LEE T M, LUR H S, CHU C. Role of abscisic acid in chilling tolerance of rice(Oryza sativa L.)seedlings[J]. Plant Science, 1997, 126: 1-10. DOI:10.1111/j.1365-3040.1993.tb00895.x |
| [19] |
DING F, WANG C, XU N, WANG M, ZHANG S. Jasmonic acidregulated putrescine biosynthesis attenuates cold-induced oxidative stress in tomato plants[J]. Scientia Horticulturae, 2021, 288: 110373. DOI:10.1016/j.scienta.2021.110373 |
| [20] |
王计平, 梁倩, 周雅莉, 李润植, 薛丽芳, 郝晓娟. 外源Me JA对低温下紫苏脂肪酸合成及FAD3基因表达的调控[J]. 山西农业大学学报(自然科学版), 2019, 39(3): 1-6. DOI:10.13842/j.cnki.issn1671-8151.201901032 WANG J P, LIANG Q, ZHOU Y L, LI R Z, XUE L F, HAO X J. Effect of exogenous MeJA on the regulation of fatty acid synthesis and FAD3 gene expression in Perilla frutescens under low temperature[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2019, 39(3): 1-6. DOI:10.13842/j.cnki.issn1671-8151.201901032 |
| [21] |
山雨思, 代欢欢, 何潇, 辛正琦, 吴能表. 外源茉莉酸甲酯和水杨酸对盐胁迫下颠茄生理特性和次生代谢的影响[J]. 植物生理学报, 2019, 55(9): 1335-1346. DOI:10.13592/j.cnki.ppj.2019.0229 SHAN Y S, DAI H H, HE X, XIN Z Q, WU N B. Effects of exogenous methyl jasmonate and salicylic acid on physiological characteristics and secondary metabolism of Atropa belladonna under NaCl stress[J]. Plant Physiology Communications, 2019, 55(9): 1335-1346. DOI:10.13592/j.cnki.ppj.2019.0229 |
| [22] |
赵虎, 樊晓培, 罗力力, 张瑞, 苍晶, 徐庆华, 于晶, 张达. MeJA对低温胁迫下冬小麦抗寒生理及关键基因表达量的影响[J]. 麦类作物学报, 2019(4): 407-414. DOI:10.7606/j.issn.1009-1041.2019.04.05 ZHAO H, FAN X P, LUO L L, ZHANG R, CANG J, XU Q H, YU J, ZHANG D. Effect of MeJA on the cold tolerance physiology and key gene expression in winter wheat under temperature stress[J]. Journal of Triticeae Crops, 2019(4): 407-414. DOI:10.7606/j.issn.1009-1041.2019.04.05 |
| [23] |
ZHU J K. Abiotic stress signaling and responses in plants[J]. Cell, 2016, 167: 313-324. DOI:10.1016/j.cell.2016.08.029 |
| [24] |
ZHAO C, ZHANG Z, XIE S, SI T, LI Y, ZHU JK. Mutational evidence for the critical role of CBF transcription factors in cold acclimation in Arabidopsis[J]. Plant Physiology, 2016, 171: 2744-2759. DOI:10.1104/pp.16.00533 |
| [25] |
杨艳丽. 外源茉莉酸影响马铃薯对晚疫病抗性的初步研究[D]. 长沙: 湖南农业大学, 2010. YANG Y L. Preliminary study on effects of exogenous jasmonic acid effects on potato resistance to late blight[D]. Changsha: Hunan Agricultural University, 2010. |
| [26] |
杨天宇, 韩小女, 徐尤先, 汤金香, 展康, 吴劲松, 王蕾. 叶面喷施茉莉酸甲酯对马铃薯微型薯生长及产量的影响[J]. 亚热带植物科学, 2020, 49(4): 247-252. DOI:10.3969/j.issn.1009-7791.2020.04.001 YANG T Y, HAN X N, XU Y X, TANG J X, ZHAN K, WU J S, WANG L. Effects of foliar sprayed methyl jasmonate on potato minituber growth and yield[J]. Subtropical Plant Science, 2020, 49(4): 247-252. DOI:10.3969/j.issn.1009-7791.2020.04.001 |
| [27] |
DREYER A, DIETZ K J. Reactive oxygen species and the redoxregulatory network in cold stress acclimation[J]. Antioxidants, 2018, 7(11). DOI:10.3390/antiox7110169 |
| [28] |
OAKLEY C G, SAVAGE L, LOTZ S, LARSON G R, THOMASHOW M F, KRAMER D M, SCHEMSKE D W. Genetic basis of photosynthetic responses to cold in two locally adapted populations of Arabidopsis thaliana[J]. Journal of Experimental Botany, 2018, 69: 699-709. DOI:10.1093/jxb/erx437 |
| [29] |
HU Y, JIANG Y, HAN X, WANG H, PAN J, YU D. Jasmonate regulates leaf senescence and tolerance to cold stress: Crosstalk with other phytohormones[J]. Journal of Experimental Botany, 2017, 68(6): 1361-1369. DOI:10.1093/jxb/erx004 |
| [30] |
YOSEFI A, MOZAFARI A A, JAVADI T. Jasmonic acid improved in vitro strawberry(Fragaria×Ananassa Duch.)resistance to PEGinduced water stress[J]. Plant Cell Tissue and Organ Culture, 2020, 142(2). DOI:10.1007/s11240-020-01880-9 |
| [31] |
WENG Y, GE L, JIA S, MAO P, MA X. Cyclophilin AtROC1 confers Arabidopsis cold tolerance by modulating jasmonic acid signaling and antioxidant metabolism[J]. Plant Physiology and Biochemistry, 2020, 152(5512). DOI:10.1016/j.plaphy.2020.04.012 |
| [32] |
THOMASHOW M F. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Physiology, 1999, 50: 571-599. DOI:10.1146/annurev.arplant.50.1.571 |
| [33] |
CHINNUSAMY V, ZHU J, ZHU J K. Cold stress regulation of gene expression in plants[J]. Trends in Plant Science, 2007, 12: 444-451. DOI:10.1016/j.tplants.2007.07.002 |
| [34] |
JIA Y, DING Y, SHI Y, ZHANG X, GONG Z, YANG S. The CBF striple mutants reveal the essential functions of CBFs in cold acclimation and allow the definition of CBF regulons in Arabidopsis[J]. New Phytologist, 2016, 212: 345-353. DOI:10.1111/nph.14088 |
| [35] |
HU Y, JIANG L, WANG F, YU D. Jasmonate regulates the inducer of CBF expression-C-repeat binding factor/dre binding factor1 cascade and freezing tolerance in Arabidopsis[J]. The Plant Cell, 2013, 25: 2907-2924. DOI:10.1105/tpc.113.112631 |
(责任编辑 邹移光)
 2021, Vol. 48
2021, Vol. 48