文章信息
基金项目
- 山东省重点研发计划项目(2019GSF108035,2017CXGC1304);济南市农业应用技术创新计划项目(201913)
作者简介
- 李兆(1996—),女,在读硕士生,研究方向为天然产物化学,E-mail:lz961023@163.com.
通讯作者
- 崔莉(1983—),女,博士,副研究员,研究方向为药食两用资源开发,E-mail:cuili0617@163.com.
文章历史
- 收稿日期:2020-09-21
【研究意义】标准样品是一类有证书的实物标准参照物,具有均匀的一种或多种性能特征[1],在分析检测和质量控制中必不可少。标准样品在检测结果溯源、方法开发与验证、仪器核查和校准、检测人员技术评估及产品质量控制等方面均具有重要作用,保证相关工作的准确可靠。随着中医药的国际化,生产及科研工作中都急需与国际标准化组织(International Standards Organization,ISO)对接的标准样品,而我国研发的中药标准样品难以满足需求,严重制约了相关产品的质量控制水平,因而研制具备量值传递功能且可溯源的计量有证国家标准样品具有重要的现实意义,相关研究正在广泛开展[2-5]。
【前人研究进展】栝楼(Trichosanthes kirilowii Maxim.)始载于《神农本草经》,是葫芦科栝楼属多年生藤本植物[6-7],其果皮瓜蒌皮是我国药典规定的中药[8-9],味甘,性寒,归肺、胃经,具有清化热痰、理气宽胸作用,可用于治疗痰热咳嗽、胸闷胁痛等[10-11],属中医临床上的常用药物。腺苷是瓜蒌皮中重要的含氮化合物,具有镇静、扩张冠状动脉、镇痛、抗缺氧、降低胆固醇等作用,是瓜蒌提取物抗血栓的主要药效成分[12-16],1998年获得了美国食品药品监督管理局的批准,应用于心血管疾病的临床诊断与治疗,是治疗转复阵发性室上性心动过速的一线药物。腺苷是瓜蒌皮中与药理活性、临床疗效密切相关的化学成分,其含量对瓜蒌皮制剂的疗效和内在质量起关键作用,已有研究建立了腺苷的HPLC-MS/MS定量分析方法,可用于临床应用广泛的瓜蒌皮注射液的质量控制[17]。
【本研究切入点】目前药典中尚未有瓜蒌的成分检测指标,仅瓜蒌子的质量控制指标为栝楼仁三醇,有研究报道采用总皂苷、腺苷含量等作为瓜蒌药材质量的控制指标是可行的[18]。目前瓜蒌中腺苷的制备尚未见报道,市场上的腺苷纯品主要是对照品,没有具备溯源性的国家标准样品,纯度及质量不一,亟需研制具备均一性、稳定性且可溯源的标准样品。【拟解决的关键问题】本研究参照ISO Guide 35[19]和GB/T15000.3-2008[20],研制腺苷国家标准样品,以期为瓜蒌饮片等相关产品的分析检测及质量控制提供技术支撑。
1 材料与方法 1.1 试验材料成熟的瓜蒌采自济南市长清区,为栝楼果实,采后自然晾干。
主要试剂:GF254薄层板及柱层析用硅胶(青岛海洋化工有限公司)、色谱纯甲醇(美国天地有限公司),其他试剂为分析纯。
主要仪器设备:Waters高效液相色谱仪、二极管阵列检测器(E2695)、岛津热重分析仪(TG-40 DTA-40M)、岛津紫外可见分光光度计(UV-2550)、瓦里安核磁共振波谱仪(INOVA 600 MHz)、Agilent液质联用仪(6520 Q-TOF)、BUCHI旋转蒸发仪(R-3)、宁波新芝冷冻干燥仪(10N)。
1.2 试验方法1.2.1 腺苷粗提物的制备 将瓜蒌果皮剥离,自然晾干,50 ℃恒温干燥,粉碎,采用5倍量蒸馏水回流提取4次,合并提取液后减压浓缩,加入乙醇使含醇量达到70% 左右,静置72 h后过滤,上层清液减压浓缩,得浸膏150 g。
1.2.2 腺苷的分离纯化 浸膏经D101大孔树脂依次用不同浓度的乙醇(0、10%、30%、50%、70%、95%)洗脱,每种溶剂均洗脱5个柱体积,HPLC检测合并相同流分。其中,30% 乙醇洗脱的流分过Sephadex LH-20凝胶,经甲醇洗脱得腺苷,纯度为90%;经制备型HPLC分离,纯度大于99%。制备条件为甲醇∶水=15 ∶ 85(V/V),流速为:10 mL/min,检测波长258 nm。
1.2.3 纯度分析 分别采用HPLC、LC-MS、热重分析技术、薄层色谱法进行样品纯度分析:
高效液相色谱采用Nano-micro C18色谱柱(250 mm×4.6 mm,5 μm),流速1.0 mL/min,柱温25 ℃,检测波长258 nm,样品浓度0.35 mg/mL,进样量10 μL。等度分析流动相为乙腈/水(5 ∶ 95,V/V)、甲醇/水(15 ∶ 85,V/V);运行时间分别为25、30 min。梯度分析流动相为甲醇/水(V/V),梯度洗脱0~15 min,5%~40% 甲醇;15~30 min,40%~100% 甲醇。
热重分析初温为30 ℃,以10 ℃/min的速率升温至终温600 ℃;气体N2,流量100 mL/min。
LC-MS条件:色谱柱Navo-micro C18(250 mm ×4.6 mm,5 μm);流动相为甲醇/水,梯度洗脱0~30 min,10%~100%甲醇;流速1.0 mL/min;柱温30℃;运行时间30 min。MS条件:ESI电喷雾离子源,毛细管电压4.0 kV,载气为普氮,流速10 L/min,温度300 ℃,扫描范围为m/z=100~ 1 000。
薄层色谱法以二氯甲烷∶甲醇∶甲酸(16 ∶ 2.5 ∶ 0.6,V/V)和乙酸乙酯∶丙酮∶甲酸(1 ∶ 18 ∶ 1.2,V/V)作为展开剂,梯度点样20、40、60、80、100 μg,采用硫酸乙醇显色剂显色法、荧光法检测目标样品的纯度。
1.2.4 结构鉴定 制备的腺苷分别采用紫外光谱(UV)、红外光谱(IR)、质谱(MS)、核磁共振(NMR)等技术进行结构鉴定及确证。UV法测试溶剂为甲醇,扫描范围为200~400 nm;IR法采用KBr压片,扫描波数范围为400~4 000 cm-1;MS分析条件参数同1.2.3;NMR的氘代试剂为DMSO。
1.2.5 均匀性检验 在相对独立和洁净空间对制备的腺苷进行分装(4 mL棕色瓶),依据GB/T 15000.3-2008的要求,采取随机顺序重复测量的方法抽取样品10瓶,从每瓶中称取3份均为0.35 mg的样品分别溶于1.0 mL色谱纯的甲醇中,进行HPLC分析,以峰面积计算样品的纯度值,以方差分析法判断均匀性。
1.2.6 稳定性检验 样品分装后于2~8 ℃保存。选择2年实验周期,对制备的腺苷标准品取样进行HPLC分析,每份样品重复测定5次,统计分析采用t检验法[21]。
1.2.7 定值 按照GB/T15000.3-2008要求,由8家实验室协作试验进行定值[20],共随机选择24瓶样品,平均寄送至8家实验室,每份样品通过HPLC重复检测2次,读取峰面积经归一化法[21]计算纯度。
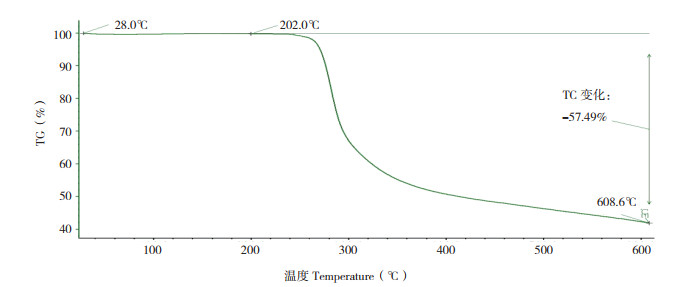
2 结果与分析 2.1 腺苷纯度分析制备的腺苷单体经HPLC法进行分析,结果除溶剂峰外,各检测波长下无其他杂峰出现。在258 nm下,扣除溶剂色谱峰后,对样品色谱峰进行面积归一法定量,等度分析条件下流动相为乙腈/水和甲醇/水时腺苷纯度分别为99.84% 和99.85%,梯度条件下腺苷纯度为99.86%。由热重分析结果(图 1)可见,TG曲线在28.0~202.0 ℃范围内为水平线,该温度范围内腺苷稳定性良好,达到235 ℃时开始分解。
|
| 图 1 腺苷的TG曲线 Fig. 1 TG curve of adenosine |
经薄层色谱分析,二氯甲烷∶甲醇∶甲酸(16 ∶ 2.5 ∶ 0.6,V/V)和乙酸乙酯∶丙酮∶甲酸(1 ∶ 18 ∶ 1.2,V/V)两种展开体系Rf均为0.45,符合化合物薄层测试的范围要求,经显色观察样品无明显杂质,判断样品纯度高。
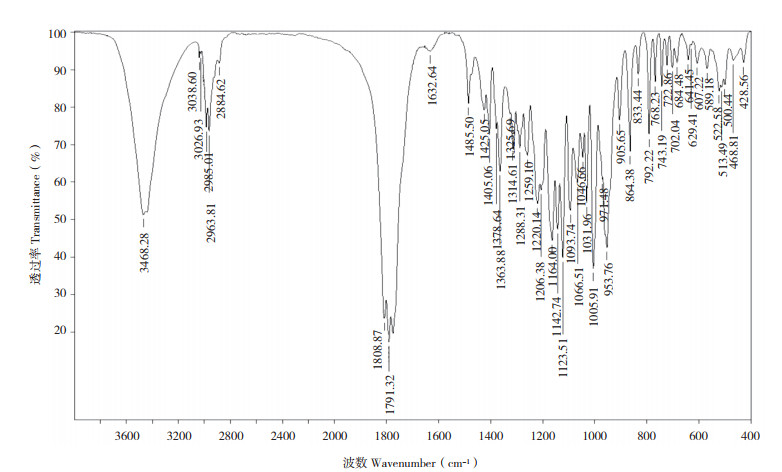
2.2 腺苷结构鉴定2.2.1 紫外及红外光谱分析 经紫外光谱分析得UVλmaxEtOH =258 nm,即最大吸收波长为258 nm。对所制备的腺苷样品进行红外光谱检测,结果见图 2,IR KBr max为3 334、3 167、3 135(νO-H),1 667、1 652、1 573、1 475、1 333、1 302、1 107、1 071、1 055、1 038 cm-1,与文献[22] 报道一致。
|
| 图 2 腺苷的红外光谱 Fig. 2 Infrared spectra of adenosine |
2.2.2 质谱分析 对所制备的腺苷样品进行质谱分析,检测正、负离子模式下的质谱结果,显示m/z 268.1 [M+H]+、290.1 [M+Na]+、266.1[M-H]-、302.1 [M+Cl]-、312.1 [M+COOH]-、533.2 [2M-H]-,即分子量为267.1。
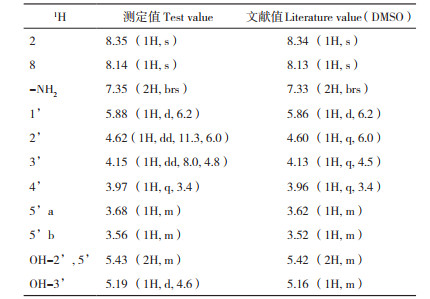
2.2.3 核磁共振分析 1H-NMR和13C-NMR结果见表 1、表 2。1H-NMR谱(表 1)中,化学位移8.35(1H, s)、8.14(1H, s)显示2位、8位质子信号,化学位移7.35(2H, brs)显示氨基质子信号。13C-NMR谱(表 2)中,156.6显示6位碳信号,152.9显示2位碳信号,88.4、86.4、73.9、71.1、62.2提示该化合物结构中有五碳糖。核磁数据与文献[22]结果一致,鉴定该化合物为腺苷。
2.3 腺苷均匀性检验
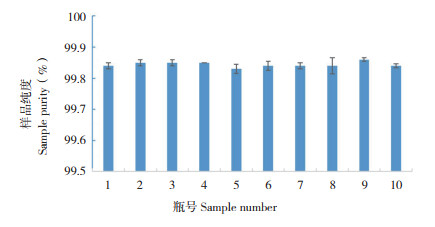
均匀性描述标准样品的空间分布特征,以F检验确定腺苷标准样品的均匀性数据是否符合正态分布,分析腺苷样品的瓶间均匀性和瓶内均匀性,结果见图 3、表 3。
|
| 图 3 腺苷样品均匀性检验结果 Fig. 3 Result of homogeneity test of adenosine samples |
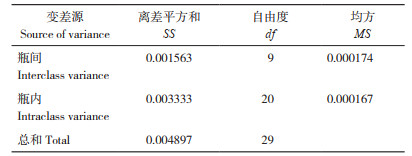
从均匀性试验方差分析结果(表 3)可见,υ1(组间)=9、υ2(组内)=20,经查表得F0.05(9,20)=2.94,由于F=MS间/MS内 =1.04<F0.05(9,20),因此本样品是均匀的。
2.4 腺苷稳定性检验从图 4可见,随着时间延长,24个月内腺苷样品检测值未见显著升高或降低,采用t检验进行统计分析,以直线为经验模型观察斜率是否有显著变化,进行稳定性变化的预测,结果显示斜率变化不显著,未观测到腺苷样品出现明显的不稳定性,即本试验的腺苷样品在两年内的稳定性良好。

|
| 图 4 腺苷样品稳定性检验结果 Fig. 4 Result of stability test of adenosine samples |
2.5 定值
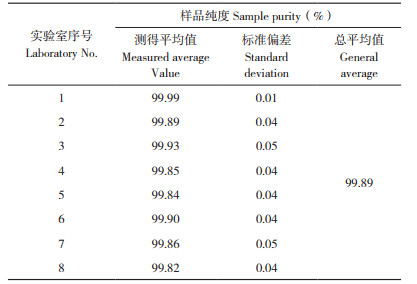
对8家协作定值实验室的检测结果进行分析,腺苷纯度的定值结果(表 4)经Grubbs(格拉布斯)检验法分析,结果呈正态分布,未见异常值。
根据GB/T 15000.3-2008的要求,定值结果由标准值与不确定度计算获得。依据协作定值实验室的腺苷HPLC检测结果得到标准值99.89%,腺苷的测量不确定度U合成由u定(标准值的不确定度)、u均(均匀性检验中取得的不确定度)和u稳(稳定性检验中取得的不确定度)组成,经计算得u稳 = 0.08%、u均 = 0.01%、u定 =0.09%,三部分不确定度的分量没有相关性,需要进行合成,在95% 置信区间,k=2条件下进行扩展,最终U合成的计算公式为:
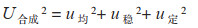
|
计算得到腺苷标准样品的最终不确定度U合成为0.18%。
3 讨论标准样品在生产质量控制中必不可少,具有高度均匀性、量值准确性和良好的稳定性,以其作为标准参照物,可以确保分析测试的质量,使测试结果具有计量学溯源性、准确性与合法性。作为实物标准,国家标准样品为科研生产、技术创新和法律法规的实施提供了有效支持,在保证不同国家/地区和不同时期测量结果的一致性和可比性、管理产品质量、保护环境、消除贸易壁垒、保障人民生活等方面发挥了积极作用[23]。
本研究研制中药天然产物标准样品有助于解决目前我国中药等天然产物提取、保健品及食品生产、化妆品开发等领域因标准样品缺乏而导致产品质量控制和检测难的问题,分析检测中采用标准样品能保证结果在国际贸易中的可比性、可溯源性,提升认可度。目前中药领域标准样品的发展仍较缓慢,标准样品的种类不多[24],尚未形成系统化和规模化的研制。随着中药越来越被国际认可,标准样品将有较大的需求和广阔的发展空间。
本研究建立的腺苷单体的制备方法具有成本低、操作简便、效率高的特点,可实现较大量从瓜蒌中分离制备出高纯度腺苷单体成分。对于有机化合物结构的鉴定,通常采用四大波谱,即紫外光谱、红外光谱、质谱、核磁共振确定[25],也可采用HPLC法,认为在同一分析条件下,同一保留时间的组分峰是同一化合物的可能性较大。本研究对所制备的腺苷标准样品进行了四大波谱分析,对其进行结构确认,符合国际通用技术标准,具有准确性。国际标准化组织ISO的标准物质委员会(REMCO)是目前国际上最权威、最具影响的国际组织,ISO Guide 35和中国合格评定国家认可委员会CNAS-GL29规定了标准物质定值的一般原则和统计方法[25],定值主要有单一方法测定、一级标准物质比较定值、多种有效方法和/或多个实验室测定3种方式,由6~8家实验室协作测试定值是国内较常用的方法,因此本研究采用此法定值的结果具有权威性。
4 结论本研究建立了一种从瓜蒌中分离制备腺苷单体的方法,按照ISO和国标的标样研制规程,研制了腺苷标准样品,经8家实验室协作定值,获得了标准值为99.89%、置信度95% 下不确定度为0.18% 的腺苷国家标准样品,均匀性符合标准,2~8 ℃条件下24个月内的长期稳定性良好,该标准样品已获得专家组验收,解决了腺苷国家标准样品缺乏的问题,为我国瓜蒌药材及相关制品的生产质量控制及分析检测提供了物质基础。
| [1] |
中国国家质量监督检验总局, 中国国家标准化管理委员会. GB/T15000. 2-94标准样品工作导则(2)标准样品常用术语及定义[S]. 北京: 中国标准出版社, 1994. China General Administration of Quality Supervision and Inspection, China National Standardization Management Committee. Directives for the work of reference materials—Part 2: Selected terms and definitions GB/T15000. 2-94[S]. Beijing: China Standard Press, 1994. |
| [2] |
杜宁, 周晓晶, 张婉, 周悦, 李津廷, 张经华. 我国天然产物标准样品研复制工作组织管理[J]. 现代科学仪器, 2010, 6(3): 140. DU N, ZHOU X J, ZHANG W, ZHOU Y, LI J Y, ZHANG J H. Management of development work for Chinese natural product reference materials[J]. Modern Scientific Instruments, 2010, 6(3): 140. |
| [3] |
马玉翠, 王尉, 吴翠, 徐靓, 杜宁, 巢志茂. 天然产物国家标准样品的研制过程、现状及展望[J]. 中国实验方剂学杂志, 2018, 24(24): 207-212. DOI:10.13422/j.cnki.syfjx.20182316.syfjx.20182316 MA Y C, WANG W, WU C, XU L, DU N, CHAO Z M. Preparation Process, Status and Prospect of China certified reference material from natural products[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(24): 207-212. DOI:10.13422/j.cnki.syfjx.20182316.syfjx.20182316 |
| [4] |
申诚, 陈涛, 王岱杰, 陈晨, 赵景阳, 陈基麟, 杨丽, 王硕, 李玉林. 獐牙菜醇苷国家天然产物标准样品的研制[J]. 中国中药杂志, 2020, 45(4): 955-960. DOI:10.19540/j.cnki.cjcmm.20191111.202.cjcmm.20191111.202 SHEN C, CHEN T, WANG D J, CHEN C, ZHAO J Y, CHEN J L, YANG L, WANG S, LI Y L. Research and development of certified reference material of swertioside[J]. China Journal of Chinese Materia Medica, 2020, 45(4): 955-960. DOI:10.19540/j.cnki.cjcmm.20191111.202.cjcmm.20191111.202 |
| [5] |
岑叶盛. 二氢丹参酮Ⅰ、丹参新酮标准样品的研制[D]. 杭州: 浙江理工大学, 2019. DOI: 10.27786/d.cnki.gzjlg.2019.000030. CEN Y S. Preparation of reference materials of DihydrotanshinoneⅠand Miltirone[D]. Hangzhou: Zhejiang Sci-Tech University, 2019. DOI: 10.27786/d.cnki.gzjlg.2019.000030. |
| [6] |
曹元宇. 神农本草经[M]. 上海: 上海科学技术出版社, 1987. CAO Y Y. Shennong's classic of materia medica[M]. Shanghai: Shanghai Science and Technology Press, 1987. |
| [7] |
刘金娜, 温春秀, 刘铭, 贾东升, 杨太新, 谢晓亮. 瓜蒌的化学成分和药理活性研究进展[J]. 中药材, 2013, 36(5): 843-848. DOI:10.3969/j.issn.1008-0805.2013.09.012 LIU J N, WEN C X, LIU M, JIA D S, YANG T X, XIE X L. Research progress on the chemical constituents and pharmacological activities of Trichosanthes kirilowii[J]. Journal of Chinese Medicinal Materials, 2013, 36(5): 843-848. DOI:10.3969/j.issn.1008-0805.2013.09.012 |
| [8] |
巢志茂, 刘静明, 王伏华, 刘岱, 杨立新. 五种瓜萎皮挥发性有机酸的分析[J]. 中国中药杂志, 1992, 17(11): 673-674. CAO Z M, LIU J M, WANG F H, LIU D, YANG L X. Analysis of the volatile organic acids in five kind of pericarpium Trichosanthes[J]. China Journal of Chinese Material Medical, 1992, 17(11): 673-674. |
| [9] |
巢志茂, 刘静明. 湖北栝楼果皮挥发油化学成分的研究[J]. 中国药学杂志, 1996, 31(3): 140-141. CAO Z M, LIU J M. Chemical constituents of essential oil from the pericarp of Trichosanthes hupehensis[J]. Chinese Pharmaceutical Journal, 1996, 31(3): 140-141. |
| [10] |
国家药典委员会. 中华人民共和国药典. 一部[S]. 北京: 中国医药卫生出版社, 2015: 112. State Pharmacopoeia Committee. Pharmacopoeia of the People 's Republic of China, Volume Ⅰ[S]. Beijing: China Medical and Health Publishing House, 2015: 112. |
| [11] |
何祥久, 邱峰, 姚新生. 栝楼属植物化学成分[J]. 国外医药: 植物药分册, 2002, 17(1): 11-13. DOI:10.7501/j.issn.1674-5515.2002.1.077 HE X J, QIU F, YAO X S. Chemical constituents of Trichosanthes[J]. World Notes on Plant Drug, 2002, 17(1): 11-13. DOI:10.7501/j.issn.1674-5515.2002.1.077 |
| [12] |
单红燕, 高兆慧, 伏瑶, 张宇, 赵启韬. 瓜蒌皮不同提取物干预急性心肌缺血的药效学研究[J]. 山东中医杂志, 2017, 36(5): 414-418. DOI:10.16295/j.cnki.0257-358x.2017.05.022 SHAN H Y, GAO Z H, FU Y, ZHANG Y, ZHAO Q T. Pharmacodynamic study on effect of different extracts of Trichosanthes pericarpium on acute myocardi[J]. Shandong Journal of Traditional Chinese Medicine, 2017, 36(5): 414-418. DOI:10.16295/j.cnki.0257-358x.2017.05.022 |
| [13] |
刘岱琳, 曲戈霞, 王乃利, 姚新生, 北中进. 瓜蒌的抗血小板聚集活性成分研究[J]. 中草药, 2004, 35(12): 1334-1336. DOI:10.7501/j.issn.0253-2670.2004.12.2004012640 LIU D L, QU G X, WANG N L, YAO X S, KITANAKA S. Antiplatelet aggregation constituents from Trichosanthes kirilowii[J]. Chinese Traditional and Herbal Drugs, 2004, 35(12): 1334-1336. DOI:10.7501/j.issn.0253-2670.2004.12.2004012640 |
| [14] |
ZHANG M, SU N, HUANG Q, ZHANG Q, WANG Y F, LI J L, YE M. Phosphorylation and antiaging activity of polysaccharide from Trichosanthes peel[J]. Journal of Food & Drug Analysis, 2017, 25(4): 976-983. DOI:10.1016/j.jfda.2016.12.013 |
| [15] |
邹纯才, 鄢海燕, 王莉丽, 卞莹莹. 瓜蒌提取物抗血栓药效成分群的筛选与验证[J]. 药学学报, 2019, 54(3): 502-509. DOI:10.16438/j.0513-4870.2018-0898 ZOU C C, YAN H Y, WANG L L, BIAN Y Y. Screening and validation of antithrombotic effective components group from Trichosanthes extract[J]. Acta Pharmaceutica Sinica, 2019, 54(3): 502-509. DOI:10.16438/j.0513-4870.2018-0898 |
| [16] |
LI A F, SUN A L, LIU R M, ZHANG Y Q, YU J P. Chemical constituents from the water-soluble fraction of the peels of Trichosanthis fructus[J]. Chinese Journal of Traditional Chinese Medicine, 2014, 29(11): 3420-3423. DOI:10.3724/SP.J.1009.2012.00115 |
| [17] |
王辉俊, 柯樱, 叶冠. HPLC-MS/MS法测定瓜蒌皮注射液中腺苷和唾液酸的含量[J]. 上海医药, 2018(17): 72-75. WANG J H, KE Y, YE G. Determination of the contents of adenosine and N-acetylneuraminic acid in Gualoupi injection by HPLC[J]. Shanghai Medical & Pharmaceutical Journal, 2018(17): 72-75. |
| [18] |
辛杰, 张荣超, 郭庆梅, 张永清. 种质差异对瓜蒌总皂苷和腺苷含量的影响[J]. 时珍国医国药, 2015, 26(9): 2236-2237. DOI:10.3969/j.issn.1008-0805.2015.09.073 XIN J, ZHANG R C, GUO Q M, ZHANG Y Q. Influence of germplasm difference on the contents of total Saponins and Adenosine of Trichosanthis[J]. Lishizhen Medicine and Materia Medica Research, 2015, 26(9): 2236-2237. DOI:10.3969/j.issn.1008-0805.2015.09.073 |
| [19] |
ISO. Reference materials-guidance for characterization and assessment of homogeneity and stability: ISO Guide 35[S/OL]. 2017. https://www.iso.org/standard/60281.html.
|
| [20] |
中国国家质量监督检验总局, 中国国家标准化管理委员会. 标准样品工作导则(3)标准样品定值的一般原则和统计方法(GB/T15000.3-2008)[S]. 北京: 中国标准出版社, 2008. China General Administration of Quality Supervision and Inspection, China National Standardization Management Committee. Directives for the work of reference materials(3)Reference materials General and statistical principles for certification(GB/T15000.3-2008)[S]. Beijing: China Standard Press, 2008. |
| [21] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T8170-2008数值修约与极限数值的表示和判定[S]. 北京: 中国标准出版社, 2008. China General Administration of Quality Supervision and Inspection, China National Standardization Management Committee. GB/T8170-2008 Rules of rounding off for numerical values & expression and judgement of limiting values[S]. Beijing: China Standard Press, 2008. |
| [22] |
孙晓业, 吴红华, 付爱珍, 张鹏. 瓜蒌的化学成分研究[J]. 药学学报, 2012(7): 922-925. SUN X Y, WU H H, FU A Z, ZHANG P. Chemical constituents of Trichosanthes kirilowii Maxim[J]. Acta Pharmaceutica Sinica, 2012(7): 922-925. |
| [23] |
张晓林, 陈虹. 国内外农药残留标准物质/标准样品现状分析[J]. 中国检验检测, 2019, 27(6): 58-61. DOI:10.16428/j.cnki.cn10-1469/tb.2019.06.021.cn10-1469/tb.2019.06.021 ZHANG X L, CHEN H. Analysis of the status of pesticide residue standard substances/standard samples at home and abroad[J]. China Inspection and Testing, 2019, 27(6): 58-61. DOI:10.16428/j.cnki.cn10-1469/tb.2019.06.021.cn10-1469/tb.2019.06.021 |
| [24] |
潘明飞, 杨晶莹, 李睿, 刘凯欣, 王硕. 药食同源食品金银花中绿原酸标准物质的研制与评价[J]. 中国食品学报, 2020, 20(4): 230-238. DOI:10.16429/j.1009-7848.2020.04.028 PAN M F, YANG J Y, LI R, LIU K X, WANG S. Development and evaluation of chlorogenic acid reference material in honeysuckle of medicinal and food homologous food[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(4): 230-238. DOI:10.16429/j.1009-7848.2020.04.028 |
| [25] |
朱红激. 浅谈药品标准物质/标准样品[J]. 化学试剂, 2017, 39(4): 379-384. DOI:10.13822/j.cnki.Hxsj.2017.04.010 ZHU H J. Brief introduction of pharmaceutical reference materials[J]. Hua Xue Shi Ji, 2017, 39(4): 379-384. DOI:10.13822/j.cnki.Hxsj.2017.04.010 |
 2021, Vol. 48
2021, Vol. 48