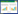文章信息
基金项目
- 国家重点研发计划项目(2017YFD0101904)
作者简介
- 刘开(1994—),女,在读硕士生,研究方向为蔬菜遗传育种与生物技术,E-mail:1603591859@qq.com.
通讯作者
- 曹必好(1970—),男,博士,教授,研究方向为蔬菜遗传育种与生物技术,E-mail:caobh01@scau.edu.cn.
文章历史
- 收稿日期:2020-12-24
2. 华南农业大学农学院, 广东 广州 510642
2. College of Agriculture, South China Agricultural University, Guangzhou 510642, China
【研究意义】茄子(Solanum melongena L.)是茄科茄属常见的蔬菜作物,起源于东南亚的热带地区,在我国南北各地广泛栽培,其根、茎、叶皆可入药,果实中富含蛋白质、脂肪、维生素、龙葵碱和多种微量元素,既可用作蔬食,又具有降血压、防治胃癌等功效[1],营养价值与药用价值极高。青枯病是茄子栽培中常见的细菌性土传病害之一,其致病因子是青枯雷尔氏菌(Ralstonia solanacearum),主要从根部侵入寄主植物的维管束部位并迅速扩散到地上部组织,对植株可造成毁灭性的破坏[2]。土温20 ℃左右时为茄子青枯病的发病高峰期,微酸性土壤、连作以及气温急剧上升等都会导致青枯病严重发生[3]。我国茄子青枯病发生较为普遍,发病时严重影响茄子的产量和品质,导致茄子大面积减产减收[3]。但茄子抗青枯病的分子机理十分复杂,涉及多种因子调控,迄今仍未研究清楚。因此,深入开展茄子抗青枯病的相关研究显得尤为重要。
【前人研究进展】植物WRKY转录因子是一种具有多功能调控作用的转录因子,最早是从甘薯〔Dioscorea esculenta(Lour.)Burkill〕的SPF1基因中被鉴定出来的,因参与调控甘薯中的糖信号转导过程而备受关注[4]。之后,陆续从野燕麦(Avena fatua L.)、欧芹〔Petroselinum crispum(Mill.)Hill〕和水稻(Oryza sativa L.)的基因中成功鉴定出相应的WRKY 基因,并详细阐明了其在植物生长发育、信号转导及其抗逆过程中发挥的重要作用[5-7]。近年来,关于WRKY转录因子响应生物胁迫及非生物胁迫相关过程的研究多有报道[8]。研究发现,小麦TaWRKY2 和陆地棉GhWRKY33 基因是响应干旱调节的关键基因,过表达TaWRKY2 和GhWRKY33 基因能够分别增强小麦和转基因拟南芥植株的抗旱性[9-10];决登伟等[11]发现,玉米ZmWRKY25-like 基因在响应盐胁迫和低温胁迫中上调表达;Sun等[12]认为,山葡萄VaWRKY33 基因在低温胁迫下诱导表达以增强植株的耐寒性。进一步研究发现,WRKY转录因子在调控植物抗病性方面起关键作用。周茜茜等[13]研究发现,苹果MdWRKY40 基因通过介导水杨酸(Salicylic acid,SA)信号途径正向调控苹果对轮纹病菌的抗性;龙琴等[14]认为,过表达CsWRKY61 能够激活与生物胁迫和信号转导相关的途径,增强柑橘对溃疡病的抗性;殷丽华等[15]研究发现,小豆VaWRKY33 基因能够响应豇豆单胞锈菌的诱导上调表达,并明显提高小豆锈病的抗性;在拟南芥抗病性研究中发现,拟南芥AtWRKY61 和AtWRKY70 基因分别正向调控芜菁皱叶病毒和丁香假单胞菌的抗性[16-17];王丹等[18]研究发现,VqWRKY53 通过促进SA和芪类物质的合成,可增强中国野生毛葡萄植株的抗病性。
【本研究切入点】目前已有研究在茄属植物欧白英(Solanum dulcamara)的基因组中克隆得到WRKY 基因,并对其相应的生物信息学功能进行了分析[19],但与茄子青枯病抗性相关的研究仍鲜见报道。【拟解决的关键问题】本研究通过克隆与茄子青枯病抗性相关的SmWRKY65 基因,对其进行生物信息学、亚细胞定位及时空表达模式分析,并以清水和pTRV2 空载为对照,构建pTRV2-SmWRKY65 载体,探究SmWRKY65 在茄子抗病植株(E-31)中沉默后对茄子青枯病的响应情况,以期为茄子青枯病抗病机理的相关研究提供理论基础,为茄子青枯病抗性品种的选育提供参考。
1 材料与方法 1.1 试验材料茄子抗病材料(S. melongena L. E-31,R)和感病材料(S. melongena L. E-32,S)由曹必好教授提供。青枯菌致病菌株从感病材料中分离得到,VIGS载体构建所需的烟草脆裂病毒载体pTRV-1 和pTRV-2 由华南地区园艺作物生物学与种质创制重点实验室保存,DH5α大肠杆菌转化菌株和GV3101转农杆菌菌株均购自生工生物科技有限公司。
RNA提取试剂盒Trizol购自北京华越洋生物科技有限公司,PCR反应试剂盒2×HiFiTaq PCR StarMix、快速DNA胶回收试剂盒StarPrep和快速质粒小提试剂盒StarPrep均为GenStar产品,反转录试剂盒HiScript®Ⅱ Q Select RT SuperMix for qPCR和实时荧光定量PCR试剂盒a SYBR Premix Ex Taq kit购自南京诺唯赞生物科技有限公司。
1.2 试验方法1.2.1 茄子不同组织部位总RNA的提取与cDNA的合成 在茄子幼苗三叶期时分别采集茄子根、茎、叶部位的样品,用锡箔纸包裹并迅速放入液氮中,每个样品3次重复并做好标记,之后采用Trizol试剂盒的方法分别提取茄子根、茎、叶的RNA,并采用HiScript®Ⅱ Q Select RT SuperMix for qPCR试剂盒进行逆转录反应合成cDNA,详细步骤参照说明书。cDNA合成PCR反应体系10 μL,反应程序为:25 ℃,10 min;50 ℃,30 min;85 ℃,5 min。
1.2.2 SmWRKY65 序列的获得与基因克隆 本课题组前期通过转录组测序得到WRKY65 基因序列(登录号:Sme2.5_00423.1_g00013.1)。利用Primer 5.0软件设计引物(SmWRKY65-F、SmWRKY65-R,表 1),以茄子叶片cDNA为模板通过PCR(10 μL体系)扩增得到SmWRKY65基因序列。PCR反应程序:94 ℃预变性2 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸50 s,32个循环;72 ℃延伸5 min。采用1%琼脂糖凝胶电泳检测PCR产物的特异性,将条带明亮、大小与预期一致的条带采用StarPrep快速DNA胶回收试剂盒进行纯化。
1.2.3 SmWRKY65 的生物信息分析 利用ExPASy ProtParam tool(http://www.expasy.org/tools/protparam.html)对SmWRKY65蛋白理化性质进行分析;使用ProtScale(http://ca.expasy.org/tools/protscale.html)和SOPM工具(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=np-sa_sopma.html)分别预测SmWRKY65蛋白亲/疏水性和二级结构类型;使用NCBI CD Search(https://www.ncbi.nlm.nih.gov/Struc-ture/cdd/wrpsb.cgi)和PredictProtein工具(http://www.predictprotein.org/)对SmWRKY65蛋白序列进行二级结构的结构域和结合位点预测;通过NCBI Blast在线比对工具,检索SmWRKY65 同源性基因,将相似性较高的同源性序列下载后,利用MEGA 7.0软件UPGMA法构建进化树。
1.2.4 PCR产物的连接与SmWRKY65质粒的提取 将上述1.2.2中的PCR产物连接pMD 19-T载体(pMD 19-T载体: Solution I : 回收产物=0.5 μL : 4.5 μL : 5 μL),之后转化大肠杆菌感受态DH5α,用pMD19-T通用引物检测阳性菌落,委托广州擎科生物技术有限公司进行测序,确定重组子。挑取重组子进行扩摇,采用StarPrep快速质粒小提试剂盒提取SmWRKY65质粒,具体步骤参照说明书。
1.2.5 SmWRKY65 的时空表达模式分析 利用Primer 5.0软件设计SmWRKY65 荧光定量引物(q-SmWRKY65-F、q-SmWRKY65-R,表 1),以茄子内参18S rRNA(18S rRNA-F、18S rRNA-R,表 1)为对照,采用a SYBR Premix Ex Taq Kit试剂盒对茄子根、茎、叶组织进行SmWRKY65 实时荧光定量(qRT-PCR)表达量的测定,详细步骤参照说明书。再分别以茄子抗病和感病植株为材料,在茄子苗3叶期接种青枯病菌以分析SmWRKY65 在茄子抗病和感病植株中的表达情况,并在接种后0、3、6、9 h 4个时间段分别采集抗病、感病植株叶片,以茄子内参18S rRNA(18S rRNA-F、18S rRNA-R,表 1)为对照,采用SmWRKY65 荧光定量引物(q-SmWRKY65-F、q-SmWRKY65-R,表 1)进行qRT-PCR表达量的测定,以分析SmWRKY65 在抗病和感病材料中的表达量差异。qRT-PCR程序为:95 ℃预变性2 min;95 ℃变性10 s、56 ℃退火20 s、72 ℃延伸35 s,35个循环。每个样品3次生物学重复,最后取平均值进行分析,基因的相对表达量应用2-ΔΔCt方法进行分析[20]。
1.2.6 构建亚细胞定位载体及转化洋葱 利用Primer 5.0软件设计SmWRKY65 亚细胞定位引物(SmWRKY65-GFP-EB-F、SmWRKY65-GFPEB-R,表 1),通过PCR反应克隆SmWRKY65亚细胞定位目的片段。使用EcoR I和BamH I酶对亚细胞定位载体pC018和目的片段进行双酶切并连接成重组质粒SmWRKY65-GFP,测序后将重组质粒转入农杆菌GV3101,转化洋葱内表皮组织,3 d后在显微镜下观察亚细胞定位结果。
1.2.7 VIGS载体的构建 通过在线工具(vigs. solgenomics.net)寻找特异性的VIGS载体区域,根据pTRV2 载体多克隆位点所包含的酶切位点,设计1对特异性引物(pTRV2-WRKY65-F、pTRV2-WRKY65-R,表 1),以茄子叶片cDNA为模板进行PCR反应获得长度为250 bp左右的特异性PCR产物,用双酶切(EcoR I和BamH I)法将产物片段连接到pTRV2 载体上,之后转入大肠杆菌DH5α,阳性单菌落进行PCR菌落筛选,送广州擎科生物科技有限公司测序,确定重组子。将阳性单菌落进行扩摇,提取重组质粒(pTRV2- SmWRKY65)后转入农杆菌GV3101用于侵染。
1.2.8 农杆菌侵染茄子幼苗 将抗病和感病茄子种子分别播种在含泥炭和珍珠岩的混合基质中,于25 ℃、16 h光照和8 h黑暗的培养室中进行培养。当茄子幼苗长至3~4片真叶时,吸取含有重组质粒(pTRV2-SmWRKY65)的阳性菌落扩摇后配制成侵染液,并将分离到的青枯菌采用伤根断根法对茄子幼苗进行侵染,青枯菌的分离与接种参照曹必好等[21]的方法,每组15株,3次重复,之后在16 ℃、60 % 的相对湿度下暗处理1 d,随后置于培养室中生长。3 d后采用断根法接种青枯病菌,观察其表型变化并拍照,2周后调查统计病情指数,方法参照Chen等[22],之后通过qRT-PCR法测定pTRV2-SmWRKY65 沉默植株表达量。
试验数据采用SPSS Statistics 17.0进行t 检验,采用Excel 2010制图。
2 结果与分析 2.1 SmWRKY65基因的克隆以茄子叶片cDNA为模板,通过PCR扩增得到948 bp的SmWRKY65 片段,经1%琼脂糖凝胶电泳,结果显示目的条带与预期结果一致(图 1),将目的条带切胶回收、纯化、测序。对SmWRKY65 测序序列与WRKY65 原始序列(登录号:Sme2.5_00423.1_g00013.1)在DNAMAN 8.0工具上进行比对,结果显示同源性为88.06%,表明在茄子中成功克隆了SmWRKY65(图 2)。

|
| 图 1 SmWRKY65电泳结果 Fig. 1 Electropherogram result of SmWRKY65 M:DNA Marker DL2000;1:SmWRKY65 电泳条带 M: DNA Marker DL2000; 1: SmWRKY65 electrophoresis band |

|
| 图 2 SmWRKY65序列比对结果 Fig. 2 Comparison result of SmWRKY65 sequences |
2.2 SmWRKY65蛋白的生物信息学分析
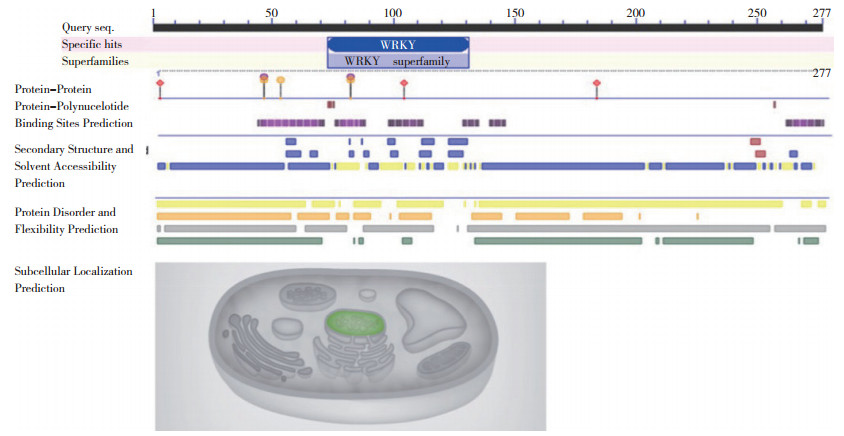
SmWRKY65蛋白理化性质分析结果显示,该基因开放阅读框为834个核苷酸序列,编码277个氨基酸残基,蛋白相对分子量大小为30 155.21 ku,等电点为5.51,分子式为C1304H1998N30O430S13,原子总量为4 115,预测该蛋白属于亲水性蛋白。对SmWRKY65蛋白的二级结构进行预测,结果显示,其主要由不规则盘绕结构(72.92%)、α-螺旋(12.27%)、延伸链(11.91%)和β-转角(2.89%)等结构元件组成(图 3)。预测该蛋白属于WRKY家族,在71~131区域具有1个含60个氨基酸的WRKY保守域,可以特异结合DNA序列(T)(T)TGAC(C/T),具有DNA结合位点3个、蛋白结合位点3个、核苷酸多肽链结合位点2个、大分子结合区域7个,主要多集中在WRKY家族的保守结构域内,预测该基因定位于细胞核中(图 4)。通过NCBI上Blast在线比对工具,将检索到的12条与SmWRKY65 同源性较高的基因进行多序列比对,使用MEGA 7.0.21软件构建进化树,结果表明,茄子SmWRKY65 与马铃薯、番茄的WRKY65同源性最高(图 5)。

|
| 图 3 SmWRKY65蛋白二级结构预测 Fig. 3 Secondary structure prediction of SmWRKY65 protein h:α-螺旋;e:延伸链;c:不规则盘绕结构;t:β-转角 h: α-helix; e: Extended strand; c: Random coil structure; t: β-turn |
|
| 图 4 SmWRKY65蛋白结合位点和亚细胞定位预测 Fig. 4 Binding sites and subcellular localization prediction of SmWRKY65 protein |

|
| 图 5 SmWRKY65同源进化树分析 Fig. 5 Analysis of homologous tree of SmWRKY65 |
2.3 SmWRKY65的时空表达模式和亚细胞定位分析
以茄子叶片cDNA为模板,通过PCR检测SmWRKY65 荧光定量引物的特异性,经1%琼脂糖凝胶电泳,结果显示在250 bp左右有1条明亮且符合预期的条带(图 6A),说明引物特异性较好,可用于后续试验。对茄子根、茎、叶不同组织部位表达量的分析结果显示,SmWRKY65 在茄子根组织部位中的表达量最高,在叶中的表达量次之,茎中最低(图 6B)。在茄子苗期接种青枯病菌后0、3、6、9 h 4个时间段分别采集抗病、感病植株叶片进行实时荧光定量分析,结果表明,SmWRKY65 在抗病和感病材料中的表达量均随接种时间延长逐渐升高,9 h时达到最高,且在抗病材料中的表达水平明显高于在感病材料中的表达水平(图 6C),说明SmWRKY65 响应茄子青枯病抗性相关基因的表达。
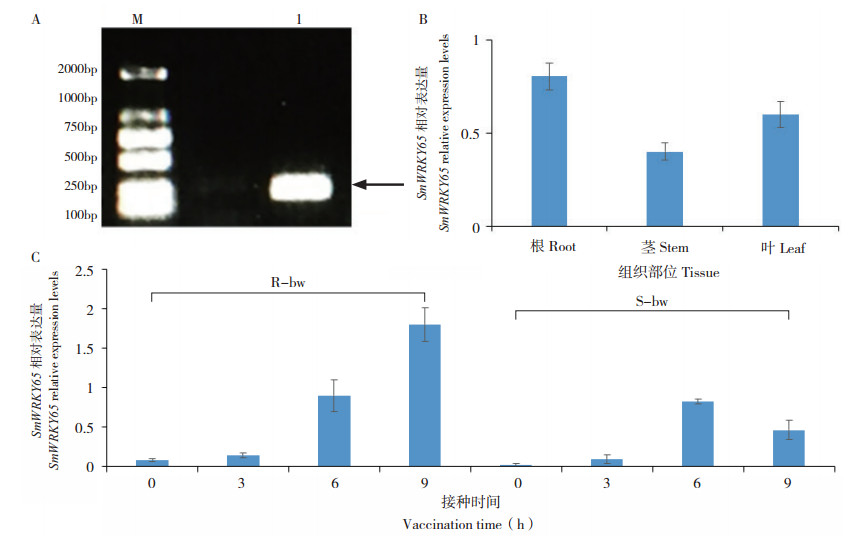
|
| 图 6 茄子不同组织及抗感病植株中SmWRKY65的表达分析 Fig. 6 SmWRKY65 expression of different tissues and disease-resistant and disease-susceptible plants of eggplant M:DNA Marker DL2000;1:SmWRKY65 荧光定量 PCR 产物;R:抗病型茄子(E-31);S:感病型茄子(E-32);bw:接种青枯病 M: DNA Marker DL2000; 1: Fluorescence quantitative PCR products of SmWRKY65; R: Disease-resistant eggplants(E-31); S: Disease-susceptible eggplants; bw: Bacterial wilt inoculation |
使用EcoR I和BamH I酶对亚细胞定位载体pC018和亚细胞定位引物成功克隆出的PCR片段进行双酶切,并连接成大小为831 bp的重组质粒SmWRKY65-GFP(图 7A),将重组质粒转化农杆菌后转化洋葱表皮细胞,在共聚焦显微镜下观察到SmWRKY65 定位在细胞核中表达(图 7B),这与预测结果一致。
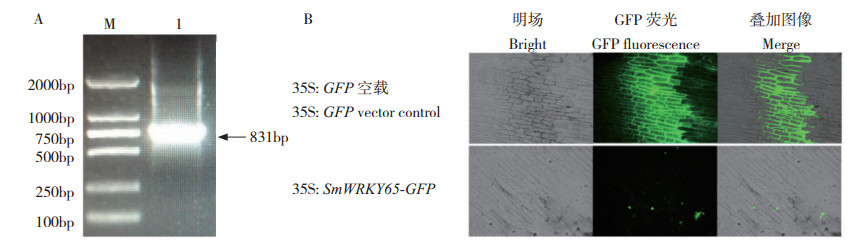
|
| 图 7 SmWRKY65亚细胞定位分析 Fig. 7 Subcellular localization analysis of SmWRKY65 M:DNA Marker DL2000;1:SmWRKY65-GFP 电泳条带 M: DNA Marker DL2000; 1: SmWRKY65-GFP electrophoretic bands |
2.4 SmWRKY6 沉默在抗病茄子中响应青枯病的情况
2.4.1 pTRV2-SmWRKY65 载体构建结果 以茄子叶片为材料提取RNA并通过逆转录反应合成cDNA,再以cDNA为模板,利用构建VIGS载体所设计的特异性引物进行PCR扩增,1%琼脂糖凝胶电泳显示,获得长度为242 bp的PCR产物(图 8A),将产物片段和pTRV2载体同时用EcoR I和BamH I进行双酶切后成功将SmWRKY65 连接到pTRV2 载体上获得重组质粒,经测序保证连接片段和读码方向正确后转入农杆菌GV3101。从阳性菌落检测结果来看,与pTRV2(图 8B1)空载相比,pTRV2-SmWRKY65(图 8B2)载体构建成功。
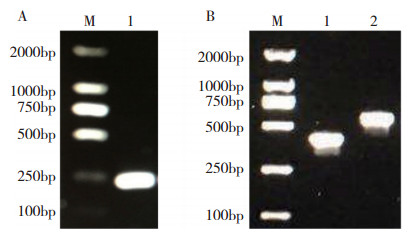
|
| 图 8 pTRV2-SmWRKY65载体构建 Fig. 8 pTRV2-SmWRKY65 vector construction M:DNA Marker DL2000;A1:SmWRKY65 特异性片段;B1:pTRV2 空载;B2:pTRV2-SmWRKY65 M: DNA Marker DL2000; A1: SmWRKY65 specific fragment; B1: pTRV2 control vector; B2: pTRV2-SmWRKY65 vector |
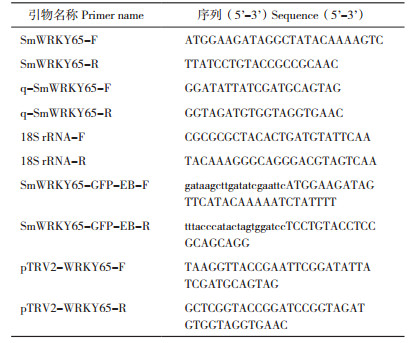
2.4.2 青枯病菌接种VIGS沉默植株 为了验证pTRV2-WRKY65 沉默植株对茄子青枯病的响应情况,在3~4片真叶时,对茄子抗病植株接种青枯病病原菌。接种7 d后观察到接种清水的叶片均没有表现出明显的萎蔫症状,接种pTRV2 空载的植株仅有1片叶片出现萎蔫,而接种pTRV2- WRKY65 的15株植株几乎全部表现出萎蔫症状;接种2周后,对pTRV2-WRKY65 植株进行病情指数调查,结果(表 2)表明,SmWRKY65 基因被沉默后影响了抗病材料对青枯病的抵御能力,即表现为感病症状。pTRV2-SmWRKY65 实时荧光定量检测结果(图 9)显示,与清水和pTRV2 空载相比,pTRV2-SmWRKY65 表达量明显下降。

|
| 图 9 VIGS沉默植株的表型(A)及qRT-PCR分析(B) Fig. 9 Phenotype(A)and qRT-PCR analysis(B)of VIGS silent plants * 表示差异显著 * represents significant difference |
3 讨论
茄子是我国南北各地广泛栽培的夏秋季重要蔬菜之一,在我国的栽培历史悠久,种植面积大,具有较高的营养价值和经济价值。但茄子易受青枯病侵袭,尤其在我国南方地区,其病原菌适应性强、分布广泛、繁殖速度较快,常规方法难以有效防治,而抗病育种可以有效防御病菌的危害,能较大幅度提高茄子的产量和品质[2, 23]。近年来,研究人员在提高茄子青枯病抗性及抗病品种选育方面作了较多努力。邵欣欣[24]在茄子青枯病抗性研究中发现,ERF转录因子参与调控茄子抗青枯病的信号途径;肖熙鸥等[25]研究认为,SA信号途径中MAPK6、MKK2、NPR1、PAD4等基因能够正向调控茄子青枯病的抗性;李威等[26]研究发现,1.5~2.0 mmol/L的硅浓度处理可有效提高快圆茄青枯病的抗性;Qiu等[27]认为,过表达SmMYB44 可诱导茄子中亚精胺相关基因(SmSPDS)的表达,促进亚精胺的合成与积累,从而增加对茄子青枯病的抗性。此外,广州市农业科学研究院经过多年研究选育出的翡翠绿2号青茄新品种在大田抗病性鉴定中表现为中抗青枯病[28],与广东省农业科学院植物保护研究所联合选育出的紫荣6号和玫瑰紫花茄均为抗青枯病的优质茄子新品种[29-30]。
研究表明,在生物胁迫下,植物体内会通过信号传导途径和防御反应作出应激防卫,而转录因子在这一系列反应中起关键作用[31]。近年来有关WRKY转录因子在植株抗病性上的研究成为一个热门话题[32]。已有研究报道,WRKY转录因子涉及调控与青枯病抗性相关的信号转导过程。王鹏飞等[33]研究发现,野生花生AdWRKY37 基因在受到青枯病菌液胁迫诱导后表达量明显升高,并推测该基因可能通过介导水杨酸(Salicylic acid,SA)和茉莉酸(Jasmonic acid,JA)途径参与青枯病抗病相关过程的调控;Dang等[34]认为,CaWRKY27转录因子通过调节SA、JA和内皮素(Endothelin,ET)介导的信号通路,可增强烟草对青枯菌的抗性;Liu等[35]发现,在烟草中过表达NtWRKY50 能够促进SA合成,从而增强植株对青枯病的抗性;Dang等[36]在辣椒抗病育种的研究中发现,CaWRKY41转录因子能够提高辣椒对青枯菌的抗性。然而,有关WRKY转录因子在茄子青枯病抗性中的相关研究还鲜见报道。本研究以茄子叶片cDNA为模板成功克隆了SmWRKY65 基因,与茄子数据库中原始WRKY65 序列比对同源性为88.06%,序列差异性的产生可能与PCR扩增过程中单核苷酸碱基变异及引物二聚体的形成有关。实时荧光定量分析结果表明,SmWRKY65 在茄子抗病和感病植株中均响应青枯病的诱导,其表达量在接种青枯病菌后0、3、6、9 h 4个时间点不断升高,且SmWRKY65 在茄子抗病材料中的表达水平明显高于感病材料,说明SmWRKY65 可能涉及茄子青枯病抗病的调节过程。在抗病茄子(E-31)植株中接种青枯菌的分析结果显示,与清水和pTRV2 空载相比,SmWRKY65 沉默植株表现出明显的萎蔫、易感症状,且qT-PCR分析表明SmWRKY65 在茄子中的表达量较清水和pTRV2 空载明显降低,这表明SmWRKY65 沉默后可能抑制了茄子青枯病抗病信号途径中相关基因的表达,从而降低了茄子植株对青枯病原菌的抗性。
4 结论本研究成功克隆了SmWRKY65 基因,与茄子数据库中原始WRKY65 序列的同源性为88.06%,该基因开放阅读框为834个核苷酸序列,编码277个氨基酸残基,在71~131区域包含1个含60个氨基酸的WRKY保守域,定位于细胞核中,与马铃薯、番茄WRKY65 的同源性最高。时空表达分析发现,SmWRKY65 在茄子根组织中的表达量最高,叶中次之,茎中最低。实时荧光定量PCR分析发现,SmWRKY65 在茄子抗病和感病材料中均响应青枯病菌的诱导上调表达,且在抗病材料中的表达水平明显高于感病材料;VIGS结果表明,接种pTRV2-SmWRKY65 植株的叶片表现出明显的萎蔫症状,结合qRT-PCR分析发现,pTRV2-SmWRKY65 表达量较对照明显下降,表明SmWRKY65 沉默后茄子抗青枯病的能力下降,说明SmWRKY65 可能涉及茄子青枯病抗病相关过程的调控。
| [1] |
汪文兴. 茄子的营养价值与设施高产高效栽培技术[J]. 现代园艺, 2014(6): 38. DOI:10.14051/j.cnki.xdyy.2014.06.123 WANG W X. Nutritional value of eggplant and high-yield and highefficiency cultivation technologies in facility[J]. Xiandai Horticulture, 2014(6): 38. DOI:10.14051/j.cnki.xdyy.2014.06.123 |
| [2] |
佘小漫, 何自福. 作物青枯病研究进展[J]. 广东农业科学, 2020, 47(12): 82-89. DOI:10.16768/j.issn.1004-874X.2020.12.009 SHE X M, HE Z F. Advances in studies on crop bacterial wilt caused by Ralstonia solanacearum[J]. Guangdong Agricultural Sciences, 2020, 47(12): 82-89. DOI:10.16768/j.issn.1004-874X.2020.12.009 |
| [3] |
柴海燕. 茄子青枯病的发病症状及防治措施[J]. 上海蔬菜, 2018(3): 62, 68. CAI H Y. Symptoms and prevention measures of bacterial wilt of eggplant[J]. Shanghai Vegetables, 2018(3): 62, 68. |
| [4] |
ISHIGURO S, NAKAMURA K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recongnizes SP8 sequences in the 5'-upstream regions of genes coding for sporamin and β-amylase from sweet potato[J]. Molecular and General Genetics, 1994, 244(6): 563-571. DOI:10.1007/BF00282746 |
| [5] |
RUSHTON P J, MACDONALD H, HUTTLY A K, LAZARUS C M, HOOLEY R. Members of a new family of DNA-binding proteins bind to a conserved cis-element in the promoters of α-Amy2 genes[J]. Plant Molecular Biology, 1995, 29(4): 691-702. DOI:10.1007/BF00041160 |
| [6] |
RUSHTON P J, TORRES J T, PARNISKE M, WERNERT P, HAHLBROCK K, SOMSSICH I E. Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes[J]. The EMBO Journal, 1996, 15(20): 5690-5700. DOI:10.1002/j.1460-2075.1996.tb00953.x |
| [7] |
KIM C Y, LEE S H, PARK H C, BAE C G, CHEONG Y H, CHOI Y J, HAN C, LEE S Y, LIM C O, CHO M J. Identification of rice blast fungal elicitor-responsive genes by differential display analysis[J]. Molecular Plant-microbe Interactions: MPMI, 2000, 13(4): 470-474. DOI:10.1094/MPMI.2000.13.4.470 |
| [8] |
任永娟, 王东姣, 苏亚春, 王玲, 张旭, 苏炜华, 阙友雄. 植物WRKY转录因子: 结构、分类、进化和功能[J]. 农业生物技术学报, 2021, 29(1): 105-124. DOI:10.3969/j.issn.1674-7968.2021.01.011 REN Y J, WANG D J, SU Y C, WANG L, ZHANG X, SU W H, QUE Y X. Structure, classification, evolution and function of plant WRKY transcription factors[J]. Journal of Agricultural Biotechnology, 2021, 29(1): 105-124. DOI:10.3969/j.issn.1674-7968.2021.01.011 |
| [9] |
GAO H M, WANG Y F, XU P, ZHANG Z B. Overexpression of a WRKY transcription factor TaWRKY2 enhances drought stress tolerance in transgenic wheat[J]. Frontiers in Plant Science, 2018, 9: 997. DOI:10.3389/fpls.2018.00997 |
| [10] |
魏鑫, 王寒涛, 魏恒玲, 付小康, 马亮, 芦建华, 王省芬, 喻树迅. 陆地棉GhWRKY33的克隆及抗旱功能分析[J]. 中国农业科学, 2020, 53(22): 4537-4549. DOI:10.3864/j.issn.0578-1752.2020.22.002 WEI X, WANG H T, WEI H L, FU X K, MA L, LU J H, WANG X F, YU S X. Cloning and drought resistance analysis of GhWRKY33 in upland cotton[J]. Scientia Agricultura Sinica, 2020, 53(22): 4537-4549. DOI:10.3864/j.issn.0578-1752.2020.22.002 |
| [11] |
决登伟, 桑雪莲, 舒波, 刘丽琴, 王一承, 石胜友. 玉米WRKY转录因子非生物胁迫的表达分析[J]. 广东农业科学, 2017, 44(1): 15-22. DOI:10.16768/j.issn.1004-874X.2017.01.003 JUE D W, SANG X L, SHU B, LIU L Q, WANG Y C, SHI S Y. Expression analysis of maize WRKY transcription factor genes under abiotic stress[J]. Guangdong Agricultural Sciences, 2017, 44(1): 15-22. DOI:10.16768/j.issn.1004-874X.2017.01.003 |
| [12] |
SUN X M, ZHANG L L, WONG D C J, WANG Y, ZHU Z F, XU G Z, WANG Q F, LI S H, LIANG Z C, XIN H P. The ethylene response factor VaERF092 f rom A mur g rape r egulates t he t ranscription f actor VaWRKY33, improving cold tolerance[J]. The Plant Journal, 2019, 99(5): 988-1002. DOI:10.1111/tpj.14378 |
| [13] |
周茜茜, 邱化荣, 何晓文, 王宪璞, 刘秀霞, 李保华, 吴树敬, 陈学森. MdWR KY4 0介导提高苹果与拟南芥对轮纹病菌的免疫抗性[J]. 中国农业科学, 2018, 51(21): 4052-4064. DOI:10.3864/j.issn.0578-1752.2018.21.005 ZHOU Q Q, QIU H R, HE X W, WANG X P, LIU X X, LI B H, WU S J, CHEN X S. MdWRKY40 mediated improvement of the immune resistance of apple and Arabidopsis thaliana to Botryosphaeria dothidea, Zhongguo Nongye Kexue[J]. Scientia Agricultura Sinica, 2018, 51(21): 4052-4064. DOI:10.3864/j.issn.0578-1752.2018.21.005 |
| [14] |
龙琴, 杜美霞, 龙俊宏, 何永睿, 邹修平, 陈善春. 转录因子CsWRKY61对柑橘溃疡病抗性的影响[J]. 中国农业科学, 2020, 53(8): 1556-1571. DOI:10.3864/j.issn.0578-1752.2020.08.006 LONG Q, DU M X, LONG J H, HE Y R, ZOU X P, CHEN S C. Effect of transcription factor CsWRKY61 on citrus bacterial canker resistance[J]. Scientia Agricultura Sinica, 2020, 53(8): 1556-1571. DOI:10.3864/j.issn.0578-1752.2020.08.006 |
| [15] |
殷丽华, 杨阳, 柯希望, 崔素萍, 张金鹏, 左豫虎. 小豆VaWRKY33基因克隆及其响应锈菌侵染的表达分析[J]. 分子植物育种, 2020, 18(22): 7301-7308. DOI:10.13271/j.mpb.018.007301 YIN L H, YANG Y, KE X W, CUI S P, ZHANG J P, ZUO Y H. Cloning of VaWRKY33 gene from adzuki bean and expression analysis in response to adzuki bean rust infection[J]. Molecular Plant Breeding, 2020, 18(22): 7301-7308. DOI:10.13271/j.mpb.018.007301 |
| [16] |
GAO R M, LI U P, YONG Y H, WONG S M. Genome-wide transcriptomic analysis reveals correlation between higher WRKY61 expression and reduced symptom severity in Turnip crinkle virus infected Arabidopsis thaliana[J]. Scientific Reports, 2016, 6(1): 1821-1831. DOI:10.1038/srep24604 |
| [17] |
JIANG C H, HUANG Z Y, XIE P, GU C, LI K, WANG D C, YU Y Y, FAN Z H, WANG C J, WANG Y P, GUO Y H, GUO J H. Transcription factors WRKY70 and WRKY11 served as regulators in rhizobacterium Bacillus cereus AR156-induced sy stemic resistance to Pseudomonas syringae pv. tomato DC30 0 0 in Arabidopsis[J]. Journal of Experimental Botany, 2016, 67(1): 157-174. DOI:10.1093/jxb/erv445 |
| [18] |
王丹, 姜长岳, 刘婉迪, 王跃进. 中国野生毛葡萄VqWRKY53正向调控植物抗病性的研究//中国园艺学会. 中国园艺学会2019年学术年会暨成立90周年纪念大会论文摘要集[C]. 北京: 中国园艺学会, 2019: 39. WANG D, JIANG C Y, LIU W D, WANG Y J. Research on the VqWRKY53 of Chinese wild grape up-regulated the plant disease resistance//Chinese Horticultural Society. Chinese Horticultural Society 2019 Academic Annual Meeting and 90th Anniversary Commemorative Conference Paper Abstract Collection, Chinese Horticultural Society Conference Paper Collection[C]. Beijng: Chinese Horticultural Society, 2019: 39. |
| [19] |
HUANG T, DUMAN J G. Cloning and characterization of a thermal hysteresis(antifreeze)protein with DNA-binding activity from winter bittersweet nightshade, Solanum dulcamara[J]. Plant Molecular Biology, 2002, 48(4): 339-350. DOI:10.1023/A:1014062714786 |
| [20] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [21] |
曹必好, 雷建军, 陈国菊, 陈清华, 肖熙鸥. 茄子抗病导入系的抗青枯病性及GISH鉴定[J]. 吉林蔬菜, 2010(4): 25-27. CAO B H, LEI J J, CHEN G J, CHEN Q H, XIAO X O. Identification of bacterial wilt-resistance and GISH in eggplant introgression line[J]. Jilin Vegetable, 2010(4): 25-27. |
| [22] |
CHEN N, WU S H, FU J L, CAO B H, LEI J J, CHEN C M, JIANG J. Overexpression of the eggplant(Solanum melongena)NAC family transcription factor SmNAC suppresses resistance to bacterial wilt[J]. Scientifi c Reports, 2016, 6(1): 1833-1866. |
| [23] |
刘丹, 崔彦玲, 潜宗伟. 茄子种业现状及遗传育种研究进展[J]. 北方园艺, 2019(1): 165-170. DOI:10.11937/bfyy.20181300 LIU D, CUI Y L, QIAN Z W. Research advances in the seed industry and breeding of eggplan[J]. Northern Horticulture, 2019(1): 165-170. DOI:10.11937/bfyy.20181300 |
| [24] |
邵欣欣. 茄子ERF转录因子表达分析及参与抗青枯病的初步研究[D]. 广州: 暨南大学, 2016. SHAO X X. Expression analysis of eggplant ERF transcription factors and initial study on adjust to resistance to bacterial wilt[D]. Guangzhou: Jinan University, 2016. |
| [25] |
肖熙鸥, 蒋晶, 陈娜, 雷建军, 吕玲玲, 曹必好. 茄子调控抗青枯病反应信号基因的筛选和鉴定[J]. 园艺学报, 2016, 43(7): 1295-1304. DOI:10.16420/j.issn.0513-353x.2015-0652 XIAO X O, JIANG J, CHEN N, LEI J J, Lü L L, CAO B H. Identification of key signal gene involved in eggplant bacterial wiltresistance[J]. Acta Horticulturae Sinica, 2016, 43(7): 1295-1304. DOI:10.16420/j.issn.0513-353x.2015-0652 |
| [26] |
李威, 肖熙鸥, 李可, 吕玲玲. 适宜浓度的硅可提高茄子青枯病抗性和抗氧化酶活性[J]. 热带作物学报, 2018, 39(8): 1540-1547. DOI:10.3969/j.issn.1000-2561.2018.08.011 LI W, XIAO X, LI K, LU L L. Silicon could enhance the resistance to bacterial wilt and increase the antioxidant enzymes activity[J]. Chinese Journal of Tropical Crops, 2018, 39(8): 1540-1547. DOI:10.3969/j.issn.1000-2561.2018.08.011 |
| [27] |
QIU Z K, YAN S S, XIA B, JIANG J, YU B W, LEI J J, CHEN C M, CHEN L, YANG Y, WANG Y Q, TIAN S B, CAO B H. The eggplant transcription factor MYB44 enhances resistance to bacterial wilt by activating the expression of spermidine synthase[J]. Journal of Experimental Botany, 2019, 70(19): 5343-5354. DOI:10.1093/jxb/erz259 |
| [28] |
曹翠文, 林鉴荣, 李莲芳. 优质茄子新品种翡翠绿2号的选育[J]. 蔬菜, 2020(2): 76-79. CAO C W, LIN J R, LI L F. Breeding of a new eggplant cultivar 'Feicuilü No.2[J]. Vegetables, 2020(2): 76-79. |
| [29] |
李莲芳, 林鉴荣, 曹翠文, 夏秀娴, 何自福. 优质抗青枯病茄子新品种紫荣6号的选育[J]. 中国蔬菜, 2011(10): 89-91. LI L F, LIN J R, CAO C W, XIA X X, HE Z F. A new eggplant F1 hybrid resistant to bacterial wilt disease-'Zirong No.6'[J]. China Vegetables, 2011(10): 89-91. |
| [30] |
林鉴荣, 曹翠文, 李莲芳, 何自福, 郭爽, 夏秀娴. 优质茄子新品种玫瑰紫花茄的选育[J]. 中国蔬菜, 2015(11): 72-74. LIN J R, CAO C W, LI L F, HE Z F, GUO S, XIA X X. A new excellent eggplant hybrid variety-'Meiguizihuaqie'[J]. China Vegetables, 2015(11): 72-74. |
| [31] |
马丽娜, 张雄, 窦道龙, 柴春月. 本氏烟NbWRKY40亚家族转录因子抗病相关功能研究[J]. 植物病理学报, 2016, 46(6): 791-802. DOI:10.13926/j.cnki.apps.2016.06.009 MA L N, ZHANG X, DOU D L, CHAI C Y. Functional analysis of NbWRKY40 transcription factors of Nicotiana bentham iana[J]. Acta Phytopathologica Sinica, 2016, 46(6): 791-802. DOI:10.13926/j.cnki.apps.2016.06.009 |
| [32] |
禹阳, 贾赵东, 马佩勇, 郭小丁, 谢一芝, 边小峰. WRKY转录因子在植物抗病反应中的功能研究进展[J]. 分子植物育种, 2018, 16(21): 7009-7020. DOI:10.13271/j.mpb.016.007009.j.mpb.016.007009 YU Y, JIA Z D, MA P Y, GUO X D, XIE Y Z, BIAN X F. Research progress on the role of WRKY transcription factors in plant defense[J]. Molecular Plant Breeding, 2018, 16(21): 7009-7020. DOI:10.13271/j.mpb.016.007009.j.mpb.016.007009 |
| [33] |
王鹏飞, 王月华, 胡子滢, 赵传志, 陈万钧, 王咏梅. 野生花生AdWRKY37 基因的克隆及表达分析[J]. 山东农业科学, 2017, 49(6): 1-6. DOI:10.14083/j.issn.1001-4942.2017.06.001.j.issn.1001-4942.2017.06.001 WANG P F, WANG Y H, HU Z Y, ZHAO C Z, CHEN W J, WANG Y M. Clone and expression analysis of wild peanut gene AdWRKY37[J]. Shandong Agricultural Sciences, 2017, 49(6): 1-6. DOI:10.14083/j.issn.1001-4942.2017.06.001.j.issn.1001-4942.2017.06.001 |
| [34] |
DANG F F, WANG Y, SHE J J, LEI Y F, LIU Z Q, EULGEM T, LAI Y, LIN J, YU L, LEI D, GUAN D Y, LI X, YUAN Q, HE S L. Overexpression of CaWRKY27, a subgroup Ⅱe WRKY transcription factor of Capsicum annuum, positively regulates tobacco resistance to Ralstonia solanacearum infection[J]. Physiologia Plantarum, 2014, 150(3): 397-411. DOI:10.1111/ppl.12093 |
| [35] |
LIU Q P, LIU Y, TANG Y M, CHEN J N, DING W. Overexpression of NtWRKY50 increases resistance to Ralstonia solanacearum and alters salicylic acid and jasmonic acid production in tobacco[J]. Frontiers in Plant Science, 2017(8): 1710. DOI:10.3389/fpls.2017.01710 |
| [36] |
DANG F F, LIU J H, CHEN Y P, LI G X, GUAN D Y, ZHENG S J, HE S L. A feedback loop between CaWRKY41 and H2O2 coordinates pepper's response to Ralstonia solanacearum and excess cadmium[J]. Journal of Experimental Botany, 2019, 70(5): 1581-1595. DOI:10.1093/jxb/erz006 |
 2021, Vol. 48
2021, Vol. 48