文章信息
基金项目
- 广东省现代农业产业技术体系创新团队项目(2020KJ112);广东省烟草科技计划项目(201701,201908)
作者简介
- 沈会芳(1973—),女,硕士,研究员,研究方向为特色作物病虫害及其防控,E-mail:951781658@qq.com.
通讯作者
- 林壁润(1963—),男,博士,研究员,研究方向为特色作物病虫害及其防控,E-mail:linbr@126.com.
文章历史
- 收稿日期:2021-03-13
2. 南雄市植物保护站, 广东 南雄 512400;
3. 广东省烟草南雄科学研究所,广东 南雄 512400
2. Plant Protection Station of Nanxiong City, Nanxiong 512400, China;
3. Nanxiong Tobacco Research Institute of Guangdong, Nanxiong 512400, China
【研究意义】广东省南雄市是重要的北运辣椒生产基地,辣椒种植在农业产业体系中占重要地位。但连年的种植,加之广东特有的高温多雨天气, 使辣椒病害特别是炭疽病频繁发生。炭疽病多发生在辣椒采收前,主要为害果实,严重降低辣椒品质和市场价值。一般年份南雄辣椒平均果实发病率达15%~30%,重病地块可达50% 以上,炭疽病成为影响当地辣椒产业的重要因素。开展辣椒炭疽病的生物学特性研究,可为病害防治提供技术支撑。
【前人研究进展】引起辣椒炭疽病的病原菌有20种以上[1-3]。我国辣椒炭疽病主要由3种病原菌引起,即胶孢炭疽菌(Colletotrichum gloeosporioides)、黑色炭疽菌(C.nigrum)和辣椒炭疽菌(C.capsici)[4-5]。2012年湖南省芷江县线果型辣椒品种红秀2003果实上发生一种新炭疽病,病原菌鉴定为尖孢炭疽菌(C.acutatum)[6],后又相继在四川[7]、江西[8]、山东[9]、陕西[10]、贵州[11]和天津[12]等省市发现尖孢炭疽菌为害辣椒。2020年对来自广东南雄的辣椒炭疽病样本进行病原菌分离,通过致病性测定、形态观察和ITS序列分析,最终鉴定为尖孢炭疽菌。近几年,尖孢炭疽菌的为害逐年加重,农业防治主要以抗性品种为主,Pereira等[13]鉴定了包含1年生辣椒(Capsicum annuum)、中国辣椒(C. chinense)、下垂辣椒(C. baccatum)、灌木状辣椒(C.frutescens)等4个种在内的129份辣椒材料对5株尖孢炭疽菌的抗性。张国芝等[7]对60份辣椒材料进行了抗病性鉴定,材料中仅有4份抗病,14份耐病,剩余的均为感病材料,未发现高抗和免疫的材料。尽管抗性育种被认为是控制病害的最有效、经济、环保的方法,但由于缺少可用的抗病材料,到目前为止世界上育成抗炭疽病的商业化辣椒品种还是极少的[14]。在生物防治方面,朱宏建等[15]分离筛选得到1株吸水链霉菌(Streptomyces hygroscopicus),对尖孢炭疽菌菌丝生长抑制率达71.60%。但生防菌田间施用受环境因素影响较大且防效不稳定,近年来,在辣椒炭疽病上登记使用的生防菌剂仅有1种。辣椒炭疽病的防治仍以化学防治为主,咪唑类杀菌剂咪鲜胺、三唑类杀菌剂戊唑醇和苯醚甲环唑、甲氧丙烯酸酯类杀菌剂嘧菌酯、啶氧菌酯和吡唑醚菌酯等对辣椒炭疽病有较好的防治效果[16-19]。但因不同地区炭疽病的致病菌种类不同,相同药剂对不同地区炭疽病田间防效存在较大差异,加大了病害防控难度。
【本研究切入点】广东南雄辣椒炭疽病的病原菌为尖孢炭疽菌,致病性强,为害重,防治难度较大,自2012年首次发现尖孢炭疽菌为害辣椒后,研究多集中于病原鉴定和防治药剂筛选,至今对尖孢炭疽菌的基本生物学特性研究较少,给病害的防治带来难度。【拟解决的关键问题】利用人工接种不同种类辣椒果实研究尖孢炭疽菌的致病性,采用病菌生长速率法和镜检孢子量研究温度、光照、pH、培养基、碳源、氮源等因素对尖孢炭疽菌的影响,明确尖孢炭疽病的生物学特性,以期为病害防控提供理论支持和技术借鉴。
1 材料与方法 1.1 试验材料供试菌株辣椒尖孢炭疽菌(C.acutatum)分离自广东省南雄市坪田镇小塘村辣椒病果,保存于广东省农业科学院植物保护研究所。
供试培养基:马铃薯葡萄糖琼脂(PDA)、查氏培养基(Czapek)和燕麦培养基配方见方中达[20];改良马丁培养基:蛋白胨5.0 g、酵母浸出粉2.0 g、葡萄糖20 g、磷酸氢二钾1.0 g、硫酸镁0.5 g、琼脂20 g,pH6.8~7.2;麦芽汁培养基:麦芽膏粉130 g、琼脂20 g,pH6.8~7.2;辣椒叶煎汁培养基:辣椒叶100 g切碎,加水1 000 mL煮沸30 min,纱布过滤,加葡萄糖20 g和琼脂20 g,pH6.8~7.2;辣椒果实煎汁培养基:辣椒果实200 g切碎,加水1 000 mL煮沸30 min,纱布过滤,加葡萄糖20 g和琼脂20 g,pH6.8~7.2;PDA + 辣椒叶煎汁培养基:PDA和辣椒叶煎汁培养基等量混合,pH6.8~7.2;PDA + 辣椒果实煎汁培养基:PDA和辣椒果实煎汁培养基等量混合,pH6.8~7.2。上述培养基均于121 ℃高压灭菌20 min后备用。
试验于2019年6月至2020年10月在广东省植物保护新技术重点实验室进行。
1.2 试验方法1.2.1 尖孢炭疽菌对不同种类辣椒的致病性 收集朝天椒、线椒、甜椒、螺丝椒、美人椒、黄皮尖椒、绿皮尖椒、皱皮椒、泡椒的辣椒果实,用75% 乙醇将辣椒果实擦拭一遍后晾干,每种辣椒设4个处理:用无菌大头针在辣椒上密集轻刺5次,取PDA上培养6 d的菌丝块,将菌丝面贴在刺伤处,以无菌琼脂块贴在刺伤处为对照;直接将菌丝面贴在健康辣椒果实,以无菌琼脂块贴在健康辣椒果实上作对照;用无菌大头针在辣椒上密集轻刺5次,将浓度为105个/mL孢子液滴在刺伤处,以无菌水滴在刺伤处为对照;直接将浓度为105个/mL孢子液滴在健康果实上,以无菌水滴在健康果实上为对照。每个处理3次重复,每个重复5个果实,果实放入磁盘中,26 ℃密封保湿培养,每24 h观察辣椒果实发病情况。
1.2.2 温度对尖孢炭疽菌菌丝生长和产孢的影响 将20 mL的PDA倒入直径9 cm培养皿中,冷却后制成平板。从PDA上培养6 d的菌落外围切取直径8 mm菌丝块,接入平板中央,设置10、15、20、22、24、26、28、30、32、35 ℃共10个温度,每个处理3次重复,每个重复5个培养皿,放入培养箱中培养8 d后,用十字交叉法测量菌落直径;然后每皿加10 mL清水,用涂布棒轻轻刮下菌落孢子,混匀后,用血球计数板镜检产孢量。
1.2.3 pH值对尖孢炭疽菌菌丝生长和产孢的影响 在无菌条件下,用1 mol/L NaOH和1 mol/L HCl溶液将PDA的pH调至3、4、5、6、7、8、9、10后,制成平板,接入菌丝块,每个处理3次重复,每个重复5个培养皿,放入26 ℃恒温培养箱中培养8 d。按1.2.2测量菌落直径和产孢量。
1.2.4 光照对尖孢炭疽菌菌丝生长和产孢的影响 制备好PDA平板,接入菌丝块,设置全光照、全黑暗及12 h光暗交替3个处理,每个处理3次重复,每个重复5个培养皿,放入26 ℃恒温培养箱中培养8 d。按1.2.2测量菌落直径和产孢量。
1.2.5 不同培养基对尖孢炭疽菌菌丝生长和产孢的影响 将PDA等9种培养基倒入直径9 cm培养皿中,制成平板,接入菌丝块,每个处理3次重复,每个重复5个培养皿,置于26 ℃恒温培养箱中培养8 d,观察菌落形态、菌丝生长情况、菌落致密程度、菌落正反两面颜色等培养性状,按1.2.2测量菌落直径和产孢量。
1.2.6 不同碳源对尖孢炭疽菌菌丝生长和产孢的影响 以Czapek培养基为基础培养基,将该培养基中的碳源蔗糖分别用葡萄糖、蔗糖、木糖、可溶性淀粉、麦芽糖、甘露醇和甘油替代,配制成不同碳源的培养基,以不加碳源为对照,在121 ℃高压蒸气灭菌20 min后,制成平板,接入菌丝块,每个处理3次重复,每个重复5个培养皿,置于26 ℃恒温培养箱中培养10 d,观察菌落形态、菌丝生长情况、菌落致密程度、菌落正反面颜色等培养性状,按1.2.2测量菌落直径和产孢量。
1.2.7 氮源对尖孢炭疽菌菌丝生长和产孢的影响 以Czapek培养基为基础培养基,将培养基中的氮源硝酸钠分别用硫酸铵、尿素、硝酸钠、天门冬酰胺、牛肉膏、蛋白胨、精氨酸替代,配制成不同氮源的培养基,以不加氮源为对照,在121 ℃高压蒸气灭菌20 min后,制成平板,接入菌丝块,每个处理3次重复,每个重复5个培养皿,置于26 ℃恒温培养箱中培养8 d,观察菌落形态、菌丝生长情况、菌落致密程度、菌落正反面颜色等培养性状,按1.2.2测量菌落直径和产孢量。
试验数据采用Excell 2007进行整理和绘图,用DPS软件进行统计,采用邓肯氏新复极差多重比较法(DMRT)进行差异显著性分析。
2 结果与分析 2.1 尖孢炭疽菌对不同种类辣椒的致病性将尖孢炭疽菌菌丝块或孢子液接种在朝天椒、柿椒、线椒、螺丝椒、美人椒、黄皮尖椒、绿皮尖孢、皱皮椒、泡椒果实的针刺伤口上,26 ℃保湿培养3 d,所有种类辣椒均发病,产生水渍状病斑,继续保湿培养,病部凹陷,其上可见白色菌丝或大量橘黄色黏孢团,即病菌的分生孢子团(图 1)。采用无伤接种菌丝块或孢子液4 d后,仅线椒产生水渍状病斑和橘黄色黏孢团,其他种类辣椒未发病。在9类辣椒果实中,朝天椒、美人椒和泡椒为红果,其余6种为青果,在伤口条件下,尖孢炭疽菌既可侵染青果,也可侵染红果。

|
| 图 1 尖孢炭疽病菌对不同种类辣椒的致病性 Fig. 1 Pathogenicity of Colletotrichum acutatum to different kinds of peppers A:朝天椒;B:柿椒;C:线椒:D:螺丝椒;E:美人椒;F:黄皮尖椒;G:绿皮尖孢;H:皱皮椒;I:泡椒 A: Red cluster pepper; B: Bell pepper; C: Line pepper; D: Spiral pepper; E: Beauty pepper; F: Yellow skin pepper; G: Green skin pepper; H: Wrinkled skin pepper; I: Pickled pepper |
2.2 温度对尖孢炭疽菌菌丝生长和产孢的影响
温度对尖孢炭疽菌菌丝生长和产孢量的影响见图 2,病原菌在10~32 ℃范围内均可生长,适宜菌丝生长温度在24~28 ℃范围内,26 ℃时菌落直径最大,温度升高到32 ℃时,菌丝生长明显受抑制,35 ℃时病菌不能生长。在10~30 ℃范围内,产孢量随着温度的上升而增多,30 ℃时产孢量最大,达81.75×106个/皿,温度升高到32 ℃,产孢量急剧下降。表明辣椒炭疽病菌对低温耐受,对高温敏感,温度高于32 ℃,病菌菌丝生长和产孢量明显受抑制。

|
| 图 2 温度对辣椒尖孢炭疽菌菌丝生长和产孢的影响 Fig. 2 Effect of temperature on mycelium growth and spore production of Colletotrichum acutatum from pepper |
2.3 pH对尖孢炭疽菌菌丝生长和产孢的影响
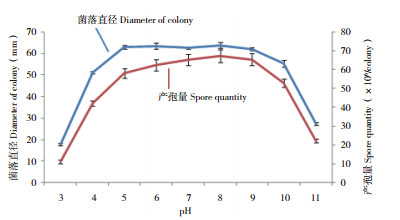
pH对尖孢炭疽菌菌丝生长和产孢量的影响见图 3,在pH为3~11范围内病菌均可生长和产孢,在5~9范围内菌丝生长和产孢量较好,且差异不显著,当pH低于4或高于10,菌丝生长和产孢受抑制,菌落直径和产孢量明显下降。表明该病菌适应pH范围较广,在偏酸至中性再至偏碱环境中均可正常生长和产孢。
|
| 图 3 pH对辣椒炭疽菌菌丝生长和产孢的影响 Fig. 3 Effect of pH on mycelium growth and spore production of Colletotrichum acutatum from pepper |
2.4 光照对尖孢炭疽菌菌丝生长和产孢的影响
不同光照条件对尖孢炭疽菌菌丝生长和产孢的影响见图 4,全光照、12 h光暗交替和全黑暗处理时,尖孢炭疽菌气生菌丝均生长旺盛,3个处理间菌落直径差异不显箸。但全光照条件下,产孢量高达84.27×106个/皿,显著高于12 h光暗交替和全光照处理的产孢量。表明不同光照条件对尖孢炭疽菌菌丝生长影响不大,但光照利于孢子产生,黑暗明显抑制产孢。

|
| 图 4 光照对辣椒炭疽菌菌丝生长和产孢的影响 Fig. 4 Effect of light on mycelium growth and spore production of Colletotrichum acutatum from pepper 相同色柱上小写英文字母不同者表示差异显著 Different lowercase letters above the bars with the same color represent significant differences |
2.5 不同培养基对尖孢炭疽菌菌丝生长和产孢的影响
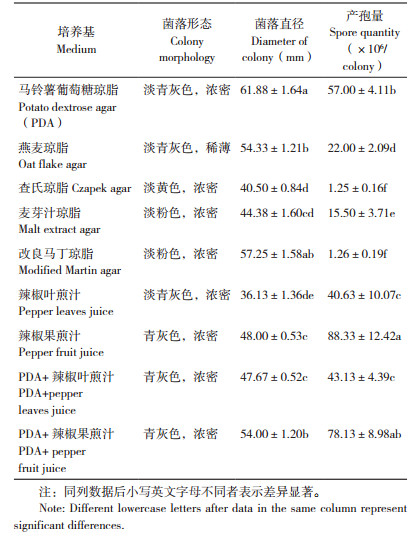
不同培养基对尖孢炭疽菌菌丝生长和产孢的影响见表 1,在供试的9种培养基中,尖孢炭疽菌均可生长,在PDA上生长速度最快,培养8 d菌落直径为61.88 mm,且菌落浓密,其后依次是改良马丁琼脂、燕麦琼脂和PDA+ 辣椒果煎汁、辣椒果煎汁、PDA+ 辣椒叶煎汁、麦芽汁琼脂、查氏琼脂和辣椒叶煎汁。辣椒果煎汁培养基利于产孢,孢子量达88.33×106个/皿,其次是PDA+ 辣椒果煎汁和PDA培养基,病菌在辣椒叶煎汁培养基上的产孢量显箸小于辣椒果煎汁培养基,在查氏琼脂和改良马丁琼脂的产孢量极差。表明辣椒果煎汁培养基利于菌丝生长和孢子产生,其效果明显。
|
2.5 不同碳源对尖孢炭疽菌菌丝生长和产孢的影响
不同碳源对尖孢炭疽菌菌丝生长和产孢的影响见表 2,在无碳对照培养基上,病菌菌丝可生长,但菌落极稀薄,无孢子产生。可溶性淀粉和蔗糖为碳源时,菌丝生长速度较快,菌落直径分别达45.17 mm和44.33 mm,且菌落浓密,其次是葡萄糖和甘露醇。葡萄糖最利于病原菌产生孢子,产孢量为35.03×106个/皿,其次为可溶性淀粉和甘露醇。综上所述,可溶性淀粉、葡萄糖和甘露醇利于病菌菌丝生长和孢子产生,蔗糖利于菌丝生长但不利于产孢。

|
2.6 不同氮源对尖孢炭疽菌菌丝生长和产孢的影响
供试7种氮源对尖孢炭疽菌菌丝生长和产孢的影响见表 3,在无氮对照培养基上,菌丝可生长,但菌落极稀薄,不产孢。有机氮源牛肉膏和蛋白胨利于尖孢炭疽菌菌丝生长,菌落直径分别为56.33 mm和55.80 mm,且菌落致密,浓厚,其次是天门冬酰胺和硝酸钠,尿素不利于菌丝的生长。牛肉膏作为氮源时,病菌产孢量最大,为43.05×106个/皿,其次为天门冬酰胺和精氨酸。综上所述,有机氮源牛肉膏利于病原菌菌丝生长和产孢。

|
3 讨论
2019年4月至2020年6月在广东南雄调查时发现,辣椒炭疽病发生普遍,对当地特色黄辣椒造成严重危害,分离纯化其病原菌,经致病性测定、形态特征观察和ITS序列分析,鉴定病菌为尖孢炭疽菌(C. acutatum)。尖孢炭疽菌寄主范围极广,除侵染辣椒外,也可侵染苹果、鳄梨、枇杷、橡胶、芒果、银杏、草莓、冠状银莲花、茄子、山茶属、蚕豆属和白酒草属植物[6]。尖孢炭疽菌致病力较强,既可侵染未成熟青果,也可感染成熟红果,而胶孢炭疽病菌(C.gloeosporioides)不感染青果,可感染红果[21]。本研究证实了南雄辣椒尖孢炭疽病菌可侵染青果和红果,同时发现病菌在有伤口时可侵染指天椒、柿椒、线椒、螺丝椒、美人椒、黄皮尖椒、绿皮尖孢、皱皮椒、泡椒9种类型辣椒果实,在无伤条件下只侵染线椒。霍建飞等[12]、高杨杨等[9]也报道在无伤口情况下,尖孢炭疽菌能够侵染健康的辣椒果实,使其患病。广东南雄特色黄辣椒正是线椒品种,对尖孢炭疽菌敏感,在适宜条件下,病菌孢子可以通过雨水溅射、灌溉水漫灌等方式传播到健康植株,造成连片危害,这可能是南雄辣椒炭疽病发生严重的重要原因之一。
胶孢炭疽菌(C.gloeosporioides)在10~35℃范围内均能生长,适宜温度为25~30 ℃,最适温度为25 ℃,低于10 ℃和高于35 ℃时生长受抑制,30 ℃时产孢量最大,pH值6~9范围内菌丝生长较好[22-24]。辣椒炭疽菌(C.capsici)在12~36 ℃均能生长,20~32 ℃均能产孢,生长和产孢的最适温度均为26~28 ℃,最适pH为4.5~6.5,黑暗利于菌丝生长和产孢[25]。对于尖孢炭疽菌(C. acutatum),杨佳文报道,温度25 ℃、连续光照、pH为6时利于菌丝生长;温度30 ℃、连续光照、pH为5~6利于产孢[10]。本研究发现尖孢炭疽菌最适菌丝生长温度在24~28 ℃范围内,26 ℃时菌丝生长最快,32 ℃时生长受抑制,30 ℃时产孢量最大,pH值在5~9范围内菌丝生长和产孢量较好,菌丝生长不受光照条件的影响,但光照促进病菌产孢。可见尖孢炭疽菌适宜生长温度低于胶孢炭疽菌,与辣椒炭疽菌相似;胶孢炭疽菌和尖孢炭疽菌适宜pH值更宽,在偏酸至中性至偏碱均可正常生长,辣椒炭疽菌喜好偏酸性。以上结果表明不同辣椒炭疽菌的生物特性存在种间差异。广东南雄地处广东北部,5—6月是辣椒结果收获期,5月份气温在21~29 ℃,6月份气温在23~32 ℃,适宜病害的发生发展,加上病菌适宜生长pH值较宽,在偏酸、中性及偏碱土壤中均可正常生长产孢,可见南雄当地环境因素利于辣椒炭疽菌的生长和增殖。
本研究显示辣椒果煎汁培养基利于菌丝生长和孢子产生,其效果明显高于辣椒叶煎汁,尤其在促进产孢方面效果明显。唐景美报道辣椒煎汁和辣椒煎汁+ 蔗糖可促进附着胞形成,附着胞在辣椒煎汁中形成率最高[22]。辣椒炭疽菌(C.capsici)菌丝生长和产孢的最适碳源分别为麦芽糖和淀粉,胶孢炭疽菌(C.gloeosporioides)菌丝生长的最适碳源为果糖和葡萄糖,产孢的最适碳源为山梨糖。2种辣椒炭疽菌菌丝生长的最适氮源为牛肉膏和蛋白胨,产孢的最适氮源为酵母[24]。杨佳文报道碳源葡萄糖、氮源酵母浸膏适合尖孢炭疽菌菌丝生长,碳源麦芽糖、氮源酵母浸膏适合产孢[10]。本研究结果显示可溶性淀粉、葡萄糖和甘露醇利于病菌生长和孢子产生,有机氮源牛肉膏利于病原菌菌丝生长和产孢。表明不同地区的尖孢炭疽菌菌株对碳、氮源的利用存在区域差异性。
4 结论尖孢炭疽病在广东南雄辣椒种植区发生普遍,较难防治,给当地种植户造成较大损失。本研究发现尖孢炭疽病菌致病性强,在伤口条件下,可侵染青果和红果,无伤条件下侵染线椒品种;适宜尖孢炭疽菌菌丝生长温度在24~28 ℃范围内,26 ℃时菌丝生长最快,30 ℃时产孢量最大,pH值在5~9范围内菌丝生长和产孢量较好,光照促进病菌产孢;辣椒果煎汁培养基促进产孢方面效果明显,炭源可溶性淀粉、葡萄糖、甘露醇和有机氮源牛肉膏利于病菌菌丝生长和产孢。研究结果表明:尖孢炭疽菌的生物学特性与辣椒炭疽菌的重要种类胶孢炭疽菌和辣椒炭疽菌存在明显种间差异,病害防治时需明确当地炭疽病菌种类,有针对性的制定防治策略,提高防治效果,特别是线椒种植区,需要提前预防,防止病害爆发。
| [1] |
SILVA D D, GROENEWALD J Z, CROUS P W, ADES P K, NASRUDDIN A, MONGKOLPORN O, TAYLOR P W. Identification, prevalence and pathogenicity of Colletotrichum species causing anthracnose of Capsicum annuum in Asia[J]. IMA Fungus, 2019, 10(1): 1-32. DOI:10.1186/s43008-019-0001-y |
| [2] |
MONGKOLPORN O, TAYLOR P W. Chili anthracnose: Colletotrichum taxonomy and pathogenicity[J]. Plant Pathology, 2018, 67(6): 1255-1263. DOI:10.1111/ppa.12850 |
| [3] |
DIAO Y Z, ZHANG C, LIU F, WANG W Z, LIU L, CAI L, LIU X L. Colletotrichum species causing anthracnose disease of chili in China[J]. Persoonia, 2017, 38: 20-37. DOI:10.3767/003158517X692788 |
| [4] |
杨青, 易图永. 辣椒炭疽病及其防治研究进展[J]. 江西农业学报, 2009, 21(7): 107-109. DOI:10.19386/j.cnki.jxnyxb.2009.07.035 YANG Q, YI T Y. Research progress in chili anthracnose and its control[J]. Acta Agriculturae Jiangxi, 2009, 21(7): 107-109. DOI:10.19386/j.cnki.jxnyxb.2009.07.035 |
| [5] |
曾向萍, 赵志祥, 符美英, 王会芳, 何舒, 肖敏. 海南辣椒炭疽病病原菌鉴定及其对嘧菌酯的敏感性分析[J]. 中国植保导刊, 2016, 36(5): 5-9. ZENG X P, ZHAO Z X, FU M Y, WANG H F, HE S, XIAO M. Identification of pepper anthracnose pathogen in Hainan province and analysis on its sensitivity to azoxystrobin[J]. China Plant Protection, 2016, 36(5): 5-9. |
| [6] |
夏花, 朱宏建, 周倩, 高必达. 湖南芷江辣椒上一种新炭疽病的病原鉴定[J]. 植物病理学报, 2012, 42(2): 120-125. DOI:10.13926/j.cnki.apps.2012.02.003 XIA H, ZHU H J, ZHOU Q, GAO B D. Pathogen identification of a new anthracnose of pepper in Zhijiang, Hunan[J]. Acta Phytopathologica Sinica, 2012, 42(2): 120-125. DOI:10.13926/j.cnki.apps.2012.02.003 |
| [7] |
张国芝, 赵霞, 杨海艳, 吴婕, 王云月, 彭化贤. 四川辣椒炭疽病菌鉴定及育种材料抗性筛选[J]. 西南农业学报, 2013, 26(3): 1026-1029. DOI:10.16213/j.cnki.scjas.2013.03.017.scjas.2013.03.017 ZHANG G Z, ZHAO X, YANG H Y, WU J, WANG Y Y, PENG H X. Identification of pepper anthracnose and resistant screen of breeding materials in Sichuan[J]. Southwest China Journal of Agricultural Sciences, 2013, 26(3): 1026-1029. DOI:10.16213/j.cnki.scjas.2013.03.017.scjas.2013.03.017 |
| [8] |
刘冰, 王连英, 黄新根, 崔汝强, 宋水林. 1种辣椒新炭疽病的初步鉴定及室内药剂筛选[J]. 生物灾害科学, 2013, 36(3): 262264. LIU B, WANG L Y, HUANG X G, CUI R Q, SONG S L. Identification of a new anthracnose of peppers and screening of fungicides[J]. Biological Disaster Science, 2013, 36(3): 262264. |
| [9] |
高杨杨, 禾丽菲, 李北兴, 林琎, 慕卫, 刘峰. 山东省辣椒炭疽病病原菌的鉴定及高效防治药剂的筛选[J]. 中国农业科学, 2017, 50(8): 1452-1464. GAO Y Y, HE L F, LI B X, LIN J, MU W, LIU F. Identification of the pathogen causing pepper anthracnose in Shandong province and screening of highly effective fungicides[J]. Scientia Agricultura Sinica, 2017, 50(8): 1452-1464. |
| [10] |
杨佳文, 赵尊练, 张管曲, 谢芳琴, 姜长岳, 张永香, 韩晓萍, 徐乃林. 陕西线辣椒炭疽病原菌的鉴定及生物学特性研究[J]. 西北农业学报, 2017, 26(11): 1695-1705. DOI:10.7606/j.issn.1004-1389.2017.11.017 YANG J W, ZHAO Z L, ZHANG G Q, XIE F Q, JIANG C Y, ZHANG Y X, HAN X P, XU N L. Identification and biological characterization of anthrax bacteria in Xianlajiao chili pepper in Shanxi province[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2017, 26(11): 1695-1705. DOI:10.7606/j.issn.1004-1389.2017.11.017 |
| [11] |
王妮, 尹显慧, 彭丽娟, 李荣玉, 龙友华, 吴小毛, 樊荣, 王坤英, 李继业. 辣椒炭疽病病原鉴定及其杀菌剂毒力测定[J]. 植物保护, 2019, 45(4): 216-223. DOI: 10.16688/j.zwbh.2018341.
|
| [12] |
霍建飞, 姚玉荣, 郝永娟, 于金萍, 刘春艳, 万立. 天津市宁河区辣椒炭疽病病原鉴定及防治药剂筛选[J]. 北方园艺, 2020(3): 1-7. HUO J F, YAO Y R, HAO Y J, YU J P, LIU C Y, WAN L. Identification of pepper anthracnose and screening of fungicides against it in Ninghe of Tianjin[J]. Northern Horticulture, 2020(3): 1-7. |
| [13] |
PEREIRA M J, MASSOLA J N, SUSSEL A A, SALA F C, COSTA C P, BOITEUX L S. Reaction of Capsicum accessions and progenies from interspecific crosses to Colletotrichum acutatum isolates[J]. Horticultura Brasileira, 2011, 29(4): 569-576. DOI:10.1590/S0102-05362011000400021 |
| [14] |
孙春英, 毛胜利, 张正海, 王立浩, 张宝玺. 辣椒抗炭疽病遗传与育种研究进展[J]. 园艺学报, 2013, 40(3): 579-590. DOI:10.16420/j.issn.0513-353x.2013.03.022 SUN C Y, MAO S L, ZHANG Z H, WANG L H, ZHANG B X. Progress on genetics and breeding of resistance to anthracnose(Colletotrichum spp.)in pepper[J]. Acta Horticulturae Sinica, 2013, 40(3): 579-590. DOI:10.16420/j.issn.0513-353x.2013.03.022 |
| [15] |
朱宏建, 欧阳小燕, 周倩, 高必达. 一株辣椒尖孢炭疽病菌拮抗菌株的分离鉴定与发酵条件优化[J]. 植物病理学报, 2012, 42(4): 418-424. DOI:10.13926/j.cnki.apps.2012.04.010 ZHU H J, OUYANG X Y, ZHOU Q, GAO B D. Isolation, identification and optimizing fermentation conditions of an antagonistic strain against Colletotrichum acutata[J]. Acta Phytopathologica Sinica, 2012, 42(4): 418-424. DOI:10.13926/j.cnki.apps.2012.04.010 |
| [16] |
朱方宇, 彭伟, 刘维川, 杨光明. 4种杀菌剂防治辣椒炭疽病田间试验[J]. 植物医生, 2013, 26(3): 23-24. ZHU F Y, PENG W, LIU W C, YANG G M. Field test of 4 fungicides against pepper anthracnose[J]. Plant Doctor, 2013, 26(3): 23-24. |
| [17] |
莫佳强, 麦接超. 4种杀菌剂防治辣椒炭疽病田间药效试验[J]. 广西植保, 2018, 31(2): 7-8. MO J Q, MAI J C. Field efficacy test of 4 fungicides against pepper anthracnose[J]. Guangxi Plant Protection, 2018, 31(2): 7-8. |
| [18] |
姚道忠, 李运超, 姚洁, 程磊, 潘月敏, 吴慧平. 啶氧菌酯对辣椒炭疽病菌室内抑制与田间防效[J]. 安徽农业大学学报, 2019, 46(6): 1028-103. DOI:10.13610/j.cnki.1672-352x.20200113.006 YAO D Z, LI Y C, YAO J, CHENG L, PAN Y M, WU H P. Control effect of picoxystrobin on Collerotrichum gloeosporioides indoor and field[J]. Journal of Anhui Agricultural University, 2019, 46(6): 1028-103. DOI:10.13610/j.cnki.1672-352x.20200113.006 |
| [19] |
周建波, 殷辉, 吕红, 秦楠, 赵晓军. 8种不同类型药剂对辣椒炭疽病的田间防治效果[J]. 中国瓜菜, 2020, 33(11): 72-76. DOI:10.16861/j.cnki.zggc.2020.0288.zggc.2020.0288 ZHOU J B, YIN H, LYU H, QIN N, ZHAO X J. Field control effect of 8 different types of fungicide on pepper anthracnose[J]. China Cucurbits and Vegetables, 2020, 33(11): 72-76. DOI:10.16861/j.cnki.zggc.2020.0288.zggc.2020.0288 |
| [20] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 46-50. FANG Z D. Methods used in plant pathology[M]. Beijing: China Agriculture Press, 1998: 46-50. |
| [21] |
KANG B K, MIN J Y, KIM Y S, PARK S W, BACH N V, KIM H T. Semi-selective medium for monitoring Colletotrichum acutatum causing pepper anthracnose in the field[J]. Research in Plant Disease, 2005, 11: 21-27. DOI:10.5423/RPD.2005.11.1.021 |
| [22] |
程勋东, 隋益虎. 辣椒炭疽病原菌生物学特性研究[J]. 安徽科技学院学报, 2015, 29(1): 34-38. CHENG X D, SUI Y H. Biological characteristics of anthracnose pathogen in chili pepper[J]. Journal of Anhui Science and Technology University, 2015, 29(1): 34-38. |
| [22] |
唐景美, 陈振毅, 廖咏梅, 周志权. 辣椒胶孢炭疽菌生物学特性初步研究[J]. 广西植保, 2009, 22(2): 12-15. TANG J M, CHEN Z Y, LIAO Y M, ZHOU Z Q. Preliminary study of biological characteristics of Colletotrichum gloeosporioides in Chilli Pepper[J]. Guangxi Plant Protection, 2009, 22(2): 12-15. |
| [23] |
李国光, 田瑞华, 赵磊, 周才芯, 林瑞雄. 辣椒炭疽病病原菌生物学特性及其拮抗菌防效研究[J]. 农产品加工, 2018(4): 11-15. DOI:10.16693/j.cnki.1671-9646(X).2018.04.004 LI G G, TIAN R H, ZHAO L, ZHOU C X, LIN R X. Biological characteristics of pepper anthracnose pathogens and their antagonistic bacteria biocontrol effects[J]. Farm Products Processing, 2018(4): 11-15. DOI:10.16693/j.cnki.1671-9646(X).2018.04.004 |
| [24] |
谷春艳, 林琳, 胡飞, 张勇, 高同春. 营养成分对辣椒炭疽病菌生物学特性的影响[J]. 安徽农业科学, 2012, 40(20): 10443-10445. DOI:10.13989/j.cnki.0517-6611.2012.20.097 GU CY, LIN L, HU F, ZHANG Y, GAO T C. Effects of nutriment on biological characteristics of anthracnose pathogen of Colletotrichum capsici[J]. Journal of Anhui Agriculture science, 2012, 40(20): 10443-10445. DOI:10.13989/j.cnki.0517-6611.2012.20.097 |
| [25] |
谢丙炎, 欧阳本友, 欧阳丰. 辣椒炭疽病菌生物学特性的研究[J]. 微生物学通报, 1992, 19(6): 321-324. DOI:10.13344/j.microbiol.na.1992.06.001 XIE B Y, OUYANG B Y, OUYANG F. Biological characteristics of anthracnose pathogen in chili pepper[J]. Microbiology China, 1992, 19(6): 321-324. DOI:10.13344/j.microbiol.na.1992.06.001 |
 2021, Vol. 48
2021, Vol. 48