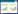文章信息
基金项目
- 广东省农业科学院科技创新战略专项资金(高水平农科院建设)-人才项目(R2018QD-059);广东省现代农业产业技术体系创新团队项目(2020KJ108,2018LM1077)
作者简介
- 崔一平(1984-),女,博士,助理研究员,研究方向为果树病害及其防控,E-mail: kktracy@163.com.
通讯作者
- 彭埃天(1962-),男,研究员,研究方向为果树病害及其防控,E-mail: pengait@163.com.
文章历史
- 收稿日期:2021-04-06
【研究意义】甘蔗(Saccharum officinarum L.)是世界上重要的糖料作物及有发展潜力的可再生能源作物,我国是世界上最大的甘蔗生产国之一[1]。近些年来,我国蔗糖产量和食糖消费量已经跃居世界第3位[2]。在我国,甘蔗种植面积占糖料种植面积的85% 以上,产糖量占食糖总产量的90% 以上[3-5]。广东省是继广西和云南之后的我国第三大蔗区,90% 左右的植蔗区位于粤西地区,珠三角、粤北地区和粤东地区也有零星种植[6];其中粤西地区主要以种植糖蔗为主,粤东地区则以种植果蔗为主。甘蔗作为用蔗茎腋芽进行无性繁殖的作物,甘蔗种苗是传播甘蔗病害的主要媒介。因此,及时科学诊断出新的甘蔗种传病害并提出具体的防治药剂,有利于增强甘蔗的种苗安全,对提高甘蔗产量和品质有重大的研究意义。【前人研究进展】在我国,甘蔗上报道的病害如甘蔗黑穗病、甘蔗花叶病、甘蔗宿根矮化病、甘蔗黄叶综合征和甘蔗凤梨病等大约有50多种,这些病害大多数都能够通过种苗进行传播[7-9]。同时,由于蔗区之间引种频繁、蔗种相互调换,缺乏检测,使得一些严重病害在甘蔗种植区造成了严重为害,如印度,赤腐病已经对甘蔗产业造成了毁灭性的打击[10]。近年来,越来越多的新病害在我国不同的蔗区被报道,如由Fusarium sacchari引起的甘蔗萎蔫病,Fusarium commune引起的甘蔗根腐病,Alternaria tenuissima引起的甘蔗叶片白条病等等[11-13]。这些新病害的出现极大增加了甘蔗病害防治的难度,给不同种植区间甘蔗的引种增加了风险。【本研究切入点】甘蔗黑斑霉叶条病为本课题组2016年和2017年在广东省广州市南沙区田间的黑皮果蔗上发现,病害初期在甘蔗幼嫩叶片的叶缘上出现黄色到白色的条状病斑,而后逐渐向叶片的中脉进行扩展;发展到后期严重的时候,从叶鞘外可看到粉色的水渍状病斑,叶鞘的颜色由淡绿色变为粉色。经过调查发现,甘蔗黑斑霉叶条病在甘蔗的苗期到成株期均可发生危害;一旦环境合适,在苗期甘蔗黑斑霉叶条病可造成甘蔗植株的大面积干枯死亡;而在甘蔗生长的后期发病,则会造成甘蔗顶梢叶片的大量枯死,从而严重影响甘蔗的光合作用,造成甘蔗糖分积累的大量减少。【拟解决的关键问题】本研究着重对引起甘蔗黑斑霉叶条病病原菌Nigrospora sphaerica进行分离鉴定,同时对其生长温度、pH、检测及化学药剂防治进行研究和筛选。
1 材料与方法 1.1 试验材料供试植物:感病和健康的黑皮果蔗于2017年采集自广州市南沙的甘蔗种植地(种植面积为5 153.3 hm2)。培养基:马铃薯葡萄糖琼脂(PDA)培养基(马铃薯200 g、葡萄糖20 g、琼脂20 g、去离子水定容至1 000 mL)。
试剂及仪器:Axygen动植物基因组DNA制备试剂盒,爱思进生物技术(杭州)有限公司;PCR扩增试剂盒2×EasyTaq PCR SuperMix(-dye),北京全式金生物技术有限公司;研究中用到的引物合成及PCR产物测序服务均购自上海生工生物工程有限公司;1 mol/L NaOH(4 g NaOH加入到100 mL水中),1 mol/L HCl(1 mL 37% 浓盐酸加入到11 mL水中)。美国贝克曼Microfuge 20微量离心机、T100TM PCR仪及美国伯乐1704487小型水平电泳槽均购自上海凌仪生物科技有限公司;生化培养箱,上海一恒科学仪器有限公司;Leica DM2500光学显微镜,德国Leica公司。
化学药剂:施保功(Sporgon),为丙氯灵prochloraz和氯化锰复合制成的50% 可湿性粉剂,德国先灵农业化学有限公司独立开发的咪唑类广谱性杀菌剂,对子囊菌引起的各种作物病害有特效。苯醚甲环唑(Difenoconazole),别名世高,有多种剂型,内吸性杀菌,具保护和治疗作用,对很多作物上的真菌病害都有保护和治疗作用。苯甲·福美双,为苯醚甲环唑和福美双进行有机配合制成的60% 可湿性粉剂,由山东东泰农化有限公司研发制成,对水稻、烟草和蔬菜等真菌性病害有特效。咪鲜胺(Prochloraz),是一种广谱杀菌剂,需避光保存,是德国艾格福公司(现为拜耳公司)于1977年开发的咪唑类广谱性杀菌剂,对多种作物由子囊菌和半知菌引起的病害具有明显的防效,也可以与大多数杀菌剂、杀虫剂、除草剂混用,均有较好的防治效果。50% 丙环唑,是一种广谱、内吸性的叶面杀菌剂,由江西正邦生物化工股份有限公司研制,对水稻和小麦纹枯病、香蕉黑星病、水稻稻曲病等都有良好防效。噻唑锌,购自浙江新农化工股份有限公司,为悬浮剂,对细菌性病害特效,对多种真菌性病害高效。噁霉灵(hymexazol),为内吸性杀菌剂、土壤消毒剂和植物生长调节剂,购自北京为民生物科技公司。
1.2 试验方法1.2.1 病原菌分离及形态特征观察 选取感病的黑皮甘蔗叶片和叶鞘,用剪刀在病健交界处剪出0.2 mm×0.2 mm左右的正方形小块,然后依次在70% 酒精中放置30 s, 2%NaClO 1.5~2 min,无菌水冲洗4次,置于无菌滤纸上在超净台中晾干,最后放置于PDA培养基上25 ℃进行暗培养。
1.2.2 致病性测定 选取在PDA上培养7 d的分离菌株, 菌丝块大小为5 mm×5 mm,分别接种于带有伤口的1月龄甘蔗苗上;同时以相同的PDA培养基块接种于带伤口的黑皮甘蔗茎秆上,作为阴性对照。
采集健康和发病的甘蔗作为种子,分别种植于已灭菌的土壤中,放置于恒温培养箱中28 ℃培养(光照/黑暗:12 h/12 h;湿度:40%);正常肥水管理,20 d后观察甘蔗苗的生长状态。
1.2.3 分离菌株的分子生物学鉴定 将培养7 d的分离菌株菌丝从PDA平板上刮下来,迅速用液氮研磨。然后依据Axygen动植物基因组DNA制备试剂盒说明书进行DNA提取。选取核糖体转录间隔区(ITS)的检测引物(ITS1:5'-TCCGTAGGTGAACCTGCGG-3'和ITS4:5'-TCCTCCGCTTATTGATATGC-3')[14],分别以分离菌株的全基因组DNA为模板进行PCR扩增。对所得到的PCR产物在1 %的琼脂糖凝胶上进行电泳检测,将获得的阳性PCR产物送去测序。对获得的片段核酸信息在NCBI中进行BLAST并把相关数据提交到NCBI数据库,同时利用MegAlign 7.1.0(44)软件以最大似然法建立进化树,从而确定该分离菌株的分类地位。
1.2.4 甘蔗组织DNA的提取 称取新鲜组织4~5 g,剪碎放入研钵中,用液氮研磨成粉末;将粉末转移到已灭菌的2 mL离心管中,根据Axygen动植物基因组DNA制备试剂盒说明书进行操作,并在1% 琼脂糖凝胶上对所获DNA进行电泳检测。
1.2.5 甘蔗黑孢霉叶斑病的检测 根据以ITS1/ITS4为引物,甘蔗黑孢霉叶斑病病原菌N.sphaerica的DNA为模板,扩增获得的ITS序列设计特异性的检测引物。通过NCBI的Primer-blast设计2对引物;Ns1F: 5-TGTACCTGCGGAGGGATCAT-3和Ns2R: 5-CCTGATCCGAGGTCAACCAG-3, PCR产物为501 bp;Ns2F: 5-GAACGCAGCGAAATGCGATA-3和Ns2R:5-ACTACGCTCAG AGGACTGCT-2,PCR产物为206 bp。分别以采集自田间发病植株的叶片和叶鞘,人工接种发病植株的叶片以及N.sphaerica菌落的DNA为模板进行PCR反应,PCR反应流程为:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸60 s,34个循环;72℃延伸10 min;取5 μL PCR产物在1%琼脂糖凝胶上进行电泳检测;同时将获得的阳性PCR产物测序,确定扩增的准确性。
1.2.6 菌株S2-1生物学特性的测定 温度对菌株S2-1菌丝生长的影响:在单胞培养7 d的N.sphaerica菌落上,用灭菌打孔器取直径5 mm的菌饼分别接种在PDA平板中央,每块平板上放1个,分别放在5、10、15、20、25、30 ℃培养箱中,每个处理3次重复。同时,分别在接种后1、2、3、4 d用十字交叉法测量菌落生长直径并记录。
pH对S2-1菌丝生长的影响:用1 mol/L NaOH和1 mol/L HCl分别调节灭菌的PDA培养基,pH分别调节为4、4.5、5、5.5、6、6.5、7、8、9。取单胞培养7 d的N.sphaerica菌落上直径5 mm的菌饼,分别接种在调好pH的平板上,每个处理3次重复。接种后,把平板放入28 ℃培养箱中进行暗培养,接种后5 d用十字交叉法测量菌落生长直径并记录。
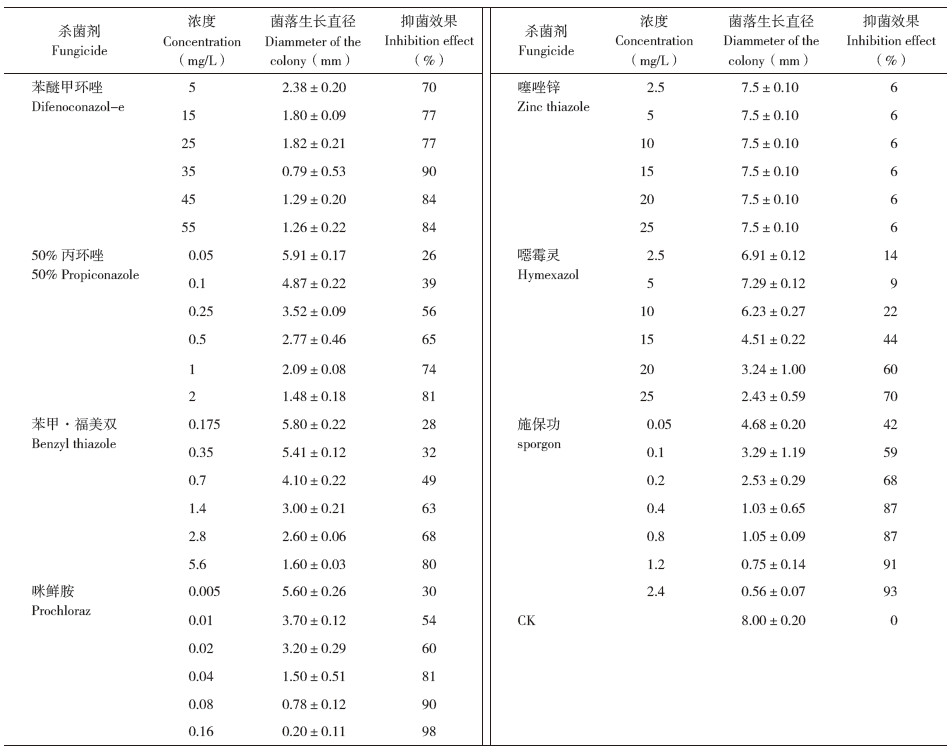
1.2.7 7种杀菌剂对N. sphaerica(S2-1)的抑制率测定 通过菌丝生长速率测定法[15],在PDA培养基中分别加入浓度为5、15、25、35、45、55 mg/L的苯醚甲环唑, 0.05、0.1、0.25、0.5、1、2 mg/L的50% 丙环唑, 0.18、0.35、0.7、1.4、2.8、5.6 mg/L的苯甲·福美双, 0.005、0.01、0.02、0.04、0.08、0.16 mg/L的咪鲜胺, 0.05、0.1、0.2、0.4、0.8、1.2、2.4 mg/L的施保功, 2.5、5、10、15、20、25、35 mg/L的噻唑锌, 2.5、5、10、15、20、25 mg/L的噁菌灵制成含药培养基;然后在培养7 d的N.sphaerica菌落上用灭菌打孔器取直径为5 mm菌饼,将菌饼生长菌丝的一面朝下接种在各含药培养基和空白PDA培养基平板中央(每个平板接种1个菌饼),每个处理3次重复,并放置在28 ℃恒温培养箱中进行暗培养;然后在培养3、4、5、6 d采用十字交叉法分别测量菌落直径并记录,每个处理4次重复,计算不同处理对菌丝生长的抑制率:

|
试验数据采用Excel 2010进行处理,采用DPS2005软件进行数据统计分析,应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析 2.1 甘蔗黑孢霉叶斑病及其病原菌特征从发病的黑皮甘蔗叶片和叶鞘上分离获得6株分离菌株,其中1株与其他分离株的菌落形态均不一样;我们把这株不一样的分离菌株命名为S1,其他分离菌株编号为S2-1~S2-5,其中S2-1~S2-5在菌落形态和培养特性方面均一致。S1在PDA上培养7 d后的菌落形态为圆形,中心淡81紫色,其他部位为白色;在显微镜下观察,其有大、小2种孢子,大孢子为明显的镰刀状,小孢子为卵圆形(图 1A、D)。S2-1~S2-5在PDA培养基上培养3~4 d后,菌落圆形,颜色从中央依次为黑色、黄色和白色(图 1B);培养7 d后,随着色素的积累,整个菌落呈现黑色(图 1C)。本试验选取S2-1为代表菌株,S2-1的菌丝有分隔和分叉,白色和黑色;分生孢子单生、顶生,单孢球形或近球形,黑色,表面光滑,直径10.2~15.8 μm(图 1E)。根据病原菌的形态特征及培养性状,初步判断S1为镰刀菌属真菌,S2-1~S2-5为球黑孢病菌Nigrospora sphaerica(Sacc.)Mason[16]。
|
| 图 1 甘蔗黑孢霉叶斑病病原菌的分离及分子鉴定 Fig. 1 Isolation and molecular identification of the pathogen of sugarcane Nigrospora blight A: S1菌落形态;B、C:S2-1菌落形态;D:显微镜下S1孢子形态;E、F:显微镜下S2-1菌丝和孢子形态 A: Colony of S1; B and C: Colony of S2-1; D: Spores of S1 under microscope; E and F: The mycelium and Spores of S2-1 under microscope |
2.2 甘蔗黑孢霉叶斑病病原菌的致病性测定和分子生物学鉴定
为进一步明确甘蔗黑孢霉叶斑病的病原菌,分别对S1和S2-1在甘蔗上进行致病性测定。结果(图 2)表明,S1在甘蔗上不具有致病性,S2-1能够在甘蔗上引起与田间相似的病害症状。同时,以带菌的甘蔗茎秆和健康甘蔗茎秆为种子种植在灭菌土壤中,放置于28 ℃培养箱内和田间,均进行正常的肥水管理;1个月后,以带菌甘蔗茎秆为种子长出的甘蔗苗叶片从叶尖到叶基表现出明显的白条症状;在田间的试验中也表现出相同的症状。而以健康甘蔗茎秆为种子长出的甘蔗苗则没有表现出任何症状。再次对这些发病甘蔗苗进行病原菌分离仍然能够获得与S2-1菌落形态和生物学特性相一致的病原菌。以上结果表明,甘蔗黑孢霉叶斑病为甘蔗的种传病害。

|
| 图 2 菌株S2-1在甘蔗上的致病性测定 Fig. 2 Pathogenicity determination of strain S2-1 on sugarcane S2-1针刺接种后30 d的甘蔗状态;B:S2-1针刺接种后50 d的甘蔗状态;C:S2-1针刺接种后50 d的甘蔗叶鞘状态;D:田间带菌甘蔗种子长出甘蔗苗的状态;E:培养箱中带菌甘蔗种子长出甘蔗苗的状态 Symptom on sugarcane 30 days after S2-1 inoculation; B: Symptom on sugarcane 50 days after S2-1 inoculation; C: Symptom on sugarcane leaf sheath 50 days after S2-1 inoculation; D: State of sugarcane seedlings growing from germ-carrying sugarcane seeds in the field; E: State of sugarcane seedlings growing from germ-carrying sugarcane seeds in incubator |
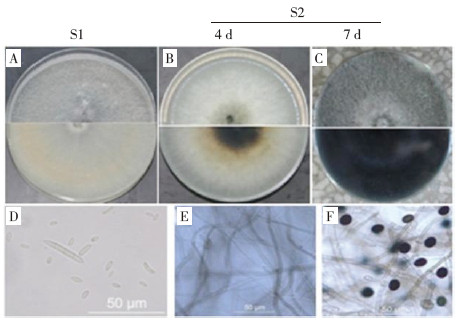
利用真菌ITS序列通用引物对菌株S2-1的DNA扩增,获得大小约为580 bp的片段。将该ITS序列进行测序,并将序列提交至NCBI,经BLAST比对发现,S2-1的ITS(登录号:MW832509)与来自N.sphaerica PTA1的ITS(登录号:KM893076.1)在序列的相似性和覆盖性上均为100%。同时通过MegAlign 7.1.0(44)软件以最大似然法建立菌株S2-1的系统发育树发现,S2-1与黑孢霉菌株PTA1在一个分支上,而与N.oryzae BY-D(KF924041)和N.osmanthi COL2(MH645207)的亲缘关系较远。根据菌株S2-1的形态学特征以及分子生物学鉴定结果,甘蔗黑孢霉叶斑病的病原菌鉴定为球孢霉菌N.sphaerica(图 3)。
|
| 图 3 基于ITS序列以最大似然法构建菌株S2-1与Nigrospora sp. 其他种的进化树 Fig. 3 Phylogenetic tree of strain S2-1 and Nigrospora sp. based on ITS sequence with maximum likelihood method |
2.3 甘蔗黑孢霉叶斑病病原菌的检测
通过PCR检测,结果表明,Ng1F/Ng1R能够对带有甘蔗黑孢霉叶斑病的甘蔗病样及其病原菌N.sphaerica进行有效扩增(图 4A),而Ng2F/Ng2R则不能够对以上甘蔗病样进行有效扩增。因此Ng1F/Ng1R可以作为检测甘蔗黑孢霉叶斑病的检测引物。

|
| 图 4 Nigrospora sphaerica的检测电泳及其在不同温度和pH条件下的菌落生长直径 Fig. 4 Detection electrophoresis of Nigrospora sphaerica and its colony growth diameter on PDA plate under different temperatures and pH |
2.4 甘蔗黑孢霉叶斑病病原菌的生物学特性
2.4.1 温度对S2-1菌丝生长的影响 甘蔗黑孢霉叶斑病病原菌S2-1对温度的适应范围较广,在10~30 ℃范围内,S2-1均能生长。但当温度为5 ℃时,菌丝停止生长;而当温度高于30 ℃时,菌丝生长速率明显下降。最适生长温度为25 ℃,其次为20 ℃(图 4B)。当温度为25 ℃时,菌落生长速率最快;培养4 d后,菌落直径已经达到80 mm,且与20 ℃和30 ℃之间的差异明显(图 4B)。
2.4.2 pH对S2-1菌丝生长的影响 甘蔗黑孢霉叶斑病病原菌S2-1对酸碱度适应范围较广,在pH为4~8范围内均可以正常生长。但以pH7时菌落生长速率最快,培养4 d后平均菌落直径为80 mm;随着pH升高,菌丝生长速度开始下降。当pH为9时,菌丝停止生长(图 4C)。
2.5 甘蔗黑孢霉叶斑病菌室内最佳防治药剂筛选咪鲜胺对甘蔗黑孢霉叶斑病菌的抑菌效果最好,最高可达到98%;苯醚甲环唑和施保功的抑菌效果次之,最高可达到90% 和93%;50% 丙环唑ˎ 苯甲·福美双和噁菌灵的防治效果较差,最高在70%~81% 之间;而噻唑锌则完全没有抑菌效果(图 5和表 1)。因此,在对甘蔗黑孢霉叶斑病进行防治时可优先选用咪鲜胺,也可选用苯醚甲环唑和施保功进行交叉使用。
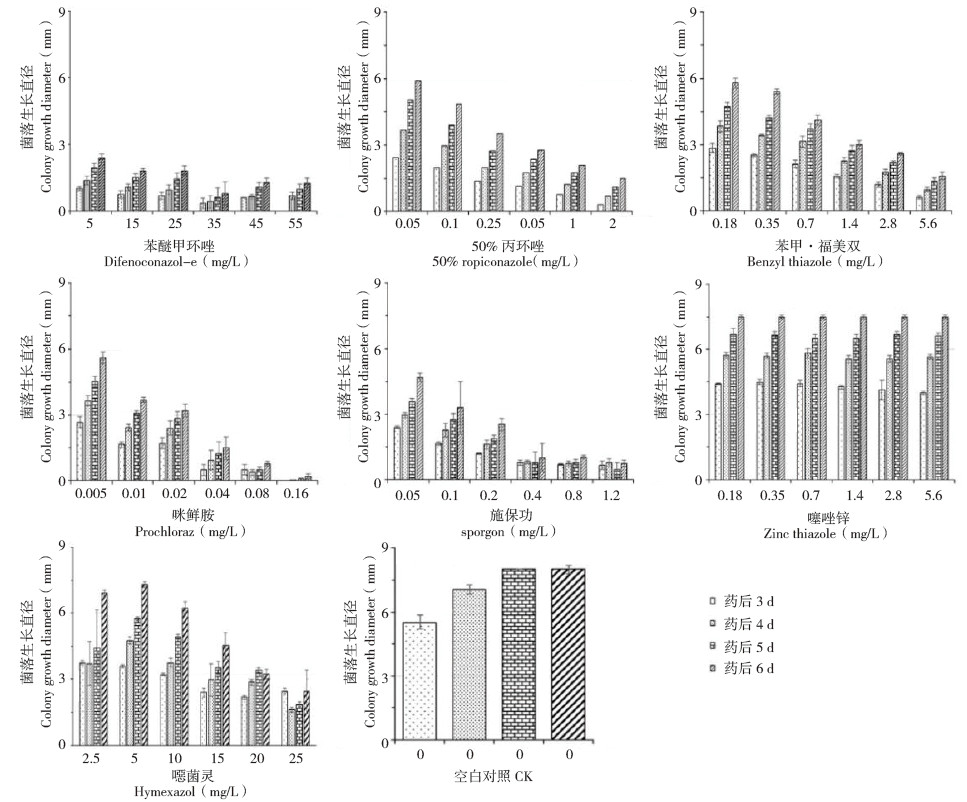
|
| 图 5 7种杀菌剂对Nigrospora sphaerica在PDA平板上生长的影响 Fig. 5 Effects of 7 fungicides on the growth of Nigrospora sphaerica on PDA plates |
|
为了选出不同杀菌剂在室内抑制甘蔗黑孢霉叶斑病菌生长效果最佳的使用浓度,通过对以上供试药剂梯度浓度(具体浓度见1.2.7)进行抑菌测定实验发现:咪鲜胺的抑菌浓度最低,抑菌效果最好,在0.16 mg/L时抑菌效果达到98%;其为90%,其他药剂的防治效果均不理想。因此在次是施保功,在2.4 mg/L时抑菌效果达到93%,防治甘蔗黑孢霉叶斑病时推荐使用0.16 mg/L咪鲜而苯醚甲环唑在浓度为35 mg/L时抑菌浓度最高胺药剂和2.4 mg/L施保功药剂。
3 讨论种苗安全对甘蔗的安全生产有着极其重要的作用。本研究中,甘蔗黑孢霉叶斑病为甘蔗上新发现的种传病害,由黑孢霉N.sphaerica引起;该病害为本课题组2016年和2017年在广东省广州市南沙区田间的黑皮果蔗上发现[17]。甘蔗黑孢霉叶斑病在甘蔗成株期发病时,主要影响甘蔗糖分的积累;但是在甘蔗幼苗期发病时会造成甘蔗植株的整株枯死,而且一旦种茎带病,长出的苗子则100% 带病。甘蔗黑孢霉叶斑病严重影响甘蔗的产量和质量。
近年来越来越多关于N.sphaerica引起病害的报道,如在印度的茶叶、中国的茶花和青钱柳上引起黑孢霉叶斑病等[16, 18-20]。但关于N.sphaerica引起甘蔗黑孢霉叶斑病及其病原菌的生物学特性还是首次报道。过去甘蔗病害的防治主要以培育抗病品种为主,辅助以化学药剂防治和栽培管理(如种植密度、种植方式及肥水管理等)[21-22];但对于种传甘蔗病害则首先是加强引种检疫,并多采用与其他作物进行轮作、种植无病种苗及改变施肥模式等[2, 23-24]。甘蔗作为用蔗茎腋芽进行无性繁殖的作物,由于多年反复种植,极易受到种苗传播病原的反复侵染,而且一旦侵染,将会给甘蔗产量和质量造成极大损失。研究者们在脱毒健康种苗的生产方面采用了各种方法,如热蒸汽消毒种苗、热水浸种消毒以及后来的热水浸种消毒结合组织培养脱毒技术;同时通过建立三级苗圃制来进一步杜绝危险性病害的蔓延,保证种苗的健康[25-26]。通过研究发现,N.sphaerica的最适生长温度为25 ℃,最适pH为7,因此也可通过以上方法对种苗进行脱毒处理。此外,也有研究表明甘蔗间套种绿豆可通过改善土壤环境提高甘蔗的产量和品质[27-29];同时通过7种不同杀菌剂对N.sphaerica的抑菌性测定发现,咪鲜胺和施保功可用以对甘蔗蔗种进行浸种处理或在甘蔗下种前,与细土混合后撒施在甘蔗基部。而在过去也有报道咪鲜胺和苯醚甲环唑在甘蔗病害的防控上发挥重要作用,如咪鲜胺和苯醚甲环唑对甘蔗褐条病有明显的防治效果,但苯醚甲环唑对甘蔗黑孢霉叶斑病病原菌的室内毒力测定效果则欠佳[30]。
4 结论引起种传病害甘蔗黑孢霉叶斑病的病原菌为N.sphaerica,引物Ng1F/Ng1R可以作为田间和室内对甘蔗黑孢霉叶斑病病原菌的检测;通过对N.sphaerica的生物学特性研究发现,该菌的最适生长温度为25 ℃,最适生长pH为7;咪鲜胺药剂0.16 mg/L和施保功药剂2.4 mg/L对N. sphaerica的抑菌效果最显著,抑菌效果均可达到93% 以上,推荐这2种药剂作为甘蔗蔗种处理和田间施用药剂。化学药剂防治仅是防治甘蔗黑孢霉叶斑病发生的一个措施,最有利的防治手段还是加强甘蔗的种苗检测,尤其是在引种时和蔗区调种时。
| [1] |
岑健俊, 张艳, 肖广江, 万忠, 谢君. 2015年广东甘蔗产业发展形势与对策建议[J]. 广东农业科学, 2016, 43(4): 1-5. DOI:10.16768/j.issn.1004-874X.2016.04.001 CEN J J, ZHANG Y, XIAO G J, WAN Z, XIE J. Development situation and countermeasures of Guangdong sugarcane industry in 2015[J]. Guangdong Agricultural Sciences, 2016, 43(4): 1-5. DOI:10.16768/j.issn.1004-874X.2016.04.001 |
| [2] |
王柏辉. 我国甘蔗病害的发生现状与研究进展[J]. 中国糖料, 2007(3): 48-51. DOI:10.3969/j.issn.1007-2624.2007.03.017 WANG B H. The occurrence status and research progress of sugarcane diseases in China[J]. Sugar Crops of China, 2007(3): 48-51. DOI:10.3969/j.issn.1007-2624.2007.03.017 |
| [3] |
XU S Q, WANG J H, SHANG H Y, HUANG Y Z, YAO W, CHEN B S, ZHANG M Q. Transcriptomic characterization and potential marker development of contrasting sugarcane cultivars[J]. Scientific Reports, 2018, 8: 1683. DOI:10.1038/s41598-018-19832-x |
| [4] |
陈月桂, 吴建涛, 杨俊贤, 谢静, 潘方胤, 吴文龙, 刘福业, 邓海华, 齐永文. 广东省甘蔗产业发展战略研究[J]. 广东农业科学, 2012, 39(5): 165-168, 174. DOI:10.3969/j.issn.1004-874X.2012.05.056 CHEN Y G, WU J T, YANG J X, XIE J, PAN F Y, WU W L, LIU F Y, DENG H H, QI Y W. Development strategy analysis of sugarcane industry in Guangdong province[J]. Guangdong Agricultural Sciences, 2012, 39(5): 165-168, 174. DOI:10.3969/j.issn.1004-874X.2012.05.056 |
| [5] |
赵欢欢, 孙东磊, 卢颖林, 陈立君, 付建涛, 龚恒亮, 戴思行, 安玉兴. 我国甘蔗研究近况、热点分析与展望[J]. 甘蔗糖业, 2018(3): 65-70. DOI:10.3969/j.issn.1005-9695.2018.03.013 ZHAO H H, SUN D L, LU Y L, CHEN L J, FU J T, GONG H L, DAI S X, AN Y X. Status, hotspot analysis and outlook of sugarcane research in China[J]. Sugarcane and Canesugar, 2018(3): 65-70. DOI:10.3969/j.issn.1005-9695.2018.03.013 |
| [6] |
林树明. 粤西蔗区主要甘蔗病虫害及高效低毒农药在病虫害防治中的应用[J]. 南方农业, 2019, 13(9). DOI:10.19415/j.cnki.1673-890x.2019.09.001 LIN S M. The main sugarcane pests and diseases and the application of high-efficiency and low-toxic pesticides in the control of pests and diseases in the sugarcane area of western Guangdong[J]. South China Agriculture, 2019, 13(9). DOI:10.19415/j.cnki.1673-890x.2019.09.001 |
| [7] |
李如丹, 张跃彬, 刘少春, 郭家文, 王炎炎. 国内外甘蔗生产技术现状和展望[J]. 中国糖料, 2009(3): 54-56. DOI:10.3969/j.issn.1007-2624.2009.03.021 LI R D, ZHANG Y B, LIU S C, GUO J W, WANG Y Y. Current status and prospects of sugarcane production technology in China and abroad[J]. Sugar Crops of China, 2009(3): 54-56. DOI:10.3969/j.issn.1007-2624.2009.03.021 |
| [8] |
鲁国东, 黎常窗, 潘崇忠, 张学博. 中国甘蔗病害名录[J]. 甘蔗, 1997, 4(4): 19-23. LU G D, LI C C, PAN C Z, ZHANG X B. List of sugarcane diseases in China[J]. Sugarcane, 1997, 4(4): 19-23. |
| [9] |
ROTT P, BAILEY R A, COMSTOCK J C, CROFT B J, GIRARD J, SAUMTALLY A S. A guide to sugarcane diseases[M]. Cirad and Issct, 2000.
|
| [10] |
SHARMA G, ANSHUL ARYA S J, SHARMA S R. Biology and management of sugarcane red rot: A review[J]. Plant Archives, 2017, 17(2): 775-784. |
| [11] |
BAO Y X, XU Y Z, WANG S, YAO Z T, RAO G P, ZHANG M Q. First report of Fusarium sacchari that causes sugarcane wilt disease in china[J]. Plant Disease, 2020, 104: 8. DOI:10.1094/PDIS-02-20-0229-PDN |
| [12] |
WANG J, CHAI Z, BAO Y, WANG H, LI Y, RAO G P, ZHANG M Q. First report of Fusarium commune causing root rot disease of sugarcane (var. Badila)in China[J]. Plant Disease, 2018, 102: 8. DOI:10.1094/PDIS-07-17-1011-PDN |
| [13] |
LI J, ZHANG R Y, ZHANG R Y, WANG X Y, SHAN H L, WANG C M, CANG X Y, HUANG Y K. First report of Alternaria tenuissima causing leaf blight on sugarcane in China[J]. Plant Disease, 2020, 105: 4. DOI:10.1094/PDIS-07-20-1507-PDN |
| [14] |
WHITE T J, BRUNS T, LEE S, TAYLOR J. Amplification and direct sequencing of fungal ribosomal RNA for phylogenetices//Innis MA et al(eds). PCR protocol: a guide to methods and applications[C]. Aeademic Press, San Diego, 1990: 315-322. DOI: 10.0000/PMID1793.
|
| [15] |
方中达. 植病研究方法[M]. 北京: 农业出版社, 1998: 122-125. FANG Z D. Plant disease research methods[M]. Beijing: Agricultural Press, 1998: 122-125. |
| [16] |
CHEN J, XIANG T T, LIU X Y, WANG W H, ZHANG B L, LIU J, ZHOU W, WAN Y J, CHEN G, ZHU H S. First report of Nigrospora sphaerica causing shot hole disease on mulberry in China[J]. Plant Disease, 2017, 102: 1. DOI:10.1094/PDIS-06-17-0914-PDN |
| [17] |
CUI Y P, WU B, PENG A T, LI Z L, LIN J F, SONG X B. First report of Nigrospora leaf blight on sugarcane caused by Nigrospora sphaerica in China[J]. Plant Disease, 2018, 102: 4. DOI:10.1094/PDIS-07-17-1060-PDN |
| [18] |
DUTTA J, GUPTA S, THAKUR D, HANDIQUE P J. First report of Nigrospora leaf blight on tea caused by Nigrospora sphaerica in India[J]. Plant Disease, 2015, 99: 3. DOI:10.1094/PDIS-05-14-0545-PDN |
| [19] |
LIU Y, QIANG T, LING F. First report of Nigrospora sphaerica causing leaf blight on camellia sinensis in China[J]. Plant Disease, 2016, 100: 1. DOI:10.1094/PDIS-04-15-0493-PDN |
| [20] |
ZHENG X R, LIU C L, ZHANG M J, SHANG X L, FANG S Z, CHEN F M. First report of leaf blight of Cyclocarya paliurus caused by Nigrospora sphaerica in China[J]. Crop Protection, 2020, 140: 105453. DOI:10.1094/PDIS-04-15-0493-PDN |
| [21] |
徐林, 吴凯朝, 邓智年, 庞天, 黄成丰, 黄海荣, 李毅杰, 刘晓燕, 王维瓒. 种植密度对甘蔗单芽生长发育及产量的影响[J]. 甘蔗糖业, 2021, 50(1): 51-56. DOI: 1005-9695(2021)01-0051-06. XU L, WU K C, DENG Z N, PANG T, HUANG C F, HUANG H R, LI Y J, LIU X Y, WANG W Z. The effect of planting density on the development and yield in single bud of sugarcane[J]. Sugarcane and Canesugar, 2021, 50(1): 51-56. DOI: 1005-9695(2021)01-0051-06. |
| [22] |
李浩, 韦本辉, 黄金玲, 李志刚, 王令强, 梁晓莹, 李素丽. 粉垄对甘蔗根系结构发育及呼吸代谢相关酶活性的影响[J]. 中国农业科学, 2021, 54(3): 522-532. DOI:10.3864/j.issn.0578-1752.2021.03.006 LI H, WEI B H, HUANG J L, LI Z G, WANG L Q, LIANG X Y, LI S L. Effects of fenlong cultivation on root cell structure and enzyme of respiratory metabolic of sugarcane[J]. Scientia Agricultura Sinica, 2021, 54(3): 522-532. DOI:10.3864/j.issn.0578-1752.2021.03.006 |
| [23] |
COMSTOCK J, GLYNN N, DAVDISON R. Sugarcane rusts in Florida[J]. Proc. Int. Soc. Sugar Cane Technol, 2010, 27: 1-9. |
| [24] |
YANG X P, ISLAM M S, SOOD S, MAYA S, HANSON E A, COMSTOCK J, WANG J P. Identifying Quantitative Trait Loci(QTLs) and developing diagnostic markers linked to orange rust resistance in sugarcane(Saccharum spp.)[J]. Froniters in Plant Sciences, 2018, 9: 350. DOI:10.3389/fpls.2018.00350 |
| [25] |
王晓燕, 李文凤, 黄应昆, 王明强, 卢文洁, 罗志明. 种传甘蔗病害流行特点及防控对策[J]. 中国糖料, 2010(2): 45-48. DOI:10.3969/j.issn.1007-2624.2010.02.015 WANG X Y, LI W F, HUANG Y K, WANG M Q, LU W J, LUO Z M. Epidemiological characteristics of seed-borne sugarcane diseases and their prevention and control strategies[J]. Sugar Crops of China, 2010(2): 45-48. DOI:10.3969/j.issn.1007-2624.2010.02.015 |
| [26] |
李文凤, 王晓燕, 黄应昆, 王明强, 卢文洁, 罗志明. 种传甘蔗病害及温水脱毒种苗检测方法[J]. 西南农业学报, 2010, 23(2): 399-404. DOI:10.3969/j.issn.1001-4829.2010.02.023 LI W F, WANG X Y, HUANG Y K, WANG M, LU W J, LUO Z M. Detection method of sugarcane seed-borne disease and virus-free seedling from warm water[J]. Southwest China Journal of Agricultural Sciences, 2010, 23(2): 399-404. DOI:10.3969/j.issn.1001-4829.2010.02.023 |
| [27] |
程须珍. 绿豆生产技术[M]. 北京: 北京教育出版社, 2016. CHENG X Z. Mung bean production technology[M]. Beijing: Beijing Education Press, 2016. |
| [28] |
LIAN T, MU Y, MA Q, CHENG Y, GAO R, CAI Z, JIANG B, NIAN H. Use of sugarcane-soybean intercropping in acid soil impacts the structure of the soil fungal community[J]. Scientifi c reports, 2018, 8(1): 14488. DOI:10.1038/s41598-018-32920-2 |
| [29] |
罗高玲, 李经成, 蔡庆生, 陈燕华. 甘蔗间种绿豆高效栽培技术[J]. 作物研究, 2020, 34(2): 173-175. DOI:10.16848/j.cnki.issn.1001-5280.2020.02.18 LUO G L, LI J C, CAI Q S, CHEN Y H. High-efficiency cultivation techniques of sugarcane interplanting mung bean[J]. Crop Research, 2020, 34(2): 173-175. DOI:10.16848/j.cnki.issn.1001-5280.2020.02.18 |
| [30] |
钱双宏, 沈林波, 熊国如, 王俊刚, 冯翠莲, 赵婷婷, 张树珍. 甘蔗褐条病病原菌分离鉴定及其室内毒力测定[J]. 热带作物学报, 2015, 36(2): 353-357. DOI:10.3969/j.issn.1000-2561.2015.02.022 QIAN S H, SHEN L B, XIONG G R, WANG J G, FENG C L, ZHAO T T, ZHANG S Z. Isolation, identification and laboratory toxicity determination of the pathogen of sugarcane brown stripe[J]. Chinese Journal of Tropical Crops, 2015, 36(2): 353-357. DOI:10.3969/j.issn.1000-2561.2015.02.022 |
 2021, Vol. 48
2021, Vol. 48