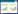文章信息
基金项目
- 广东省粤穗联合基金(2020A1515110358);仲恺农业工程学院人才项目(KA2005408C7)
作者简介
- 郑丽(1984-),女,博士,助理研究员,研究方向为果树病害生物防治,E-mail:bluestar183@163.com.
通讯作者
- 黄石连(1989-),男,博士,助理研究员,研究方向为果树逆境生理学,E-mail:shiil_huang@163.com.
文章历史
- 收稿日期:2010-04-30
2. 广东省农业科学院果树研究所/农业农村部南亚热带果树生物学与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广东 广州 510640;
3. 黄埔海关技术中心,广东 广州 510627
2. Institute of Fruit Tree Research, Guangdong Academy of Agricultural Sciences/Key Laboratory of South Subtropical Fruit Biology and Genetic Resource Utilization, Ministry of Agriculture and Rural Affairs/Guangdong Key Laboratory of Tropical and Subtropical Fruit Tree Research, Guangzhou 510640, China;
3. Deparment of Huangpu Customs Technology Center, Guangzhou 510627, China
【研究意义】荔枝作为中国南方特有的水果,其年总产值达62.88亿元[1],荔枝霜疫霉(Peronophythora litchii Chen ex Ko et al.)是荔枝产区普遍发生且为害严重的重要病害,侵染果实后,造成裂果和烂果,长出白色霉状物,严重影响外观和品质,进一步加速果实褐变,影响鲜果贮藏和销售[2-3]。目前,化学药剂是重要防控措施,存在安全隐患和抗药性风险。寻求高效、安全、无残留、环境友好的生物制剂,切实保证水果产量和品质的需求迫切。生防制剂一般低毒,环境兼容性较好,符合当前绿色生产要求,该方法将成为水果采后病害防控和延缓褐变的重要措施之一。本研究前期优选到生防解淀粉芽孢杆菌(Bacillus amyloliquefaciens)PP19和生防乙酰微小杆菌(Exiguobacterium acetylicum)SI17,拟探究两株菌防控荔枝霜疫病的可能机理,为开发新型绿色农药提供理论基础。
【前人研究进展】研究表明,荔枝霜疫霉菌对羧酸酰胺类杀菌剂的抗性风险水平较低[4]。随杀菌剂的使用推广及用药次数增多,病菌产生抗药性的潜在性风险提高[5]。生物防治由于具备绿色、安全及有效等特点已成为蔬果采后病害防治的研究热点[6-7]。生防菌剂对环境生态友好、安全性高且防治谱宽,在许多蔬果采后病害生物防治中有广泛引用,如柑橘[8]、葡萄[9]、苹果[10]、草莓[11]及梨[12]等。生防菌在荔枝生产和抗病性上的应用也有相关报道,其中以芽孢杆菌属(Bacillus sp.)为主[13-16]。果蔬采后病害的生防机理主要有水解酶[17]、营养和空间竞争[18]、重寄生[19]、分泌次生代谢物[20]以及诱导寄主抗性[21]。诱导抗性指的受到外界的刺激因子通过信号传递激活植物体内的应答信号从而产生广谱持久抗性[22]。据报道,蜡质芽孢杆菌(Bacillus cereus)和枯草芽孢杆菌(B. subtilis)对桃软腐病具有priming效应[23-24],能诱导抗病有关的酶如苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)的合成及合成降解病菌细胞壁的降解酶如几丁质酶(CHI)和β-1, 3-葡聚糖酶(GLU)[25];恶臭假单胞菌Pseudomonas putida处理过的木瓜明显提升抗性酶PAL、过氧化氢酶(CAT)、POD及总酚含量从而抵抗木瓜炭疽病的发生[26];接种红灰链霉菌Streptomyces rubrogriseus可提高番茄根部POD和超氧化物歧化酶(SOD)的活性从而提高抗病性[27];哈茨木霉Trichoderma harzianum诱导过的茄子叶片内的抗病性相关酶SOD、POD、PPO的活性升高抵御黄萎病[28];生防菌梅奇酵母Metschnikowia zizyphicola处理梨果实,提升贮藏期间PAL等抗性基因表达而提高抗病性。
【本研究切入点】从前期研究基础出发,分析两株分离自荔枝果皮的生防菌PP19和SI17的菌体悬浮液对采后荔枝霜疫病的防效,以及其对果皮抗病相关酶的影响,初步解析生防菌可能的作用方式。【拟解决的关键问题】明晰生防菌菌体悬浮液的作用效果,以及植物抗病性酶和相关活性物质的变化;揭示生防菌作用下植物抗病相关生理机制,旨在寻找新型高效的生防菌来防治荔枝果实采后霜疫病,减少荔枝采后运输过程中的经济损失。
1 材料与方法 1.1 菌株培养和植物材料病原菌活化:由华南农业大学植物病理学系真菌实验室提供,荔枝霜疫霉菌株为该实验室2013年从四川泸州某荔枝果园果实上分离获得,命名为SC18。将保存于16 ℃的病原菌在CJA(Carrot juice agar,200 g去皮胡萝卜,榨汁,琼脂15 g,定容至1 L)上活化,25 ℃培养5~7 d,用适量无菌水洗下并经茶漏过滤,滤液收集于烧杯中。反复清洗多次,尽量将孢子囊从菌丝顶端洗脱下来,滤液即为游动孢子囊悬浮液。显微镜观察其个数,调整到5×104个孢子囊/mL,备用。
生防菌活化:从-80 ℃冰箱中取出本实验用生防菌PP19和SI17,在LB(胰蛋白胨10 g、氯化钠10 g、酵母提取物5 g、琼脂糖15 g)平板上划线,28 ℃下培养24 h,转接到LB培养液试管中,28 ℃、200 r/min培养20 h作为种子培养液,以1∶500的比例将种子菌液接到LB培养液中培养24 h,4 ℃、6 000 r/min离心15 min,去除上清液,0.85% NaCl进行等体积重悬浮;随后用滴液法检测浓度,调整至浓度为5×108 CFU/mL,备用。
果实采摘:来自海南儋州南阳农场某果农的妃子笑荔枝,约80% 成熟度采摘到实验室。在室温条件下,摆放到保鲜盒(盒底铺上灭菌滤纸,直径18 cm,灭菌水润湿,保鲜盒规格为323 mm×220 mm×100 mm),随后相关实验以12 h:12 h=光照:黑暗培养,开展实验。
1.2 生防菌菌悬液防效测定试验设5.0×107CFU/mL生防菌PP19和SI17菌悬液,以及0.85% NaCl 10倍液3个处理。采用喷雾处理的方法,24 h后喷雾接种P. litchii。室温25 ℃培养。每个处理3次重复,每个重复30个果实。接种病原菌后24 h开始调查病害严重度。根据蔡学清[13]病害严重度调查方法稍加改善:0级:无病症;1级:接种点有轻微病斑, 坏死面积5% 以下;3级:坏死面积5%~10%;5级:坏死面积10%~25%;7级:坏死面积25%~50%;9级:坏死面积超过50% 或全部白霉(果实)。计算病情指数和防治效果:
病情指数(%)=〔∑(病级数×该病级果数)/(最高病级×总果数)〕×100
防治效果(%)=〔(对照病情指数-处理病情指数)/对照病情指数〕×100
1.3 抗病酶活性和相关物质含量测定样品处理方法同1.2。取样时间点为接种后0、12、24、36、48、60、72 h。去掉果肉,果皮迅速分装在锡箔纸中,液氮速冻25~30 min,放置在-80 ℃冰箱保存,备用。每个处理每次95取样总计9个果实(3次重复,每个重复3个果实)。抗病酶活性和相关物质含量指标分为3类:(1)保护酶和物质含量:超氧化物歧化酶(SOD,superoxide dismutase)、过氧化氢酶(CAT,catalase)、H2O2;(2)抗病酶:β-1, 3-葡聚糖酶(β-1, 3-glucansae,GLU)、几丁质酶(chitinase,CHI)、苯丙氨酸解氨酶(PAL,phenylalanin ammonia-lyase)、过氧化物酶(POD,peroxidase);(3)保鲜相关酶或物质含量:多酚氧化酶(PPO,polyphenol oxidase)、总酚(total phenolic)、花色素苷(anthocyanin)、花色素苷酶(anthocyanase)。测定采用全波长酶标仪(Multiskan Go-1510)或分光光度计。
1.3.1 保护酶和物质含量测定 H2O2:采用试剂盒法检测(南京建成生物工程有限公司),检测OD405。SOD:参考余中莲的方法测定[29],测定OD560。CAT:参照余中莲[29]的方法测定,提取荔枝果皮样品的粗酶液,测定OD405。
1.3.2 抗病酶测定 GLU:采用试剂盒法检测(北京索莱宝科技有限公司),测定OD540值。CHI:参考余中莲的方法测定[29],测定OD585。PAL:采用试剂盒法检测(南京建成生物工程有限公司),1 cm光径石英比色皿,双蒸水调零,测定OD290。POD:采用试剂盒法检测(南京建成生物工程有限公司),双蒸水调零,1 cm光径比色皿,测定OD420。PPO:参照余中莲[29]的方法测定,测定OD398。
1.3.3 其他酶或物质测定 总酚(total phenolic):参照蔡学清[13]的方法,用Folin-Ciocalteu法测定,绘制标准曲线,测定OD700。花色素苷(anthocyanin):参照蔡学清[13]的方法,测定OD510。花色素苷酶(anthocyanase):参照蔡学清[13]的方法,测定OD530。
1.4 数据统计与分析在Microsoft Excel中对病情指数、生防效果、酶活性及物质含量等数据进行处理、分析。采用DPS软件7.05进行LSD Test(P < 0.05),ANOVA Analysis进行各个因子的单因素(One-way)分析。
2 结果与分析 2.1 菌悬液对荔枝霜疫病的生防效果分析PP19和SI17菌悬液分别预处理荔枝果实,接种后36、48、60 h,果实病情指数分别为1.23%、4.98%、32.59% 和0.99%、6.79%、44.20%(图 1A);生防效果分别为88.76%、80.41%、39.59% 和91.01%、73.30%、18.08%(图 1B)。与对照相比,两株生防菌菌悬液接种后36、48 h显著降低妃子笑荔枝果实霜疫病的发生;但接种后60 h与对照差异不显著(图 1)。
|
| 图 1 PP19和SI17菌悬液处理后荔枝果实的病情指数和生防效果 Fig. 1 Disease index and biocontrol efficacy of litchi fruit treated with bacterial suspensions of PP19 and SI17 同组柱上小写英文字母不同者表示差异显著 Different lowercase letters above the bar charts with the same color represent significant differences |
2.2 菌悬液对荔枝果皮相关酶活性和物质含量的影响
PP19和SI17菌悬液预处理果实24 h接种P. litchii,检测11种相关指标。数据分析显示,它们和对照存在差异;后期随着果实褐变和病情加重,各指标活性或含量均呈现下降趋势。
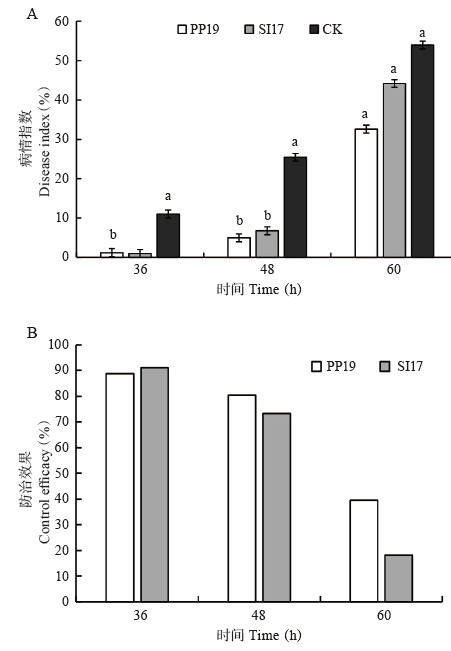
2.2.1 菌悬液对果皮H2O2含量、CAT和SOD活性分析 结果(图 2)显示,H2O2含量呈现“下降-上升-下降”趋势,均在24 h含量最高,随后都下降;对照果皮H2O2含量下降斜率最高,其次为PP19,且在24 h下降幅度达18.92%,其他时间点含量均增加,最高可达74.05%(72 h);SI17处理果皮H2O2含量在24~48 h下降最高,分别为22.58% 和21.36%,72 h增加58.05%。并且,在0~24 h(无病原菌)时,三者差异较小;24~72 h(接种霜疫霉菌)的含量均下降,但PP19含量高于对照,可能此过程具有保护细胞的功能。PP19和SI17处理果实后,CAT活性在48~72 h高于对照,而24~48 h的两个处理和对照的变化趋势较为相似,呈现“平稳-上升-下降-上升”。PP19和SI17处理后,果皮CAT活性仅在48~72 h增幅较大(60 h分别增加15.65% 和19.75%)。PP19和SI17处理果实,在24~48 h果皮SOD活性显著高于对照,随后相似,趋势为“下降-上升-下降”,36 h分别增加18.89% 和17.35%。PP19和SI17菌悬液处理可提高果实的CAT、SOD活性,接种霜疫霉后果皮的H2O2含量表现增加,可能激发了果皮的抗病性。
|
| 图 2 PP19和SI17菌悬液对荔枝果皮H2O2含量及CAT、SOD活性的影响 Fig. 2 Effects of bacterial suspensions of PP19 and SI17 on the content of H2O2 content and CAT, SOD activity in litchi fruit peel |
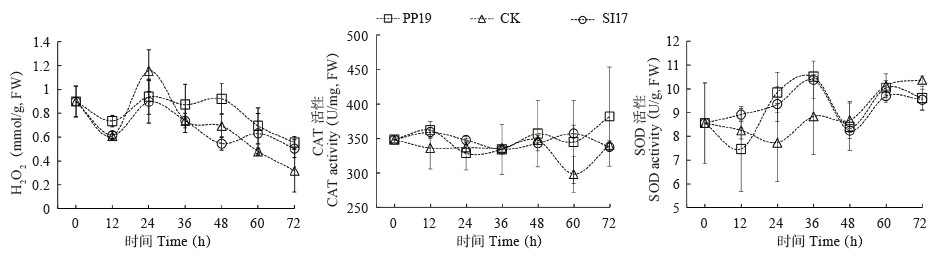
2.2.2 菌悬液对果皮GLU、CHI和PAL活性分析 PP19菌悬液预处理果皮,结果(图 3)显示,接种后36~60 h显著提高果皮GLU活性(分别增加200%、92.23% 和7.84%),而SI17则在12~36 h表现更优(分别增加89.13%、651.18%、184.62%),变化趋势均为“上升-下降-上升-下降”。PP19和SI17菌悬液对CHI活性影响较小,在病原菌侵染后期60~72 h可提高其活性,SI17在48 h活性表现最高(增加12.36%),48~72 h下降幅度和对照无差异,PP19在60~72 h其活性高于对照(分别增加95.29% 和43.63%),且在0~24 h CHI活性和对照无差异;三者变化趋势相似,为“上升-下降-上升-下降”。PP19和SI17处理果皮PAL活性呈现相似趋势“,为上升-下降-上升/下降”,PP19在24~36 h(分别增加11.44% 和12.96%)和60~72 h(分别增加5.55% 和166.90%)活性高于对照,SI17则在60~72 h高于对照(分别增加16.94% 和169.54%),二者均提高PAL活性。
|
| 图 3 PP19和SI17菌悬液对荔枝果皮GLU、CHI和PAL活性的影响 Fig. 3 Effects of bacterial suspensions of PP19 and SI17 on the activity of GLU, CHI and PAL in litchi fruit peel |
2.2.3 菌悬液对果皮POD和PPO活性分析 POD和PPO均表现为对照果皮酶活性高于PP19和SI17处理,其中PP19处理对2种酶影响更大,下降趋势更为显著(变化斜率更大)。PP19和SI17处理果皮POD活性在24、60、72 h分别减少24.96%、25.10%、31.39% 和4.73%、20.68%、30.87%,三者变化趋势相似为“下降-上升”;而PP19处理果皮PPO活性在24、48 h分别减少37.18% 和93.75%,SI17处理果皮PPO活性在24、48、60 h分别减少50%、62.50%、30.16%,三者变化趋势相似为“下降-上升-下降”(图 4)。
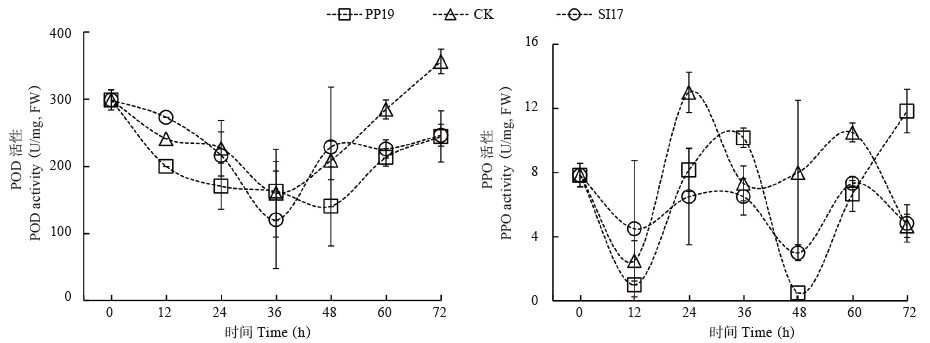
|
| 图 4 PP19和SI17菌悬液对荔枝果皮POD和PPO活性的影响 Fig. 4 Effects of bacterial suspensions of PP19 and SI17 on the activity of POD and PPO in litchi fruit peel |
2.2.4 生防菌对果皮总酚和花色素苷含量及花色素苷酶分析 和褐变有关的酶和物质主要有总酚、花色素苷和花色素苷酶。结果(图 5)显示,菌悬液可增加总酚和花色素苷含量(48、60 h和24、36 h高于对照)。PP19处理可降低花色素苷酶活性(36~60 h),SI17处理后期活性也低于对照,但变化斜率高于PP19处理的果皮,显示PP19处理更利于降低果皮花色素苷酶活性。PP19处理果皮总酚在48、60 h分别增加13.29% 和9.68%,在36 h下降5.39%;SI17处理果皮在60 h增加28.59%,其他时间点总酚含量低于对照,其中在36 h下降20.21%,三者变化趋势相似,均呈现“下降”。PP19处理果皮花色素苷含量和花色素苷酶活性在36 h增加124%、48 h减少78.52%,SI17处理则在72 h增加55%、48 h减少31.17%,花色素苷变化趋势为“下降-上升-下降”,花色素苷酶变化趋势为“下降-上升-下降”。
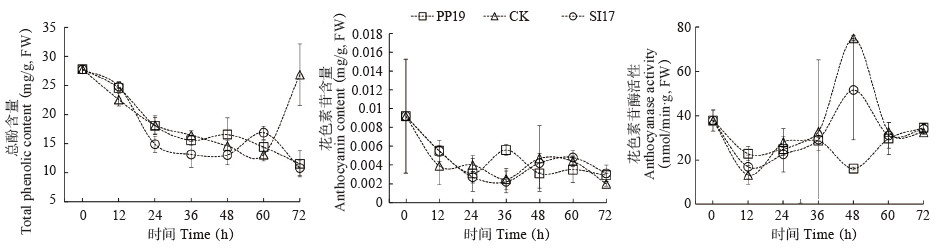
|
| 图 5 PP19和SI17菌悬液对荔枝果皮总酚和花色素苷含量及花色素苷酶活性的影响 Fig. 5 Effects of bacterial suspensions of PP19 and SI17 on the content of total phenolic and activity of anthocyanin and anthocyanase in litchi fruit peel |
3 讨论
生物防治由于其高效持久、环境友好以及无药剂残留的特点被广泛用于防治植物病害,成为防治植物病害的主流研究方向[30]。而生防菌作为一种生物防治的方法,常被用于诱导果实提高自身的抗病性[31-32]。当植物受到病原菌入侵时,体内多种与抗病性有关的酶会参与其中,这些酶作为衡量植物抗病性能力的指标,主要包括PAL、SOD、PPO、CAT、POD等,受到外界生物或者非生物胁迫时植物体内防御酶体系就会被启动[33-35],从而延缓果实劣变[36]、提高植株抗病性[37-38]以及限制病害的扩展[39]。本研究发现,PP19和SI17菌悬液能显著降低荔枝果实霜疫病的发生,且能改变相关抗病保鲜酶的活性。接种后12、36、48 h,生防菌处理抗病相关酶(GLU、CHI、POD、PAL)活性稍高于对照;PP19接种后72 h CAT活性高于对照,SOD活性在36 h高于对照。接种后12~48 h,生防菌处理总酚、花色素苷含量高于对照;PP19和SI17对荔枝果皮酶活性影响不完全相同,对酶活性的影响存在差异,如SI17比PP19更能提高植物CHI活性;PP19处理果皮H2O2含量下降较多;SI17和PP19从48 h开始可降低花色素苷酶活性。
本实验数据POD活性(生防菌处理后POD活性低于对照)和蔡学清[13]报道的研究结果不完全一致,其研究数据显示内生菌处理后荔枝果皮POD活性大于对照。关于POD活性变化趋势,目前并无统一定论,也有文献报道其含量越低越好,其可能参与酚的氧化,活性越高越容易使果皮褐变;但也有研究认为其活性可能与植物抗病相关,比如参与了植物的木质化过程[40]。由此推测,本实验中生防菌处理果皮POD可能主要影响了果皮褐变过程。
在病原菌胁迫下,PP19处理果皮H2O2含量下降较多,对荔枝果实起保护作用;生防菌可提前增加总酚、花色素苷含量(12~48 h高于对照);SI17和PP19从48 h开始可降低花色素苷酶活性,前期(12~36 h)绝对含量虽然高于对照,但变化斜率低于对照,故对照对花色素苷影响更大,导致其含量比生防菌处理的要低。但随着果实褐变和病情加重,活性或含量均表现下降。此研究数据和文献报道保持一致[13, 29]。
4 结论生防菌PP19和SI17菌悬液喷雾预处理荔枝果实后,可显著降低采后荔枝霜疫病的发生;它们处理果实后,可能通过改变果皮相关抗病保鲜酶活性或物质含量起到防病保鲜效果。菌悬液处理果实后,影响果皮CAT、SOD、GLU、PAL、PPO、POD、花色素苷酶的活性和总酚及花色素苷含量;SI17比PP19更能提高果皮CHI活性;PP19对果皮酶活性或相关物质含量影响更大。在下一步研究中,我们将进一步分析两株菌菌悬液对调控酶活性或活性物质相关基因表达的定量分析,深入揭示菌悬液防病的作用机制。
| [1] |
郑重禄. 荔枝霜疫霉病菌及其生物学特性研究概述[J]. 中国南方果树, 2015, 44(6): 157-172. DOI:10.13938/j.issn.1007-1431.20140313 ZHENG Z L. Study on litchi Peronophythora litchii and its biological characteristics[J]. South China Fruits, 2015, 44(6): 157-172. DOI:10.13938/j.issn.1007-1431.20140313 |
| [2] |
KAO C W, LEU L S. Sporangium germination of Peronophythora litchii, the causal organism of litchi downy blight[J]. Mycologia, 1980, 72(4): 737-748. DOI:10.1080/00275514.1980.12021242 |
| [3] |
戚佩坤, 潘雪萍, 刘任. 荔枝霜疫病的研究Ⅰ. 病原菌的鉴定及其侵染过程[J]. 植物病理学报, 1984, 14(2): 113-119. DOI: 10.13926/j.cnki.apps.1984.02.009. QI P K, PAN X P, L IU R. Study on Litchi downy blight Ⅰ. Identification and infection process of pathogenic bacteria[J]. Acta Phytopathologica Sinica, 1984, 14(2): 113-119. DOI: 10.13926/apps.1984.02.009. |
| [4] |
汪汉成. 烯酰吗啉对荔枝霜疫霉(Peronophythora litchii)的生物活性及其抗性研究[D]. 南京: 南京农业大学, 2009. DOI: 10.7666/d.Y2359955. WANG H C. Bioactivity and resistance of dimethomorph to Peronophythora litchii[D]. Nanjing: Nanjing Agricultural University, 2009. DOI: 10.7666/d.Y2359955. |
| [5] |
彭埃天, 凌金锋, 习平根, 宋晓兵, 冼继东, 姜子德. 我国荔枝产区杀菌剂的使用现状及建议[J]. 中国热带农业, 2011(5): 64-67. PENG A T, LING J F, XI P G, SONG X B, XIAN J D, JIANG Z D. Present situation and suggestion of using fungicides in litchi production area of China[J]. China Tropical Agriculture, 2011(5): 64-67. |
| [6] |
AMIL-RUIZ F, BLANCO-PORALES R, MUNOZ-BLANCO J, CABALLERO J L. The strawberry plant defense mechanism: a molecular review[J]. Plant and Cell Physiology, 2011, 52(11): 1873-1903. DOI:10.1093/pcp/pcr136 |
| [7] |
JIANG C H, WU F, YU Z Y, XIE P, KE H J, LI H W, YU Y Y, GUO J H. Study on screening and antagonistic mechanisms of Bacillus amyloliquefaciens 54 against bacterial fruit blotch(BFB)caused by Acidovorax avenae subsp. citrulli[J]. Microbiological Research, 2015, 170: 95-104. DOI:10.1016/j.micres.2014.08.009 |
| [8] |
ZHOU Y H, MA J H, XIE J, DENG L L, YAO S X, ZENG K F. Transcriptomic and biochemical analysis of highlighted induction of phenylpropanoid pathway metabolism of citrus fruit in response to salicylic acid, Pichia membranaefaciens and oligochitosan[J]. Postharvest Biology and Technology, 2018, 142: 81-92. DOI:10.1016/j.postharvbio.2018.01.021 |
| [9] |
刘慧敏. 葡萄采后灰霉病生防酵母菌作用机理及其生防效力改良[D]. 武汉: 华中农业大学, 2010. DOI: 10.7666/d.y1805336. LIU H M. Mechanism of antagonist yeast agaist Botrytis cinerea of grape and improvement of the biocontrol efficacy[D]. Wuhan: Huazhong Agricultural University, 2010. DOI: 10.7666/d.y1805336. |
| [10] |
陈亮亮. 解脂亚罗酵母对苹果采后病害生防效力及诱导苹果抗性相关基因影响的研究[D]. 镇江: 江苏大学, 2016. CHEN L L. Study on the biological control of postharvest diseases of apples and effect of induced resistance relate genes in apples by Yarrowia lipolytica[D]. Zhenjiang: Jiangsu University, 2016. |
| [11] |
GAO P, QIN J X, LI D L, ZHOU S Y. Inhibitory effect and possible mechanism of a Pseudomonas strain QBA5 against gray mold on tomato leaves and fruits caused by Botrytis cinerea[J]. PLoS ONE, 2018, 13(1): e0190932. DOI:10.1371/journal.pone.0190932 |
| [12] |
YAN Y, ZHENG X F, APALIYA M T, YANG H J, ZHANG H Y. Transcriptome characterization and expression profile of defense-related genes in pear induced by Meyerozyma guilliermondii[J]. Postharvest Biology and Technology, 2018, 141: 63-70. DOI:10.1016/j.postharvbio.2018.03.011 |
| [13] |
蔡学清. 荔枝采后主要病原菌的特性及内生细菌对其防治保鲜研究[D]. 福州: 福建农林大学, 2010. CAI X Q. Study on the characteristics of the major postharvest disease pathogen of lychee and its control or preservation by endophytic bacteria [D]. Fuzhou: Fujian Agriculture and Forestry University, 2020. |
| [14] |
JIANG Y M, ZHU X R, LI Y B. Postharvest control of litchi fruit rot by Bacillus subtilis[J]. LWT-Food Science and Technology, 2001, 34(7): 430-436. DOI:10.1006/fstl.2001.0758 |
| [15] |
KORSTEN L, VILLIERS E E D, JAGER E S D, HARMELEN M W S V, HEITMANN A. Biological control of litchi fruit diseases[J]. South African Litchi Growers' Association Yearbook, 1993, 5: 36-40. |
| [16] |
陈海英, 林健荣, 廖富蘋, 林碧敏. 多粘类芽孢杆菌CP7对荔枝霜疫霉菌的抗菌活性及其作用机制[J]. 园艺学报, 2010, 37(7): 1047-1056. DOI:10.16420/j.issn.0513-353x.2010.07.003 CHEN H Y, LIN J R, LIAO F P, LIN B M. Antibacterial activity and mechanism of Paenibacillus Polymyxa CP7 against Peronophythora litchi[J]. Acta Horticulturae Sinica, 2010, 37(7): 1047-1056. DOI:10.16420/j.issn.0513-353x.2010.07.003 |
| [17] |
LASTOCHKINA O, SEIFIKALHOR M, ALINIAEIFARD S, BAYMIEV A, PUSENKOVA L, GARIPOVA S, KULABUHOVA D, MAKSIMOV I. Bacillus spp. : Efficient biotic strategy to control postharvest diseases of fruits and vegetables[J]. Plants(Basel), 2019, 8(4): 97. DOI: 10.3390/plants8040097.
|
| [18] |
周海莲. 葡萄有孢汉逊酵母(Hanseniaspora uvarum)对灰霉病抑制机理的探讨[D]. 南京: 南京农业大学, 2012. DOI: 10.7666/d.Y2361338. ZHOU H L. The inhibition mechenism study of Hanseniaspora uvarum control of gray mold[D]. Nanjing: Nanjing Agricultural University, 2012. DOI: 10.7666/d.Y2361338. |
| [19] |
戴忠良, 高克祥. 生防酵母菌株的分离筛选及其防治苹果果实轮纹病效果[J]. 山东农业科学, 2018, 50(9): 102-108. DOI:10.14083/j.issn.1001-4942.2018.09.022 DAI Z L, GAO K X. Isolation and screening of biocontrol yeast strains and their control effects on apple fruit ring rot[J]. Shandong Agricultural Sciences, 2018, 50(9): 102-108. DOI:10.14083/j.issn.1001-4942.2018.09.022 |
| [20] |
司琳媛. 葡萄有孢汉逊酵母(Hanseniaspora uvarum)挥发性代谢物对草莓采后贮藏性能的影响[D]. 南京: 南京农业大学, 2015. SI L Y. Effect of volatile metabolites of Hanseniaspora uvarum on storability of postharvest strawberry[D]. Nanjing: Nanjing Agricultural University, 2015. |
| [21] |
ROMONAZZI G, SANZANI S M, BI Y, TIAN S P, MARTINEZ P G, ALKAN N. Induced resistance to control postharvest decay of fruit and vegetables[J]. Postharvest Biology and Technology, 2016, 122: 82-94. DOI:10.1016/j.postharvbio.2016.08.003 |
| [22] |
PIETERSE C M J, ZAMIOUDIS C, BERENDSEN R L, WELLER D M, WE ES, S C M V, BAKKER, P A H M. Induced systemic resistance by beneficial microbes[J]. Annual Review of Phytopathology, 2014, 52: 347-375. DOI:10.1146/annurev-phyto-082712-102340 |
| [23] |
WANG X L, XU F, WANG J, JIN P, ZHENG Y H. Bacillus cereus AR156 induces resistance against Rhizopus rot through priming of defense responses in peach fruit[J]. Food Chemistry, 2012, 136: 400-406. DOI:10.1016/j.foodchem.2012.09.032 |
| [24] |
WANG X L, WANG L, WANG J, JIN P, LIU H X, ZHENG Y H. Bacillus cereus AR156-induced resistance to Colletotrichum acutatum is associated with priming of defense responses in loquat fruit[J]. PloS ONE, 2014, 9(11): e112494. DOI:10.1371/journal.pone.0112494 |
| [25] |
HAMMERSCHMIDT. Challenge inoculation reveals the benefits of resistance priming[J]. Physiological and Molecular Plant Pathology, 2009, 73: 59-60. DOI:10.1016/j.pmpp.2009.06.002 |
| [26] |
SHI J Y, LIU A Y, LI X P, FENG S J, CHEN W X. Identification of endophytic bacterial strain MGP1 selected from papaya and its biocontrol effects on pathogens infecting harvested papaya fruit[J]. Journal of the Science of Food and Agriculture, 2010, 90(2): 227-232. DOI:10.1002/jsfa.3798 |
| [27] |
金娜, 卢修亮, 文洋, 刘倩, 简恒. 红灰链霉菌HDZ-9-47对番茄生长及其防御酶的影响[J]. 植物病理学报, 2016, 46(6): 833-840. DOI:10.13926/j.cnki.apps.2016.06.013 JIN N, LU X L, WEN Y, LIU Q, JIAN H. Effect of Streptomyces rubrogriseus HDZ-9-47 on the growth and defense enzymes of tomato[J]. Acta Phytopathologica Sinica, 2016, 46(6): 833-840. DOI:10.13926/j.cnki.apps.2016.06.013 |
| [28] |
刘朝辉, 曾华兰, 何炼, 叶鹏盛, 韦树谷, 张骞方, 李琼英. 哈茨木霉T23对茄子叶片内防御酶系的影响[J]. 西南农业学报, 2014, 27(5): 1945-1948. DOI:10.16213/j.cnki.scjas.2014.05.022 LIU C H, ZENG H L, HE L, YE P S, WEI S G, ZHANG Q F, LI Q Y. Effect of Trichoderma harzianum T23 on defence enzymes in leaves of eggplants[J]. Southwest China Journal of Agricultural Sciences, 2014, 27(5): 1945-1948. DOI:10.16213/j.cnki.scjas.2014.05.022 |
| [29] |
余中莲. 氨基寡糖素诱导荔枝果实对霜疫霉病的抗性[D]. 福州: 福建农林大学, 2012. YU Z L. Induced resistance of the litchi fruit to litchi downy blight by oligosaccharins[D]. Fuzhou: Fujian Agriculture and Forestry Universit, 2012. |
| [30] |
MANCINI V, ROMANAZZI G. Seed treatments to control seedborne fungal pathogens of vegetable crops[J]. Pest Management Science, 2014, 70(6): 860-868. DOI:10.1002/ps.3693 |
| [31] |
DROBY S, WISNIEWSKI M, MACARISIN D, WILSON C. Twenty years of postharvest biocontrol research: Is it time for a new paradigm[J]. Postharvest Biology and Technology, 2009, 52(2): 137-145. DOI:10.1016/j.postharvbio.2008.11.009 |
| [32] |
SHARMA R R, SINGH D, SINGH R. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: a review[J]. Biological Control, 2009, 50(3): 205-221. DOI:10.1016/j.biocontrol.2009.05.001 |
| [33] |
常伟东, 惠亮亮, 徐敏, 付爱根, 王玉华. 植物叶绿体蛋白酶研究进展[J]. 基因组学与应用生物学, 2016, 36(3): 728-739. DOI:10.13417/j.gab.035.000728 CHANG W D, HUI L L, XU M, FU A G, WANG Y H. Research progress of the plant chloroplast protease[J]. Genomics and Applied Biology, 2016, 36(3): 728-739. DOI:10.13417/j.gab.035.000728 |
| [34] |
陈军, 高贵珍, 赵亮, 徐礼生, 张兴桃, 薛文. 干旱胁迫下壳聚糖浸种对小麦萌发期保护酶活性的影响[J]. 基因组学与应用生物学, 2015, 35(10): 2251-2254. DOI:10.13417/j.gab.034.002251 CHEN J, GAO G Z, ZHAO L, XU L S, ZHANG X T, XUE W. Effects of wheat seeds soaking chitosan on protective enzymetic activities in germination stage under drought stress[J]. Genomics and Applied Biology, 2015, 35(10): 2251-2254. DOI:10.13417/j.gab.034.002251 |
| [35] |
赵秀娟, 唐鑫, 程蛟文, 李卫鹏, 谭澍, 胡开林. 酶活性、丙二醛含量变化与苦瓜抗枯萎病的关系[J]. 华南农业大学学报, 2013, 34(3): 372-377. ZHAO X J, TANG X, CHENG J W, LI W P, TAN S, HU K L. The relationship between malonaldehyde content, enzymatic changes and the resistance of bitter gourd to fusarium wilt[J]. Journal of South China Agricultural University, 2013, 34(3): 372-377. |
| [36] |
窦国霞, 蒋春号, 郭虹娜, 刘佳, 贺沁玉, 肖红梅. 葡萄汁有孢汉逊酵母对采后草莓灰霉病抗性诱导机理研究[J]. 园艺学报, 2019, 46(7): 1290-1302. DOI:10.16420/j.issn.0513-353x.2019-0308 DOU G X, JIANG C H, GUO H N, LIU J, HE Q Y, XIAO H M. Studies on the resistance induction of Hanseniaspora uvarum to postharvest gray mold in strawberry[J]. Acta Horticulturae Sinica, 2019, 46(7): 1290-1302. DOI:10.16420/j.issn.0513-353x.2019-0308 |
| [37] |
宋金秋, 崔丽红, 赵军. 一株生防菌处理条件下对猕猴桃溃疡病抗病相关酶活性的影响[J]. 分子植物育种, 2019, 17(19): 6495-6500. DOI:10.13271/j.mpb.017.006495 SONG J Q, CUI L H, ZHAO J. Effects of a bio-control bacteria on the activity of disease resistance related enzymes in kiwifruit canker[J]. Molecular Plant Breeding, 2019, 17(19): 6495-6500. DOI:10.13271/j.mpb.017.006495 |
| [38] |
张红楠, 张旭辉, 吴頔. 生防烟管菌对植物抗病性相关酶活性及叶绿素含量的影响[J]. 浙江农业科学, 2017, 58(12): 2226-2230, 2234. DOI:10.16178/j.issn.0528-9017.20171245 ZHANG H N, ZHANG X H, WU Y. Effects of tobacco-control fungi on the activities of enzymes and chlorophyll content related to plant disease resistance[J]. Journal of Zhejiang Agricultural Sciences, 2017, 58(12): 2226-2230, 2234. DOI:10.16178/j.issn.0528-9017.20171245 |
| [39] |
洪永聪, 范晓静, 来玉宾, 胡方平. 枯草芽孢菌株TL2在茶树体内的内生定殖[J]. 茶叶科学, 2006, 26(4): 270-274. DOI:10.13305/j.cnki.jts.2006.04.007 HONG Y C, FAN X J, LAI Y B, HU F P. Colonization of Bacillus subtilis strain TL2 in tea plant[J]. Journal of Tea Science, 2006, 26(4): 270-274. DOI:10.13305/j.cnki.jts.2006.04.007 |
| [40] |
SARMA B K, YADAV S K, SINGH S, SINGH H B. Microbial consortium-mediated plant defense against phytopathogens: Readdressing for enhancing efficacy[J]. Soil Biolog y and Biochemistry, 2015, 87: 25-33. DOI:10.1016/j.soilbio.2015.04.001 |
 2021, Vol. 48
2021, Vol. 48