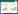文章信息
基金项目
- 广东省大学生创新创业训练计划项目(S202010566035)
作者简介
- 伍楚妍(2000—),女,在读本科生,研究方向为动物医学,E-mail:wuchuyan2021@163.com.
通讯作者
- 徐春厚(1962—),男,硕士,教授,研究方向为兽医微生物学与免疫学,E-mail:xuchunhou@sina.com.
文章历史
- 收稿日期:2021-04-29
【研究意义】随着2020年养殖业全面禁用抗生素,寻找安全可靠且高效的抗生素替代产品刻不容缓。海洋低温、高压、缺氧、寡营养、高盐等极端自然条件,致使生活其中的微生物产生结构新颖多样、活性独特的天然代谢产物[1]。因陆生生物资源日益匮乏,人们逐渐把开发天然活性物质的研究重点转移到海洋。
微生态制剂能调节畜禽肠道菌群、拮抗致病菌、增强机体免疫力、降低疾病发生率[2],是一种抗生素的理想替代品。在用于制作微生态制剂的菌源库中,芽孢杆菌具有独特优势。芽孢杆菌能形成芽孢,对周围的环境条件如热量、胃酸和湿度具有很高的稳定性[3]。在生长过程中,芽孢杆菌能产生许多具有抗菌活性的代谢物质,如多粘菌素、表面活性素、双效菌素等[4],且这些抗菌物质具有抗菌谱广、对酸碱度要求不高、热稳定性好等特点[5-6]。此外,芽孢杆菌可产具有很强蛋白酶、脂肪酶、淀粉酶活性的代谢产物[7],用于饲料添加剂可提高饲料转化率,并有效改善养殖动物的肠道生态[8]。因此,在海洋不同环境条件下生存的芽孢杆菌可能会在调节机体肠道微生态平衡方面迸发出更大潜力。
【前人研究进展】目前国内对海洋源芽胞杆菌的研究主要围绕其对重金属的吸附作用[9]、抗肿瘤物质研发和产蛋白酶发酵条件优化等[10-11],以及应用于微生物菌剂和杀菌剂研发、红树林生态系统保护和修复及防治蔬果病害等方面[12-13],这些研究都具有较大的市场价值与社会价值。国外对海洋源芽孢杆菌的研究主要围绕海洋芽孢杆菌Sh10菌株所产细菌素对奇异变形杆菌的抗生物膜活性,首次报道可产生纳米维生素的海洋芽孢杆菌及研究其不同环境下纳米维生素的产量、可用性等,可应用于医疗与工业方面[14-15]。【本研究切入点】近10年来,国内外较少有关具有潜在应用特色的海洋源芽孢杆菌的报道。本研究从临近南海、拥有火山锥和丰富红树林资源的雷州半岛近岸海域的海洋生物及环境中采集样品,以期获得性能优良的芽孢杆菌益生菌株,为海洋源芽孢杆菌的菌源库扩充容量,为今后制备微生态制剂提供优质菌源。【拟解决的关键问题】对8株优质海洋益生菌株通过菌株分离、生化试验,形态、结构、染色、培养特征的观察及16SrRNA基因测序进行分离鉴定,并进行消化酶活性物质测定。
1 材料与方法 1.1 试验材料供试样品采于2020年下半年,在雷州半岛近岸海域采集红树根、叶、茎和土壤及中国对虾、虾姑、蟹、鱼、蚝和螺等,共计22份样品。将鱼鳃和内脏、螺、蟹内脏、虾和虾姑消化道以及红树根、茎、叶剪碎,分别加入等量生理盐水;取红树林土壤,加入生理盐水;将样品生理盐水混合液充分震荡,1 000 r/min离心5 min,取上清液,即为待检样品液。
改良的营养肉汤和营养琼脂:1% 大豆蛋白胨、0.5% 牛肉浸膏、2%NaCl、0.1%K2HPO4;121℃灭菌30 min。
27种细菌微量生化反应管,购于杭州微生物试剂有限公司。
1.2 芽孢杆菌的分离鉴定1.2.1 菌株分离 将待测样品液按2% 接种于改良的营养肉汤试管中,置于80 ℃水浴锅中30 min,取出后迅速冷却,于35 ℃温箱中培养24 h;将该培养物划线接种于改良的营养琼脂平板,35 ℃培养24~48 h,根据菌落的形状、大小、光泽、边缘、颜色特征,选取不同的菌落进行涂片、染色和镜检;将分离菌株接种于改良的营养琼脂斜面,纯培养后保存于4 ℃冰箱中。
1.2.2 菌株形态、结构、染色和培养特征观察 用显微镜观察革兰氏染色后分离菌株的菌体形态、排列方式、有无芽孢及革兰染色特征;肉眼观察其在改良的营养琼脂平板上的菌落特征。
1.2.3 菌株的生化试验 将分离菌株接种于细菌微量生化反应管中,35 ℃培养24~48 h,观察结果;根据《伯杰细菌鉴定手册》[16]对分离菌株进行生化试验鉴定。
1.2.4 菌株的16S rRNA基因测序 PCR反应体系(30 μL):上游引物5'-AGAGTTTGAT CMTGGCTCAG-3'(27F)和下游引物5'-GGTTA CCTTGTTACGACTT-3'(1492R)(10 μmol/μL,各0.75 μL),ddH2O(12.9 μL),2×MightAmp Buffer(15 μL),MightyAmp DNA Polymerase (0.6 μL);用无菌牙签挑取少量分离菌株的菌落,加入体系中混匀作为DNA模板。PCR扩增程序:98 ℃ 2 min;95 ℃ 10 s、57 ℃ 15 s、68 ℃ 90 s,共40个循环;最后在10 ℃下保存10 min。取扩增产物进行2% 琼脂糖凝胶电泳检测,将预期产物送至生工生物工程(上海)股份有限公司测序。测序结果在NCBI和EZBioCloud数据库进行同源性分析,利用MEGA 6.0软件进行多序列比对,并构建系统发育树。
1.3 菌株消化酶代谢产物测定1.3.1 代谢产物提取 将分离菌株接种于改良的营养肉汤,35 ℃培养24 h,得到第1代培养物;将其按5% 再次接种于改良的营养肉汤,35 ℃、220 r/min震荡培养48 h,得到第2代培养物;将第2代培养物以4 000 r/min离心30 min,取上清液用0.22 μm的微孔滤膜过滤,滤液即为待测的代谢产物。
1.3.2 消化酶活性测定 用福林-酚比色法[17]、淀粉-碘比色法[16]和橄榄油乳化法[18]分别测定代谢产物中的蛋白酶、淀粉酶和脂肪酶活性。3种酶活力单位定义分别为:100 mL消化酶在37 ℃、30 min内水解10 mg淀粉为1个淀粉酶活力单位;每毫升消化酶在37 ℃下每分钟水解酪素产生1 μg酪氨酸为1个蛋白酶活力单位;每毫升消化酶在一定条件下水解脂肪每分钟产生1 μg分子脂肪酸为1个脂肪酶活力单位。
2 结果与分析 2.1 芽孢杆菌的分离鉴定2.1.1 芽孢杆菌的分离 22份样品经高温处理、富集培养和分离培养,共获得43株分离菌(表 1),经形态、结构和染色特征观察,均为疑似芽孢杆菌。
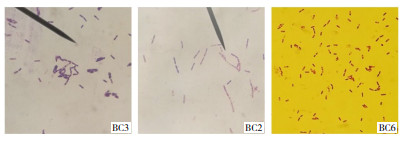
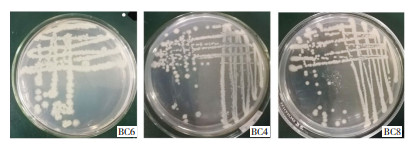
2.1.2 菌株的形态、结构、染色及培养特征 43株分离菌均为革兰氏阳性杆菌,以单个、双链与多链的排列方式存在,均形成芽孢,芽孢多位于菌体中央,小于菌体(图 1)。改良的营养琼脂平板上的菌落均呈灰白色,表面轻度隆起、有皱褶,边缘不规则(图 2)。
|
| 图 1 分离菌株的形态、结构和染色特征(1 000×) Fig. 1 Morphology, structure and staining characteristics of isolated strains(1 000×) |
|
| 图 2 分离菌株的菌落特征 Fig. 2 Colony characteristics of isolated strains |
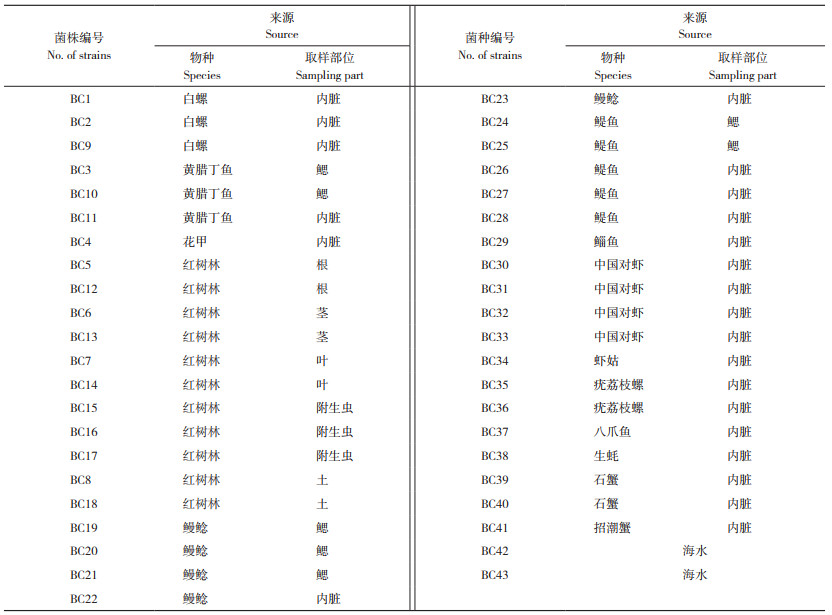
2.1.3 菌株的生化试验结果 选取3种消化酶综合活性最强的8株分离菌进行生化试验,由表 2可知,8株分离菌均可利用七叶甘、果糖和蔗糖,对甘露糖、纤维二糖、麦芽糖、蕈糖和葡萄糖的发酵试验及尿素酶产生试验结果不一,其他糖类发酵试验、硝酸盐还原试验和枸橼酸盐利用试验结果均为阴性。
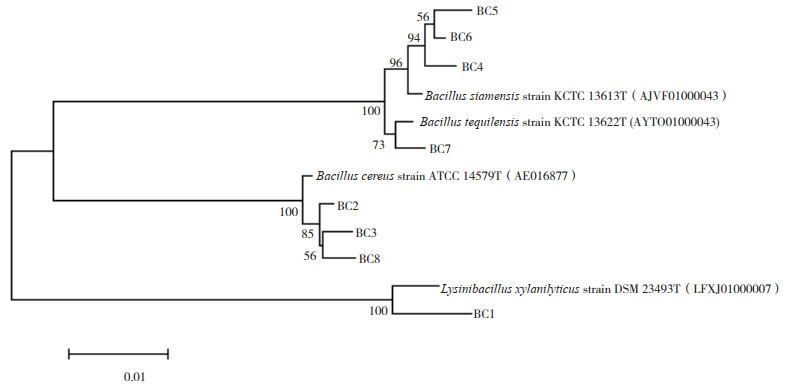
2.1.4 菌株的16S rRNA基因测序结果 选取3种消化酶综合活性最强的8株分离菌进行16S rRNA基因测序,通过PCR扩增得到8株疑似芽孢杆菌的16S rRNA序列,由凝胶电泳分析结果(图 3)可见,目的条带基因片段长度约为1 500 bp。在NCBI和EZBioCloud网站上进行同源性比对,发现8株分离菌归属为芽孢杆菌属的4个种(表 3)。菌株BC2、BC3、BC6、BC7和BC8与其最相似模式菌株的相似性均达99% 以上。结合其形态染色特征和生化试验结果,鉴定为蜡样芽孢杆菌3株、暹罗芽孢杆菌1株和特基拉芽孢杆菌1株,分别命名为蜡样芽孢杆菌BC3(Bacillus cereus BC3)、蜡样芽孢杆菌BC8(Bacillus cereus BC8)、蜡样芽孢杆菌BC2 (Bacillus cereus BC2)、暹罗芽孢杆菌BC6(Bacillus siamensis BC6)和特基拉芽孢杆菌BC7(Bacillus tequilensis BC7)。菌株BC1与解木糖赖氨酸芽孢杆菌模式菌株相似性为98.35%,疑似为解木糖赖氨酸芽孢杆菌,命名为解木糖赖氨酸芽孢杆菌BC1(Lysinibacillus xylanilyticus BC1);菌株BC4和BC5与暹罗芽孢杆菌模式菌株相似性分别为98.49% 和98.54%,疑似为暹罗芽孢杆菌,命名为暹罗芽孢杆菌BC4(Bacillus siamensis BC4) 和暹罗芽孢杆菌BC5(Bacillus siamensis BC5)

|
| 图 3 8株分离菌的16S rRNA基因的PCR扩增结果 Fig. 3 PCR amplification results of 16S rRNA genes of 8 isolated strains |

|
由本研究所构建的系统发育树(图 4)可知,8株分离菌可分为4支,其中菌株BC4、BC5和BC6与暹罗芽孢杆菌模式菌株在同一进化水平上;菌株BC7与特基拉芽孢杆菌模式菌株在同一进化水平上;菌株BC2、BC3和BC8与蜡样芽孢杆菌模式菌株在同一进化水平上;菌株BC1与解木糖赖氨酸芽孢杆菌模式菌株在同一进化水平上。
|
| 图 4 基于8株分离菌16S rRNA序列构建的系统发育树 Fig. 4 Phylogenetic tree constructed based on the 16S rRNA sequences of 8 isolated strains |
2.2 消化酶活性测定
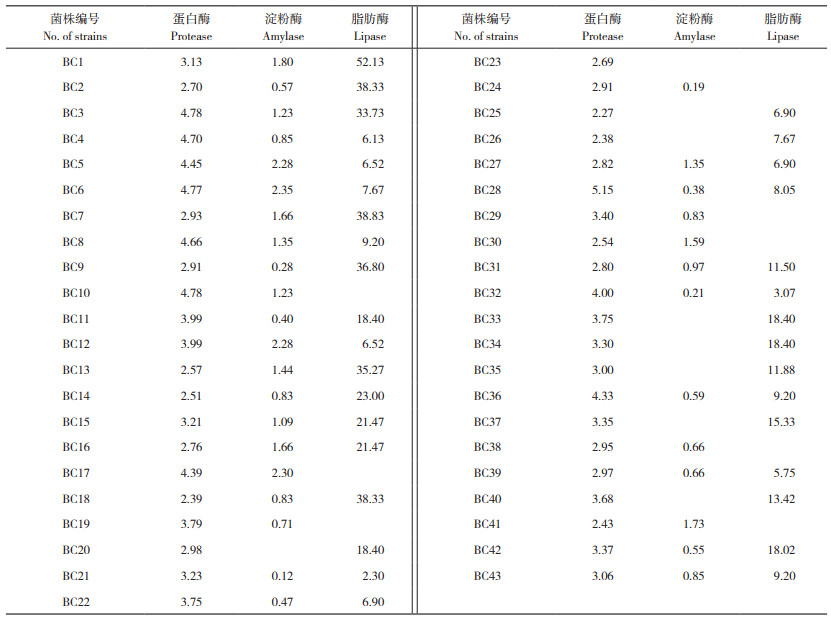
由表 4可知,在43株分离菌中筛选得到蛋白酶、淀粉酶与脂肪酶3种消化酶综合活性最强的8株菌(BC1、BC2、BC3、BC4、BC5、BC6、BC7和BC8)。8株芽孢杆菌均产生蛋白酶、淀粉酶和脂肪酶代谢产物,以脂肪酶的活性最强;3种消化酶中,蜡样芽孢杆菌BC3产生蛋白酶活性最高,为4.78 U/mL;暹罗芽孢杆菌BC6产生的淀粉酶活性最高,为2.35 U/mL;解木糖赖氨酸芽孢杆菌BC1产生的脂肪酶活性最高,为52.13 U/mL。
|
3 讨论
海洋拥有复杂的生态系统与生存环境,与陆地环境有较大差异,可能会进化出具有优良代谢产物的微生物。本研究从临近南海、拥有火山锥和丰富红树林资源的雷州半岛近岸海域采集样品,并分离鉴定出产消化酶活性代谢产物的芽孢杆菌,具备一定的理论与应用创新。在所分离鉴定的产消化酶(蛋白酶、淀粉酶、脂肪酶)的8株芽孢杆菌中,来源于红树林的菌株较多。已有研究在红树林中分离出纤维素酶较高产的芽孢杆菌[19],表明红树林独特的生存环境与复杂的生态系统可能会赋予微生物良好的生存条件。
芽孢杆菌可产生含有蛋白酶、脂肪酶、淀粉酶等多种酶活性的代谢产物,也可在机体新陈代谢的过程中合成未知因子来增强消化酶活性,可有效促进营养成分的吸收,现已作为益生菌应用于家禽微生态制剂[20]。在消化酶活性结果中,菌株BC1、BC3和BC7的综合酶活性最高。BC7为特基拉芽孢杆菌,该菌所产脂肪酶活性相对较高。相关研究报道,在嗜极端细菌中分离鉴定出产脂肪酶的特基拉芽孢杆菌,其所产脂肪酶的分子水平在各领域应用中具有很大潜能[21]。菌株BC3和BC8属蜡样芽孢杆菌,其产蛋白酶和淀粉酶活性较强,孙娜等[22]也从海水鱼肠道中分离出产蛋白酶和淀粉酶的蜡样芽孢杆菌,在海水鱼的养殖中极具潜力。已有研究在鸡的日粮中添加蜡样芽孢杆菌制剂,能够增加肉鸡重量、肠道消化酶活性及免疫机能[23]。菌株BC6和BC5为暹罗芽孢杆菌,该种芽孢杆菌含有相对较高的蛋白酶和淀粉酶活性,已有报道暹罗芽孢杆菌作为饲料添加剂或发酵剂应用于畜禽养殖中以提高生产性能[24]。目前有关解木糖赖氨酸芽孢杆菌产生消化酶活性方面的研究未见报道。
本研究分离的芽孢杆菌所产脂肪酶活力最高为52.13 U/mL,蛋白酶活力最高为4.78 U/mL,淀粉酶活力最高为2.35 U/mL。蒋磊等[25]在肉鸡日粮中添加市售凝结芽孢杆菌制剂,测定十二指肠中脂肪酶、胰蛋白酶和淀粉酶活力分别为80.80 (±6.62)、225.43(±31.22)、21.54(±1.46)U/mL,表明本研究所测消化酶活性与市售芽孢杆菌仍有较大差异,但不排除有部分消化酶活性受芽孢杆菌在机体内的增强作用。闫一博等[26]在研究实验室保存菌种枯草芽孢杆菌KG109时,饲喂最低剂量组肉鸡的十二指肠脂肪酶、蛋白酶和淀粉酶活力分别为1.89(±0.06)、20.55(±0.61)、194.91(±3.83)U/mL,本研究所测的脂肪酶活性相对较高。本研究后续将对8株芽孢杆菌的药物敏感性、致病性及毒性等进行测定,以期为应用于微生态制剂奠定基础。
4 结论本研究成功从雷州半岛近岸海域采集的22个样品中分离出疑似芽孢杆菌43株,其所产的代谢产物均有消化酶(蛋白酶、淀粉酶和脂肪酶)活性,但水平参差不齐,其中筛选3种消化酶综合活性最高的8株分离菌鉴定出种名,分别为3株蜡样芽孢杆菌、3株暹罗芽孢杆菌、1株特基拉芽孢杆菌及1株解木糖赖氨酸芽孢杆菌,这些杆菌的代谢产物脂肪酶活性较高,蛋白酶和淀粉酶活性较低,为海洋源芽孢杆菌微生态制剂的相关应用提供菌种资源积累。
| [1] |
柏凤月, 倪孟祥. 海洋微生物来源的抗菌活性物质研究进展[J]. 化学与生物工程, 2016, 33(5): 15-19, 25. DOI:10.3969/j.issn.1672-5425.2016.05.004 BAI F Y, NI M X. Research progress on antimicrobial bioactive substances from mar ine microorganisms[J]. Chemical & Bioengineering, 2016, 33(5): 15-19, 25. DOI:10.3969/j.issn.1672-5425.2016.05.004 |
| [2] |
曹艳子, 翟秀艳, 顾艳丽, 刘艳, 林洋, 单春乔, 李志兴, 江国托. 浅谈饲用益生菌在养殖业中的应用[J]. 饲料研究, 2021(7): 149-152. DOI:10.13557/j.cnki.issn1002-2813.2021.07.034 CAO Y Z, ZHAI X Y, GU Y L, LIU Y, LIN Y, SHAN C Q, LI Z X, JIANG G T. Application of feed probiotics in breeding industry[J]. Feed Research, 2021(7): 149-152. DOI:10.13557/j.cnki.issn1002-2813.2021.07.034 |
| [3] |
LEE N K, KIM W S, PAIK H D. Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier[J]. Food Science and Biotechnology, 2019, 28(5): 1297-1305. DOI:10.1007/s10068-019-00691-9 |
| [4] |
陶宗, 王海华, 申权, 彭喜旭, 周定港, 邬姝欣, 邹琰. 链霉菌和芽孢杆菌的生防机理及抗菌活性产物[J]. 农业与技术, 2019, 39(14): 1-5. DOI:10.19754/j.nyyjs.20190730001 TAO Z, WANG H H, SHEN Q, PENG X X, ZHOU D G, WU S X, ZOU Y. biological prevention mechanism and antibacterial activity products of Streptomyces and Bacillus[J]. Agriculture and Technology, 2019, 39(14): 1-5. DOI:10.19754/j.nyyjs.20190730001 |
| [5] |
O SC R I Z J C, L A SA I, PI SA BA R RO A G. Detection a nd characterization of cerein 7, a new bacteriocin produced by Bacillus cereus with a broad spectrum of activity[J]. FEMS Microbiology Letters, 1999, 178(2): 337-341. DOI:10.1016/S0378-1097(99)00370-5 |
| [6] |
OSC RIZ J C, PISABARRO A G. Characterization and mechanism of action of cerein 7, a bacteriocin produced by Bacillus cereus Bc7[J]. Journal of Applied Microbiology, 2000, 89(2): 361-369. DOI:10.1046/j.1365-2672.2000.01123.x |
| [7] |
游龙, 韩茵, 张凯, 祁自忠. 芽孢杆菌产胞外酶的活性分析及其对凡纳滨对虾的作用[J]. 中国海洋大学学报(自然科学版), 2018, 48(3): 80-87. DOI:10.16441/j.cnki.hdxb.20160404 YOU L, HAN Y, ZHANG K, QI Z Z. Profiling the enzyme activities of bacillus cultures and their dietary effects ongrowth and digestive enzymes of Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2018, 48(3): 80-87. DOI:10.16441/j.cnki.hdxb.20160404 |
| [8] |
PATTNAIK P, KAUSHIK J K, GROVER S, BATISH V K. Purification and characterization of a baceriocin-like compound(Lichenin) produced anaerobically by Bacillus licheniformis isolated from water buffalo[J]. Journal of applied microbiology, 2001, 91(4). DOI:10.1046/j.1365-2672.2001.01429.x |
| [9] |
刘洋, 吴进怡, 闫小宇, 柴柯. 海洋环境中芽孢杆菌对聚氨酯清漆涂层分解的影响[J]. 中国腐蚀与防护学报, 2021, 41(1): 36-42. DOI:10.11902/1005.4537.2020.087l LIU Y, WU J Y, YAN X Y, CHAI K. Effect of Bacillus flexus on degradation of polyurethane varnish coating in marine environment[J]. Journal of Chinese Society for Corrosion and Protection, 2021, 41(1): 36-42. DOI:10.11902/1005.4537.2020.087l |
| [10] |
衣尧, 郑兰红, 陈世建, 盛军, 孙谧. 两株海洋微生物抗肿瘤代谢产物的筛选及其菌种鉴定[J]. 渔业科学进展, 2014, 35(6): 114-119. DOI:10.11758/yykxjz.20140617 YI Y, ZHENG L H, CHEN S J, SHENG J, SUN M. Screening of antitumor metabolites from two marine microorganisms and their strain identification[J]. Sustainable Development of Marine Fisheries, 2014, 35(6): 114-119. DOI:10.11758/yykxjz.20140617 |
| [11] |
朱祥杰, 王震, 苑志欣, 郝建华, 郑兰红. 海洋芽孢杆菌N11-8产蛋白酶的发酵条件优化[J]. 渔业科学进展, 2018, 39(6): 155-163. DOI:10.19663/j.issn2095-9869.20171009002 ZHU X J, WANG Z, YUAN Z X, HAO J H, ZHENG L H. Optimization of fermentation conditions of Bacillus sp. N11-8 on the production of protease PBN11-8[J]. Progress in Fishery Sciences, 2018, 39(6): 155-163. DOI:10.19663/j.issn2095-9869.20171009002 |
| [12] |
凌娟, 董俊德, 张燕英, 王聪, 林丽云, 杨清松, 张颖. 一株海洋解磷巨大芽孢杆菌及其应用: 中国, CN109517756A[P]. 2019-03-26. LING J, DONG J D, ZHANG Y Y, WANG C, LIN L Y, YANG Q S, ZHANG Y. One Bacillus megaterium and its Application: China, CN109517756A[P]. 2019-03-26. |
| [13] |
李思源, 谢远芳, 代新红, 周蕲, 李扬. 一种含有海洋芽孢杆菌的杀菌组合物及其应用: 中国, CN109042739A[P]. 2018-12-21. LI S Y, XIE Y F, DAI X H, ZHOU Q, LI Y. A bactericidal composition containing Bacillus marinus and its application: China, CN109042739A[P]. 2018-12-21. |
| [14] |
FATEMEH S, ASMAT A, GIRES U. In vitro anti-biofilm activity of bacteriocin from a marine Bacillus sp. strain Sh10 against Proteus mirabilis[J]. Iranian journal of microbiology, 2020, 12(1): 52-61. |
| [15] |
ABOUELKHEIR S S, KAMARA M S, ATIA S M, AMER S A, YOUSSEF M I, ABDELKAWY R S, KHATTAB S N, SABRY S A. Novel research on nanocellulose production by a marine Bacillus velezensis strain SMR: a comparative study[J]. Scientific reports, 2020, 10(1): 14202-14202. DOI:10.1038/s41598-020-70857-7 |
| [16] |
布坎南 R E, 吉本斯NE N E. 伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984. BUCHANAN R E, GIBBONS N E. Bergey's manual of determinative bacteriology[M]. Eighth Edition. Beijing: Science Press, 1984. |
| [17] |
杨成林, 林淦旻, 常林瑞, 刘学迁, 刘峰, 赵彦翠. 单环刺螠(Urechis unicinctus)幼体肠道消化酶活性的测定方法[J]. 河北渔业, 2020(1): 10-16. DOI:10.3969/j.issn.1004-6755.2020.01.003 YANG C L, LIN G M, CHANG L R, LIU X Q, LIU F, ZHAO Y C. Determination of digestive enzyme activities in the intestine of Urechis unicinctus larvae[J]. Hebei Fisheries, 2020(1): 10-16. DOI:10.3969/j.issn.1004-6755.2020.01.003 |
| [18] |
滕宏飞, 王丹静, 徐青, 辛建美, 罗红宇. 橄榄油乳化法测定脂肪酶活性的优化研究[J]. 食品工业, 2011, 32(6): 80-83. TENG H F, WANG D J, XU Q, XIN J M, LUO H Y. Optimization study of olive oil emulsification method determining lipase activity[J]. The Food Industry, 2011, 32(6): 80-83. |
| [19] |
胡芮, 孙晓晖, 杨淼森, 唐旭, 徐长安, 贾若琨. 红树林生境产嗜热纤维素酶芽孢杆菌的筛选及其活性分析[J]. 应用海洋学学报, 2020, 39(3): 352-358. DOI:10.3969/J.ISSN.2095-4972.2020.03.006 HU R, SUN X H, YANG M S, TANG X, XU C A, JIA R K. Screening and activity analysis of thermophilic cellulase-producing Bacillus sp. from mangrove sediments[J]. Journal of Applied Oceanography, 2020, 39(3): 352-358. DOI:10.3969/J.ISSN.2095-4972.2020.03.006 |
| [20] |
蒋磊, 吕永平, 刘敏. 微生态制剂在家禽生产中的应用研究综述[J]. 洛阳师范学院学报, 2017, 36(5): 32-35. DOI:10.16594/j.cnki.41-1302/g4.2017.05.009 JIANG L, LYU Y P, LIU M. An overview on the application of probiotics in poultry production[J]. Journal of Luoyang Normal University, 2017, 36(5): 32-35. DOI:10.16594/j.cnki.41-1302/g4.2017.05.009 |
| [21] |
VERMA S, KUMAR R, KUMAR P, SHARMA D, GAHLOT H, SHARMA P K, MEGHWANSHI G K. Cloning, characterization, and structural modeling of an extremophilic bacterial lipase isolated from saline habitats of the Thar Desert[J]. Applied Biochemistry and Biotechnology, 2020, 192(2): 557-572. DOI:10.1007/s12010-020-03329-3 |
| [22] |
孙娜, 王腾腾, 韩慧宗, 张明亮, 王斐, 姜海滨. 两株海水鱼肠道芽孢杆菌的分离鉴定及特性分析[J]. 海洋渔业, 2019, 41(5): 606-615. DOI:10.13233/j.cnki.mar.fish.2019.05.008 SUN N, WANG T T, HAN H Z, ZHANG M L, WANG F, JIANG H B. Isolation, identification and characteristics of two Bacillus associated from intestine of marine fishes[J]. Marine Fisheries, 2019, 41(5): 606-615. DOI:10.13233/j.cnki.mar.fish.2019.05.008 |
| [23] |
张娇. 蜡样芽孢杆菌PAS38对肉鸡生长性能、消化酶活性及免疫功能的影响[D]. 成都: 四川农业大学, 2018. ZHANG J. Effects of Baillus cereus PAS38 on the growth performance, digestive enzyme activity and immune function of broilers[D]. Chendu: Sichuan Agricultural University, 2018. |
| [24] |
林志楷, 林文珍. 暹罗芽孢杆菌研究进展[J]. 亚热带植物科学, 2019, 48(4): 391-396. DOI:10.3969/j.issn.1009-7791.2019.04.016 LIN Z K, LIN W Z. Research progress on Bacillus siamensis[J]. Subtropical Plant Science, 2019, 48(4): 391-396. DOI:10.3969/j.issn.1009-7791.2019.04.016 |
| [25] |
蒋磊, 苏绍辉, 陈杰. 凝结芽孢杆菌对肉鸡肠道形态和菌群的影响[J]. 白城师范学院学报, 2021, 35(2): 48-53. JIANG L, SU S H, CHEN J. Effects of Bacillus coagulans on intestinal morphology and flora of broilers[J]. Journal of Baicheng Normal University, 2021, 35(2): 48-53. |
| [26] |
闫一博, 丁小玲, 陈美琪, 盛环宇, 张琳琨, 季志远, 姜润深, 王在贵. 枯草芽孢杆菌KG109对肉鸡饲喂效果的研究[J]. 动物营养学报, 2021, 33(1): 270-284. DOI:10.3969/j.issn.1006-267x.2021.01.028 YAN Y B, DING X L, CHEN M Q, SHENG H Y, ZHANG L K, JI Z Y, JIANG R S, WANG Z G. Study on feeding effects of Bacillus subtilis KG109 on broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 270-284. DOI:10.3969/j.issn.1006-267x.2021.01.028 |
 2021, Vol. 48
2021, Vol. 48