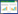文章信息
基金项目
- 广东省重点领域研发计划项目(2020B020220003);广东省基础与应用基础研究基金-粤穗联合基金(2020A1515111138);广东省农业科学院科技创新战略专项资金(高水平农科院建设)-人才项目(R2020PYJG003);广东省蔬菜新技术研究重点实验室开放基金(201902)
作者简介
- 陈凤(1998—),女,在读硕士生,研究方向为蔬菜分子生物学,E-mail:chen20192159f@163.com.
通讯作者
- 李梅兰(1964—),女,博士,教授,研究方向为蔬菜遗传育种与分子生物学,E-mail:15935485975@163.com; 江彪(1983—),男,博士,研究员,研究方向为蔬菜遗传育种与分子生物学,E-mail:jiangbiao198354@163.com.
文章历史
- 收稿日期:2021-05-17
2. 广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室,广东 广州 510640
2. Vegetable Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory for New Technology Research on Vegetables, Guangzhou 510640, China
【研究意义】冬瓜(Benincasa hispida Cogn.)是我国重要的蔬菜作物,对调节蔬菜淡季、保证周年供应有着重要作用[1]。酵母双杂交技术是研究蛋白质互作的重要分子生物学技术,也是研究生物大分子互作和调控的重要方法。构建高质量cDNA文库是运用酵母双杂交技术的前提,其中均一化cDNA文库可增加克隆低丰度mRNA的机会,克服基因转录水平的巨大差距给文库筛选和分析带来的障碍[2]。此外,构建冬瓜酵母双杂交cDNA文库为探究冬瓜基因功能奠定重要的材料基础。【前人研究进展】构建均一化cDNA文库对新基因发掘并研究其调节网络具有重要作用,而运用SMART技术结合DSN均一化处理是构建均一化酵母文库的常用方法。李真真等[3]利用该技术构建了大白菜pol型雄性不育花蕾均一化cDNA文库。茄子SmEDS1正调控青枯病抗性[4],肖熙鸥等[5]利用酵母双杂交技术从相应的均一化cDNA酵母文库中筛选到包括TCP转录因子在内的9个茄子SmEDS1互作蛋白,推测SmEDS1可能通过与TCP转录因子互作调控水杨酸的合成,进而调控茄子的青枯病抗性。酵母双杂交技术是研究蛋白质分子间相互作用的有效手段[6]。构建高质量的酵母双杂交cDNA文库是深入研究基因功能、高效率高质量进行酵母杂交实验的基础[7]。在白菜[3]、甜瓜[8]、草莓[9]、黄瓜[10]、番茄[11]等蔬菜作物中已构建了cDNA文库。张文慧[10]通过构建黄瓜顶芽cDNA文库,以CsWIP1构建双杂交诱饵质粒,以CsPI的启动子片段构建单杂交诱饵质粒,筛选与其有相互作用的成分,获得有效基因和单克隆测序。王洋等[11]以番茄的根、叶、花及不同发育时期的果实为材料,构建酵母双杂交文库,并用于互作蛋白筛选。【本研究切入点】冬瓜应用基础研究起步相对较晚,但基因组测序及核心种质资源基因组重测序的完成显著促进了冬瓜分子生物学的快速发展[12],目前已对冬瓜果重、果实长度、果皮颜色等重要性状进行了基因定位[1]。然而,冬瓜酵母双杂交cDNA文库的构建仍未见报道,一定程度上限制了依赖于酵母双杂交技术的冬瓜基因功能研究。【拟解决的关键问题】本研究以冬瓜参考基因组测序所用材料B227的根、茎、叶、雄花和嫩果等不同组织为试验材料,构建高质量的冬瓜酵母双杂交cDNA文库,以期为冬瓜蛋白质互作等试验提供物质条件,为深入开展基因功能研究奠定基础。
1 材料与方法 1.1 试验材料供试材料为冬瓜自交系B227(冬瓜参考基因组测序材料),由广东省农业科学院蔬菜研究所提供,于2019年春季种植在广东省农业科学院白云基地。在坐果期选取长势良好植株的根、茎、叶、雄花、嫩果(开花后5 d)等组织,放置液氮中速冻后,于-80℃超低温冰箱保存备用。实验过程中主要采用cDNACloneMinerTM Ⅱ cDNA Library Construction Kit(Invitrogen)文库构建试剂盒进行文库构建。PureLink® HiPure Plasmid Filter Midiprep Kit、LRClonaseTM Ⅱ Enzyme Mix、ElectroMAXTM DH10BTM T1 Phage Resistant Cells购自Life。cDNACloneMinerTM Ⅱ cDNA Library Construction Kit试剂盒、Platinum® Taq DNA Polymerase试剂盒、Gateway® BP Clonase® Ⅱ Enzyme Mix试剂盒、PureLink® HiPurePlasmid Filter Midiprep Kit试剂盒均购自Invitrogen公司。DSN酶试剂盒购自Evrogen公司。
1.2 RNA提取和mRNA分离取适量不同组织样品,利用CTAB法分别提取各组织总RNA并等量混合,随后按照Invitrogen公司构建cDNA文库操作说明书进行mRNA的分离和纯化,用1% 琼脂糖凝胶电泳测定总RNA和mRNA的完整性,用NanoDrop 2000蛋白核酸定量测定仪测定其浓度和质量。
1.3 双链cDNA合成以分离得到的mRNA为模板,利用SuperScript Ⅲ RT酶按照试剂盒SuperScriptTM Plasmid System with Gate-way Technology for cDNA Synthesis and Cloning说明书进行cDNA第一条链的合成;以反转录后的第一链cDNA为模板,与在Escherichia coli DNA Ligase、E. coli DNA Polymerase I和E. coli RNase H及T4 DNA Polymerase的作用下反应合成cDNA第二链,随后与三框att B1 Adapter重组接头连接。
1.4 cDNA均一化处理按照DSN酶试剂盒(Evrogen)说明,进行带接头双链cDNA的DSN均一化处理。以处理过的cDNA为模板,按照Platinum® Taq DNA Polymerase(Invitrogen)说明书进行2轮PCR扩增,PCR反应程序:95 ℃ 1 min,95 ℃ 15 s,66 ℃ 20 s,72 ℃ 3 min,20个循环。然后按照文库构建试剂盒说明进行cDNA分级分离。
1.5 cDNA初级文库构建按照Gateway® BP Clonase® Ⅱ Enzyme Mix说明,处理得到的cDNA和pDONR222载体的BP重组反应,重组产物通过电转化方法转化ElectroMAX DH10B细胞后,加2mL S.O.C. 培养基至电转化杯中,将菌液吸至15 mL离心管中,在37℃摇床中225~250 r/min振荡培养1h后涂布LB平板,37℃培养箱中过夜培养,培养2d计数。在平板中随机挑取24个单克隆,以pDONR222F(5'-TCCCAGTCACGACGTTGTAAAA CGACG GCCAGTCTT-3')和pDONR222R(5'-AG AGCTGCCAGGAAACAGCTATGACCATGTAATA CGAC TC-3')为正、反向引物进行菌落PCR,PCR反应程序:94 ℃ 5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,35个循环,72 ℃ 5 min。按照“文库库容量(CFU)=平板上的克隆数/50 μL× 1 000倍×1×103 μL×文库菌液总体积(mL)”的方法,计算初级文库库容量和初级文库重组率:

|
取初级文库菌液接种至100mL肉汤培养基(含50μg/mL卡那霉素)中,30℃下250 r/min摇菌培养至OD600为1.0。使用PureLink® HiPurePlasmid Filter Midiprep Kit提取文库质粒,并将pGADT7-DEST载体与初级文库质粒混合进行LR重组反应。重组产物电转化大肠杆菌感受态细胞DH10B后,添加2mL S.O.C. 培养基到电转化杯中,将菌液吸至15 mL离心管中,置于37 ℃、225~250 r/min培养1 h。培养结束后,取菌液1 μL按照1︰1 000稀释,取50 μL涂布平板,37℃培养过夜,第2天计数。剩余培养物加入甘油至终浓度为20%并存于-80℃,此为酵母文库菌液。随机挑取24个克隆进行菌落PCR鉴定,以ADR(5'-GTGA ACTTGCGGGGTTTTTCAGTATCTACGATT-3')和T7(5'-TAATACGACTCACTATAGGGCGA GCGCCGCCATG-3')为正、反向引物进行PCR反应,反应产物经1% 琼脂糖凝胶检测。
2 结果与分析 2.1 总RNA提取及mRNA分离采用CTAB法提取冬瓜不同组织RNA,等量混合后进行RNA质量检测。经1% 琼脂糖凝胶电泳检测,结果显示28S和18S条带清晰,宽度和亮度约为2 ︰ 1,无拖尾现象,核糖体RNA条带清晰且完整、稳定性好(图 1A)。总RNA经分离和纯化后获得mRNA,利用琼脂糖凝胶电泳检测mRNA质量,结果(图 1B)显示纯化后的mRNA弥散性分布、长度分布均匀、条带范围分布广,拖带最亮部分大于500 bp。表明分离纯化的mRNA质量良好,可作为建库起始样品。

|
| 图 1 总RNA提取(A)及mRNA分离(B) Fig. 1 Total RNA extraction(A) and mRNA isolation(B) |
2.2 均一化cDNA初级文库的构建
由图 2可知,均一化处理后,与原来的cDNA相比,均一化的cDNA没有较亮的特异条带,片段呈均匀弥散分布,表明不同片段的转录产物拷贝数已是相似数量,实现了不同转录本拷贝数量的均一化。
|
| 图 2 cDNA均一化处理 Fig. 2 cDNA homogenization treatment |
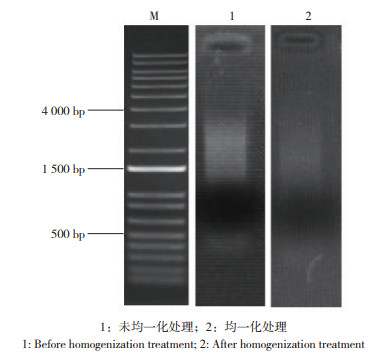
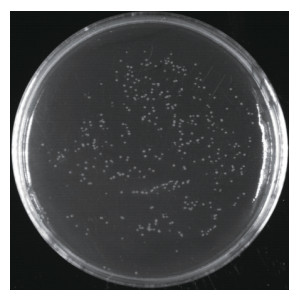
以均一化的cDNA为模板构建初级文库,经统计,平均每个平板菌落生长的克隆数为206个(图 3),计算出初级文库库容量为8.24×106CFU。随机挑选文库中24个单克隆进行菌落PCR鉴定,琼脂糖凝胶电泳结果显示均有扩增产物,初级文库重组率为100%;扩增出的插入片段大小不一,插入片段平均长度大于850 bp,主要分布在850~3 000 bp,说明转入了大小不等的片段(图 4)。以上结果表明,所构建的均一化cDNA初级文库重组率较高、质量好,可用于后续次级文库的构建。
|
| 图 3 初级文库库容量鉴定 Fig. 3 Identification of primary library capacity |
|
| 图 4 初级文库重组率检测 Fig. 4 Detection of recombination rate of primary library |
2.3 次级文库的构建及质量鉴定
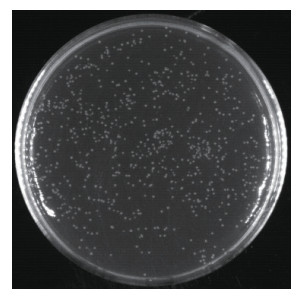
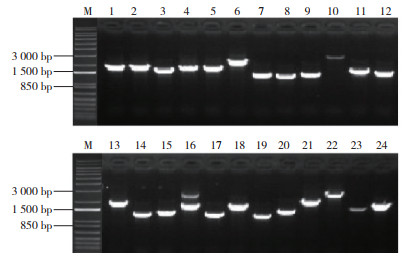
将pGADT7-DEST载体与初级文库质粒稀释后混合于LR重组反应体系,重组产物电转化大肠杆菌感受态细胞DH10B后,培养得到酵母文库菌液。取菌液10 μL按照1 ︰ 1 000稀释后,取50 μL涂布LB平板计数生长克隆用于库容量鉴定。平均每个平板菌落生长的克隆数为258个(图 5),根据公式计算冬瓜酵母双杂交cDNA文库的库容量为1.03×107CFU,足以克隆到低丰度表达的基因。随机挑取24个克隆进行菌落PCR鉴定,用琼脂糖凝胶电泳检测插入cDNA片段的大小。由图 6可知,挑取的24个单菌落均有效扩增,表明得到的酵母文库阳性重组率达100%;扩增出的插入片段大小集中在850~3 000 bp,条带之间大小存在明显差异,表明文库多态性良好;扩增条带基本上都大于1 000 bp,表明文库中长片段所占比例较大,插入片段序列的完整性较好。综上所述,本研究构建的酵母文库完整性好、覆盖度高,能反映来自冬瓜组织的遗传信息,符合酵母双杂交筛选要求,可用于后续互作蛋白筛选或蛋白与DNA互作等相关试验。
|
| 图 5 酵母双杂交cDNA文库库容量鉴定 Fig. 5 Identification of yeast two-hybrid cDNA library capacity |
|
| 图 6 酵母双杂交cDNA文库重组率鉴定 Fig. 6 Identification of recombination rate of yeast two-hybrid cDNA library |
3 讨论
酵母杂交技术是进行基因功能研究的重要手段,构建高质量的酵母文库是进行酵母杂交技术的基础。为避免文库中组织特异性表达基因的丢失,本研究以冬瓜参考基因组所用材料B227的根、茎、叶、雄花和嫩果等不同组织为材料,构建均一化酵母双杂交cDNA文库。高纯度、完整性好的mRNA是构建文库的关键,直接影响文库质量[13]。本研究提取的冬瓜组织混合RNA样本经琼脂糖凝胶电泳检测,条带清楚,无明显降解,纯度和完整性较高;分离纯化后的mRNA呈弥散状均匀分布,质量较高,符合建库要求。cDNA文库的质量可根据其代表性和重组序列的完整性进行评价[14-16],且一个具备完整信息的cDNA文库的库容量至少应达到1×106 CFU[17]。本研究构建的初级和次级cDNA文库的库容量分别为8.24×106 CFU和1.03×107 CFU,容量均达到建库标准,说明本文库覆盖度完整,满足了低丰度mRNA的筛选要求。文库中的重组cDNA插入片段大小和基因的重组率代表重组序列的完整性[18-19]。植物cDNA长度在0.5~3.0 kb之间,文库插入片段过小或过大均会对文库质量造成一定影响[20]。本研究构建的初级和次级cDNA文库基因重组率均是100%,且插入片段主要集中在850~3 000 bp,说明本文库重组的cDNA序列遗传信息完整性高,符合cDNA文库的完整性好、高质量等要求。
cDNA文库的普遍应用已取得一定成果,不仅可以用于目的基因克隆,而且还适用于基因功能研究。花生AhRRS5基因是花生响应青枯病菌侵染的正调控因子[21],陈玉婷等[22]利用酵母双杂交技术从青枯病菌诱导的花生根组织cDNA文库中筛选到包括AhSBT1.6在内的互作蛋白,并通过双分子荧光互补验证了AhRRS5与AhSBT1.6体内互作关系,为研究AhRRS5基因提供花生青枯病菌抗性的分子机制奠定了重要基础。通过酵母双杂交技术,廖钰秋等[23]从马铃薯cDNA文库中筛选到若干StMAPKK1互作蛋白,为研究该基因参与植物生长发育等功能提供依据。
在冬瓜及其变种节瓜中,研究者进行了部分基因的克隆和表达分析。冬瓜BhMAPK15在高温、低温和干旱等非生物胁迫下表达量发生变化,表明该基因参与冬瓜非生物胁迫响应[24]。节瓜CqACS基因受GA3诱导表达,且在普通材料中雄花和雌花中的表达量显著高于雌性系材料,表明CqACS可能与节瓜性型分化有关[25]。此外,本课题组及其他冬瓜研究团队已经开展重要农艺性状的基因定位,之后将会进行候选基因的挖掘和功能验证。冬瓜cDNA文库的缺乏在一定程度上限制了冬瓜基因功能的研究工作,因此,本研究所构建的冬瓜酵母双杂交cDNA文库具有重要意义,为后续开展相关基因功能研究奠定了基础。
4 结论本研究以冬瓜参考基因组测序材料B227的根、茎、叶、雄花、嫩果等不同组织为材料,经过RNA提取、mRNA分离、cDNA合成并进行DSN均一化处理后,以此为模板连接到pGADT7- DEST载体,成功构建了冬瓜均一化酵母双杂交cDNA文库。该cDNA文库库容量为1.03×107 CFU,重组率为100%,插入片段主要集中在850~3 000 bp。文库中长片段所占比例较大,插入片段序列的完整性较好,均一化处理提升了研究表达丰度较低蛋白的成功率。综上所述,本研究所构建的酵母文库完整性好、覆盖度高,能反映来自冬瓜组织的遗传信息,符合酵母双杂交筛选要求,可用于后续依赖于酵母双杂交技术的互作蛋白筛选或蛋白与DNA互作等相关试验,为冬瓜基因功能研究、分子调控网络解析的开展提供了条件。
| [1] |
谢大森, 江彪, 刘文睿, 薛舒丹, 张白鸽. 优质、抗病冬瓜多样化育种研究进展[J]. 广东农业科学, 2020, 47(11): 50-59. DOI:10.16768/j.issn.1004-874X.2020.11.006 XIE D S, JIANG B, LIU W R, XUE S D, ZHANG B G. Research progress on diversified breeding of high-quality and disease-resistant wax gourd[J]. Guangdong Agricultural Sciences, 2020, 47(11): 50-59. DOI:10.16768/j.issn.1004-874X.2020.11.006 |
| [2] |
晏慧君, 黄兴奇, 程在全. cDNA文库构建策略及其分析研究进展[J]. 云南农业大学学报, 2006(1): 1-6. DOI:10.16211/j.issn.1004-390x(n).2006.01.001 YAN H J, HUANG X Q, CHENG Z Q. cDNA library construction strategy and analysis research progress[J]. Journal of Yunnan Agricultural University, 2006(1): 1-6. DOI:10.16211/j.issn.1004-390x(n).2006.01.001 |
| [3] |
李真真, 武佩琪, 程亚雄, 宋红霞, 李梅兰, 侯雷平, 许小勇. 大白菜雄性不育花蕾均一化cDNA文库的构建及评价[J]. 植物生理学报, 2018, 54(2): 291-296. DOI:10.13592/j.cnki.ppj.2017.0497.ppj.2017.0497 LI Z Z, WU P Q, CHENG Y X, SONG H X, LI M L, HOU L P, XU X Y. Construction and evaluation of flower bud normalized cDNA library of male sterile of Chinese cabbage(Brassica rapa L. pekinensis)[J]. Acta Plant Physiology, 2018, 54(2): 291-296. DOI:10.13592/j.cnki.ppj.2017.0497.ppj.2017.0497 |
| [4] |
李可, 肖熙鸥, 林文秋, 李威, 吕玲玲, 曹必好. EDS1正调控茄子抗青枯病反应[J]. 热带作物学报, 2018, 39(2): 332-337. DOI:10.3969/j.issn.1000-2561.2018.02.018 LI K, XIAO X O, LIN W Q, LI W, LYU L L, CAO B H. EDS1 positively regulates the resistance of eggplant tobacterial wilt[J]. Acta Tropical Crops, 2018, 39(2): 332-337. DOI:10.3969/j.issn.1000-2561.2018.02.018 |
| [5] |
肖熙鸥, 林文秋, 李可, 冯雪峰, 李威, 邹华芬, 金辉. 茄子Enhanced disease susceptibility 1互作蛋白的初步筛选与分析[J]. 热带作物学报, 2018, 39(8): 1580-1584. DOI:10.3969/j.issn.1000-2561.2018.08.016 XIAO X O, LIN W Q, LI K, FENG X F, LI W, ZOU H F, JIN H. Preliminary screening and analysis of eggplant enhanced disease susceptibility 1 interaction proteins[J]. Journal of Tropical Crops, 2018, 39(8): 1580-1584. DOI:10.3969/j.issn.1000-2561.2018.08.016 |
| [6] |
周敬伟, 付涵予, 李萌萌, 刘英奎, 刘永. 酵母双杂交系统在本科实验教学中的应用[J]. 实验技术与管理, 2020, 37(7): 164-168. DOI:10.16791/j.cnki.sjg.2020.07.037 ZHOU J W, FU H Y, LI M M, LIU Y K, LIU Y. Application of yeast two-hybrid system in undergraduate experimentalteaching[J]. Experimental Technology and Management, 2020, 37(7): 164-168. DOI:10.16791/j.cnki.sjg.2020.07.037 |
| [7] |
李颖波, 宗营杰, 刘成洪, 陆瑞菊, 黄剑华, 杜志钊, 许建华, 王亦菲. 盐胁迫下大麦酵母双杂交文库的构建与鉴定[J]. 上海农业学报, 2019, 35(6): 1-5. DOI:10.15955/j.issn1000-3924.2019.06.01 LI Y B, ZONG Y J, LIU C H, LU R J, HUANG J H, DU Z Z, XU J H, WANG Y F. Construction and identification of barley yeast two-hybrid library under salt stress[J]. Shanghai Journal of Agriculture, 2019, 35(6): 1-5. DOI:10.15955/j.issn1000-3924.2019.06.01 |
| [8] |
吴会杰, 康保珊, 彭斌, 刘丽锋, 古勤生. 甜瓜响应甜瓜坏死斑点病毒侵染的cDNA文库构建[J]. 中国蔬菜, 2020(9): 36-40. DOI:10.3969/j.issn1000-2561.2018.02.018 WU H J, KANG B S, PENG B, LIU L F, GU Q S. Construction of cDNA library of muskmelon in response to muskmelon necrosis spot virus infection[J]. Chinese Vegetables, 2020(9): 36-40. DOI:10.3969/j.issn1000-2561.2018.02.018 |
| [9] |
谷思, 刘璐, 李安然, 张伟伟, 赵帅琪, 邢宇. 草莓果实酵母双杂交文库的构建及FvM4K1互作蛋白的筛选[J]. 园艺学报, 2021, 48(6): 1067-1078. DOI:10.16420/j.issn.0513-353x.2020-0674 GU S, LIU L, LI A R, ZHANG W W, ZHAO S Q, XING Y. Construction of strawberry fruit yeast two-hybrid library and screening of FvM4K1 interaction protein[J]. Acta Horticultural Science, 2021, 48(6): 1067-1078. DOI:10.16420/j.issn.0513-353x.2020-0674 |
| [10] |
张文慧. 黄瓜花发育基因CsWIP1和CsPI的互作组分筛选[D]. 杨凌: 西北农林科技大学, 2020. DOI: 10.27409/d.cnki.gxbnu.2020.001158. ZHANG W H. Screening of interaction components of cucumber flower development genes CsWIP1 and CsPI[D]. Yangling: Northwest SciTech University of Agriculture and Forestry, 2020. DOI: 10.27409/d.cnki.gxbnu.2020.001158.d.cnki.gxbnu.2020.001158. |
| [11] |
王洋, 张政, 王莹莹, 冯国栋, 陈丹阳, 周宇, 牛向丽. 利用番茄cDNA酵母双杂交文库筛选Pti4互作蛋白[J]. 安徽农业科学, 2019, 47(18): 111-114. DOI:10.3969/j.issn.0517-6611.2019.18.029 WANG Y, ZHANG Z, WANG Y Y, FENG G D, CHEN D Y, ZHOU Y, NIU X L. Using tomato cDNA yeast two-hybrid library to screen Pti4 interaction protein[J]. Journal of Anhui Agricultural Sciences, 2019, 47(18): 111-114. DOI:10.3969/j.issn.0517-6611.2019.18.029 |
| [12] |
XIE D S, XU Y C, WANG J P, LIU W R, ZHOU Q, LUO S B, HUANG W, HE X M, LI Q, PENG Q W, YANG X Y, YUAN J Q, YU J G, WANG X Y, LUCAS W J, HUANG S W, JIANG B, ZHANG Z H. The wax gourd genomes offer insights into the genetic diversity and ancestral cucurbit karyotype[J]. Nature Communications, 2019, 10(1): 51-58. DOI:10.1038/s41467-019-13185-3 |
| [13] |
李舒文, 董笛, 李殷睿智, 王梦迪, 韩烈保, 张铁军. 蒺藜苜蓿酵母杂交cDNA文库的构建与分析[J/OL]. 分子植物育种: 14[2021-06- 10]. http://kns.cnki.net/kcms/detail/46.1068.S.20200825.1121.002. html. LI S W, DONG D, LI Y R Z, WANG M D, HAN L B, ZHANG T J. Construction and analysis of a yeast cDNA library from Medicago truncatula[J/OL]. Molecular Plant Breeding: 1-14[2021-06-10]. http://kns.cnki.net/kcms/detail/46.1068.S.20200825.1121.002. html. |
| [14] |
刘露露, 曲俊杰, 郭泽西, 孙大运, 潘凤英, 尹玲. 霜霉菌侵染后葡萄叶片酵母双杂交cDNA文库构建[J]. 南方农业学报, 2020, 51(4): 829-835. DOI:10.3969/j.issn.2095-1191.2020.04.013 LIU L L, QU J J, GUO Z X, SUN D Y, PAN F Y, YIN L. Construction of ayeast two-hybrid cDNA library from Vitis vinifera leaves infected by downy mildew[J]. Southern Agricultural Journal, 2020, 51(4): 829-835. DOI:10.3969/j.issn.2095-1191.2020.04.013 |
| [15] |
王沛雅. 葡萄霜霉菌诱导华东葡萄抗霜霉病基因cDNA文库构建及EST分析[D]. 杨凌: 西北农林科技大学, 2008. WANG P Y. Construction of cDNA library and EST analysis of downy mildew resistance genes in East China grape induced by downy mildew of grapevine[D]. Yangling: Northwest Sci-Tech University of Agriculture and Forestry, 2008. |
| [16] |
王晖. 黄瓜超矮生基因scp-1功能初步分析及酵母双杂交cDNA文库的构建[D]. 杨凌: 西北农林科技大学, 2017. WANG H. Preliminary function analysis of cucumber super-dwarf gene scp-1 and construction of yeast two-hybrid cDNA library[D]. Yangling: Northwest Sci-Tech University of Agriculture and Forestry, 2017. |
| [17] |
PIERO C, YUKO S, NORIHITO H, YUICHI S, KAZUHIRO S, MASAYOSHI I, HIDEAKI K, YASUSHI O, MASAMIM, YOSHIHIDE H. Normalization and subtraction of Cap-Trapper-Selected cDNA to prepare full-length cDNA libraries for rapid discovery of new genes[J]. Genome Research, 2000, 10(10): 1617-1630. DOI:10.1101/gr.145100 |
| [18] |
宁小清, 张璐, 潘瑞兰, 曾泉, 陈保善, 蒙姣荣. 利用酵母双杂交系统筛选与黄瓜花叶病毒外壳蛋白互作的寄主蛋白[J]. 基因组学与应用生物学, 2019, 38(7): 3123-3131. DOI:10.13417/j.gab.038.003123 NING X Q, ZHANG L, PAN R L, ZENG Q, CHEN B S, MENG J R. Screening of host proteins that interact with cucumber mosaic virus coat protein using yeast two-hybrid system[J]. Genomics and Applied Biology, 2019, 38(7): 3123-3131. DOI:10.13417/j.gab.038.003123 |
| [19] |
王静. 莲藕酵母双杂交cDNA文库及PPO基因诱饵载体构建[D]. 杨凌: 西北农林科技大学, 2015. WANG J. Construction of lotus root yeast two-hybrid cDNA library and PPO gene bait vector[D]. Yangling: Northwest Sci-Tech University of Agriculture and Forestry, 2015. |
| [20] |
杨成君, 王军. cDNA文库的构建策略及其应用[J]. 生物技术通报, 2007(1): 5-9. DOI:10.3969/j.issn.1002-5464.2007.01.002.j.issn.1002-5464.2007.01.002 YANG C J, WANG J. Strategy of cDNA library construction and its application[J]. Biotechnology Bulletin, 2007(1): 5-9. DOI:10.3969/j.issn.1002-5464.2007.01.002.j.issn.1002-5464.2007.01.002 |
| [21] |
ZHANG C, CHEN H, CAI T, DENG Y, ZHUANG R, ZHANG N, ZENG Y, ZHENG Y, TANG R, PAN R, ZHUANG W. Overexpression of a novel peanut NBS-LRR gene AhRRS5 enhances disease resistance to Ralstonia solanacearum in tobacco[J]. Plant Biotechnology Journal, 2016, 15(1): 39-55. DOI:10.1111/pbi.12589 |
| [22] |
陈玉婷, 刘露, 楚盼盼, 魏嘉贤, 钱慧娜, 陈华, 蔡铁城, 庄伟建, 张冲. 受青枯菌诱导的花生根酵母双杂交文库构建和AhRRS5互作蛋白的筛选[J/OL]. 作物学报: 1-21[2021-07-05]. http://kns.cnki.net/kcms/detail/11.1809.S.20210514.1350.004.html. CHEN Y T, LIU L, CHU P P, WEI J X, QIAN H N, CHEN H, CAI T C, ZHUANG W J, ZHANG C. Construction of yeast two-hybrid library induced by Ralstonia solanacearum and interaction protein screening for AhRRS5 in peanut[J/OL]. Acta Crops: 1-21[2021-07-05]. http://kns.cnki.net/kcms/detail/11.1809.S.20210514.1350.004.html. |
| [23] |
廖钰秋, 王芳芳, 朱熙, 张宁, 司怀军. 酵母双杂交系统筛选马铃薯StMAPKK1互作蛋白及其生物信息学分析[J]. 分子植物育种, 2021, 19(11): 3515-3522. DOI:10.13271/j.mpb.019.003515 LIAO Y Q, WANG F F, ZHU X, ZHANG N, SI H J. Screening and bioinformatics analysis of proteins interacting with StM-APKK1 in potato by yeast two-hybrid system[J]. Molecular Plant Breeding, 2021, 19(11): 3515-3522. DOI:10.13271/j.mpb.019.003515 |
| [24] |
叶新如, 王彬, 陈敏氡, 刘建汀, 曾美娟, 朱海生, 温庆放. 冬瓜BhMAPK15基因的克隆及其非生物胁迫下的表达分析[J]. 中国细胞生物学学报, 2020, 12(9): 1526-1537. DOI:10.13271/j.mpb.019.003515 YE X R, WANG B, CHEN M D, LIU J T, ZENG M J, ZHU H S, WEN Q F. Cloning and abiotic stress expression analysis of BhMAPK15 gene in Benincasa hispida(Thunb.)Cogn[J]. Chinese Journal of Cell Biology, 2020, 12(9): 1526-1537. DOI:10.13271/j.mpb.019.003515 |
| [25] |
彭琴, 王敏, 彭庆务, 江彪, 林毓娥, 刘文睿, 梁肇均, 李玲, 何晓明. 节瓜ACC合酶基因CqACS的克隆与表达分析[J]. 中国蔬菜, 2020(10): 35-41. PENG Q, WANG M, PENG Q W, JIANG B, LIN Y E, LIU W R, LIANG Z J, LI L, HE X M. Analysis on cloning and expression of ACC synthase (CqACS)gene from Benincasa hispida[J]. Chinese Vegetables, 2020(10): 35-41. |
 2021, Vol. 48
2021, Vol. 48