文章信息
基金项目
- 清远市创新创业科研团队项目(2018002); 广东省农业科学院院长基金(201911); 清远市科技计划项目(DZXQY012); 广东省科技专项资金(201106166270779)
作者简介
- 辛海云(1988—),女,博士,助理研究员,研究方向为猪育种与繁殖调控,E-mail:xinhaiyun503@163.com.
通讯作者
- 杜宗亮(1969—),男,硕士,高级畜牧师,研究方向为动物营养和畜牧生产管理,E-mail: 577077972@qq.com.
文章历史
- 收稿日期:2020-05-29
2. 广东省农业科学院动物科学研究所/畜禽育种国家重点实验室/广东省畜禽育种与营养研究重点实验室,广东 广州 510640;
3. 岭南现代农业科学与技术广东省实验室茂名分中心,广东 茂名 525000
2. Institute of Animal Science, Guangdong Academy of Agricultural Sciences/State Key Laboratory of Livestock and Poultry Breeding/Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China;
3. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agriculture, Maoming 525000, China
近年来,受“非洲猪瘟”疫情的影响,我国生猪养殖业对集约化、规模化、高效化的养殖需求逐渐增强。传统发情鉴定和配种方式的生产效率相对较低,需要大量的人力劳动和时间成本,而且通过征兆判断发情的方式准确性较差,部分母猪因发情征兆不明显而表现隐性发情,导致母猪生产延误甚至被淘汰。研究表明,10%~30% 的后备母猪存在隐性发情,9%~21% 的初产母猪在断奶后无发情征兆,15%~25% 的经产母猪断奶后7 d内存在隐性发情,而这些隐性发情的母猪群体大部分均能照常排卵[1]。因此,亟需对常规发情鉴定和人工输精配种方式进行技术改进和创新,以改善母猪生产管理现状,适应养殖业发展需求。
母猪定时输精是人工授精和同期发情技术联合应用后产生的一项技术[2],1990年该技术在拥有110万头母猪群的东德猪场中的应用率达到86%[3],后经几十年的研发推广,该技术在欧美广泛应用。2015年我国引入该技术[1],并开始逐步应用于大规模养猪场。定时输精技术通过添加外源合成激素对母猪体内的生殖激素进行分泌调控,从而调节卵泡的发育状况,使大量母猪在特定时间内集中表现发情症状、排卵,并对母猪进行批量输精配种[4]。多年来的国内外生猪生产试验表明,定时输精技术能降低查情依赖性、减少隐性发情而造成的生产损失、增加母猪年产胎次数和提高母猪繁殖利用率[5];同时,定时输精技术是规模猪场实现批次生产和科学管理的重要途径,有利于猪群全进全出,方便防疫消毒,减少疫病交叉感染,在降低劳动强度、提高生产效率方面具有独特优势[6]。然而,定时输精技术引入我国时间较短,在其本土化利用过程中仍然存在效果不稳定、胚胎数增加不明显等问题[7],需要深入研究和解决。
本文综述了母猪体内生殖激素的繁殖调控规律,针对不同生产阶段的母猪开展定时输精技术的途径,分析各类激素的应用效果及影响激素效果的关键因素,为优化定时输精技术方案,提高母猪繁殖管理水平提供参考。
1 母猪体内生殖激素的繁殖调控规律母猪的发情和排卵过程由多种激素调控完成,包括促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)、促卵泡素(follicle-stimulating hormone,FSH)、促黄体素(luteinizing hormone,LH)、雌激素(estrogen,E2)、孕酮(progesterone,P4)和催乳素(prolactin,PRL)等,这些激素之间存在正负反馈调节作用,具有明显的生理阶段特征[1]。
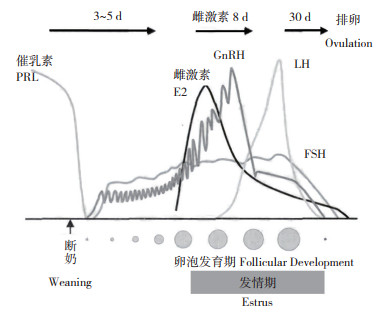
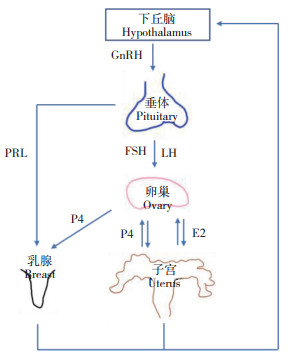
对于经产母猪,哺乳期间血液中PRL维持高水平,抑制下丘脑分泌释放GnRH,垂体未受到足够的刺激,FSH和LH分泌受抑制,卵泡发育受阻,母猪不表现发情;断奶后母猪乳头吸吮刺激减少,血液中PRL水平骤降,PRL对下丘脑GnRH分泌的抑制作用解除,GnRH水平重新上升,刺激垂体分泌FSH和少量LH,两者促进卵泡的发育成熟;卵泡分泌的E2水平上升,促使母猪表现发情症状,E2分泌至一定水平时抑制FSH分泌,LH峰形成,40~42 h后母猪发生排卵并形成黄体,由黄体合成和分泌孕酮(图 1)[8]。若排卵后没有受精,高水平的孕酮通过负反馈调节作用抑制FSH和LH的分泌,同时抑制下丘脑释放GnRH,进一步降低FSH和LH的水平,发情周期进入黄体期,这段时间持续12 d左右。随后,子宫开始释放PGF溶解黄体,孕酮水平迅速降低,其对卵泡的生长抑制被解除,FSH、LH分泌增加,卵泡产生的雌激素水平上升,母猪再次表现发情症状,准备排卵,进入下一个发情周期(图 2)。
|
| 图 1 母猪断奶后体内激素分泌及卵泡发育情况 Fig. 1 Hormone secretion and follicular development in sows after weaning |
|
| 图 2 母猪体内激素间的相互调节作用 Fig. 2 Modulation of hormones in sows |
对于后备母猪,在其进入初情期前,下丘脑已经分泌GnRH,也能检测到垂体前叶分泌的FSH和LH,但由于激素分泌水平较低,且激素分泌没有节律性,母猪并未表现初情期症状[1]。只有当促性腺激素(FSH、LH)有规律地分泌,且其水平达到一定值时,才能促使卵泡正常生长、成熟和排卵,并表现初情期症状。由于后备母猪卵泡发育阶段不同,通过添加外源激素来提高促排卵相关激素的水平或孕酮类药物抑制母猪卵泡发育,可使母猪群的卵泡发育处于同步水平。
2 定时输精技术过程及常用激素根据母猪繁殖生理进程和定时输精目的,可将定时输精技术划分为同步化卵泡发育、同步化排卵和同步化配种3个过程[1]。由于经产母猪和后备母猪生殖激素分泌规律不同,因此在定时输精过程中应用的激素组合和剂量也不同。
2.1 同步化卵泡发育目前,用于同步化卵泡发育的激素主要包括孕马血清促性腺激素(PMSG/eCG)、PG600、烯丙孕素/四烯雌酮(altrenogest)[4, 9]。其中,孕马血清促性腺激素同时具有类似FSH和LH的功能,以FSH活性为主,因而可以显著促进卵泡发育[4],也具有一定的促排卵和黄体形成活性,是目前定时输精技术常用的激素。PG600是400 IU eCG+200 IU hCG两种激素的组合,能够促进卵泡发育和母猪发情。研究证实,PG600能有效同步化后备母猪发情[9]和断奶母猪发情[10-11],且发情率相比对照显著提高。烯丙孕素是孕激素的类似物,为目前后备母猪定时输精程序中常用的激素,生产中通过连续饲喂该激素14~18 d(15~20 mg/d),母猪内源性LH分泌受抑制,导致卵泡发育停滞,母猪性周期的黄体期延长,停喂后5~7 d母猪性周期恢复,约93% 的母猪进入相同的性周期状态,因而使卵泡发育同步化,且口服给药后可迅速吸收和消除,临床应用安全有效[1]。同时烯丙孕素还具有少量雌激素的作用,使用烯丙孕素处理后,后备母猪初次妊娠早期(16、25 d)子宫角长度、子宫重量、子宫容量均显著提高,子宫内膜微血管更加致密丰富,子宫内膜腺体更加发达、分布更均匀[12],这些都是子宫容受性增强的表现[13-15],因而更有利于胚胎附植和发育[12, 16]。以上激素可以调控母猪卵泡发育,但对发情至排卵时间间隔的控制仍需其他激素协助。
2.2 同步化排卵用于同步化排卵的激素主要包括促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)、猪促黄体素(porcine luteinizing hormone,pLH)和人绒毛膜促性腺激素(Human chorionic gonadotropin,hCG)[4]。其中,国内定时输精技术主要使用GnRH同步化母猪排卵。体内GnRH由下丘脑分泌,在母猪卵泡发育同步化并表现发情症状之后,通过肌肉注射给药,再作用于垂体,引起血浆LH和FSH水平的升高,随后诱导母猪排卵,因而具有促进排卵、提高产仔数的效果[17]。因此,外源性GnRH的作用效果依赖于垂体内LH的储存水平[4]。pLH作用于卵巢和输卵管[18],不仅能引起卵泡破裂和黄体化,缩短排卵时间,提高排卵集中度,还能调控输卵管收缩,有助于精子运行,其对断奶母猪的繁殖性能无显著影响,但对后备母猪的分娩率有抑制效果。hCG作为LH的类似物可直接作用于卵巢,其作用效果不受垂体内源性LH分泌的影响。母猪断奶后80 h注射750 IU hCG,42 h左右母猪集中排卵,使得断奶至起始发情间隔(Wean-to-Estrus intervals, WEI)明显缩短[19-21],但随着hCG使用剂量的增加,母猪出现卵泡囊肿的几率增高[22]。
2.3 同步化配种母猪卵泡发育状况不同,母猪起始发情至排卵时间间隔存在差异,经产母猪的WEI也存在个体差异。WEI与发情期长短存在一定程度的负相关[23],表现为较长WEI的母猪排卵时间较早,排卵时间相距发情起始间隔可最短小于24 h,而较短的WEI其排卵时间较晚,距发情起始间隔最大可超过40 h[4]。因此配种的最佳时间随前期激素的应用组合而发生变化。以GnRH为例,在使用100 μg GnRH后,母猪开始排卵的时间为给药后32~40 h,结束排卵的时间为给药后35~40 h,排卵持续2~6 h(正常为4~8 h)[24],因此使用GnRH后24 h和40 h各输精1次,可使配种时间同步化,保证母猪的配怀率。为增加人工授精效果,在输精时先注入10 μg催产素,或者将催产素混合精液进行输精,能弥补人工授精时的刺激不足,有效促进子宫颈收缩,使精子快速移动[25]。
3 定时输精技术应用效果母猪定时输精程序根据激素处理后母猪是否需要人工发情鉴定分为简式定时输精(Simplified Timed Artificial Insemination, TAI)和精准定时输精(Fixed-Timed Artificial Insemination, FTAI),其中TAI因为需要发情鉴定,生产效率相对较低,且查情次数和技术员的经验水平对发情鉴定结果和输精时间影响较大[26],发情配种时间相对分散,不利于大规模推广。FTAI则利用激素对母猪卵泡发育、排卵时间进行更加精准的同期化控制,无需依赖发情鉴定,排卵和输精时间更加集中,可实现真正意义上的定时输精,更适合规模化的商业应用。
3.1 后备母猪定时输精技术3.1.1 后备母猪初情期的建立 研究表明,有无初情期对后备母猪定时输精的效果具有显著影响,相同TAI程序处理母猪后,有初情期的母猪发情率、发情集中度和妊娠率均显著高于无初情期的母猪,且隐性发情母猪受胎率高于无初情期的母猪[27]。此外,陈志林等[28]研究表明,后备母猪在初次配种前有两次或以上的发情期,配种产仔数显著提高,这可能与初情期建立后母猪卵母细胞在减数分裂和发育能力方面的差异相关[29],提示后备母猪初情期的建立在定时输精效果中具有重要作用,因此使用定时输精处理前后备母猪最好已经建立初情期。
目前已知的后备母猪初情期建立方法主要有2种:一种是利用公猪诱情,建立自然情期;另一种使用PMSG等激素诱导母猪发情[30]。激素诱导后的母猪发情时间明确,计划性更强;而公猪诱导自然发情的母猪使用烯丙孕素后母猪发情更集中,卵泡发育同步化效果更好,实施定时输精程序后后备母猪利用率显著高于PMSG诱导后的母猪,这可能是因为公猪诱导初情期的母猪个体发育更完善、体内激素水平更高。
3.1.2 后备母猪定时输精技术及效果 对于后备母猪定时输精,TAI一般只使用烯丙孕素处理,FTAI过程则采用烯丙孕素结合PMSG调控卵泡生长,并在适当时间给予GnRH、hCG、pLH及类似物以调控排卵时间。郭秀丽[31]研究发现,后备母猪饲喂烯丙孕素(15 mg/头)14 d后,6 d内的发情率可达到95%,母猪发情时间集中分布于72 h内,而采用FTAI程序母猪发情集中度更高,分布于24 h内,两种方法的发情集中度均高于对照组。这与吴宝云等[7]的研究结果一致。Degenstein等[32]在投喂母猪烯丙孕素14~18 d和注射PMSG 80 h后分别比较了hCG、pLH和生理盐水处理后的效果,发现pLH处理组的排卵时间更加集中,给药排卵间隔43.2 h相比生理盐水(59.5 h)和hCG(47.6 h)更短,因而效果更佳。但pLH生产成本高,且使用须符合国家政策规定,因此其应用有限,可使用GnRH的类似物Buserelin和Triptorelin替代以间接促进其释放。
吴宝云等[7]研究两种程序对后备母猪生产性能的影响,发现FTAI组和烯丙孕素组母猪窝产仔数(13.40、12.65头)和窝产活仔数(12.75、12.03头)均较对照组(10.88、10.35头)显著提高,且FTAI组高于烯丙孕素组,但差异不显著。为探究FTAI程序影响后备母猪产仔性能的机理,刘闯等[12]比较了FTAI程序和对照组母猪妊娠早期的子宫发育,发现激素处理后母猪子宫内膜厚度增加,血管更加丰富,腺体分布更均匀,因此定时输精程序可能是通过改变妊娠早期母猪子宫发育状态来影响早期胚胎存活,进而影响母猪产仔数。朱志伟等[33]分别从母猪体内激素水平、排卵数和妊娠早期胚胎发育方面分析FTAI程序对母猪和胚胎的影响,表明FTAI程序符合母猪正常繁殖生理周期激素变化趋势,能协同发情排卵,排卵数上升但差异不显著,早期胚胎发育正常,窝产活仔数和断奶成活率均高于对照组,对提高后备母猪利用率具有积极作用。
3.2 经产母猪定时输精技术定时输精技术在经产母猪群中的合理使用,均能显著提高母猪的发情率、分娩率、窝产仔数[34]。经产母猪在哺乳时分泌的高浓度PRL抑制下丘脑分泌GnRH,母猪发情受抑制,其所处的生理状态相似,通过同期断奶即可初步实现发情周期的同步化。
针对断奶母猪的TAI过程主要使用GnRH、pLH、hCG及其类似物等激素促进排卵,再结合发情鉴定选择合适的时间进行人工输精。Driancourt等[35]比较了断奶77 h后给予母猪6、10、16 μg GnRH类似物Buserelin的效果,发现32~44 h内平均排卵率分别为73%、73%、83%,组间差异不显著,但不同浓度处理、相同时间段内经产母猪和初产母猪的排卵率差异显著,经产母猪达到100%,初产母猪分别只有50%、50%、67%,造成这种显著差异的原因可能是初产母猪激素调节机能不完善,断奶后其垂体储存的LH水平不足,GnRH促排效果受限。Zak等[36]检测了pLH(5 mg)促排卵的效果,在发情后立即注射pLH,发情后24~42 h实施两次输精,与对照组相比产仔数和产活仔数均增加1头。Fontana等[37]利用类似的方案比较输精时间和次数对繁殖指标的影响,发现单次输精和2次输精母猪分娩率、排卵时间、窝产仔数、窝产活仔数差异不显著,表明pLH在促进排卵和节约时间、人力成本方面具有较大优势,适合深入研究和推广。
为了使母猪排卵时间更集中,以及免除后期查情对定时输精效果的影响而采用的FTAI策略,即母猪断奶后注射PMSG及其类似物,再注射促排药物,一定时间后进行人工输精,母猪繁殖成绩较为理想。Christenons等[38]对3周或6周哺乳期的母猪断奶后24 h注射1 000 IU PMSG,72 h或56 h后注射500 IU hCG,24 h后单次人工授精,母猪产仔数极显著高于对照组。Brussow等[39]在PMSG处理后55~58 h分别注射25、50 μg的GnRH-A,之后在24 h和42 h分别进行人工输精,其妊娠率、产活仔数与阳性对照差异不显著。为分析FTAI技术对规模猪场经产母猪繁殖性能及效益的影响,黄正等[5]对断奶当天的母猪注射1 000 IU PMSG,72 h后注射100 μg GnRH,之后分别于24 h和42 h进行两次人工输精,两个规模场的母猪年产胎次相比自然发情对照均提高0.27,年提供活仔数分别提高3.97头和3.34头,投入与产出效益比分别为1 ︰ 12.97和1 ︰ 10.45,获得良好的经济效益。在FTAI过程中,PMSG和GnRH两者的注射间隔时间对繁殖效果的影响不容忽视。现有研究表明,两者间隔时间需根据母猪哺乳期的长短进行调整,哺乳期越长,两者间隔时间越短,即哺乳期为21 d时,间隔时间为78~80 h;哺乳期为21~28 d时,间隔时间为72 h;哺乳期大于28 d时,间隔时间为56~58 h[40]。
4 定时输精技术应用效果的影响因素定时输精作为一项新的繁殖调控技术,对提高母猪利用率、推进批次化生产进程意义重大,但该技术在我国生猪养殖过程中大规模应用的时间较短,其在生产应用中影响因素很多,包括输精程序、激素选择、饲养管理等。
4.1 激素选择4.1.1 激素组合 在卵泡发育同步化、排卵同步化等过程中,应用不同激素组合,使用不同剂量,处理时间存在差异,效果也不相同。以后备母猪为例,相比以烯丙孕素为基础实行的简式定时输精程序,使用烯丙孕素+ 促卵泡发育(如PMSG)+ 促排卵(如GnRH)激素的组合能使母猪发情时间更集中,发情率、配种率和窝产仔数均高于非处理组[7, 27],且母猪发情率和分娩率的提高对管理的精细化和后备母猪的更新率要求更高,烯丙孕素+PMSG+GnRH激素组合下生产率更高、执行力更强、生产更加集中[41],也更适合规模生产。
4.1.2 激素安全性 不同厂家来源的同一种激素产品,其质量和稳定性参差不齐[42],对母猪妊娠率影响较大。一些激素的使用方法及负面效应限制了生产应用。目前生产的烯丙孕素通过口服方式给药,需要连续饲喂14~18 d才能达到理想的同期化效果[4],增加了人力、时间成本,且不能兼顾母猪个体差异;同时口服制剂从生产到使用过程中受到温度、光照等理化因素的影响,产品质量无法有效保障。因此,如何改善烯丙孕素的制剂形式,优化使用方法,缩短给药天数,是未来烯丙孕素推广应用中需重点解决的问题。PMSG的使用提高了母猪排卵率,但胚胎的存活数量却没有同步提高,这可能是由于PMSG处理影响了卵泡质量,使卵泡发育不同步,卵母细胞成熟、黄体形成、胚胎发育等也受影响,使得胚胎存活数量大幅下降[43-44]。因此不同激素的质量和安全性仍需深入研究。
4.2 输精程序4.2.1 输精时间 输精时间受母猪断奶时间、断奶发情间隔以及激素诱导排卵时间等多种因素影响,其内在决定因素为母猪卵泡的发育状况。断奶后至发情的时间间隔一般为3~6 d,其长短影响发情期的持续时间和开始发情到排卵的时间间隔,断奶至发情间隔太长的母猪往往产仔数和分娩率较低,这可能是由于没有选择最佳的授精时间进行配种。授精到排卵的时间间隔影响到母猪的排卵率和受精率[45-46],目前普遍认为最佳时间间隔为24 h[47]。激素诱导对于卵泡发育的影响不容忽视,研究表明,后备母猪注射GnRH时,卵泡直径较对照组偏小,且注射后24 h有38.46%~68.75% 母猪提前排卵,48 h后绝大多数母猪排卵[48],因而排卵时间提前。
4.2.2 输精次数 在应用定时输精技术对母猪进行卵泡发育和排卵的同步调控后,母猪卵泡发育和排卵时间更趋一致,使单次定时输精技术成为可能。目前对于单次输精仍有较大争议,其应用效果不稳定是主要原因。Knox等[49]应用GnRH类似物OvuGel处理断奶母猪后进行单次定时输精,母猪表现良好的繁殖性能,与多次授精相比差异不显著。而Bortolozzo等[50]对后备母猪实施每天1次和2次输精,前者较后者产仔数低1.2头;Ulguim等[51]应用单次定时输精时后备母猪的分娩率降低。尽管如此,单次定时输精在降低精液使用量、方便母猪配种和分娩集中管理方面意义重大,具有较大的研究和发展应用前景。
4.2.3 公猪刺激和催产素 自然交配的母猪在公猪刺激下会产生大量催产素,增强子宫收缩能力,促使更多精子快速到达输卵管的授精部位[52],而人工授精时母猪受到的刺激远低于自然交配,输精人员对母猪背部和侧面的刺激并不能对子宫收缩产生影响[25],因而到达输精部位的有效精子数量大幅降低。应用定时输精程序进行定时配种时加入一定数量的催产素,可弥补人工授精时的刺激不足,增加输卵管中的精子数量,并减少繁殖季节性问题,提高母猪繁殖力[53]。此外,在精液中添加氯前列烯醇和GnRH类似物对提高母猪窝产仔数、怀孕率和分娩率有一定促进作用[53]。
4.3 饲养管理研究表明,相同的激素组合在不同猪场的应用效果存在一定差异[18],这可能与猪场饲养管理水平密切相关。因此,为提高定时输精技术效果,一方面,在使用激素进行同步化调控前需提高猪场饲养管理水平,如有效控制猪群环境、优化猪群结构、提供优良饲料、按时接种疫苗保障繁殖母猪健康状况[42];另一方面,针对不同猪场、不同生理状态的母猪开展激素使用预试验,以确定最佳激素组合和使用剂量,优化使用方案。此外,不同的母猪品种、使用季节对激素处理效果也有影响[54]。
4.4 其他因素定时输精技术的应用使母猪发情配种时间更加集中,单位时间内精液的需求量大幅提升,精液供应不足成为该技术面临的难题。为解决该问题,科研人员探索将定时输精技术中的传统子宫颈输精改为子宫低剂量深部输精,发现可有效降低精液量至1/3~1/2[42],但该技术对操作人员的水平要求较高,操作不当容易引发母猪子宫感染。此外,应用单次定时输精技术,提高单次定时输精效果是解决精液不足的另一种方法[34]。
5 展望定时输精技术是母猪批次生产管理中不可或缺的一项综合性技术,对于提高生物安全、母猪繁殖性能和生产效率具有重要作用,尤其在“非洲猪瘟”防控常态化的形势下,以定时输精为基础的批次生产在规模猪场中的试验应用越来越普及。但其应用效果不一,给养殖业带来了新的考验和顾虑。一方面,现有的定时输精策略中,大部分应用两次定时输精程序后配种仍失败的母猪将被淘汰[6],初产母猪出现繁殖问题的比例高于其他胎次,这可能是由于初产母猪的激素水平不稳定,使用外源激素干扰了母猪体内激素的正常分泌,尤其在饲养管理水平较低的情况下,没有掌握最佳的给药时间,重复使用激素增加母猪患病几率,加快猪群更新速度,因此,如何选择合适的给药时间,综合考虑胎次和产仔性能的影响,调整猪群的胎次结构,最大化利用母猪繁殖性能,提高母猪利用年限,值得深入研究;另一方面,部分生殖激素在母猪体内代谢后以粪便和养殖废水的形式排放到环境中[55],经过堆肥发酵和废水处理后,仍可污染地下水和地表水[56],对人类和动物的内分泌健康构成潜在威胁,如何优化激素使用方法和剂量,在保证使用效果的前提下降低激素剂量,寻找可能的生物或非生物转换途径,降低激素的环境浓度和持续存在时间,研发新型排泄物处理设施,是定时输精应用中面临的又一挑战。此外,相比自然发情和常规人工授精,定时输精中的激素处理导致时间成本和经济成本增加,如何权衡成本和效益,提高单次输精的成功率,在定时输精技术研究应用中也需要加以关注。
| [1] |
郭晓飞, 张金龙, 李义海, 田见晖, 李俊杰, 翁士乔, 张效生. 猪定时输精技术研究进展[J]. 中国畜牧杂志, 2019, 55(9): 28-33. DOI:10.19556/j.0258-7033.20181221-02 GUO X F, ZHANG J L, LI Y H, TIAN J H, LI J J, WENG S Q, ZHANG X S. Research progress on technology of timed artificial insemination in pig[J]. Chinese Journal of Animal Science, 2019, 55(9): 28-33. DOI:10.19556/j.0258-7033.20181221-02 |
| [2] |
TANABE T Y, CASIDA L E, GRUMMER R H. The effects of gonadotrophins administered to sows at different stages of the estrous cycle[J]. Journal of Animal Science, 1947, 6(4): 500. DOI:10.2527/jas1949.84550x |
| [3] |
翁士乔. 母猪定时输精技术[J]. 国外畜牧学(猪与禽), 2016, 36(6): 1-3. WENG S Q. Timed artificial insemination(TAI)of swine[J]. Animal Science Abroad Pigs and Poultry, 2016, 36(6): 1-3. |
| [4] |
DE RENSIS F, KIRKWOOD R N. Control of estrus and ovulation. fertility to timed insemination of gilts and sows[J]. Theriogenology, 2016, 86(6): 1460-1466. DOI:10.1016/j.theriogenology.2016.04.089 |
| [5] |
黄正, 周剑辉, 李智. 定时输精技术对规模化猪场经产母猪繁殖性能及效益的影响[J]. 今日养猪业, 2019(4): 38-39. HUANG Z, ZHOU J H, LI Z. Effect of timed insemination technology on reproductive performance and benefits of multiparous sows in largescale pig farms[J]. Pigs Today, 2019(4): 38-39. |
| [6] |
李智, 刘彦, 白佳桦, 许光勇. 批次化生产与定时输精对母猪利用率的影响[J]. 猪业科学, 2021, 38(6): 110-112. DOI:10.3969/j.issn.1673-5358.2021.06.028 LI Z, LIU Y, BAI J H, XU G Y. The effect of batch production and timed insemination on sow utilization[J]. Swine Industry Science, 2021, 38(6): 110-112. DOI:10.3969/j.issn.1673-5358.2021.06.028 |
| [7] |
吴宝云, 李贺, 张衡, 刘仲武, 姜思畅, 张思思, 黄正, 李俊杰, 孙树春. 不同定时输精程序对后备母猪繁殖性能的影响[J]. 中国畜牧杂志, 2018, 54(7): 55-58. DOI:10.19556/j.0258-7033.2018-07-055 WU B Y, LI H, ZHANG H, LIU Z W, JIANG S C, ZHANG S S, HUANG Z, LI J J, SUN S C. Effects of different fixed-time artificial insemination programs on the reproductive performance of gilts[J]. Chinese Journal of Animal Science, 2018, 54(7): 55-58. DOI:10.19556/j.0258-7033.2018-07-055 |
| [8] |
陈志林, 张常明, 叶超, 吴俊辉, 陈预明, 卫恒习, 李莉, 张守全. 国外种猪繁殖技术进展[J]. 中国猪业, 2015, 10(3): 37-41. DOI:10.16174/j.cnki.115435.2015.03.008 CHEN Z L, ZHANG C M, YE C, WU J H, CHEN Y M, WEI H X, LI L, ZHANG S Q. Progress in abroad pig breeding technology[J]. Pigs Today, 2015, 10(3): 37-41. DOI:10.16174/j.cnki.115435.2015.03.008 |
| [9] |
LEWCHALERMWONG D, TUMMARUK P, KNOX R V. Investigation into the variation in follicular and endocrine responses of prepubertal gilts treated with exogenous gonadotropins[J]. Animal Reproduction Science, 2020, 223: 106622. DOI:10.1016/j.anireprosci.2020.106622 |
| [10] |
BREEN S M, RODRIGUEZ-ZAS S L, KNOX R V. Effect of altering dose of PG600 on reproductive performance responses in prepubertal gilts and weaned sows[J]. Animal Reproduction Science, 2006, 95(3/4): 316-323. DOI:10.1016/j.theriogenology.2014.04.020 |
| [11] |
BRACKEN C, SEAMAN-BRIDGES J S, SAFRANSKI T, LUCY M. Ovarian follicular development, estrus, and ovulation in seasonally anestrous sows treated seven days post weaning with equine and human chorionic gonadotropins[J]. Journal of Swine Health and Production, 2006, 14: 207-209. |
| [12] |
刘闯, 魏巧莉, 潘建治, 朱志伟, 陈晓宇, 华卫东, 李俊杰. 定时输精前激素处理对后备母猪妊娠早期子宫发育的影响[J]. 中国畜牧杂志, 2020, 56(4): 70-73. DOI:10.19556/j.0258-7033.20190921-02 LIU C, WEI Q L, PAN J Z, ZHU Z W, CHEN X Y, HUA W D, LI J J. Effects of hormonal treatment before fixed-time artificial insemination on uterine development in early pregnant gilts[J]. Chinese Journal of Animal Science, 2020, 56(4): 70-73. DOI:10.19556/j.0258-7033.20190921-02 |
| [13] |
CHA J, SUN X, DEY S K. Mechanisms of implantation: strategies for successful pregnancy[J]. Nature Medicine, 2012, 18(12): 1754-1767. DOI:10.1038/nm.3012DOI:10.1038/nm.3012 |
| [14] |
ZHANG S, LIN H, KONG S, WANG S, WANG H, WANG H, ARMANT D R. Physiological and molecular determinants of embryo implantation[J]. Molecular Aspects of Medicine, 2013, 34(5): 939-980. DOI:10.1016/j.mam.2012.12.011 |
| [15] |
HANTAK A M, BAGCHI I C, BAGCHI M K. Role of uterine stromalepithelial crosstalk in embryo implantation[J]. The International Journal of Developmental Biology, 2014, 58(2/4): 139-146. DOI:10.1387/ijdb.130348mb |
| [16] |
杜雪莲, 温泽清, 姜涛, 张华玲, 王桂丽. 孕激素对卵巢切除大鼠子宫肌层发育的影响[J]. 山东医药, 2005(8): 15-17. DOI:10.3969/j.issn.1002-266X.2005.08.006 DU X L, WEN Z Q, JIANG T, ZHANG H L, WANG G L.. The effect of progesterone to the uterus smooth muscle in ovariectomized rats[J]. Shandong Medical Journal, 2005(8): 15-17. DOI:10.3969/j.issn.1002-266X.2005.08.006 |
| [17] |
K NOX R V, W EBEL S K, SWANSON M, JOHNSTON M E, KRAELING R R. Effects of estrus synchronization using Matrix(®) followed by treatment with the GnRH agonist triptorelin to control ovulation in mature gilts[J]. Animal Reproduction Science, 2017, 185: 66-74. DOI:10.1016/j.anireprosci.2017.08.003 |
| [18] |
刘闯, 李楠, 白佳桦, 刘彦, 翁士乔, 田见晖, 李俊杰. 母猪定时输精常用激素与应用效果的研究进展[J]. 今日养猪业, 2019(4): 33-37. LIU C, LI N, BAI J H, LIU Y, WENG S Q, TIAN J H, LI J J. Research progress on commonly used hormones and application effects of timed artificial insemination in sows[J]. Pigs Today, 2019(4): 33-37. |
| [19] |
WONGKAWEEWIT K, PROMMACHART P, RAKSASUB R, BURANAAMNUAY K, TECHAKUMPHU M, DE RENSIS F, TUMMARUK P. Effect of the administration of GnRH or hCG on time of ovulation and the onset of estrus-to-ovulation interval in sows in Thailand[J]. Tropical Animal Health and Production, 2012, 44(3): 467-470. DOI:10.1007/s11250-011-9920-3 |
| [20] |
MANJARÍN R, CASSAR G, FRIENDSHIP R M, GARCIA J C, DOMINGUEZ J C, KIRKWOOD R N. Effect of additional human chorionic gonadotrophin(hCG)on follicular growth and ovulation in gonadotrophin-treated gilts[J]. Canadian Journal of Veterinary Research, 2015, 79(3): 210-213. |
| [21] |
CASSAR G, FRIENDSHIP R M, Zak L, ROGAN D, KIRKWOOD R. Effect of dose of equine chorionic gonadotrophin on the estrus responses of gilts and weaned sows and effect of the interval between equine chorionic gonadotrophin and luteinizing hormone injections on sow performance[J]. Journal of Swine Health and Production, 2010, 18: 182-186. |
| [22] |
MANJARÍN R, GARCÍA J C, HOVING L, SOEDE N M, MAJ M, DOMINGUEZ DE TEJERINA J C, KIRKWOOD R N. Ovulatory response of weaned sows to an altered ratio of exogenous gonadotrophins[J]. Animals, 2020, 10(3). DOI:10.3390/ani10030380 |
| [23] |
KNOX R V, RODRIGUEZ-ZAS S L, MILLER G M, WILLENBURG K L, ROBB J A. Administration of PG 600 to sows at weaning and the time of ovulation as determined by transrectal ultrasound[J]. Journal of Animal Science, 2001, 79(4): 796-802. DOI:10.2527/2001.794796x |
| [24] |
BRÜS SOW K P, R ÁT KY J, RODRIGUE Z-M A RTI NE Z H. Fertilization and early embryonic development in the porcine fallopian tube[J]. Reproduction in Domestic Animals, 2008, 43(S2): 245-251. DOI:10.1111/j.1439-0531.2008.01169.x |
| [25] |
LANGENDIJK P, BOUWMAN E G, SCHAMS D, SOEDE N M, KEMP B. Effects of different sexual stimuli on oxytocin release, uterine activity and receptive behavior in estrous sows[J]. Theriogenology, 2003, 59(3/4): 849-861. DOI:10.1016/s0093-691x(2)01157-3 |
| [26] |
ALMEIDA F R, NOVAK S, FOXCROFT G R. The time of ovulation in relation to estrus duration in gilts[J]. Theriogenology, 2000, 53(7): 1389-1396. DOI:10.1016/s0093-691x(0)00281-8 |
| [27] |
魏巧莉, 张振红, 赵倩倩, 刘明智, 翁士乔, 白佳桦, 刘彦, 黄正, 田见晖, 李俊杰. 不同定时输精程序处理对有无初情期后备母猪发情及妊娠的影响[J]. 畜牧与兽医, 2019, 51(6): 1-5. WEI Q L, ZHANG Z H, ZHAO Q Q, LIU M Z, WENG S Q, BAI J H, LIU Y, HUANG Z, TAIN J H, LI J J. Effect of puberty on ovulation and pregnancy in gilts treated with different timed artificial insemination programs[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(6): 1-5. |
| [28] |
陈志林, 吴德铭, 钟淑琴, 刘文敏, 龚朋飞, 张守全. 后备母猪初情日龄、发情次数和初配日龄与繁殖性能的关系[J]. 养猪, 2016(2): 41-43. DOI:10.3969/j.issn.1002-1957.2016.02.015 CHEN Z L, WU D M, ZHONG S Q, LIU W M, GONG P F, ZHANG S Q. The puberty, heat times and first mating time on the relationship between gilt's reproductive performance[J]. Swine Production, 2016(2): 41-43. DOI:10.3969/j.issn.1002-1957.2016.02.015 |
| [29] |
MARCHAL R, FEUGANG J M, PERREAU C, VENTURI E, TERQUI M, MERMILLOD P. Meiotic and developmental competence of prepubertal and adult swine oocytes[J]. Theriogenology, 2001, 56(1): 17-29. DOI:10.1016/s0093-691x(1)00539-8 |
| [30] |
陈建辉. 定时输精技术在后备母猪批次生产中的应用[J]. 养殖与饲料, 2020, 19(10): 22-24. DOI:10.13300/j.cnki.cn42-1648/s.2020.10.010 CHEN J H. Application of timed insemination technology in batch production of gilts[J]. Animals Breeding and Feed, 2020, 19(10): 22-24. DOI:10.13300/j.cnki.cn42-1648/s.2020.10.010 |
| [31] |
郭秀丽. 猪场三周批次生产模式//中国畜牧兽医学会养猪学分会第五次全国会员代表大会暨养猪业创新发展论坛[C]. 2010. GUO X L. Three-week batch production model for pig farms//Pig Branch of China Association of Animal Veterinary, Science[C]. 2010. |
| [32] |
DEGE NS T E I N K L, O 'D ONO GH U E R, PAT T E R S ON J L, BELTRANENA E, AMBROSE D J, FOXCROF T G R, DYCK M K. Synchronization of ovulation in cyclic gilts with porcine luteinizing hormone(pLH)and its effects on reproductive function[J]. Theriogenology, 2008, 70(7): 1075-1085. DOI:10.1016/j.theriogenology.2008.06.027 |
| [33] |
朱志伟, 陈晓宇, 于福先, 张樑, 黄菁, 王志刚, 赖建兵, 沈顺新, 殷文彬, 潘建治. 精准定时输精对后备母猪早期胚胎发育与繁殖性能的影响[J]. 浙江农业学报, 2021, 33(5): 794-800. DOI:10.3969/j.issn.1004-1524.2021.05.003 ZHU Z W, CHEN X Y, YU F X, ZHANG L, HUANG J, WANG Z G, LAI J B, SHEN S X, YIN W B, PAN J Z.. Effect of fixed-time artificial insemination on earlier embryonic development and reproduction performance in gilts[J]. Acta Agriculturae Zhejiangensis, 2021, 33(5): 749-800. DOI:10.3969/j.issn.1004-1524.2021.05.003 |
| [34] |
方礼禄, 杨光. 定时输精对母猪繁殖性能的影响[J]. 饲料工业, 2017, 38(16): 49-52. DOI:10.13302/j.cnki.fi.2017.16.010 FANG L L, YANG G. Control of estrus and ovulation: fertility to double fixed-time artificial insemination in gilts and weaned sows[J]. Feed Industry, 2017, 38(16): 49-52. DOI:10.13302/j.cnki.fi.2017.16.010 |
| [35] |
DRIANCOURT M A, COX P, RUBION S, HARNOIS-MILON G, KEMP B, SOEDE N M. Induction of an LH surge and ovulation by buserelin(as Receptal)allows breeding of weaned sows with a single fixed-time insemination[J]. Theriogenology, 2013, 80(4): 391-399. DOI:10.1016/j.theriogenology.2013.05.002 |
| [36] |
ZAK L J, PATTERSON J, HANCOCK J, ROGAN D, FOXCROFT G R. Benefits of synchronizing ovulation with porcine luteinizing hormone (pLH)in a fixed time insemination protocol in weaned multiparous sows[J]. Society of Reproduction and Fertility Supplement, 2009, 66: 305-306. |
| [37] |
FONTANA D L, ULGUIM R R, SBARDELLA P E, BERNARDI M L, WENTZ I, BORTOLOZZO F P. Fixed-time post-cervical artificial insemination in sows receiving porcine luteinising hormone at oestrus onset[J]. Animal Reproductive Science, 2014, 144(3/4): 109-114. DOI:10.1016/j.anireprosci.2013.12.003 |
| [38] |
CHRISTENSON R K, TEAGUE H S. Synchronization of ovulation and artificial insemination of sows after lactation[J]. Journal of Animal Science, 1975, 41(2): 560-563. DOI:10.2527/jas1975.412560x |
| [39] |
BRÜSSOW K P, JÖCHLE W, HÜHN U. Control of ovulation with a GnRH analog in gilts and sows[J]. Theriogenology, 1996, 46(6): 925-934. DOI:10.1016/s0093-691x(96)00258-0 |
| [40] |
BRÜSSOW K P, SCHNEIDER F, KANITZ W, RÁTKY J, KAUFFOLD J, WÄHNER M. Studies on fixed-time ovulation induction in the pig[J]. Society of Reproduction and Fertility Supplement, 2009, 66: 187-195. DOI:10.1530/biosciprocs.18.0019 |
| [41] |
刘明智, 孙洁, 刘闯, 赵倩倩, 房晓欢, 李飒, 李俊杰. 影响母猪定时输精效果的关键因素[J]. 黑龙江畜牧兽医, 2020(13): 40-43. DOI:10.13881/j.cnki.hljxmsy.2019.09.0161 LIU M Z, SUN J, LIU C, ZHAO Q Q, FANG X H, LI S, LI J J. Key factors for influencing timed artificial insemination in sow[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(13): 40-43. DOI:10.13881/j.cnki.hljxmsy.2019.09.0161 |
| [42] |
李俊杰, 刘彦, 翁士乔, 张守全, 田见晖. 母猪定时输精技术及存在的若干问题[J]. 猪业科学, 2018, 35(6): 46-48. DOI:10.3969/j.issn.1673-5358.2018.06.020 LI J J, LIU Y, WENG S Q, ZHANG S Q, TIAN J H.. Timed artificial insemination technique(TAI)and several related existed problems for sows[J]. Swine Industry Science, 2018, 35(6): 46-48. DOI:10.3969/j.issn.1673-5358.2018.06.020 |
| [43] |
ZIECIK A J, KLOS J, PRZYGRODZKA E, MILEWSKI R, JANA B. Aberrant effects of altrenogest and exposure to exogenous gonadotropins on follicular cysts appearance in gilts[J]. Theriogenology, 2017, 89: 250-254. DOI:10.1016/j.theriogenology.2016.10.028 |
| [44] |
JIA R, CHEN X, ZHU Z, HUANG J, YU F, ZHANG L, OGURA A, PAN J. Improving ovulation in gilts using anti-inhibin serum treatment combined with fixed-time artificial insemination[J]. Reproduction In Domestic Animals, 2021, 56(1): 112-119. DOI:10.1111/rda.13854 |
| [45] |
CORNOU C. Automated oestrus detection methods in group housed sows: Review of the current methods and perspectives for development[J]. Livestock Science, 2006, 105(1): 1-11. DOI:10.1016/j.livsci.2006.05.023 |
| [46] |
RODRIGUES L, AMEZCUA R, CASSAR G, O'SULLIVAN T, FRIENDSHIP R. Comparison of single, fixed-time artificial insemination in weaned sows using 2 different protocols to synchronize ovulation[J]. The Canadian Veterinary Journal, 2020, 61(1): 53-56. |
| [47] |
KEMP B, SOEDE N M. Relationship of weaning-to-estrus interval to timing of ovulation and fertilization in sows[J]. Journal of Animal Science, 1996, 74(5): 944-949. DOI:10.2527/1996.745944x |
| [48] |
白佳桦, 肖银霞, 宋玉清, 许晓玲, 冯涛, 肖霖力, 刘彦. 卵泡图像检测在母猪定时输精技术研究中的应用[J]. 猪业科学, 2018, 35(6): 38-40. DOI:10.3969/j.issn.1673-5358.2018.06.017 BAI J H, XIAO Y X, SONG Y Q, XU X L, FENG T, XIAO L L, LIU Y. Application of follicle image detection in the research of timed artificial insemination technology of sows[J]. Swine Industry Science, 2018, 35(6): 38-40. DOI:10.3969/j.issn.1673-5358.2018.06.017 |
| [49] |
KNOX R V, TAIBL J N, BREEN S M, SWANSON M E, WEBEL S K. Effects of altering the dose and timing of triptorelin when given as an intravaginal gel for advancing and synchronizing ovulation in weaned sows[J]. Theriogenology, 2014, 82(3): 379-386. DOI:10.1016/j.theriogenology.2014.04.020 |
| [50] |
BORTOLOZZO F P, UEMOTO D A, BENNEMANN P E, POZZOBON M C, CASTAGNA C D, PEIXOTO C H, BARIONI W, WENTZ I. Influence of time of insemination relative to ovulation and frequency of insemination on gilt fertility[J]. Theriogenology, 2005, 64(9): 1956-1962. DOI:10.1016/j.theriogenology.2005.04.023 |
| [51] |
ULGUIM R R, FONTANA D L, BERNARDI M L, WENTZ I, BORTOLOZZO F P. Single fixed-time artificial insemination in gilts and weaned sows using pLH at estrus onset administered through vulvar submucosal route[J]. Theriogenology, 2016, 86(4): 1072-1080. DOI:10.1016/j.theriogenology.2016.03.039 |
| [52] |
OKAZAKI T, IKOMA E, TINEN T, AKIYOSHI T, MORI M, TESHIMA H. Addition of oxytocin to semen extender improves both sperm transport to the oviduct and conception rates in pigs following AI[J]. Animal Science Journal, 2014, 85(1): 8-14. DOI:10.1111/asj.12089 |
| [53] |
MANJARÍN R, KIRKWOOD R N, NGULA J, MARTINEZ-PASTOR F, ALEGRE B, DOMÍNGUEZ J C. Effect of Oxytocin, Cloprostenol or Buserelin in semen doses on sow fertility[J]. Animals, 2019, 9(10). DOI:10.3390/ani9100746 |
| [54] |
杨光, 沈君, 严彩虹, 刘峰, 方礼禄. 定时输精对后备母猪繁殖性能的影响[J]. 饲料博览, 2017(5): 32-33, 36. DOI:10.3969/j.issn.1001-0084.2017.05.009 YANG G, SHEN J, YAN C H, LIU F, FANG L L. The Effects of fixedtime artificial insemination on the reproductive performance of gilts[J]. Feeding Expo, 2017(5): 32-33, 36. DOI:10.3969/j.issn.1001-0084.2017.05.009 |
| [55] |
LIU S, XU X R, QI Z H, CHEN H, HAO Q W, HU Y X, ZHAO J L, YING G G. Steroid bioaccumulation profiles in typical freshwater aquaculture environments of South China and their human health risks via fish consumption[J]. Environmental Pollution, 2017, 228: 72-81. DOI:10.1016/j.envpol.2017.05.031 |
| [56] |
ZHANG J N, YANG L, ZHANG M, LIU Y S, ZHAO J L, HE L Y, ZHANG Q Q, YING G G. Persistence of androgens, progestogens, and glucocorticoids during commercial animal manure composting process[J]. Science of the Total Environment, 2019, 665: 91-99. DOI:10.1016/j.scitotenv.2019.02.120 |
 2021, Vol. 48
2021, Vol. 48