文章信息
基金项目
- 广东省重点领域研发计划项目(2018B020206001);广州市科技计划项目(201803020023,201904010408);广东省农业科学院院长基金(201840)
作者简介
-
刘明(1984—),男,博士,副研究员,研究方向为食用菌遗传与育种,E-mail:liuming@gdaas.cn
刘明,博士,副研究员,现任广东省农业科学院蔬菜研究所食用菌研究室主任,广东省食用菌协会常务理事,德国马克斯普朗克演化生物研究所访问学者。
主要从事食药用菌遗传育种与高效栽培技术研究工作。主持省级科研项目3项,获广东省科技进步奖二等奖1项、广东省农业技术推广奖一等奖1项,发表科技论文10多篇,获发明专利4项。作为广东省科技特派员在韶关、河源、梅州、湛江等地开展食用菌新品种与栽培技术推广工作.
通讯作者
- 罗学梅(1968—),男,高级农艺师,研究方向为农业技术推广,E-mail:L117902@163.com.
文章历史
- 收稿日期:2021-08-20
2. 广东省现代农业装备研究所,广东 广州 510630;
3. 广东省农业技术推广中心,广东 广州 510520
2. Guangdong Institute of Modern Agriculture Equipment, Guangzhou 510630, China;
3. Guangdong Agricultural Technology Promotion Center, Guangzhou 510520, China
【研究意义】草菇(Volvariella volvacea),别名南华菇、兰花菇、美味草菇及中国菇等,是一种生长于热带、亚热带地区的食用菌,其人工栽培技术起源于中国[1]。新鲜草菇肉质脆嫩,易受到机械损伤,因具有强烈的呼吸作用和代谢活动,采后1~2 d子实体萎缩褐变,价值显著降低,新鲜草菇长时间贮藏和远距离运输较难实现[2]。研究发现,草菇发生褐变主要与多酚氧化酶(Polyphenol oxidase, PPO)活性、维生素C及总酚含量有关。在PPO作用下酚类底物氧化形成黑色素的醌类物质,促使草菇快速褐变[3]。在运输过程中受到机械损伤的影响,草菇组织破裂会导致酚类底物与PPO接触,从而加速褐变反应[4]。克隆并分析草菇PPO基因家族对草菇抗褐变品种选育及改良有重要参考价值。【前人研究进展】 PPO是一种广泛存在于植物、动物、细菌和真菌中的含铜酶。PPO可根据底物特异性和结构分为酪氨酸酶(EC 1.14.18.1)、儿茶酚氧化酶(EC 1.10.3.1)和漆酶(EC 1.10.3.2)[5]。在食用菌中如双孢蘑菇(Agaricus bisporus)、香菇(Lentinula edodes)、滑子菇(Pholiota nameko)、平菇(Pleurotus ostreatus)、玉木耳(Auricularia cornea)等已鉴定多个多酚氧化酶,其中在香菇中分离到1个多酚氧化酶基因,表达量分析发现该基因在菌丝期到转色期表达量逐渐升高,在原基形成后表达量降低,该基因可能与香菇的转色有关[6-7];在对滑子菇的研究中分离到1个42 ku的多酚氧化酶,该酶以活性前体的形式表达,在蛋白酶的作用下切割C端序列而生成有活性的成熟酶[8];在平菇中分离到1个75 ku的酪氨酸酶,该酶具有较高比活力,可用于食品工业[9];在玉木耳中克隆到1个多酚氧化酶,其在菌丝期表达量较低在子实体中表达量较高[10]。在双孢菇中已克隆鉴定出6个PPO基因[11],利用CRISPR-Cas9基因编辑系统对双孢蘑菇基因组中1个多酚氧化酶基因进行编辑,使得PPO酶活降低30%,有效减缓了双孢蘑菇的褐变现象[12]。
【本研究切入点】草菇基因组测序的完成对草菇基因功能的研究起到了极大的促进作用[13]。本研究通过生物信息学分析,从草菇中筛选和克隆获得PPO基因家族成员,分析其家族序列特征,分析该家族在各个发育时期和组织部位的表达差异,为进一步进行遗传改良提供参考。【拟解决的关键问题】分析研究草菇中PPO基因家族的结构特点和表达模式,以期为解析草菇褐变机理积累数据,为草菇抗褐变、耐存储品种选育等提供支撑。
1 材料与方法 1.1 试验材料供试草菇菌株v26,保存于广东省农业科学院蔬菜研究所食用菌菌种保藏中心。菌丝培养采用PDA培养基,出菇培养基为50% 稻草、50% 棉籽壳,含水量65%。
1.2 试验方法出菇试验于2021年3月在广东省农业科学院钟落潭白云试验基地进行,于菌丝期、原基期、蛋形期、成熟期4个不同时期取样。另外,在蛋形期对外菌膜、菌柄、菌盖3个不同部位进行取样,迅速用液氮冷冻,然后于-80 ℃保存,备用。
1.2.1 VvPPO基因家族序列获得 根据广东省蔬菜新技术重点实验室2015年测得的草菇菌丝转录组结果(PRJNA408191)和公布的草菇基因组信息(NCBI登录号:GCA_000349905),筛选得到功能注释为PPO的4个基因全长序列,分别命名为VvPPO1(MZ322862)、VvPPO2(MZ440853)、VvPPO3(MZ440854)、VvPPO4(MZ440855)。据此设计CDS全长引物,设计VvPPO1、VvPPO2、VvPPO3和VvPPO4基因序列引物和CDS引物,引物信息见表 1。
采用生工生物工程(上海)股份有限公司总RNA提取试剂盒提取草菇菌丝RNA,采用赛默飞有限公司生产的逆转录试剂盒合成cDNA,采用CTAB法提取草菇DNA。以草菇菌丝cDNA和基因组DNA为模板进行扩增。PCR扩增产物纯化后,与pMD18-T载体进行连接,阳性克隆进行测序。
1.2.2 生物信息学分析 蛋白质一级结构分析采用ProtParam(https://web.expasy.org/protparam/)在线程序,三级结构分析采用SWISSMODEL(https://swissmodel.expasy.org/interactive/);蛋白序列相似性分析运用LALIGN(https://www.ebi.ac.uk/Tools/psa/lalign/);基因结构分析运用Simple Modular Architecture Research Tool(http://smart.embl-heidelberg.de/)。
1.2.3 进化树分析 利用Clustal W对草菇、双孢蘑菇、香菇、巴西蘑菇(Agaricus blazei)、烟曲霉(Aspergillus fumigatus)、粗糙脉孢菌(Neurospora crassa)的PPO氨基酸序列进行多重序列比对,并在MEGA7软件中使用邻位相连法(Neighborjoining)构建进化树[14],并进行1 000次抽样置换检测。
1.2.4 VvPPO基因家族表达分析 以草菇不同发育时期和蛋形期不同组织部位的cDNA为模板,以VvTUBα为内参[15],反应引物见表 1。采用擎科2×T5 Fast qPCRMix (SYBRGreen) 试剂盒,PCR反应程序:95 ℃预变性30 s;95 ℃变性5 s、58 ℃退火30 s,40个循环;每个反应重复3次,采用2-ΔΔCt计算基因的相对表达量[16]。
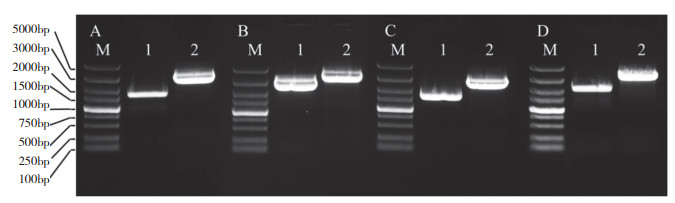
2 结果与分析 2.1 VvPPO基因家族的获得测序结果表明,VvPPO1 CDS全长1 596 bp(图 1 A),含7个外显子和6个内含子;VvPPO2 CDS全长2 685 bp(图 1B),含9个外显子和8个内含子;VvPPO3 CDS全长1 593 bp(图 1C),含7个外显子和6个内含子;VvPPO4 CDS全长2 067 bp(图 1D),含14个外显子和13个内含子。
|
| A: VvPPO1基因扩增产物,M:Marker DL5000,泳道1: VvPPO1基因CDS, 泳道2: VvPPO1基因全长;B: VvPPO2基因扩增产物,M:Marker DL5000,泳道1: VvPPO2基因CDS, 泳道2: VvPPO2基因全长;C: VvPPO3基因扩增产物,M:Marker DL5000,泳道1: VvPPO3基因CDS, 泳道2: VvPPO3基因全长;D: VvPPO4基因扩增产物,M:Marker DL5000,泳道1: VvPPO4基因CDS, 泳道2: VvPPO4基因全长 A: Amplified product of VvPPO1, M: Marker DL5000, lane1: CDS of VvPPO1, lane 2: Full-length of VvPPO1; B: Amplified product of VvPPO2, M: Marker DL5000, lane1: CDS of VvPPO1, lane 2: Full-length of VvPPO2; C: Amplified product of VvPPO3, M: Marker DL5000, lane1: CDS of VvPPO1, lane 2: Full-length of VvPPO3; D: Amplified product of VvPPO4, M: Marker DL5000, lane1: CDS of VvPPO1, lane 2: Full-length of VvPPO4 图 1 VvPPO基因家族PCR扩增产物 Fig. 1 Amplified product of VvPPO gene family by PCR |
2.2 VvPPO基因家族编码蛋白质特征分析
ProParam分析表明,草菇PPO基因家族所编码蛋白的氨基酸数目在530~894之间,相对分子量最小的是VvPPO1,最大的是VvPPO2;理论等电点pI范围5.34~5.95;蛋白的不稳定系数均大于40,表明草菇PPO蛋白为不稳定蛋白;总平均疏水指数均为负值,表明4个草菇PPO蛋白为亲水蛋白(表 2)。
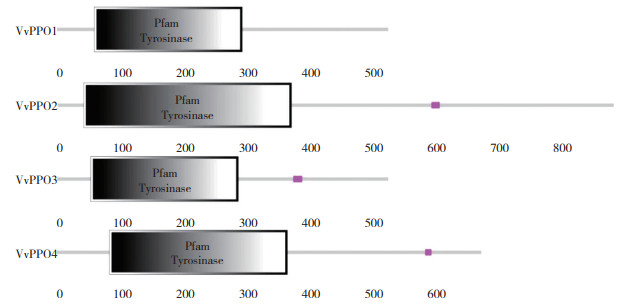
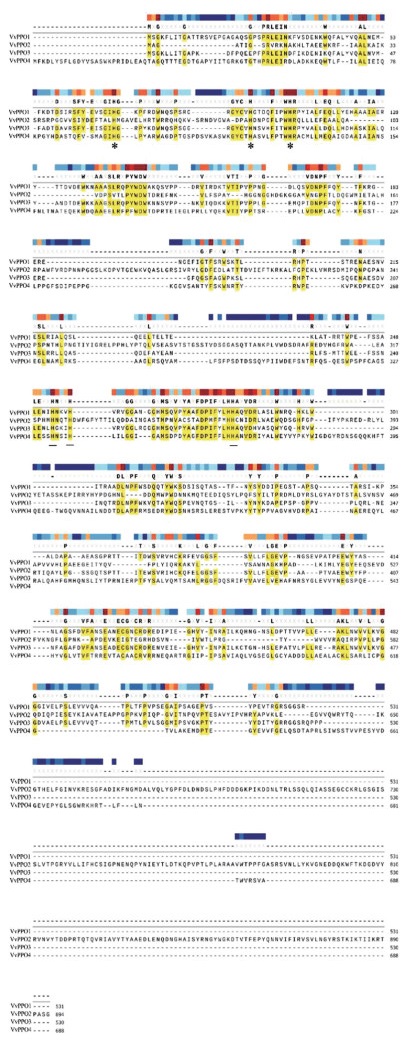
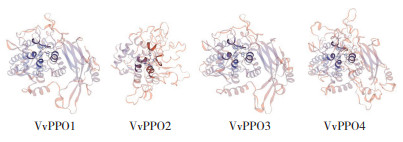
SMART分析表明,4个草菇PPO蛋白的Tyrosinase结构域长度为236~335个氨基酸(图 2)。双孢蘑菇PPO催化活性中心都包括2个保守的含铜结构域CuA和CuB,其中含高度保守的3个组氨酸,蛋白序列比对显示草菇PPO蛋白,酪氨酸酶CuA和CuB结合位点保守(图 3)。Swiss-model分析表明,三级结构中间有2个铜离子结合域(图 4)。
|
| 图 2 VvPPO蛋白保守结构域预测 Fig. 2 Conventional domains prediction for VvPPO protein |
|
| 突出显示的区域具有60% 或更高的同源性;* 表示CuA结合组氨酸,_表示CuB结合组氨酸 Highlighted areas have 60% or higher homology. * underlined histidines are of CuA. Second three underlined and bold histidines are of CuB 图 3 VvPPO蛋白序列比对 Fig. 3 Comparism of VvPPO protein sequence |
|
| 深色区域显示铜离子结合区 Dark area represents the copper ion binding area 图 4 VvPPO 蛋白三级结构预测 Fig. 4 Three-dimensional structure prediction for VvPPO proteins |
2.3 VvPPO蛋白的同源比对与进化树分析
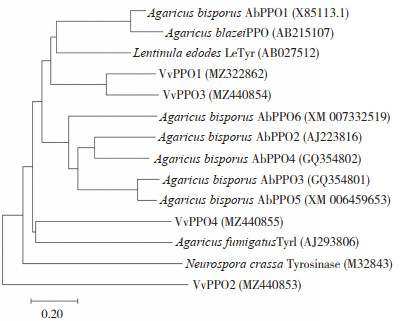
蛋白序列相似性分析显示(表 3),VvPPO蛋白序列相似度介于48.1%~73.5%,其中VvPPO1与VvPPO3最高相似度为63.1%,VvPPO2与VvPPO4最高相似度为73.5%。将草菇PPO蛋白序列与双孢蘑菇、香菇、巴西蘑菇、烟曲霉、粗糙脉孢菌PPO蛋白序列进行进化树分析,VvPPO1、VvPPO3与双孢蘑菇、香菇、巴西蘑菇PPO聚为一类,VvPPO4与烟曲霉聚为一类,VvPPO2单独聚为一类(图 5)。
|
| 图 5 VvPPO蛋白进化树分析 Fig. 5 Phylogenetic tree analysis of VvPPO proteins |
2.4 VvPPO基因家族表达分析
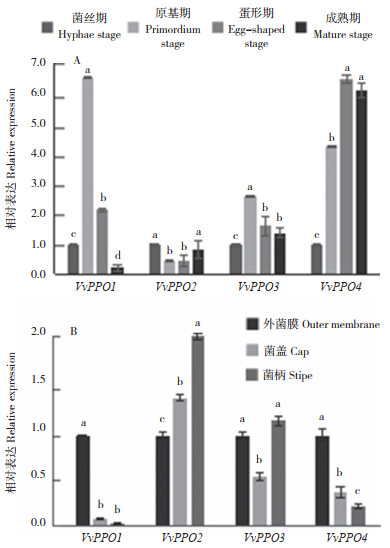
VvPPO基因在不同发育时期的表达量分析表明,4个多酚氧化酶基因在草菇各个发育时期中都有表达。VvPPO1在原基期表达量最高,随着发育的成熟表达量逐渐降低;VvPPO2在菌丝期表达量最高;VvPPO3在原基期表达量最高,其在各个时期的表达模式和VvPPO1较为相似;VvPPO4在菌丝期表达量最低,蛋形期表达量最高(图 6 A)。VvPPO基因在蛋形期不同组织部位的表达量分析表明,VvPPO1、VvPPO4在外菌膜中表达量较高,在菌盖和菌柄中表达量较低,其中VvPPO1在外菌膜的表达量要比在菌盖和菌柄中的表达量高10倍以上;VvPPO2、VvPPO3在菌柄中的表达量较高,在外菌膜和菌盖中表达量较低(图 6 B)。
|
| 小写英文字母不同者表示经LSD法检验差异显著 Lowercase letterrs represent significant differences by using LSD Method. 图 6 VvPPO基因在不同发育时期和蛋形期组织部位表达情况 Fig. 6 Expression of VvPPO genes in different developmental stages and tissue parts |
3 讨论
研究发现PPO与果蔬发生褐变有关[17],在大花金鸡菊(Coreopsis grandiflora)的研究中发现多酚氧化酶AUS1与aurone的合成有关[18],说明PPO功能的多样性。草菇PPO家族蛋白序列相似性分析显示,草菇VvPPO1与VvPPO3相似度较高,在不同发育时期的表达模式也较相似;三级结构预测显示VvPPO2与另外3个草菇PPO蛋白结构差异明显;草菇PPO蛋白序列与双孢蘑菇、香菇、巴西蘑菇、烟曲霉、粗糙脉孢菌PPO序列进化分析结果显示,VvPPO2单独聚为一类,说明VvPPO2与另外3个PPO生物功能不同。
不同的PPO基因表达模式不同,在植物不同发育时期表达量差异明显,且PPO的表达还受到生物和非生物胁迫的影响[19]。双孢蘑菇的发育过程中,子实体时期PPO的活性增强,菌盖表面褐变程度与PPO活性呈正相关关系[6]。对VvPPO基因的表达分析结果显示,除VvPPO2外,其他草菇PPO基因在菌丝期表达量较低,原基形成后表达量迅速升高,到成熟期时表达量渐渐降低,在蛋形期的不同组织部位表达量检测结果显示,在蛋形期PPO在各个组织部位均有表达。VvPPO1和VvPPO4在外菌膜中的表达量最高,可能是蛋形期引起草菇褐变的关键基因。VvPPO2在外菌膜中表达量最低,在菌柄中表达量最高,VvPPO2在各个组织部位的表达量差异不明显,这意味着草菇PPO功能的差异。
在果蔬抗褐变的研究中以PPO基因为靶标进行基因编辑已经获得了抗褐变的苹果(Malus sieversii)、茄子(Solanum melongena)和马铃薯(Solanum tubersoum)[20-22]等,如在马铃薯中通过编辑多酚氧化酶基因StPPO2获得了多酚氧化酶活性降低63%、酶促褐变降低73% 的植株。在双孢蘑菇中通过编辑PPO基因获得了抗褐变双孢蘑菇[12],本研究初步分析了草菇PPO基因家族的特征和表达模式,为进一步揭示草菇褐变的发生机理、培育抗褐变草菇提供理论依据。
4 结论本研究基于草菇基因组数据,挖掘获得4个多酚氧化酶基因,蛋白序列分析显示4个草菇PPO蛋白中菌含有保守Tyrosinase结构域,具有PPO蛋白典型特征,含有铜离子A(CuA) 和B(CuB) 结合区。同源比对与进化分析显示VvPPO1与VvPPO3相似性较高,VvPPO4与烟曲霉同源性较高,VvPPO2单独聚为一类,表明它们可能具有不同功能。草菇PPO基因表达模式分析显示VvPPO1、VvPPO3与VvPPO4子实体时期表达量比菌丝期表达量高,VvPPO2在各个发育时期表达量变化不明显。在蛋形期外菌膜中VvPPO1和VvPPO4表达量较高,VvPPO1和VvPPO4可能与蛋形期草菇褐变有关。
| [1] |
何焕清, 肖自添, 彭洋洋, 刘明, 徐江. 草菇栽培技术发展历程与创新研究进展[J]. 广东农业科学, 2020, 47(12): 53-61. DOI:10.16768/j.issn.1004-874x.2020.12.006 HE H Q, XIAO Z T, PENG Y Y, LIU M, XU J. Development history and innovation research progress of straw mushroom cultivation technology[J]. Guangdong Agricultural Sciences, 2020, 47(12): 53-61. DOI:10.16768/j.issn.1004-874x.2020.12.006 |
| [2] |
李瑞容, 林俊芳, 郑倩望, 邹苑, 郭丽琼. 草菇采后生物学特性变化及保鲜技术研究进展[J]. 中国蔬菜, 2021(6): 27-33. DOI:10.19928/j.cnki.1000-6346.2021.2017 LI R R, LIN J F, ZHENG Q W, ZOU Y, GUO L Q. Changes in biological characteristics of postharvest mushroom (Volvariella volvacea) and research progress in quality preservation technology[J]. China Vegetables, 2021(6): 27-33. DOI:10.19928/j.cnki.1000-6346.2021.2017 |
| [3] |
CHEN B, WU G H, LI L, WEI Q, ZHONG Q G, CHEN X N, XIAO K Q, XIE B G, JIANG Y J. Effects of 1‐methylcyclopropene on the quality attributes of harvested Chinese mushroom (Volvariella volvacea) fruiting bodies[J]. Food Science & Nutrition, 2019, 7(2): 747-754. DOI:10.1002/fsn3.919 |
| [4] |
SAKINAH N M J, MISRAN A, MAHMUD T M M, ABDULLAH S. A review: production and postharvest management of Volvariella volvacea[J]. International Food Research Journal, 2019, 26(2): 367-376. |
| [5] |
PANADARE D, RATHOD V K. Extraction and purification of polyphenol oxidase: A review[J]. Biocatalysis and Agricultural Biotechnology, 2018, 14: 431-437. DOI:10.1016/j.bcab.2018.03.010 |
| [6] |
KANDA K, SATO T, ISHII S, EHNEI, EJIRI S. Purification and properties of tyrosinase isozymes from the gill of Lentinus edodes fruiting body[J]. Bioscience, Biotechnology, and Biochemistry, 1996, 60(8): 1273-1278. DOI:10.1271/bbb.60.1273 |
| [7] |
VETCHINKINA E P, GORSHKOV V Y, AGEEVA M V, GOGOLEV Y V, NIKITINA V E. Activity and expression of laccase, tyrosinase, glucanase, and chitinase genes during morphogenesis of Lentinus edodes[J]. Microbiology, 2015, 84(1): 49-58. DOI:10.1134/S0026261715010166 |
| [8] |
KAWAMURA-KONISHI Y, TSUJI M, HATANA S, ASANUMA M, KAKUTA D, KAWANO T, MUKOUYAMA E B, GOTO H, SUZUKI H. Purification, characterization, and molecular cloning of tyrosinase from Pholiota nameko[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(7): 1752-1760. DOI:10.1271/bbb.70171 |
| [9] |
ZAIDI K U, ALI A S, ALI S A. Purification and characterization of high potential tyrosinase from macrofungi and its appliance in food engineering[J]. Journal of Microbiology, Biotechnology and Food Sciences, 2021, 2021: 203-206. DOI:10.15414/jmbfs.2015.5.3.203-206 |
| [10] |
苏文英, 杨和川, 谭一罗, 惠林冲, 秦裕营, 李晓. 玉木耳络氨酸酶基因的克隆及表达分析[J]. 江西农业学报, 2021, 33(3): 88-93. DOI:10.19386/j.cnki.jxnyxb.2021.03.14.jxnyxb.2021.03.14 SU W Y, YANG H C, TAN Y L, HUI L C, QIN Y Y, LI X. Cloning and expression analysis of tyrosinase gene from Auricularia cornea[J]. Acta Agriculturae Jiangxi, 2021, 33(3): 88-93. DOI:10.19386/j.cnki.jxnyxb.2021.03.14.jxnyxb.2021.03.14 |
| [11] |
WEIJN A, BASTIAAN-NET S, WICHERS H J, MES J J. Melanin biosynthesis pathway in Agaricus bisporus mushrooms[J]. Fungal Genetics and Biology, 2013, 55: 42-53. DOI:10.1016/j.fgb.2012.10.004 |
| [12] |
WALTZ E. Gene-edited CRISPR mushroom escapes US regulation[J]. Nature News, 2016, 532(7599): 293. DOI:10.1038/nature.2016.19754 |
| [13] |
BAO D P, GONG M, ZHENG H J, CHEN M J, ZHANG L, WANG H, ZHOU Y, JIANG J P, WU L, ZHU Y Q, ZHU G, LI C H, WANG S Y, ZHAO Y, ZHAO G P, TAN Q. Sequencing and comparative analysis of the straw mushroom (Volvariella volvacea) genome[J]. PLOS ONE, 2013, 8(3): e58294. DOI:10.1371/journal.pone.0058294 |
| [14] |
KUMAR S, STECHER G, AND TAMURA K. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33: 1870-1874. DOI:10.1093/molbev/msw054 |
| [15] |
QIAN J, GAO Y N, WANG Y, WU Y Y, WANG Y, ZHAO Y C, CHEN H Y, BAO D P, XU J Y, BIAN X H. Selection and evaluation of appropriate reference genes for RT-qPCR normalization of Volvariella volvacea gene expression under different conditions[J]. BioMed Research International, 2018, 2018. DOI:10.1155/2018/6125706 |
| [16] |
ZHAO X, SONG X X, LI Y P, YU C X, ZHAO Y, GONG M, SHEN X X, CHEN M J. Gene expression related to trehalose metabolism and its effect on Volvariella volvacea under low temperature stress[J]. Scientific Reports, 2018, 8(1): 1-14. DOI:10.1038/s41598-018-29116-z |
| [17] |
李彩云, 李洁, 严守雷, 王清章. 果蔬酶促褐变机理的研究进展[J]. 食品科学, 2021, 42(9): 283-292. DOI:10.7506/spkx1002-6630-20200401-008 LI C Y, LI J, YAN S L, WANG Q Z. Progress in research on the mechanism of enzymatic browning in fruits and vegetables[J]. Food Science, 2021, 42(9): 283-292. DOI:10.7506/spkx1002-6630-20200401-008 |
| [18] |
KAINTZ C, MOLITOR C, THILL J, KAMPATSIKAS I, MICHAEL C, HALBWIRTH H, ROMPEL A. Cloning and functional expression in E.coli of a polyphenol oxidase transcript from Coreopsis grandifl ora involved in aurone formation[J]. FEBS Letters, 2014, 588(18): 3417-3426. DOI:10.1016/j.febslet.2014.07.034 |
| [19] |
王丽, 王万兴, 索海翠, 胡新喜, 秦玉芝, 李小波, 熊兴耀. 植物中多酚氧化酶基因研究进展[J]. 分子植物育种, 2020, 18(14): 4629-4636. DOI:10.13271/j.mpb.018.004629 WANG L, WANG W X, SUO H C, HU X X, QIN Y X, LI X B, XIONG X Y. Research progress of polyphenol oxidase gene in plants[J]. Molecular Plant Breeding, 2020, 18(14): 4629-4636. DOI:10.13271/j.mpb.018.004629 |
| [20] |
STOWE E, DHINGRA A. Development of the Arctic®Apple[J]. Plant Breeding Reviews, 2021, 44: 273-296. DOI:10.1002/9781119717003.ch8 |
| [21] |
MAIOLI A, GIANOGLIO S, MOGLIA A, ACQUADRO A, VALENTINO D, MILANI A M, PROHENS J, ORZAEZ D, GRANELL A, LANTERI S, COMINO C. Simultaneous CRISPR/cas9 editing of three PPO genes reduces fruit flesh browning in Solanum melongena L[J]. Frontiers in Plant Science, 2020, 11: 1883. DOI:10.3389/fpls.2020.607161 |
| [22] |
GONZÁLEZ M N, MASSA G A, ANDERSSON M, TURESSON H, OLSSON N, FÄLT A F, STORANI L, DÉCIMA O C A, HOFVANDER P, FEINGOLD S E. Reduced enzymatic browning in potato tubers by specific editing of a polyphenol oxidase gene via ribonucleoprotein complexes delivery of the CRISPR/Cas9 system[J]. Frontiers in Plant Science, 2020, 10: 1649. DOI:10.3389/fpls.2019.01649 |
(责任编辑 邹移光)
 2021, Vol. 48
2021, Vol. 48