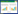文章信息
基金项目
- 国家自然科学基金面上项目(31872127);广东省科技计划项目(2015B020231004);广东省农业科学院农业优势产业新兴学科团队建设项目(202131TD); 广东省农业科学院院长基金(201937)
作者简介
- 和婷婷(1996—),女,在读硕士生,研究方向为瓜类枯萎病广谱抗性生理与分子基础,E-mail:1916660767@qq.com; 姚春鹏,中国科学院遗传与发育生物学研究所博士,德国马普植物育种研究所博士后,广东省农业科学院蔬菜研究所副研究员,广东省农业科学院基因编辑技术创新应用团队骨干成员,华南农业大学、广东海洋大学和湖北民族大学硕士生导师,《农业研究与应用》编委。主要采用正/ 反向遗传学、多组学、生物信息学与细胞/ 分子生物学技术,开展蔬菜枯萎病和白粉病的抗性精准鉴评、广谱抗性相关基因发掘与抗性调控机理研究,以及特色功能蔬菜的基因编辑育种技术与产业化研究。2016年入职以来主持国家自然科学基金面上项目、广东省省科技创新战略专项、广东省应用型科技研发专项(副主持)、广州市科技计划项目、广东省农业科学院院长基金等项目;获授权发明专利3项(排名第一),参与育成苦瓜新品种2个;在Plant Journal、Scientia Horticulturae、《园艺学报》等期刊发表科技论文10多篇.
通讯作者
- 姚春鹏(1980—),男,博士,副研究员,研究方向为特色功能蔬菜逆境生物学与精准育种技术开发,E-mail:chunpengyao@gdaas.cn.
文章历史
- 收稿日期:2021-07-28
2. 广东省农业科学院设施农业研究所,广东 广州 510640;
3. 广东省农业科学院农业生物基因研究中心/农作物种质资源保存与利用重点实验室,广东 广州 510640
2. Institute of Facility Agriculture, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;
3. Agro-biological Gene Research Center, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory of Crop Germplasm Resources Preservation and Utilization, Guangzhou 510640, China
【研究意义】由尖孢镰孢菌(Fusarium oxysporum)引发的枯萎病已成为影响瓜类产量和品质、制约瓜类产业绿色高质量发展的严重障碍,选育和种植抗病品种被认为是防控枯萎病,保障相关产业提质、节本、增效的重要途径[1]。枯萎病抗性鉴评是开展枯萎病抗性育种和抗性基因定位、抗性分子标记开发等应用基础研究的关键环节。目前,研究人员主要采用田间病圃筛选鉴定和苗期人工接种枯萎病菌两类方法进行瓜类枯萎病抗性材料的评价和筛选,但田间病圃筛选鉴定的结果重复性差、可靠性不强,人工接种枯萎病菌则需耗费相对大量的人力物力和时间成本。因此,建立一种操作简单且能快速可靠地鉴定及筛选抗感枯萎病植株的方法,对瓜类枯萎病分子育种及相关的应用基础研究具有重要的现实意义。
【前人研究进展】镰刀菌酸别名萎蔫酸,化学名称为5- 丁基-2- 吡啶甲酸,是包括有140多种专化型尖孢镰孢菌在内的镰刀菌属的许多真菌产生的一种非寄主特异性毒素,在尖孢镰孢菌对动植物致病过程中起重要作用[2-4]。研究发现不同浓度/ 剂量的镰刀菌酸对人体及哺乳动物的心血管系统、消化系统、免疫系统等都有不同程度的影响或危害[4-5]。镰刀菌酸对植物的影响也是剂量依赖型的,低浓度的镰刀菌酸(低于10-6 mol/L)能够诱导产生植物防卫反应,但较高浓度的镰刀菌酸(>10-5 mol/L)则能够破坏细胞的活性,引起细胞膜电位修饰和ATP合成抑制、重要辅助因子螯合、电解质渗漏以及细胞程序性死亡等[6-8]。在番茄、棉花、西瓜、黄瓜、香蕉等作物上的研究发现,尖孢镰孢菌粗毒素中的镰刀菌酸或商业化的镰刀菌酸纯品都能诱导植株萎蔫和植物细胞膜损伤等枯萎病的症状和生理反应,浓度越高的镰刀菌酸引发的症状越严重,而分解脱毒镰刀菌酸或破坏尖孢镰孢菌合成镰刀菌酸则能够有效减轻致病性尖孢镰孢菌的危害[9-13]。Kluepfel发现对尖孢镰孢菌的抗性较强的番茄品种对镰刀菌酸的抗性也较强[14]。许勇等发现参试的黄瓜自然群体中,各品系对镰刀菌酸的萎蔫指数与其对尖孢镰孢菌的发病指数呈显著或极显著正相关[15]。此外,从西瓜、甜瓜、节瓜、香蕉等体细胞变异体中筛选和再生出抗镰刀菌酸的材料,其对尖孢镰孢菌的抗性也相应提高[16-18],显示通过遗传改良植物对镰刀菌酸的抗性(如体细胞变异后筛选抗镰刀菌酸的变异体)是改良植物对尖孢镰孢菌性枯萎病的有效途径。Wang等研究发现镰刀菌酸或尖孢镰孢菌处理条件下,黄瓜叶片发生一系列高度相似的生理反应,包括气孔关闭、叶温上升,蒸腾速率(Tr)、气孔导度(Gs)、叶片含水量及水势降低,以及叶片细胞膜损伤等。黄瓜受尖孢镰孢菌侵染后,根部和叶片都能检测到镰刀菌酸,且镰刀菌酸在叶片中积累的相对含量比根部还要高,暗示尖孢镰孢菌入侵黄瓜维管组织后产生的镰刀菌酸被运输到叶部,可能是造成叶片枯萎症状发展的关键因素[19]。在香蕉中也报道了相似的研究结果[20],进一步揭示了黄瓜等植物抗镰刀菌酸胁迫与抗尖孢镰孢菌侵染过程中一些重要生理反应的相似性,显示黄瓜等植物对镰刀菌酸的抗性是其对尖孢镰孢菌抗性的重要组成部分。
【本研究切入点】基于上述镰刀菌酸的重要特性,利用一些对尖孢镰孢菌和镰刀菌酸抗/ 感表型一致的黄瓜、苦瓜育种研究材料作为范例,通过镰刀菌酸处理模拟替代尖孢镰孢菌处理,为黄瓜、苦瓜等瓜类作物枯萎病抗性鉴评提供新的便捷方法。【拟解决的关键问题】在瓜类枯萎病抗性育种及相关应用基础研究过程中,应用现行的瓜类枯萎病抗性鉴评方法存在费时、费力等诸多问题。本研究建立一种可替代尖孢镰孢菌进行瓜类枯萎病抗性鉴评的高效便捷的方法,为瓜类枯萎病抗性育种及抗性基础研究提供便利条件。
1 材料与方法 1.1 试验材料抗、感尖孢镰孢菌枯萎病的黄瓜材料3对和苦瓜材料1对,包括2对业内同行公认的材料W2757(抗)、9930(感)和长春密刺(CCMC,抗)、津研2号(JY2H,感);广东省农业科学院蔬菜研究所筛选的黄瓜材料1对〔CsFA-Rl(抗)、CsFA-Sl(感)〕和苦瓜材料1对〔McFA-Rl(抗)、McFA-Sl(感)〕。黄瓜F2分离群体的种子为CsFA-Rl和CsFA-Sl杂交后自交的后代。
1.2 试验方法1.2.1 对于子叶平展的植物如黄瓜,采用子叶叶盘法 挑选饱满的黄瓜材料种子,用网状种子袋包扎好,用无菌水洗涤干净,并用55 ℃温水浸泡15 min后于30 ℃湿润条件下催芽,将萌发种子播种于营养土中,温室培养(28 ℃、12 h光照,25 ℃、12 h黑暗,相对湿度75%~85%);在两叶一心期,用打孔器取出黄瓜幼苗子叶的叶盘(直径为8 mm),置于12孔或48孔的细胞培养板中。每孔加入适当体积的3 mmol/L镰刀菌酸处理液,48孔板用于处理单个子叶的叶盘,12孔板可用于多个子叶盘的混合处理。
1.2.2 对于子叶不平展的植物如苦瓜,采用首片真叶法 挑选饱满的苦瓜材料种子,用网状种子袋包扎好,用无菌水洗涤干净,用55 ℃热水浸泡20 min,室温浸泡4 h后于30 ℃湿润条件下催芽,将萌发种子播种于营养土中。在苦瓜两叶一心期取样,选取叶面平整光滑的第一片真叶,负压条件下进行2 mmol/L镰刀菌酸处理,将处理好的叶片平整放置到湿润的培养皿中,正常光照24 h后观察叶片变化。
2 结果与分析 2.1 镰刀菌酸处理快速鉴定抗、感枯萎病的黄瓜材料如图 1所示,未经镰刀菌酸处理的黄瓜子叶叶盘均为绿色,无法区分是否为抗、感尖孢镰孢菌枯萎病材料,但经镰刀菌酸处理后的黄瓜材料的子叶叶盘的颜色出现明显差异,且W2757、长春密刺(CCMC)和CsFA-Rl的颜色大部分为绿色或边缘黄化, 而9930、津研2号和CsFA-Sl均表现为黄色。表 1比较了供试黄瓜材料对尖孢镰孢菌的抗、感鉴定信息,可见对镰刀菌酸表现为抗性表型的均为抗枯萎病材料,对镰刀菌酸表现为敏感表型的均为感枯萎病材料。
|
| 图 1 镰刀菌酸处理代表性抗、感枯萎病黄瓜叶盘的表型 Fig. 1 Fusaric acid induced phenotypes in the leaf discs of the representative fusarium wilt resistant and susceptible cucumber |

|
2.2 镰刀菌酸处理快速筛选黄瓜F2群体中抗、感枯萎病的分离单株
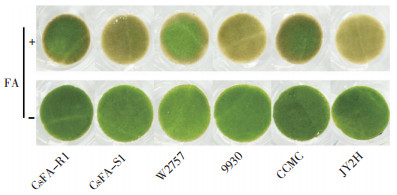
利用CsFA-R1和CsFA-S1杂交创制的F2分离群体,在进行F2群体的叶盘处理时发现叶盘颜色整体呈现连续的变化,图 2为代表性的分离单株。从F2群体中选取高抗(R++)、高感(S++)的单株,待植株长至2片真叶期,开始人工接种尖孢镰孢菌,处理2周后鉴评分离单株的病症[9]。试验结果表明,对FA高抗、高感表型的单株对尖孢镰孢菌处理也分别表现出抗、感表型(与其父母本的抗性一致)。
|
| 图 2 利用镰刀菌酸筛选F2群体中的极端抗、感单株 Fig. 2 Screening of extremely resistant and susceptible individuals in the F2 population by fusaric acid |
2.3 镰刀菌酸处理快速鉴定苦瓜抗、感枯萎病材料
考虑到苦瓜的子叶小而肥厚,不宜用上述子叶叶盘处理法,我们选择用首片真叶进行镰刀菌酸处理。图 3为广东省农业科学院蔬菜研究所鉴定保存的典型的抗、感枯萎病材料McFAR1和McFAS1在镰刀菌酸处理后0、24 h的表型。刚处理时抗感材料的叶盘颜色相近,但经镰刀菌酸处理24 h后感病材料几乎完全褪绿,而抗病材料仍然保持明显绿色,说明利用镰刀菌酸可以准确鉴别出苦瓜抗感枯萎病材料。

|
| 图 3 镰刀菌酸处理典型抗、感枯萎病苦瓜真叶的表型 Fig. 3 Fusaric acid induced phenotypes in the true leaves of bitter gourds with typical resistantce and susceptibility to fusarium wilt |
3 讨论
本研究采用特定浓度的镰刀菌酸处理液对国内黄瓜枯萎病抗性鉴定的标准对照CCMC(长春密刺,抗)和JY2H(津研2号,感),枯萎病抗、感表型明确的黄瓜材料W2757和9930,广东省农业科学院蔬菜研究所选育的抗感枯萎病的黄瓜材料CsFA-R1和CsFA-S1、苦瓜材料McFAR1和McFAS1进行了鉴定,从播种到鉴定出抗感表型的时间为2周左右,实际鉴定的时间在24 h之内,与现行传统方法相比具有明显优势。瓜类枯萎病现行的田间或温室病圃法占地多、时间长、工作量大,易受不同年份、不同季节气候变化的限制和影响,导致实验结果受环境条件的影响而不稳定。人工接种尖孢镰孢菌法实验过程繁琐冗长、工作量大、根据早期发病指数筛选出的抗/ 感单株由于染菌而很难存活留种,对于接菌侵染后的病情划分(即发病指数)易受环境和主观因素的影响而导致实验结果似是而非,需要多次重复才能取得可信结论,另外该方法还会产生大量有菌的实验垃圾(病株和栽培用土等),需要严格的隔离和后续处理措施,以防病菌扩散[21-22]。本研究利用镰刀菌酸处理进行鉴定和筛选,能快速准确地鉴定筛选岀抗、感枯萎病的植株,且该方法无需将整棵植株用于鉴定筛选,对植株的生长发育没有任何影响,方便快捷、而且能够节省大量人力物力成本,同时该方法不受自然气候及病害是否发生的影响,几乎不产生实验垃圾,因而更加环保;该方法对植株的子叶或第一片真叶进行处理,大大缩短了鉴定及筛选时间。
本研究对子叶平展的植物(如黄瓜)采用子叶叶盘处理法,对子叶不平展的植物(如苦瓜)则采用首片真叶处理法。相比较而言,首片真叶处理法的适用范围比子叶叶盘法更广泛,而子叶叶盘法的优势在于可以在植物子叶平展后即开始鉴定,更加节省时间和种植成本。本研究建立的方法可以作为初步筛选瓜类乃至其他作物抗尖孢镰孢菌引起的枯萎病的方法,为大规模高通量鉴评作物抗枯萎病材料提供简便、高效的室内方法。目前尚不排除某些植物材料对尖孢镰孢菌的抗性与其对FA抗性并不一致的情况,因此,使用本方法最保险的做法是分别独立地通过传统的枯萎病菌侵染鉴评抗感表型和利用本研究建立的鉴评方法盲测,比较确定植物材料或育种材料对尖孢镰孢菌的抗性与其对FA抗性一致之后,后续这些材料及其衍生的分离群体的枯萎病抗性鉴评实验均可采用镰刀菌酸筛选。随着研究的深入,通过比较研究更多植物对镰刀菌酸抗性与其对尖孢镰孢菌抗性的生理和分子机制,将有助于该方法在更多作物枯萎病抗性育种中的推广应用。
4 结论本研究建立了一种利用适当浓度的FA处理植株子叶叶盘或首片真叶从而快速鉴评瓜类枯萎病抗性的方法,该方法可适用于瓜类乃至其他作物。与传统的枯萎病抗性鉴评方法相比,本研究建立的方法具有明显的优势和广泛的应用前景,将为瓜类乃至其他作物枯萎病的抗性鉴评和抗枯萎病分子育种提供便利条件。
| [1] |
EDEL H V, LECOMET C. Current status of Fusarium oxysporumformae speciales and races[J]. Phytopathology, 2018, 109(4): 512-530. DOI:10.1094/PHYTO-08-18-0320-RVW.2018 |
| [2] |
BACON C W, PORTER J K, NOREED W P, LESLE J F. Production of fusaric acid by fusarium species[J]. Applied & Environmental Microbiology, 1996, 62(11): 4039-4043. |
| [3] |
LÓPEZ-DÍAZ C, RAHJOO V, SULYOK M, GHIONNA V, MARTIN- VICENTE A, CAPILLA J. Fusaric acid contributes to virulence of Fusarium oxysporum on plant and mammalian hosts[J]. Molecular Plant Pathology, 2017. DOI:10.1111/mpp.12536= |
| [4] |
NIEHAUS E M, DÍAZ-SÁNCHEZ V, BARGEN K, KLEIGREWE K, TUDZYNSKI B. Fusarins and fusaric acid in fusaria[J]. Biosynthesis and Molecular Genetics of Fungal Secondary Metabolites, 2014, 239-262. |
| [5] |
ABDUL S N, NAGIAH S, CHUTURGOON A A. T he neglected foodborne mycotoxin Fusaric acid induces bioenergetic adaptations by switching energy metabolism from mitochondrial processes to glycolysis in a human liver(HepG2)cell line[J]. Toxicology Letters, 2020, 318: 74-85. DOI:10.1016/j.toxlet.2019.10.013 |
| [6] |
JIAO J, SUN L, ZHOU B, GAO Z, HAO Y, ZHU X, LIANG Y. Hydrogen peroxide production and mitochondrial dysfunction contribute to the fusaric acid-induced programmed cell death in tobacco cells[J]. Journal of Plant Physiology, 2014, 171(13): 1197-1203. DOI:10.1016/j.jplph.2014.03.015 |
| [7] |
DERNARAIN N, TILOKE C, NAGIAH S, ANIL A, CHUTURGOON. Fusaric acid induces oxidative stress and apoptosis in human cancerous oesophageal SNO cells[J]. Toxicon, 2017, 126: 4-11. DOI:10.1016/j.toxicon.2016.12.006 |
| [8] |
LIU S, LI J, ZHANG Y, LIU N, VILJOEN A, MOSTERT D, ZUO C W, HU F C, BI H J, GAO O S, GUI M, DENG Q S, YANG T, DONG T G, DOU G J, LI J, MA C L. Fusaric acid instigates the invasion of banana by Fusarium oxysporum f. sp. cubense TR4[J]. New Phytologist, 2020, 225(2): 913-929. DOI:10.1111/nph.16193 |
| [9] |
GAPILLOUT L, MILAT J, BLEIN J P. Effects of fusaric acid on cells from tomato cultivars resistant or susceptible to Fusarium oxysporum f. sp. lycopersici[J]. European Journal of Plant Pathology, 1996, 102(2): 127-132. DOI:10.1007/BF01877099 |
| [10] |
马国斌, 林德佩, 王叶筠, 郭庆元. 西瓜枯萎病菌镰刀菌酸对西瓜苗作用机制的初步探讨[J]. 植物病理学报, 2000, 4(4): 373-374. DOI:10.13926/j.cnki.apps.2000.04.018 MA G B, LIN P D, WANG Y Y, GUO Q Y. Preliminary study on the mechanism of fusaric acid of Watermelon Fusarium Wilt on watermelon seedlings[J]. Journal of Plant Patholog y, 2000, 4: 373-374. DOI:10.13926/j.cnki.apps.2000.04.018 |
| [11] |
王瑞瑞, 王敏, 曾吉兴, 朱林星, 郭世伟. 镰刀菌酸在尖孢镰孢菌侵染过程中的产生规律及运输过程探究[J]. 植物病理学报, 2021. DOI:10.13926/j.cnki.apps.000756 WANG R R, WANG M, ZENG J X, ZHU L X, GUO S W. Production regularity and transportation process of fusarium acid in the process of Fusarium oxysporum infection[J]. Chinese Plant Pathology, 2021. DOI:10.13926/j.cnki.apps.000756 |
| [12] |
XIE X G, HUANG C Y, CAI Z D, CHEN Y, DAI C C. Targeted acquisition of Fusarium oxysporum f. sp. niveum toxin-deficient mutant and its effects on watermelon Fusarium Wilt[J]. Journal of Agricultural and Food Chemistry, 2019, 67(31): 8536-8547. DOI:10.1021/acs.jafc.9b02172 |
| [13] |
DING Z, YANG L, WANG G, GUO L, LEI L, WANG J, HUANG J. Fusaric acid is a virulence factor of Fusarium oxysporum f. sp. cubense on banana plantlets[J]. Tropical Plant Pathology, 2018, 43(4): 297-305. DOI:10.1007/s40858-018-0230-4 |
| [14] |
KLUEPFUL D. Über die Biosynthese und die Umwandlung von Fusarinsäure in Tomatenpfl anzen[J]. Phytopathol Z, 1957, 29: 349-379. |
| [15] |
许勇, 朱其杰, 陈晓莉, 梁根庆. 镰刀菌酸对黄瓜不同品种的致萎力与枯萎病菌致病力的相关性[J]. 中国蔬菜, 1993(1): 19-20. XU Y, ZHU Q J, CHEN X L, LIANG G Q. Correlation between the wilting activity of fusaric acid on different cucumber varieties and the pathogenicity of Fusarium oxysporum[J]. Chinese Vegetables, 1993(1): 19-20. |
| [16] |
何晓明, 谢大森, 彭庆务, 穆利霞. 节瓜抗镰刀菌酸突变体的筛选和特性研究[J]. 中国农学通报, 2009, 25(2): 172-175. HE X M, XIE D S, PENG Q W, MU L X. Study on the screening and characteristics of fusarium-resistant mutants of chiehqua[J]. Chinese Agricultural Science Bulletin, 2009, 25(2): 172-175. |
| [17] |
韩伟, 魏岳荣, 盛鸥, 胡春华, 易干军, 杨乔松, 黄永红, 李春雨, 邝瑞 彬'. 巴西蕉'离体芽的化学诱变和抗镰刀菌酸材料的筛选[J]. 核农学报, 2012, 26(9): 1237-1243. HAN W, WEI Y R, SHENG O, HU C H, YI Q J, YANG Q S, HUANG Y H, LI C Y, KUANG R B. Chemical mutagenesis of in vitro buds of'Brazil banana'and screening of fusarium-resistant materials[J]. Journal of Nuclear Agriculture, 2012, 26(9): 1237-1243. |
| [18] |
MATSUMOTO K, BARBOSA M, SOUZA L, TEIXIRA J. Race 1 fusarium wilt tolerance on banana plants selected by fusaric acid[J]. Euphytica, 1995, 84(1): 67-71. DOI:10.1007/BF01677558 |
| [19] |
WANG M, SUN Y, SUN G, LIU X K, ZHAI L C, SHEN Q R, GUO S W. Water balance altered in cucumber plants infected with Fusarium oxysporum f. sp. Cucumerinum[J]. Scientific Reports, 20105, 5: 7722. DOI:10.1038/srep07722 |
| [20] |
DONG X, XIONG Y F, LING N, GUO S W. Fusaric acid accelerates the senescence of leaf in banana when infected by Fusarium[J]. World Journal of Microbiology and Biotechnology, 2014, 30(4): 1399-408. DOI:10.1007/s11274-013-1564-1 |
| [21] |
黄瓜主要病害抗病性鉴定技术规程第3部分: 黄瓜抗枯萎病鉴定技术规程NY/T 1857-2010[S]. 2010. Rules for evaluation of cucumber for resistance to diseases Part 3: Rule for evaluation of cucumber for resistance to fusarium wilt NY/T 1857-2010[S]. 2010. |
| [22] |
李树德, 方智远, 李明远. 中国主要蔬菜抗病育种进展[M]. 北京: 科学出版社, 1995: 420-421, 439-444. LI S D, FANG Z Y, LI M Y. Progress in disease resistance breeding of major vegetables in China[M]. Beijing: Science Press, 1995: 420-421, 439-444. |
责任编辑 杨贤智
 2021, Vol. 48
2021, Vol. 48