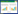文章信息
基金项目
- 国家重点研发计划项目(2017YFD0201602)
作者简介
- 岳鑫璐(1987 -),女,硕士,农艺师,研究方向为种子病理学与检疫性有害生物防治,E-mail:yxl20071029@163.com.
通讯作者
- 胡茂林(1981 -),男,博士,高级农艺师,研究方向为种子病理学,E-mail:maolin522612@126.com.
文章历史
- 收稿日期:2021-08-11
【研究意义】由野油菜黄单胞菌野油菜致病变种(Xanthomonas campestris pv. campestris(Pam.)Dowson,Xcc)引起的十字花科蔬菜黑腐病是目前蔬菜上重要的种传细菌性病害[1]。该病害在幼苗期即可发病,出苗或出苗后子叶呈水浸状,根髓部变黑而死亡;成株期发病一般从叶缘开始,形成“V”字形病斑;受害叶片多数从叶缘开始出现由外向内扩展的黄色楔状斑,黄斑内的网状叶脉呈褐色至紫褐色病变[2-4],最终至植株腐烂。黑腐病不仅可以通过感染的种子和种苗远距离传播,也可通过风、昆虫、灌溉、雨水、农业设备及人的活动等媒介近距离传播[5-6]。黑腐病通常适于在25~30 ℃条件下发生,在多雨湿热的环境下更易造成该病害的暴发[7]。20世纪50年代末,该病害在我国华北地区首次出现,到80年代在全国普遍发生,且危害逐年加重,严重时导致蔬菜减产70%左右[8]。十字花科蔬菜黑腐病不仅严重影响十字花科蔬菜的产量和品质,同时也危害除十字花科以外的多种蔬菜[9],做好种传黑腐病的防控具有现实意义。
【前人研究进展】目前,防治种子传带黑腐病等种传病害除了选用无病种子或耐、抗病品种外,主要是采用种子消毒处理。化学药剂消毒及拌种能较快速控制病害,但一些化学处理种子方法可能对种子产生伤害,对于植物、土壤、水体可能会产生不良影响[10]。与化学方法相比,种子热处理方法是利用有效杀菌温度与种子可能受伤害的温度存在一定温差,以此达到抑制或杀死种子携带的病原菌,从而达到防控病害以及保护环境的目的[11]。由于不同作物种子及其携带的病原菌对温度、时间的敏感度不同,因而需要针对特定作物及病原菌设置特定的干热处理条件。种子干热处理可以阻止病原菌在种子表面的进一步繁殖,降低种子的带菌率[12];孟姗姗对4种蔬菜种子进行干热处理技术研究,表明干热处理可以有效减少种子上的病原菌,同时降低种子携带病原菌的致病性[13];张永平等对甜瓜种子携带细菌性果斑病进行干热处理研究,结果表明适宜的干热处理温度和处理时间能有效提高种子活力和出苗率,显著降低甜瓜种子幼苗细菌性果斑病发病率[14]。
【本研究切入点】目前有关蔬菜种子热处理研究大多关注对象为葫芦科及茄果科作物种子,主要研究不同热处理条件对作物种子活力及生长的影响,对种子携带病原菌尤其是十字花科蔬菜种子携带病原菌的热处理研究报道较少。本研究通过设置不同的温度和时间组合干热条件,对黑腐病菌及带菌白菜种子进行处理,综合评价抑菌率及种子活力等指标,筛选安全、适宜的干热处理条件,以期为十字花科蔬菜黑腐病菌防治、病害绿色防控技术提供理论基础和技术支撑。【拟解决的关键问题】本研究旨在探究干热处理对十字花科蔬菜种子及其种传黑腐病菌的影响,筛选出可抑制种传病菌生长同时不影响种子活力的温度与时间组合处理条件。
1 材料与方法 1.1 试验材料试验于2020年4月至2021年6月在深圳市农业科技促进中心实验室进行。供试菌株十字花科蔬菜黑腐病菌Xcc 8004,由中国农业大学种子健康中心实验室提供。桂柳四季高脚甜白菜种子由柳州市桂柳农业科技有限公司生产,经前期检测为未携带黑腐病菌的健康种子。
LB固体培养基:胰蛋白胨10 g,NaCl 10 g,酵母粉5 g,琼脂粉16 g加蒸馏水定容至1 000 mL,121 ℃灭菌21 min后备用;LB液体培养基:不含琼脂粉,其他同LB固体培养基;改良mCS20ABN培养基:大豆蛋白胨2 g,细菌胰蛋白胨2 g,磷酸二氢钾1.59 g,磷酸氢二铵0.33 g,七水合硫酸镁0.4 g,谷氨酰胺6.0 g,甲基绿1 mL,可溶性淀粉12.5 g,细菌琼脂粉15 g,蒸馏水定容到1 000 mL,121 ℃灭菌21 min,冷却至55 ℃后迅速加入1 mL浓度为200 mg/mL的放线菌酮、1 mL浓度为20 mg/mL的新霉素、1 mL浓度为100 mg/mL的枯草菌素,充分摇匀后倒入培养皿备用[15]。
仪器:METTLER TOLEDO DL203电子天平,Eppendorf 5425R台式高速离心机,FYL-YS-150YL-YS-28L菌株培养箱,知楚ZQTY-70F台式全温振荡培养箱,Leica DM400B生物显微镜,WEWO TEM1880可程式恒温恒湿试验箱,HiPoint FH-1200植物生长培养箱。
1.2 试验方法1.2.1 黑腐病菌的活化与培养 病原菌活化:用接种环蘸取冻存的菌株培养液,在LB固体培养基上划线,在菌株培养箱内于28 ℃、相对湿度>60% 遮光倒置培养2~3 d。
病菌悬浮液制备:用无菌接种环挑取LB固体培养基上的单菌落,接种到装有200 mL的LB液体培养基中,150 r/min培养16 h,制备成浓度为106 CFU/mL的菌液备用。
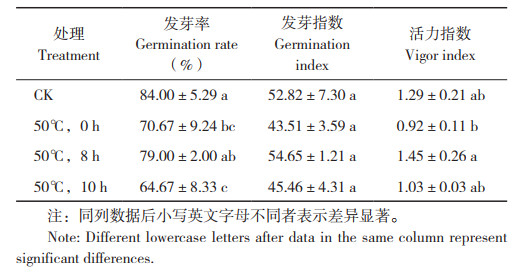
1.2.2 离体条件下病原菌干热处理 参照孟珊珊[13]所做滤纸片法进行干热处理试验,将2张1 cm×1 cm无菌滤纸片浸入制备好的106 CFU/ mL菌悬液中,浸泡5 min后在超净工作台取出晾干备用。随后将晾干后的带菌滤纸片置于直径5 cm、高3 cm的敞盖圆柱体铝盒内,按照温度(45、50、60、65 ℃)、时间(0.5、1、2、4、6 h)组成的20个处理条件对带菌滤纸片进行处理。处理完成后将各个滤纸片分别浸泡在5 mL无菌水中,180 r/min摇床振荡30 min,制备洗脱液,每个处理的洗脱液稀释成100、10-1、10-2、10-3、10-4梯度,分别吸取100 μL液体于LB固体培养基上涂板,每个浓度3次重复,以未进行热处理的病原菌为对照。涂板后将平板倒置于28 ℃、相对湿度>60% 黑暗倒置培养48 h后,记录菌落生长情况并计算病原菌抑制率:
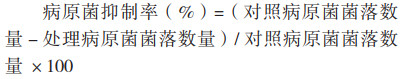
|
1.2.3 种子携带黑腐病菌干热处理 带菌种子制备:每组处理随机选取1 000粒种子于3%NaClO溶液中消毒5 min后用无菌水冲洗3次,滤纸吸干种子表面水分,随后将种子放入铺有两层无菌滤纸的培养皿中,于超净工作台中风干。将风干的种子置于无菌培养皿内,加入5 mL浓度为106 CFU/mL菌悬液,浸泡30 min后,在超净工作台内吸出菌液,风干后置于直径5 cm、高3 cm的敞盖圆柱体铝盒内于恒温恒湿箱进行干热处理。
种子携带黑腐病菌的抑制率计算:每组样品干热处理完成后取2 g(1 000粒)种子按照种子质量∶无菌纯净水=1∶4的比例置于10 mL试管中,于180 r/min摇床振荡30 min,制备洗脱液。随后分别稀释成100、10-1、10-2、10-3梯度,分别吸取100 μL菌液于改良mCS20ABN培养基上涂板,每个处理3次重复。将平板倒置于28 ℃、相对湿度>60% 黑暗培养48 h后,在4组稀释梯度平板中选取菌落数在30~300个之间、无蔓延菌落生长的平板计数菌落总数,统计单粒种子带菌量,计算病原菌抑制率:

|
式中,0.3 mL表示3皿平板内菌液总量,8 mL为制备种子洗脱液的量。
1.2.4 种子携带黑腐病菌的活力评价 参照GB/T 3543.4-1995《农作物种子检验规程- 发芽试验》,将热处理后的种子置于19 cm ×13 cm ×8 cm发芽盒中,每个发芽盒铺两层无菌发芽纸保湿,每盒摆放100粒种子,3次重复。将发芽盒置于植物生长培养箱中,在20 ℃、相对湿度>70% 黑暗条件下发芽,待种子出芽后,于20 ℃、相对湿度>70%、L//D=12 h//12h条件下培养。以健康的种子为对照。分别测定发芽率、发芽指数、活力指数[16],综合评价种子活力。
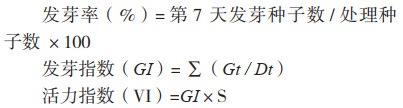
|
式中,Dt为发芽日数,Gt为与Dt相对应的每天发芽数,S为第7天正常幼苗鲜重(g)。
2 结果与分析 2.1 十字花科蔬菜黑腐病菌生物学特性将活化的病原菌在LB液体培养基培养16 h,稀释成103 CFU/mL后均匀涂布于LB固体培养基和改良mCS20ABN固体培养基上(28 ℃、相对湿度>60%,黑暗倒置培养)。病原菌在LB固体培养基上培养2 d后,菌落生长至1~2 mm,前期呈淡黄色,后期呈蜡黄色,圆形、黏稠状、微凸起(图 1A、B);病原菌在改良mCS20ABN固体培养基上培养2 d,菌落生长到0.5~1 mm,呈淡绿色或半透明、圆形、黏稠状、稍隆起且有光泽,菌落周围被水解淀粉圈包围(图 1C、D)。
|
| A、B:Xcc在LB培养基上生长2 d的形态;C、D:Xcc在改良mCS20ABN培养基上生长2 d的形态 A, B: Morphologies of Xcc cultured on LB medium for two days; C, D: Morphologies of Xcc cultured on modified MCS20ABN medium for two days 图 1 Xcc在LB培养基和改良mCS20ABN培养基上的生长形态 Fig. 1 Morphologies of Xcc cultured on LB and modified mCS20ABN media |
2.2 干热处理对离体条件下病原菌的抑制作用
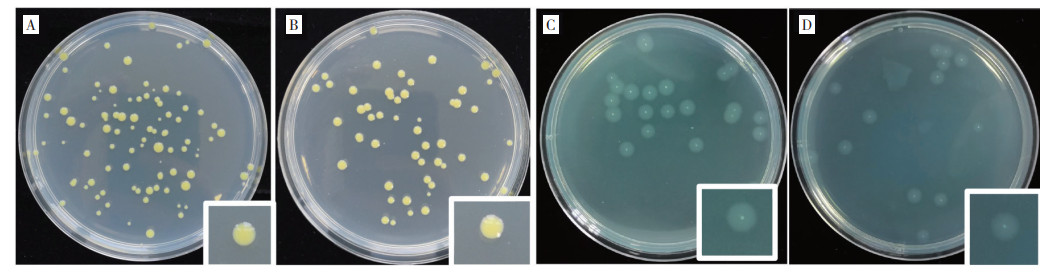
采用滤纸片法,按照温度(45、50、60、65 ℃)、时间(0.5、1、2、4、6 h)组成的20个处理条件对病原菌进行处理,结果(表 1)显示,当干热处理温度为45 ℃,处理时间为4 h及以上,病原菌抑制率达100%。当干热处理温度分别为50、60、65 ℃时,处理时间为0.5 h及以上,病原菌抑制率均可达到100%。
|
2.3 干热处理对种子携带黑腐病菌的抑制作用
根据上述干热处理对病原菌的抑制结果,选取温度为45、50 ℃,时间为0、4、8、10 h的组合条件对带菌种子进行干热处理(0 h处理表示带菌种子未进行热处理)。
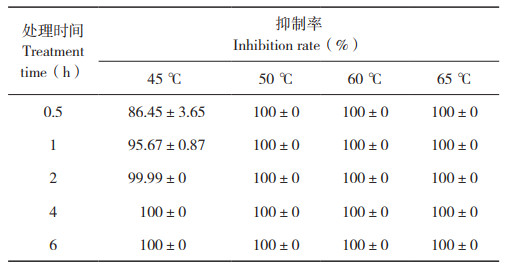
带菌种子干热处理后,制备洗脱液涂板并在改良mCS20ABN培养基上培养2 d后,统计病原菌在培养基上的生长情况,并计算抑制率,结果显示,同一温度条件下,随着处理时间的延长,平板上菌落数量随之减少(图 2),当温度为50 ℃,持续干热处理8 h及以上时,平板上菌落数为0,病原菌抑制率达100%(表 2)。
|
| 图 2 不同干热处理种子携带Xcc分离情况 Fig. 2 Xcc isolated from seeds under different dry heat treatments |
2.4 干热处理对带菌种子活力的影响
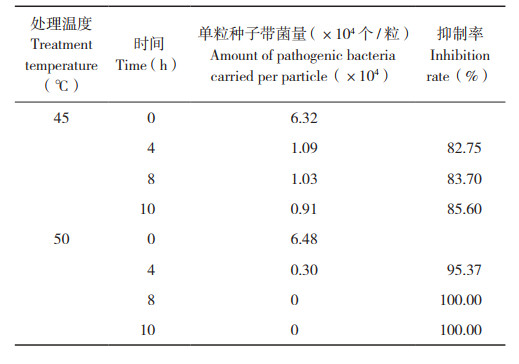
将带菌种子选取50 ℃与0、8、10 h组合条件进行干热处理(0 h处理表示带菌种子未进行热处理),以未经处理的健康种子为对照。结果显示,在50 ℃条件下干热处理8 h,对种子发芽率、发芽指数以及活力指数没有显著影响,且活力高于未进行干热处理的带菌种子;在50 ℃条件下干热处理10 h,对发芽率影响显著。
3 讨论
种子干热处理利用干热空气对种子进行高温处理,利用热力及有效杀菌温度与种子耐受温度的差距来杀灭病菌[17]。前人利用不同作物品种及种传病原菌为试验材料,探究热处理对种子活力及杀菌的影响,已有相关成果。刘永胜研究了不同干热处理对油菜种子发芽及幼苗生长的影响,得出50 ℃处理是油菜种子较为理想的干热处理温度[18]。刘正鲁等探究干热处理的不同温度和时长对黄瓜种子发芽及植株生长发育的影响,得出干热温度75 ℃、时长24 h处理的种子育苗,黄瓜的茎粗、植株鲜质量和干质量均显著高于对照,且未发生病毒病[19]。宋顺华等研究了干热处理对不同种类葫芦科瓜菜种子活力的影响,结论为干热处理会降低种子的活力,其影响程度会因不同作物种类及同一种类不同品种而异[20]。本研究在前人的研究基础上,设置干热处理对黑腐病菌及人工拌菌白菜种子进行处理,综合评价病原菌抑制率、带菌种子苗期发病率及种子活力。
从试验结果看,本研究对桂柳四季高脚甜白菜种子携带黑腐病菌所筛选能有效抑制黑腐病菌同时显著提高带菌种子活力的处理条件为50 ℃持续干热8 h。宋顺华等研究表明,80 ℃处理3 d能完全抑制带菌种子上的黑腐病菌,并对不带菌的京春白、京春黄和新奶白品种的种子发芽率和发芽势没有影响[21]。本研究结果验证了宋顺华等的观点,即同一种作物种子不同品种对高温的敏感度不一样,针对不同的品种应选择适宜的高温[21]。
从试验条件上分析,宋顺华等[21]的试验,干热条件预设35 ℃ 24 h、55 ℃ 24 h对白菜种子进行前置处理,目的在于控制种子含水量低于4%,而本研究未对种子进行前置处理,种子含水量变化致使不同条干热条件对种子活力的影响有待进一步研究。
从试验对象上看,宋顺华等[21]对带菌京春白种子干热处理,其种子在65、70、75、80 ℃干热处理72 h,单粒种子上病原细菌的带菌量比对照分别减少92%、99%、99% 和100%,推测其种子为内外部均携带黑腐病菌的自然种子。而本研究则对健康种子进行人工拌菌,从而模拟种子表面带菌,干热处理后180 r/min摇床振荡30 min,可将种子表面携带病原菌洗脱,统计单粒种子带菌量种子;结果显示50 ℃持续干热处理8 h病原菌抑制率达100%,其结果基于种子表面携带病原菌进行探究,种子内部携带病菌相关分析有待进一步探究。
4 结论本研究通过对黑腐病菌及带菌白菜种子进行干热处理,对比分析了不同热处理条件对病原菌抑制效果、种子的灭菌效果以及种子活力指标。筛选出温度为45 ℃持续干热处理4 h及以上或温度为50、60、65 ℃持续干热处理0.5 h及以上的干热处理条件能使离体黑腐病菌失活;温度为50 ℃持续干热处理8 h能完全抑制带菌种子携带病原菌,且能提高种子的活力。综合研究结果表明,50 ℃持续干热处理8 h能有效抑制黑腐病菌生长,对种子具有灭菌效果,同时能提高种子的活力。
| [1] |
WILLIAMS P H, STAUB T, SUTTON J C. Inheritance of resistance in cabbage to black rot[J]. Phytopathology, 1971, 62: 247-252. DOI:10.1094/Phyto-62-247 |
| [2] |
罗宽. 十字花科黑腐病的研究[J]. 中国蔬菜, 1983(3): 51-54. LUO K. Studies on black rot of cruciferae[J]. China Vegetables, 1983(3): 51-54. |
| [3] |
盛镜方, 陈卫良, 罗永良. 十字花科蔬菜黑腐病菌初探[J]. 浙江农业大学学报, 1989(3): 6. SHENG J F, CHEN W L, LUO Y L. Preliminary study on black rot of cruciferous vegetables[J]. Journal of Zhejiang Agricultural University, 1989(3): 40. |
| [4] |
张文修, 李亚鹏. 十字花科蔬菜黑腐病的发生与防治[J]. 现代蔬菜, 2006(7): 8. DOI:10.3969/j.issn.1001-0254.2006.07.019 ZHANG WX, LI YP. Occurrence and control of black rot in cruciferaceae vegetables[J]. Modern Vegetable, 2006(7): 8. DOI:10.3969/j.issn.1001-0254.2006.07.019 |
| [5] |
ROBERTS S J, BROUGH J, HUNTER P J. Modelling the spread of Xanthomonas campestris pv. campestris in module-raised brassica transplants[J]. Plant Pathology, 2007, 56(3): 391-401. DOI:10.1111/j.1365-3059.2006.01555.x |
| [6] |
张黎黎, 刘玉梅, 田自华, 方智远, 杨丽梅, 庄木, 张扬勇, 李占省, 舒金帅. 十字花科蔬菜抗黑腐病育种研究进展[J]. 园艺学报, 2012, 39(9): 1727-1738. DOI:10.16420/j.issn.0513-353X.2012.09.014 ZHANG L L, LIU Y M, TIAN Z H, FANG Z Y, YANG L M, ZHUANG M, ZHANG Y Y, LI Z S, SHU J S. Advances of research on breeding of resistance to black rot in crucifer[J]. Acta Horticulturae Sinica, 2012, 39(9): 1727-1738. DOI:10.16420/j.issn.0513-353X.2012.09.014 |
| [7] |
MEENU G, VIKRAM A, BHARAT N. Black rot-A devastating disease of crucifers: a review[J]. Agricultural Research Communication Centre, 2013, 34(4): 269-278. DOI:10.5958/j.0976-0741.34.4.012 |
| [8] |
李树德. 中国主要蔬菜抗病育种进展[M]. 北京: 科学出版社, 1995: 583-584. LI S D. Advances in main vegetable crops breeding for diseases resistance in China[M]. Beijing: Science Press, 1995: 583-584. |
| [9] |
芦燕. 大白菜黑腐病病原菌鉴定和抗病性鉴定方法研究[D]. 杨凌: 西北农林科技大学, 2008. LU Y. Study on the pathogenic bacteria identification and resistance identification method of black rot of in Chinese cabbage[D]. Yangling: Northwest A & F University, 2008. |
| [10] |
刘山, 欧阳西荣, 聂荣邦. 物理方法在作物种子处理中的应用现状与发展趋势[J]. 作物研究, 2007(S1): 520-524. DOI:10.16848/j.cnki.issn.1001-5280.2007.S1.008 LIU S, OUYANG X R, NIE R B. The application status and development trend of physical methods in crop seed treatment[J]. Crop Research, 2007(S1): 520-524. DOI:10.16848/j.cnki.issn.1001-5280.2007.S1.008 |
| [11] |
毛连纲, 颜冬冬, 吴篆芳, 马涛涛, 王秋霞, 李园, 郭美霞, 欧阳灿斌, 曹坳程, 郑建秋. 种子处理技术研究进展[J]. 中国蔬菜, 2013(10): 9-15. DOI:10.3969/j.issn.1000-6346.2013.10.002 MAO L G, YAN D D, WU Z F, MA T T, WANG Q X, LI Y, GUOM X, OUYANG C B, CAO A C, ZHENG J Q. Research progress in seed treatment[J]. China Vegetables, 2013(10): 9-15. DOI:10.3969/j.issn.1000-6346.2013.10.002 |
| [12] |
宋顺华, 吴萍, 孟淑春, 宫国义, 邢宝田. 种子处理对西瓜细菌性果斑病的防治效果[J]. 中国瓜菜, 2013, 26(3): 5-9. DOI:10.16861/j.cnki.zggc.2013.03.002 SONG S H, WU P, MENG S C, GONG G Y, XING B T. Control effect of seed treatment on bacterial fruit spot of watermelon[J]. China Cucurbits and Vegetables, 2013, 26(3): 5-9. DOI:10.16861/j.cnki.zggc.2013.03.002 |
| [13] |
孟姗姗. 四种带菌蔬菜种子的干热处理技术研究[D]. 北京: 中国农业科学院, 2014. MENG S S. Studies on dry heat treatment of four infected vegetables seeds[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. |
| [14] |
张永平, 张文献, 许爽, 杨少军, 陆世钧, 陈幼源. 干热处理对甜瓜种子活力和细菌性果斑病抑制能力的影响[J]. 西北植物学报, 2017, 37(7): 1364-1371. DOI:10.7606/j.jssn.1000-4025.2017.07.1364 ZHANG Y P, ZHANG W X, XU S, YANG S J, LU S J, CHEN Y Y. Effects of dry-heat treatment on seed vigor and controlling bacterial fruit blotch of melon[J]. Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(7): 1364-1371. DOI:10.7606/j.jssn.1000-4025.2017.07.1364 |
| [15] |
李慧. 十字花科蔬菜种子携带黑腐病菌Bio-PCR检测方法的改良[D]. 北京: 中国农业大学, 2013. LI H. Bio-PCR detection improvement of Xanthomonas campestris pv. campestris on Brassica spp. seed[D]. Beijing: China Agricultural University, 2013. |
| [16] |
张春庆, 王建华. 植病研究方法[M]. 北京: 高等教育出版社, 2006: 74-77. ZHANG C Q, WANG J H. Seed testing science[M]. Beijing: Higher Education Press, 2006: 74-77. |
| [17] |
姚东伟, 李明, 吴凌云, 陈利明. 种子物理处理技术研究与应用概况[J]. 种子, 2019, 38(1): 135-138. DOI:10.16590/j.cnki.1001-4705.2019.01.135 YAO D W, LI W, WU L Y, CHEN L M. Overview of research and appliction on physical methods for seed treatment[J]. Seed, 2019, 38(1): 135-138. DOI:10.16590/j.cnki.1001-4705.2019.01.135 |
| [18] |
刘永胜, 黄启梅, 云兴福. 干热处理对油菜种子发芽及幼苗生长的影响[J]. 北方农业学报, 2016, 44(1): 56-60, 64. LIU YS, HUANG QM, YUN XF. Effect of dry heat treatment on seed germination and seedling growth of young Chinese cabbage[J]. Journal of Northern Agriculture, 2016, 44(1): 56-60, 64. |
| [19] |
刘正鲁. 干热处理对碧玉2号黄瓜种子发芽和植株生长的影响[J]. 上海蔬菜, 2021(4): 83-85. DOI:10.3969/j.issn.1002-1469.2021.04.034 LIU Z L. Effect of Dry Heat Treatment on Seed Germination and Plant Growth of Biyu 2 Cucumber[J]. Shanghai Vegetables, 2021(4): 83-85. DOI:10.3969/j.issn.1002-1469.2021.04.034 |
| [20] |
宋顺华, 耿丽华. 干热处理对几种不同葫芦科瓜菜种子活力的影响[J]. 种子, 2020, 39(11): 51-54. DOI:10.16590/j.cnki.1001-4705.2020.11.051 SONG S H, GENG L H. Effects of dry heat treatment on seed vigor of several cucurbitaceous vegetables[J]. Seed, 2020, 39(11): 51-54. DOI:10.16590/j.cnki.1001-4705.2020.11.051 |
| [21] |
宋顺华, 吴萍, 郑晓鹰, 丁海凤. 干热处理对蔬菜种子质量的影响及其杀菌效果研究[J]. 河南农业科学, 2011, 40(4): 117-119. DOI:10.15933/j.cnki.1004-3268.2011.04.034 SONG S H, WU P, ZHENG X Y, DING H F. Sterilizing effects of dry heat treatment and its influence on vegetable seed quality[J]. Journal of Henan Agricultural Sciences, 2011, 40(4): 117-119. DOI:10.15933/j.cnki.1004-3268.2011.04.034 |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49