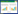文章信息
基金项目
- 国家自然科学基金(32072902)
作者简介
- 徐国双(1992—),男,硕士,研究方向为禽流感致病机制,E-mail: 947590661@qq.com.
通讯作者
- 关振宏(1976—),女,博士,副教授,研究方向为人兽共患病毒病致病机制,E-mail: guanzh@jlu.edu.cn.
文章历史
- 收稿日期:2021-10-27
【研究意义】禽流感病毒(Avian Influenza Virus,AIV)可引发家禽及野生禽类出现高度接触性传染病,高致病性AIV亚型病毒的致死率接近100%。AIV通过在宿主中频繁变异和基因重组而不断跨越种属屏障,在人及其他哺乳动物之间造成感染和传播,H5N1和H7N9亚型是其最典型的毒株[1-2]。自2013年H7N9亚型AIV首次在我国出现后,人感染此亚型AIV的病例持续增多,死亡率接近40%,已对人类健康造成严重威胁[3-6]。研究H7N9亚型AIV的致病机制是其防控的迫切需要,而病毒蛋白质与宿主细胞蛋白质相互关系的阐明有利于揭示病毒生命活动的分子机制,对流感治疗和抗病毒新药开发也具有一定指导意义。
【前人研究进展】PA-X蛋白是流感病毒PA基因通过核糖体移码来识别X-ORF而产生的一种融合蛋白[7]。PA-X蛋白已被证实在病毒感染过程中具有多种重要功能,包括宿主细胞关闭[8]、参与病毒复制[9-10]、调控宿主天然免疫和获得性免疫反应[11-12]、调节病毒毒力和聚合酶活性[13-14]等。Jagger等[7]证实PA-X蛋白可以减弱1918年大流行的H1N1亚型AIV对小鼠的致病性,并能显著抑制与炎症及细胞凋亡相关的细胞免疫应答。研究发现,H5N1亚型AIV的PA-X蛋白作为病毒毒力的负调控因子,可以通过抑制病毒复制和钝化宿主的整体免疫反应而使病毒的毒力降低[15]。也有研究证实PA-X蛋白能够降低2009年大流行的H1N1亚型AIV和H5N1亚型AIV在小鼠中的毒力和宿主炎症反应[16]。许多证据表明PA-X蛋白的功能具有毒株、亚型或宿主特异性,其潜在的作用机制仍未被阐明。
【本研究切入点】AIV感染过程中,PA-X蛋白可能通过与宿主细胞多种蛋白发生互作,进而影响宿主细胞的诸多生理过程。但目前对于PA-X与宿主蛋白的互作及作用机制研究仍比较匮乏。为了更深入地解析H7N9亚型AIV的PA-X蛋白影响其致病性的分子机制,本研究采用GST融合蛋白沉降技术(GST pull-down)在哺乳动物细胞中筛选与之相互作用的宿主细胞蛋白。【拟解决的关键问题】本研究在原核表达系统中表达纯化可溶性GST-PA-X融合蛋白,通过GST pull-down技术将A549细胞中能与PA-X蛋白特异相互作用的宿主蛋白捕获,并进行质谱鉴定及生物信息学分析,为进一步研究PA-X蛋白的作用机制和H7N9亚型AIV的分子致病机制及预防控制提供重要线索。
1 材料与方法 1.1 试验材料质粒pGEX-4T-1、pcDNA3-HA-Hsp70-2、pCAGGS-FLAG-PA-X及PA-X T载体和A549细胞均由吉林大学人兽共患病研究所病毒病研究室保存。大肠杆菌菌株DH5α和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。Glutathione Sepharose 4B beads购自美国General Electric(GE)公司;异丙基硫代半乳糖苷(IPTG)、聚偏二氟乙烯膜(PVDF膜)、蛋白分子量标准、荧光素标记的羊抗鼠IgG及羊抗兔IgG购自美国赛默飞世尔科技公司;Anti-HA Antibody和Anti-FLAG Antibody购自美国Cell Signaling Technology(CST)公司;其他化学试剂均为国产分析纯。
1.2 试验方法1.2.1 PA-X原核表达载体的构建 根据GenBank公布的H7N9亚型AIV的PA-X(KF420307.1)序列,设计引物扩增PA-X的X-ORF结构域(C末端191~252 aa),上游引物F:5'-CGGGATCCATGG AAGACTTTGTGCGACA-3',下游引物R:5'-CG GAATTCTCACTTCTTTTGACATCTGAG-3',引物由长春库美生物公司合成。以pMD-18T-PA-X野生型载体为模板进行扩增,将扩增片段连接至BamH Ⅰ/EcoR Ⅰ双酶切后的pGEX-4T-1载体上。连接后转化DH5α感受态细胞,挑取平板上单克隆菌培养并提取质粒。随后进行PCR鉴定及双酶切鉴定,对阳性质粒进行测序验证,测序正确的重组表达载体命名为pGEX-4T-PA-X。
1.2.2 融合蛋白的诱导表达及纯化 将构建的pGEX-4T-PA-X原核表达载体转化BL21感受态细胞,进行GST-PA-X融合蛋白的诱导表达。利用0.2 mmol/L IPTG诱导剂于16 ℃下对融合蛋白进行诱导表达,收集菌体对其进行超声裂解并收集上清,利用SDS-PAGE分离蛋白后,通过考马斯亮蓝染色法检测GST-PA-X融合蛋白的表达。
1.2.3 GST pull-down筛选与PA-X互作的蛋白 采用RIPA裂解液裂解A549细胞,离心收集上清液。将A549全蛋白裂解物500 μL分别加入到GST蛋白及GST-PA-X蛋白吸附柱中,4 ℃震荡孵育3 h。两组蛋白沉淀物用裂解液洗涤4次以洗掉非特异性结合蛋白,加入SDS上样缓冲液煮沸后,进行SDS-PAGE分析及考马斯亮蓝染色。将两组蛋白泳道中GST蛋白富集处的条带切下,其余部分蛋白胶进行后续的质谱分析。
1.2.4 质谱鉴定与PA-X互作的蛋白 将GST pull-down试验获得的蛋白胶送至北京华大蛋白质研发中心有限公司,以液相色谱- 质谱- 质谱(LC-MS/MS)联用方法进行质谱分析,采用Mascot软件[17]鉴定蛋白质。
1.2.5 PA-X互作蛋白的生物信息学分析 整理质谱鉴定结果,去掉GST空载体组所有的非特异性蛋白,筛选出与H7N9亚型AIV PA-X互作的特异性宿主蛋白,利用PANTHER、DAVID等在线数据库进行GO功能富集和KEGG通路分析,包括蛋白质分类(Protein Class,PC)、生物学过程(Biological Process,BP)和分子功能(Molecular Function,MF)分析。
1.2.6 免疫荧光技术验证Hsp70-2与PA-X的相互作用 将A549细胞接种于铺有细胞爬片的12孔培养板,长成单层后用脂质体转染试剂Lipofectamine LTX共转染pcDNA3-HA-Hsp70-2和pCAGGS-FLAG-PA-X质粒,24 h后细胞用4% 多聚甲醛固定20 min,再用2% Triton X-100透化处理10 min;随后加入一抗FLAG和HA,4 ℃下结合过夜;加入二抗Alexa 488标记的山羊抗鼠和Alexa 594标记的山羊抗兔IgG,室温下结合1 h;最后用Hochest染细胞核5 min,置荧光显微镜下观察蛋白共定位情况。
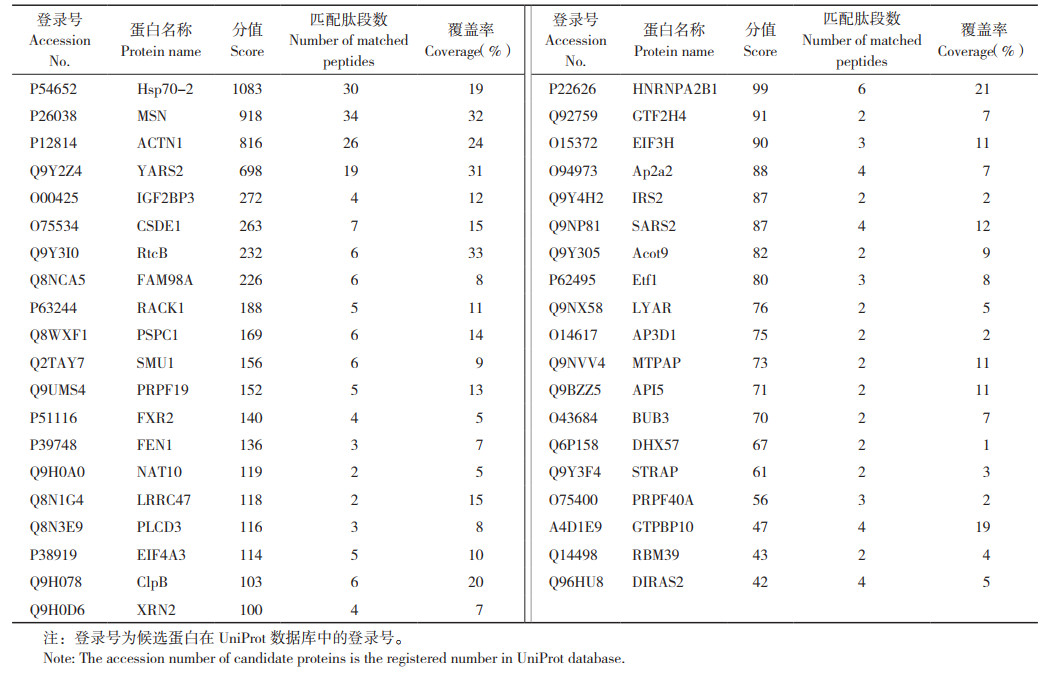
2 结果与分析 2.1 PA-X原核表达载体的构建为了在大肠杆菌中表达纯化PA-X蛋白,将PA-X特有的X-ORF结构域基因构建到pGEX-4T-1原核表达载体上,对pGEX-4T-PA-X重组表达载体进行PCR鉴定和双酶切鉴定,对阳性质粒进行测序分析。从鉴定结果(图 1)可见,得到与预期大小一致的目的条带,表明成功构建PA-X原核表达载体。
|
| M: DL 2000 Marker; 1~2: PCR扩增产物; 3~4: pGEX-4T-PA-X的BamH Ⅰ和EcoR Ⅰ双酶切产物 M: Marker DL 2000; 1-2: PCR amplification products; 3-4: Products from pGEX-4T-PA-X digested by BamH Ⅰ and EcoR Ⅰ 图 1 重组质粒pGEX-4T-PA-X的PCR鉴定(A)及酶切鉴定(B)结果 Fig. 1 Results of PCR identification(A)and enzyme digestion of pGEX-4T-PA-X recombinant plasmid(B) |
2.2 GST pull-down筛选与PA-X互作的蛋白
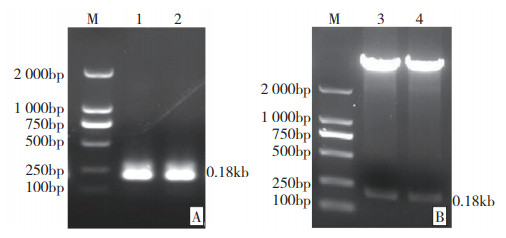
从A549细胞中提取总蛋白,考马斯亮蓝染色结果显示蛋白大小分布均匀(图 2),可以进行GST pull-down试验。对试验得到的蛋白沉淀复合物进行SDS-PAGE电泳分析,与GST阴性对照相比,PA-X融合蛋白沉淀存在多条差异条带,该试验进行了2次重复,蛋白条带型基本一致(图 2)。
|
| M: 蛋白分子量标准Marker; 1, 4: A549细胞提取的总蛋白; 2, 5: GST对照的蛋白; 3, 6: GST-PA-X融合蛋白 M: Protein molecular weight Marker; 1, 4: Total proteins extracted from A549 cell; 2, 5: GST control protein; 3, 6: GST-PA-X fusion protein 图 2 GST pull-down产物的SDS-PAGE检测结果 Fig. 2 SDS-PAGE detection results of GST pull-down products |
2.3 质谱鉴定与PA-X互作的蛋白
将质谱鉴定出的肽段剔除空载体GST对照中的非特异性蛋白,在UniProt蛋白质信息数据库中进行检索,从而确定每组条带内含有的蛋白质种类。基于匹配肽段数≥ 2的原则,筛选到39个可信度高的与PA-X互作的蛋白(表 1)。已有研究表明热休克蛋白Hsp70可对多种病毒的复制发挥调控作用,因此本研究选取可信度最高的Hsp70蛋白家族的Hsp70-2,对其与PA-X的相互作用作进一步验证,以阐明Hsp70调控病毒复制的机制。
2.4 PA-X互作蛋白的生物信息学分析
2.4.1 GO功能富集分析 采用PANTHER在线数据库对PA-X潜在的互作蛋白进行分类分析及功能注释。分析结果(图 3)表明,39种蛋白包括核酸代谢蛋白、翻译相关蛋白、代谢转换酶、蛋白修饰酶及骨架蛋白等,其中27.5% 的蛋白属于核酸代谢蛋白类,17.5% 的蛋白属于翻译过程相关蛋白类。此外,从分子功能角度来看,筛选到的这些蛋白主要发挥翻译调节活性、大分子结合活性、分子功能调节活性、催化活性等分子功能(图 3)。

|
| 图 3 潜在PA-X相互作用蛋白的GO富集分析 Fig. 3 GO enrichment analysis of potential PA-Xinteracting proteins |
2.4.2 生物过程及信号通路富集分析 利用DAVID在线分析软件进一步对鉴定的PA-X潜在互作蛋白进行生物学过程分析,结果(图 4)表明,这些蛋白主要参与mRNA、ncRNA的分解代谢,RNA加工、翻译,细胞周期调控、多肽生物合成和基因表达的转录后调控等生物过程。KEGG通路分析结果表明,这些PA-X互作蛋白主要参与剪接体、RNA运输、核糖体生物合成、麻疹病毒感染等通路。

|
| 图 4 潜在PA-X相互作用蛋白的生物学过程分析 Fig. 4 Biological process enrichment analysis of potential PA-X interaction proteins |
2.5 免疫荧光技术验证Hsp70-2与PA-X的相互作用
将质粒pcDNA3-HA-Hsp70-2和pCAGGS-FLAG-PA-X共转染A549细胞,荧光抗体染色后在荧光显微镜下观察蛋白共定位情况,结果(图 5)显示,过表达的HA-Hsp70-2主要集中在细胞浆,而FLAG-PA-X在细胞浆和细胞核均有分布,这与已知文献报道相符[7]。两个蛋白的荧光图像重叠后呈现黄色荧光,说明二者可以共定位于细胞浆内,进一步证实了Hsp70-2与PA-X蛋白在哺乳动物细胞中互作的可能性。
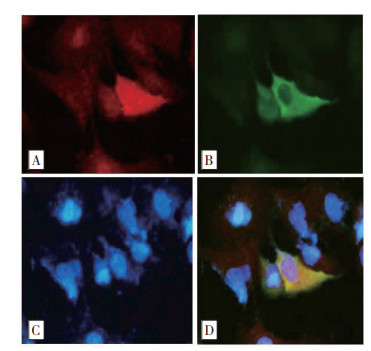
|
| 图 5 免疫荧光检测Hsp70-2和PA-X的相互作用 Fig. 5 Interaction of Hsp70-2 and PA-X by immunofluorescence examination |
流感病毒PA-X蛋白是甲型流感病毒基因组片段3编码的非结构蛋白,被证实可以减弱1918 H1N1、2009 H1N1和H5N1等亚型流感病毒对小鼠的致病性,并能显著抑制宿主的先天性免疫应答。己有研究表明PA-X在不同亚型流感病毒的致病性中发挥的作用不同。但目前国内外关于PA-X蛋白对H7N9亚型AIV致病性影响的研究寥寥无几[18]。从整体上研究病毒蛋白与宿主细胞蛋白的相互作用及生物学功能,是揭示病毒蛋白功能及病毒致病机制的重要手段。目前对于流感病毒PA-X与宿主蛋白的互作及作用机制仍不明确。Li等[19]利用亲和纯化和质谱分析方法,在感染H5N1亚型AIV的鸡细胞中鉴定出56种潜在与PA-X互作的宿主蛋白。因此,筛选和鉴定出与H7N9亚型AIV PA-X蛋白互作的宿主因子对AIV的致病机制研究具有重要价值。
本研究利用GST pull-down和质谱技术相结合的方法,在哺乳动物细胞水平对与H7N9亚型AIV PA-X蛋白存在互作的宿主蛋白进行了鉴定及生物信息学分析。将质谱鉴定出的肽段在UniProt蛋白质信息数据库中进行检索,并且按照匹配肽段数≥ 2的原则,共筛选到39个潜在的PA-X互作蛋白质。对这些候选蛋白进行GO富集分析,其分子功能主要是翻译调节活性、大分子结合活性、分子功能调节活性和催化活性等。大多数蛋白(55%)具有大分子结合活性,如mRNA和各种蛋白质等。15个蛋白(37.5%)具有催化活性,如聚合酶、核酸酶、连接酶、乙酰转移酶等。这些蛋白主要参与mRNA及ncRNA的代谢,RNA加工、翻译,细胞周期调控,多肽生物合成和基因表达的转录后调控等生物过程。KEGG通路分析结果表明,这些PA-X的潜在互作蛋白中有4个蛋白参与剪接体通路,4个蛋白参与RNA运输通路,2个蛋白参与核糖体生物合成通路,4个蛋白参与麻疹病毒感染等通路。这些候选互作蛋白的功能与PA-X的宿主细胞关闭和核酸内切酶活性相一致,提示PA-X可能通过与多种宿主蛋白特异性互作而在病毒感染周期中执行其重要分子功能。
研究证实,一种通过RIG-I样受体(RLR)信号途径而介导炎症反应的正调节宿主蛋白Ankrd17,能够直接与PA-X相互作用[20]。而且PA-X蛋白可以通过与Ankrd17的互作而调控病毒感染后的天然免疫反应。本研究鉴定的PA-X候选互作蛋白中也包含Ankrd17(匹配肽段数=1),说明本研究方法有较好的可信度。
Hsp70蛋白家族是一类重要的分子伴侣蛋白,通过控制蛋白质构象而参与信号转导,发挥抗凋亡活性、血管生成、细胞器和分泌蛋白的跨膜转运等作用。Hsp70蛋白家族至少包括14个成员,进化上高度保守[21]。Hsp70已被证实对多种病毒的复制发挥重要作用,包括A型流感病毒、狂犬病毒、寨卡病毒、猪PRRSV病毒、口蹄疫病毒和登革病毒等[22-27]。Hsp70已经被证实可以通过阻止流感病毒RNP复合体的核输出,或者阻断病毒聚合酶与病毒RNA的结合而发挥抑制流感病毒复制的作用[28]。本研究对评分最高的宿主蛋白Hsp70-2与PA-X的相互作用作进一步验证,免疫荧光试验结果表明,Hsp70-2与PA-X可以在细胞浆中共定位,提示Hsp70-2可能通过与病毒PA-X蛋白相互作用而调控病毒复制。后续可对二者互作的生物学意义和分子机制作进一步研究。
4 结论本研究利用GST pull-down联合质谱技术的方法,在哺乳动物细胞A549中筛选了与AIV PA-X存在相互作用的宿主蛋白,质谱分析鉴定得到39个高可信度的PA-X候选互作蛋白。GO富集分析发现这些蛋白主要参与RNA代谢、加工和转运等生物学过程,这与PA-X的核酸内切酶活性密切相关,PA-X蛋白很可能通过与这些宿主蛋白的相互关联而执行其宿主细胞关闭功能和抑制宿主的抗病毒反应功能。
| [1] |
卜欣欣, 顾敏, 刘秀梵. H7N9亚型流感病毒受体结合特性的研究进展[J]. 中国家禽, 2019, 41(21): 45-51. DOI:10.16372/j.issn.1004-6364.2019.21.010 BU X X, GU M, LIU X F. Research progress of receptor binding characteristics of H7N9 subtype influenza virus[J]. China Poultry, 2019, 41(21): 45-51. DOI:10.16372/j.issn.1004-6364.2019.21.010 |
| [2] |
黄泽颖, 王济民. 2004-2014年我国禽流感发生状况与特征分析[J]. 广东农业科学, 2015, 42(4): 93-98. DOI:10.16768/j.issn.1004-874X.2015.04.029 HUANG Z Y, WANG J M. Analysis on occurrence and characteristics of avian influenza in China during 2004-2014[J]. Guangdong Agricultural Sciences, 2015, 42(4): 93-98. DOI:10.16768/j.issn.1004-874X.2015.04.029 |
| [3] |
LIU W J, XIAO H, DAI L, LIU D, CHEN J, QI X, BI Y, SHI Y, GAO G F, LIU Y. Avian influenza A(H7N9)virus: from low pathogenic to highly pathogenic[J]. Frontiers of Medicine, 2021, 15(4): 507-527. DOI:10.1007/s11684-020-0814-5 |
| [4] |
WU X, XIAO L, LI L. Research progress on human infection with avian influenza H7N9[J]. Frontiers of Medicine, 2020, 14(1): 8-20. DOI:10.1007/s11684-020-0739-z |
| [5] |
SUN Y, HU Z, ZHANG X, CHEN M, WANG Z, XU G, BI Y, TONG Q, WANG M, SUN H, PU J, IQBAL M, LIU J. An R195K mutation in the PA-X protein increases the virulence and transmission of influenza A virus in mammalian hosts[J]. Journal of Virology, 2020, 94(11): e01817-e01819. DOI:10.1128/JVI.01817-19 |
| [6] |
刘根梅, 简茗琪, 高天. 三重PCR快速检测H7N9亚型流感病毒方法的建立[J]. 广东农业科学, 2018, 45(1): 114-119. DOI:10.16768/j.issn.1004-874X.2018.01.019 LIU G M, JIAN M Q, GAO T. Development of a triple PCR method for rapid detection of H7N9 subtype influenza virus[J]. Guangdong Agricultural Sciences, 2018, 45(1): 114-119. DOI:10.16768/j.issn.1004-874X.2018.01.019 |
| [7] |
JAGGER B W, WISE H M, KASH J C, WALTERS K A, WILLS N M, XIAO Y L, DUNFEE R L, SCHWARTZMAN L M, OZINSKY A, BELL G L, DALTON R M, LO A, EFSTATHIOU S, ATKINS J F, FIRTH A E, TAUBENBERGER J K, DIGARD P. An overlapping protein-coding region in influenza A virus segment 3 modulates the host response[J]. Science, 2012, 337(6091): 199-204. DOI:10.1126/science.1222213 |
| [8] |
HAYASHI T, CHAIMAYO C, MCGUINNESS J, TAKIMOTO T. Critical role of the PA-X C-terminal domain of influenza A virus in its subcellular localization and shutoff activity[J]. Journal of Virology, 2016, 90(16): 7131-7141. DOI:10.1128/JVI.00954-16 |
| [9] |
GONG X Q, SUN Y F, RUAN B Y, LIU X M, WANG Q, YANG H M, WANG S Y, ZHANG P, WANG X H, SHAN T L, TONG W, ZHOU Y J, LI G X, ZHENG H, TONG G Z, YU H. PA-X protein decreases replication and pathogenicity of swine influenza virus in cultured cells and mouse models[J]. Veterinary Microbiology, 2017, 205: 66-70. DOI:10.1016/j.vetmic.2017.05.004 |
| [10] |
GAO H, SUN H, HU J, QI L, WANG J, XIONG X, WANG Y, HE Q, LIN Y, KONG W, SENG L G, PU J, CHANG K C, LIU X, LIU J, SUN Y. Twenty amino acids at the C-terminus of PA-X are associated with increased influenza A virus replication and pathogenicity[J]. Journal of General Virology, 2015, 96(8): 2036-2049. DOI:10.1099/vir.0.000143 |
| [11] |
HU J, KONG M, CUI Z, GAO Z, MA C, HU Z, JIAO X, LIU X. PA-X protein of H5N1 avian influenza virus inhibits NF-kappaB activity, a potential mechanism for PA-X counteracting the host innate immune responses[J]. Veterinary Microbiology, 2020, 250: 108838. DOI:10.1016/j.vetmic.2020.108838 |
| [12] |
RIGBY R E, WISE H M, SMITH N, DIGARD P, REHWINKEL J. PA-X antagonises MAVS-dependent accumulation of early type I interferon messenger RNAs during influenza A virus infection[J]. Scientific Reports, 2019, 9(1): 7216. DOI:10.1038/s41598-019-43632-6 |
| [13] |
HU J, MA C, LIU X. PA-X: a key regulator of influenza A virus pathogenicity and host immune responses[J]. Medical Microbiology and Immunology, 2018, 207(5-6): 255-269. DOI:10.1007/s00430-018-0548-z |
| [14] |
CLEMENTS A L, PEACOCK T P, SEALY J E, LEE H M, HUSSAIN S, SADEYEN J R, SHELTON H, DIGARD P, IQBAL M. PA-X is an avian virulence factor in H9N2 avian influenza virus[J]. Journal of General Virology, 2021, 102(3): 1531. DOI:10.1099/jgv.0.001531 |
| [15] |
HU J, MO Y, WANG X, GU M, HU Z, ZHONG L, WU Q, HAO X, HU S, LIU W, LIU H, LIU X, LIU X. PA-X decreases the pathogenicity of highly pathogenic H5N1 influenza A virus in avian species by inhibiting virus replication and host response[J]. Journal of Virology, 2015, 89(8): 4126-4142. DOI:10.1128/JVI.02132-14 |
| [16] |
GAO H, SUN Y, HU J, QI L, WANG J, XIONG X, WANG Y, HE Q, LIN Y, KONG W, SENG L G, SUN H, PU J, CHANG K C, LIU X, LIU J. The contribution of PA-X to the virulence of pandemic 2009 H1N1 and highly pathogenic H5N1 avian influenza viruses[J]. Scientific Reports, 2015, 5: 8262. DOI:10.1038/srep08262 |
| [17] |
李卫锦, 张静文, 袁长春, 张颖. 基于iTRAQ技术筛选红榄李种子响应败育差异表达蛋白[J]. 广东农业科学, 2020, 47(7): 68-78. DOI:10.16768/j.issn.1004-874X.2020.07.009 LI W J, ZHANG J W, YUAN C C, ZHANG Y. Identification of differentially expressed proteins in abortive seeds of lumnitzera littorea based on iTRAQ[J]. Guangdong Agricultural Sciences, 2020, 47(7): 68-78. DOI:10.16768/j.issn.1004-874X.2020.07.009 |
| [18] |
KONG M, CHEN K, ZENG Z, WANG X, GU M, HU Z, JIAO X, HU J, LIU X. The virulence modulator PA-X protein has minor effect on the pathogenicity of the highly pathogenic H7N9 avian influenza virus in mice[J]. Veterinary Microbiology, 2021, 255: 109019. DOI:10.1016/j.vetmic.2021.109019 |
| [19] |
LI Q, YUAN X, WANG Q, CHANG G, WANG F, LIU R, ZHENG M, CHEN G, WEN J, ZHAO G. Interactomic landscape of PA-X-chicken protein complexes of H5N1 influenza A virus[J]. Journal of Proteomics, 2016, 148: 20-25. DOI:10.1016/j.jprot.2016.07.009 |
| [20] |
LI M, QI W, CHANG Q, CHEN R, ZHEN D, LIAO M, WEN J, DENG Y. Influenza A virus protein PA-X suppresses host Ankrd17-mediated immune responses[J]. Microbiology and Immunology, 2021, 65(1): 48-59. DOI:10.1111/1348-0421.12863 |
| [21] |
SU Y S, HSIEH P Y, LI J S, PAO Y H, CHEN C J, HWANG L H. The heat shock protein 70 family of chaperones regulates all phases of the enterovirus A71 life cycle[J]. Frontiers in Microbiology, 2020, 11: 1656. DOI:10.3389/fmicb.2020.01656 |
| [22] |
MANZOOR R, KURODA K, YOSHIDA R, TSUDA Y, FUJIKURA D, MIYAMOTO H, KAJIHARA M, KIDA H, TAKADA A. Heat shock protein 70 modulates influenza A virus polymerase activity[J]. Journal of Biological Chemistry, 2014, 289(11): 7599-7614. DOI:10.1074/jbc.M113.507798 |
| [23] |
TAGUWA S, YEH M T, RAINBOLT T K, NAYAK A, SHAO H, GESTWICKI J E, ANDINO R, FRYDMAN. Zika virus dependence on host Hsp70 Provides a protective strategy against infection and disease[J]. Cell Reports, 2019, 26(4): 906-920. DOI:10.1016/j.celrep.2018.12.095 |
| [24] |
GANDIKOTA C, MOHAMMED F, GANDHI L, MAISNAM D, MATTAM U, RATHORE D, CHATTERJEE A, MALLICK K, BILLORIA A, PRASAD V S V, SEPURI N B V, VENKATARAMANA M. Mitochondrial import of dengue virus NS3 protease and cleavage of GrpEL1, a cochaperone of mitochondrial Hsp70[J]. Journal of Virology, 2020, 94(17): e01178-e01120. DOI:10.1128/JVI.01178-20 |
| [25] |
GAO J, XIAO S, LIU X, WANG L, JI Q, MO D, CHEN Y. Inhibition of HSP70 reduces porcine reproductive and respiratory syndrome virus replication in vitro[J]. BMC Microbiology, 2014, 14: 64. DOI:10.1186/1471-2180-14-64 |
| [26] |
MALLICK S, SUBRAMANIAM S, BISWAL J K, RANJAN R, MOHAPATRA J K, SAHOO A P. Short communication: preliminary observations on the serum levels of HSP70 and its correlation with serum cortisol, thyroid hormones, and acute-phase protein concentration in cattle naturally infected with foot-and-mouth disease virus[J]. Tropical Animal Health and Production, 2021, 53(4): 408. DOI:10.1007/s11250-021-02814-z.PMID:34292411 |
| [27] |
CHAILANGKARN T, TANWATTANA N, JAEMTHAWORN T, SRISWASDI S, WANASEN N, TANGPHATSORNRUANG S, LEETANASAKSAKUL K, JANTRAPHAKORN Y, NAWAE W, CHANKEEREE P, LEKCHAROENSUK P, LUMLERTDACHA B, KAEWBORISUTH C. Establishment of human-induced pluripotent stem cell-derived neurons-A promising in vitro model for a molecular study of rabies virus and host interaction[J]. International Journal of Molecular Sciences, 2021, 22(21): 11986. |
| [28] |
LI G, ZHANG J, TONG X, LIU W, YE X. Heat shock protein 70 inhibits the activity of Influenza A virus ribonucleoprotein and blocks the replication of virus in vitro and in vivo[J]. PLOS ONE, 2011, 6(2): e16546. DOI:10.1371/journal.pone.0016546 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49