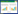文章信息
基金项目
- 广州市科技计划项目(202002030245,201903010105);广东省现代农业关键技术模式集成与示范推广项目(粤财农〔2021〕37号-200011);广东省科技专项资金(“大专项+ 任务清单”)项目(2020020103);广东省现代农业产业技术体系创新团队建设专项资金(2020KJ108);广东省教育厅特色创新类项目(2019KTSCX013)
作者简介
- 刘烁玲(1999—),女,在读本科生,研究方向为电子信息工程及农业信息化,E-mail:2298293634@qq.com.
通讯作者
- 林伟君(1965—),男,硕士,研究员,研究方向为智慧农业,E-mail:498590819@qq.com.
文章历史
- 收稿日期:2021-05-29
2. 广东省农业科学院农业经济与信息研究所,广东 广州 510640
2. Institute of Agricultural Economics and Information, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
【研究意义】在气候变化的生态环境中,干旱已成为主要的非生物胁迫因子之一,严重影响到作物的品质和产量[1],所以迫切需要协调好干旱的气候与水资源利用问题,寻找合适的灌溉湿度,从植物的生长中获取合适的平衡点,在不影响植物生长的前提下,发挥植物的最大的经济价值。而根系是植物与自然界进行物质交换的重要途径,也是植物接受水分的重要来源之一。因此,探究根系生长的最佳土壤水分湿度,具有重要意义。【前人研究进展】不同水分胁迫条件不仅会影响根系生长发育,还会影响植物地上部分的形态建成和物质积累[2]。高雪等[3]使用不同浓度的PEG6000溶液模拟干旱胁迫对白菜型春油菜生长特性的影响,田宏先等[4]研究水分胁迫对春油菜根系的影响,结果表明短期干旱胁迫可以促进春油菜总根的生长,水分胁迫显著抑制了根粗,且适宜的水分胁迫使得根系总体积显著提高。此外,干旱胁迫会导致植物体内水分调节失衡,严重影响冬小麦冠部、根部的正常生长发育[5-6]。在对于根系研究的技术上也存在一定的变化趋势。挖掘法是研究根系最早使用的方法,又名轮廓法(Skeleton method)。日本研究人员Karizumi利用扇形挖掘法对林木根系进行研究,不仅获取了根系的总体形态资料,还统计出直径大于2 mm的根数[7]。随着理论的深入和科技的进步,逐渐跳脱出了宏观物理的技术束缚,进而转向图像摄取的形式。目前,微根管法已被广泛用于森林[8-9]、草地[10-12]、农作物[13-14]等根系研究中。洪文俊等[15]运用微根管技术研究了边坡植被根系形态变化特征和影响因素。在活体探测技术上,探地雷达以电磁波探测的无损方式进行植物根系探测,并研究植物根系体的展布规律及范围。Liu等[16]提出利用探地雷达信号反演根的伸展角度的方法。张开伟等[17]对探地雷达技术在植物根系体探测异常识别电导率变化特征方面进行分析,对植物根系体进行形态延展影响范围、根径大小的探测计算。张璐云等[18]分析验证探地雷达在野外自然条件下对小叶锦鸡儿根系的识别率和识别精度,结果表明,3种天线频率的识别率均可达50% 以上且900 MHz的识别率达56%。在结合数字图像等新技术后,根系研究技术利用数字图像处理技术更加直观地观测植物根系的特点。由于探地雷达B-scan数据是二维数字图像,因此数字图像处理技术可以用于探地雷达双曲线形态识别中[19]。此外,地下根系成像技术在作物根系的监测中具有重要的作用,秦天元等[20]筛选出能够原位监测马铃薯根系发育且不破坏其生长的成像技术和高效的图像分析系统。对于根系的分析和研究方式由先前的离土式研究到后期的数字式分析,有了很大的进步和发展,但仍然存在一定的局限性,如监测方式不够便捷,实时分析较为复杂等。
【本研究切入点】前人对利用微根管法观察水分胁迫对于根系形态参数的影响的研究较少,缺少对在不同水分胁迫中的植物根系形态参数动态变化持续原位监测的研究。【拟解决的关键问题】本研究以模拟土壤湿度为主要条件,以绿萝为主要研究对象,基于植物根系生长监测系统,对不同水分胁迫下的植物根系生长状态进行监测。通过硬件探测与软件分析相结合,绘制各类生长指标曲线,并利用最小二乘法对数据进行分析,拟合现实环境的需求,更加直观地监测水分胁迫下的根系生长状态,以期为合理灌溉与植物适宜生长之间寻求平衡点,利用科学的方法进行植物培养,提高植物生长的使用价值。
1 材料与方法 1.1 试验材料试验于2021年2月12日至3月17日在华南农业大学工程学院(113°34’N,23°14’E)进行。试验期间处于雨季前期,温湿度变化较小,适合植物生长及试验变量的控制。
试验材料为盆栽绿萝。绿萝属于麒麟叶属植物,根系发达,具有肥大的圆柱状肉质根,选取长势相同的材料进行试验。采用4个中号塑料盆桶,底内径、口内径和高度分别为15、21、21 cm,盆内土壤为红土,具有高含水率、低密度而强度较高、压缩性较低的特性。
选取绿萝植株均长势相同,根部长势差异小,此外,将绿萝根系进行适量修整,使整体适合试验的要求,并将处理后的试验材料置于清水中静止水培1 d,保证植物的正常生长发育,并使植物根系恢复至适合的条件,为栽培做好准备。在隔天晚上进行绿萝的栽培工作,此时绿萝均处于光合作用及呼吸作用较低的环境,栽培工作对植株影响较小。在进行正式实验前,先对绿萝进行一段时间(2月12—24日)的观测,待绿萝生长稳定后进行监测。
试验研究采用小米植物湿度计对土壤湿度进行测量,并通过手机蓝牙设备对数据进行采集和呈现。在根系测量上,采用植物根系生长监测器CI-600进行测量。(1)小米植物湿度计:主要由固件探测器及蓝牙链接构成,集成了监测,分析和信号模块,其测量的水含量精度可达土壤探头EC5标准。(2)根系生长监测器CI-600:由美国CID研究制造的一款用于监测土壤活体根系生长动态及结构特征,通过扫描标定,利用软件快速分析根系的相关参数的仪器。系统主要由硬件设备和软件程序构成,分别为:CI-600 Root Scanne(硬件扫描仪)、CI-600 In-Situ Root Imager(扫描软件)及CI-690 RootSnap(图像分析软件)组成。
1.2 试验方法变量控制:试验水分胁迫对绿萝根系生长的影响,控制变量为土壤水分含量。由于绿萝在土壤中的适宜湿度为35% 左右,因此为了更好的进行试验的对照及区分,采用单一因子差异试验设计,设置土壤含水量15%、25%、35%、45% 4个处理,每盆装土深度为18 cm。
提前将土壤晒干并平均分配到4个盆中,重量为11.4 kg,按照土壤湿度的计算方法——重量法:土壤湿度(%)=〔(含水土壤(g)-干燥土壤(g))÷干燥土壤(g)〕×100,使用烧杯进行水量测量,并计算理论土壤湿度,此外,利用小米植物湿度计进行湿度测量,得出实际土壤湿度,统计实际湿度与理论湿度的相对关系如表 1所示。经过测量和计算,理论湿度和实际湿度的相对误差在3%~7% 之间,在误差允许的范围内,能够使用小米植物湿度计代替实际湿度,确保试验数据的准确性。
在第一次进行浇水后,每日依照湿度计为绿萝盆栽进行湿度检测及人工浇水工作,由于植物置于试验室内,温度均视为恒定温度,且其他因素保持不变。
1.3 测定标准及方法1.3.1 天气测定 利用试验室内温度计及天气预报软件,对试验每天的天气进行评估和预测,尽量保持室内温度不变。
1.3.2 土壤湿度 使用自动土壤检测仪及小米植物湿度计进行实时监控,自动土壤检测仪采用探针设计,通过探针间的电子反应来测得土壤的湿度,大致分为“干旱,适宜,湿润”3种状态,适用于对植物区间的整体把控,缩小人工植物浇水的范围及准确性。小米植物湿度计采用探头与蓝牙相互结合的方式,实时查询土壤的相对湿度,在上述检测仪的基础上,进一步精确至1% 的湿度。
1.3.3 根系测定 利用植物根系生长监测工具CI-600与软件In-Situ Root Imager进行绿萝根系的获取与扫描工作,采用Root Snap根系分析软件对上述扫描后的绿萝根系进行分析。实物图如图 1、图 2所示。

|
| 图 1 CI-600根系监测设备 Fig. 1 CI-600 root monitoring equipment |

|
| 图 2 使用CI-600进行根系监测 Fig. 2 Root monitoring with CI-600 |
1.4 数据分析方法
对Root Snap根系分析软件所产生的数据进行汇总及整理,采用Excel进行数据汇整,并绘制相关参数与土壤水分胁迫之间的关系曲线,采用最小二乘法,运用二次项拟合的方法进行模型拟合,分析绿萝在水分胁迫下的变化规律。
多项式拟合是一种线性模型,二次项拟合是其中的一种,目的是构造输入的2阶多项式函数,使得该2阶多项式能够近似地表示自变量和因变量的关系。多项式拟合的自变量是一维的,这是与线性回归最主要的区别之一。本试验中自变量也是一维的,故可以用2阶多项式拟合的方法来进行模型拟合。多项式拟合采用均方误差这个评价指标来衡量某一个多项式函数逼近自变量和因变量函数关系的程度。因此,优化的目标是让均方误差最小。本试验采用最小二乘法来求解这个最优化问题。
2 结果与分析 2.1 水分对绿萝根数量的影响根据试验数据,绘制绿萝根数量与不同土壤水分胁迫之间的关系曲线,见图 3。从图 3可以看出,在试验时间内,不同水分胁迫绿萝根系生长数量大致呈现平稳增长趋势,在25%、35% 水分处理绿萝根数量增长较为接近,生长较为迅速,其中35% 水分处理绿萝根系生长在后期逐渐超过25% 处理;而15%、45% 处理均受到不同程度的抑制作用。
|
| 图 3 绿萝根数量与不同水分胁迫关系 Fig. 3 Relationship between root number of Scindapsus aureus and different water stress |
针对不同水分胁迫进行单独分析,为了更加直观地呈现,利用最小二乘法对各水分胁迫数据进行二次曲线拟合(y=ax2+bx+c),结果为:

|
从拟合结果可以看出,各水分处理绿萝根数量的变化均呈现正相关性,由各拟合曲线的R2可知,可以由拟合曲线反映绿萝幼根数量生长情况。由表达式可得出,35% 处理a=0.078,大于其他曲线,增长速率优于其他3个处理;15%、45%处理,a分别为0.0192和0.018,增长较为缓慢,抑制绿萝幼根的生长。其中25% 处理出现a<0的情况,可以近似说明在该湿度下,绿萝幼根生长会逐渐趋于缓慢。说明在缺水和淹水条件下,影响植物的呼吸作用及养分吸收,不利于绿萝幼根的生长。
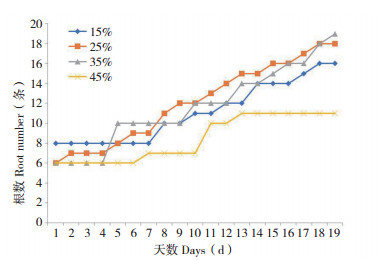
2.2 水分对绿萝根长度的影响根据试验数据,绘制绿萝根长度与不同土壤水分胁迫之间的关系曲线,见图 4。图 4描述了不同水分胁迫绿萝根长度随着时间的演变情况。其中出现了一处数据空缺,这是因为软件扫描出现了错误导致数据缺失,但不影响整体趋势分析。由图 4可以直观看出绿萝根长度在时间上均表现出正相关关系。由于15% 水分处理初始状态有较多的根数而起点较高,但曲线整体增幅较小,最终趋于平稳;25%、35% 处理变化趋势较为一致,说明在此区间内适合生长,但后期35% 水分处理可能由于绿萝幼根增长优势及原有根的延展而占据优势;45% 水分处理后10天,长度明显低于其他处理的根系长度,这可能是淹水胁迫限制了绿萝幼根的生长。说明在不同湿度情况下,各处理绿萝根系生长的速度有所不同,并在25%~35% 区间内更加利于绿萝根系的伸长。
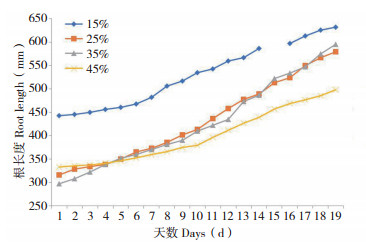
|
| 图 4 绿萝根长度与不同水分胁迫关系 Fig. 4 Relationship between root length of Scindapsus aureus and different water stress |
对不同水分胁迫进行单独分析,为了更加直观地呈现,利用最小二乘法对各水分胁迫数据进行二次曲线拟合(y=ax2+bx+c),结果为:
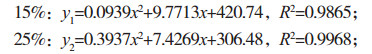
|

|
从拟合结果来看,R2均大于0.9,拟合程度高。由表达式可得出,在二次项系数a值中,35% 处理最大,增长速率最快;15% 处理,a值趋近于0,使得增长速度慢;25%、45% 处理二次项系数相近,然而一次项系数相差较大,说明25% 湿度下绿萝根系长度增长速率高于45%。分析表明,在稳定的水分胁迫下,绿萝根长度变化呈现正相关性,干旱和水淹条件下限制根长度的生长状态。
2.3 水分对绿萝根面积的影响根据试验数据,绘制绿萝根面积与不同土壤水分胁迫之间的关系曲线,见图 5。图 5反映了不同水分胁迫绿萝根面积随着时间推移的大致变化趋势。其中两处数据出现缺失,是由于软件扫描出现错误引起数据缺失,但不影响整体的变化分析。由图 5可知,35% 水分处理绿萝根面积变化最大;而15% 水分处理变化趋势最小,图中曲线小幅度平缓增长;25%、45% 水分处理开始时趋势一致,但处理后10 d,25% 水分处理增长速度明显快于45% 水分处理增长速度。说明35% 湿度条件具有最大优势。
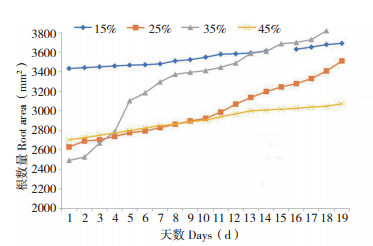
|
| 图 5 绿萝根面积与不同水分胁迫关系 Fig. 5 Relationship between root area of Scindapsus aureus and different water stress |
对不同水分胁迫进行单独分析,为了更加直观地呈现,利用最小二乘法对各水分胁迫数据进行二次曲线拟合(y=ax2+bx+c),结果为:

|
由R2均大于0.9可知,采用该拟合结果具有可行性。由各个表达式反映得出,35% 水分处理条件下,其二次项系数的绝对值远大于其他三者,表明具有相对较大的根面积。而15% 和45% 水分处理条件下,系数较为接近,根据a值得正负性推测,在未来的发育中,45% 水分处理条件下绿萝根系生长应该会趋于停滞状态,这是由于板结土壤及水淹胁迫的作用,极大影响绿萝的生长;在25% 水分处理条件下,变化趋势稳定增长,但其幅度小于35% 水分处理,由于两个管子在根数量及根长度这两个指标中较为一致,由此可说明在不同的水分胁迫下,绿萝根系在通过伸长的同时,也依赖于直径的拓展以获取有效的吸收面积,从而更加利于植物生长。分析表明,在特定的水分胁迫下,绿萝根系吸收面积的增加不仅来源于根系的伸长,也来源于其根系直径的增加,从而在环境中获取更多的养分。
2.4 水分对绿萝根体积的影响根据试验数据,绘制绿萝根体积与不同土壤水分胁迫之间的关系曲线,见图 6。图 6描述了不同水分胁迫绿萝根体积的大致变化情况。其中两处数据出现缺失,是由于软件扫描出现错误引起数据缺失,但不影响整体的变化分析。从图 6可以看出,35% 湿度条件下绿萝根体积增量最大,曲线的增长趋势最好,结合上述对于其他指标的分析,其通过绿萝幼根及其他根系的伸长变宽来获得体积上的增长;由15% 水分下的曲线可以反映出,在干旱条件下,绿萝根系体积的变化较小,结合上述对于其他指标的分析,可进一步推断缺水对绿萝的生长具有一定的抑制作用;而25% 和45% 水分下的绿萝根体积增长较为一致,但25% 水分下的绿萝体积增长势头较好,结合上述统计关系,可以猜想,在淹水胁迫(45%)的条件下,绿萝的体积增加主要来源于环境与植物体的水势差异而形成吸水,从而使绿萝根系体积稍稍膨胀。分析说明,水分胁迫下绿萝根体积变化表现出增长趋势,其中35% 湿度条件下增长速率最高。

|
| 图 6 绿萝根体积与不同水分胁迫关系 Fig. 6 Relationship between root volume of Scindapsus aureus and different water stress |
对不同水分胁迫进行单独分析,为了更加直观地呈现,利用最小二乘法对各水分胁迫数据进行二次曲线拟合(y=ax2+bx+c),结果为:

|
各表达式R2均大于0.9,可见拟合度高。由表达式可知,35% 处理a绝对值不是最大,但只有其为正数,表明其在之后的生长中会继续呈现增长的趋势,绿萝根系体积的生长最为适宜,增长速度较快,而其他3个处理a为负值,均受到一定程度的抑制。15% 处理,a值接近于0,生长缓慢;25% 和45% 处理a值较为接近,但一次项系数b具有明显差异,致使25% 处理绿萝根系生长在后期超过45% 处理。分析说明,35% 湿度条件下绿萝根系体积的增长效率较高,根系体积的变化与根数量、根系直径等均有联系,在干旱和淹水的条件下,均不适宜绿萝植株发育。
3 讨论本研究通过微根管法采集绿萝根系形态参数,并且利用Root Snap根系分析软件快速分析绿萝根系的相关参数,实现对绿萝根系生长动态过程的监测。前人研究表明,微根管法能够可靠的监测植物根系生长动态过程。陈文岭等[21]利用微根管法获得膜下滴灌棉花根系生长图像,并利用根系分析软件实现根系形态参数的动态监测,并且与传统网格法作对比,两种方法得到的数据有很高的相关性。Ramsuer等[22]对比分析土钻法和微根管法采集到的小麦细根参数,发现两种方法所得数据显著正相关。微根管法具有损伤破坏性小[23]、效率高、省时省力等优点,但大量数据的后期分析方法仍具有进一步改进的空间[24],通过增大检测频率,提高数据分析效率与精度,同时注意降低微根管对土壤的扰动,是将来微根管技术发展的主要方向。
干旱胁迫影响植物生理特征和形态,特别是土壤水分与植株根系之间关系的研究已经成为植物生态学研究的热点问题之一[2]。李彦彬等[25]研究表明,冬小麦遭受干旱胁迫时,根质量下降,在遭受连续重旱处理时,根系严重受损且无法恢复。侯丹平等[26]研究表明,适当的水分胁迫有利于根系形态和生理特征的优化,过度干旱胁迫不利于水稻根系的建成。本研究利用微根管技术实现对绿萝根系的持续原位监测,最终得出植物根系生长与水分胁迫之间的关系,利用微根管法观察水分胁迫对于根系形态参数的影响的研究,少见报道。本试验结果与李彦彬等[25]和侯丹平等[26]研究结果相近,水分胁迫对绿萝的根系生长产生了显著影响,其中干旱胁迫(15%)使得植物体根系因缺水而生长缓慢,而在适宜的生长水分(35%)下,植物根系生长良好,且生长速率呈现增长趋势。
本研究显示,根系的各项生理指标在不同的水分胁迫中有不同的趋势和表现,此外,各项指标又相互关联,相辅相成,构成和谐的生长系统。在培养植物时,应该基于其所处的环境,根据其生理状态控制在适宜的水分范围内,从而获得该植物的优质生物特征值,进而保证其经济效益。
4 结论本研究结果表明,干旱胁迫或淹水胁迫会抑制绿萝根数量增长,而在适宜的水分胁迫(35%)下,绿萝根数量增长呈现正相关性,增长速率最高。在干旱胁迫的情况下,绿萝根长度生长较慢;当水分逐渐增加,到达适宜的湿度(25%、35%)时,绿萝根系生长较为迅速;在淹水胁迫下,抑制绿萝根长度增长。水分胁迫通过影响绿萝根长度及根数量,进而作用于根系面积和体积的变化。绿萝根系在伸长的同时,根系直径也产生变化,影响面积与体积的生长,进而影响根系的有效吸收面积,有利于其从土壤中汲取养分。干旱胁迫时,主要通过原有根系及少量幼根来进行适当的延拓,而淹水胁迫时,主要由环境与根部的水势差异而产生略微的膨胀,以达到生长的需求。不同水分胁迫对于绿萝根系生长状态具有不同的作用效果。当处于干旱胁迫时,绿萝体根系会因为缺水而生长缓慢;而当处于淹水胁迫时,绿萝根系生长会因为环境的作用(如土壤板结,水中含氧量低)而受到一定程度的抑制作用。适宜的生长水分(35%)下,绿萝根系生长良好,生长速率呈现增长趋势。
| [1] |
李鑫, 李雪峰, 马艳青, 张清壮, 唐艺欣, 肖鑫, 曾建国. 干旱胁迫条件下喷施吡咯喹啉醌对辣椒生理响应研究[J]. 广东农业科学, 2019, 46(9): 40-46. DOI:10.16768/j.issn.1004-874X.2019.09.006 LI X, LI X F, MA Y Q, ZHANG Q Z, TANG Y X, XIAO X, ZENG J G. Effects of spraying pyrrolidine quinoline quinone on the physiological responses of pepper under drought stress[J]. Guangdong Agricultural Sciences, 2019, 46(9): 40-46. DOI:10.16768/j.issn.1004-874X.2019.09.006 |
| [2] |
黄海霞, 杨琦琦, 崔鹏, 陆刚, 韩国君. 裸果木幼苗根系形态和生理特征对水分胁迫的响应[J]. 草业学报, 2021, 30(1): 197-207. HUANG H X, YANG Q Q, CUI P, LU G, HAN G J. Changes in morphological and physiological characteristics of Gymnocarpos przewalskii roots in response to water stress[J]. Chinese Journal of Aeronautics, 2021, 30(1): 197-207. |
| [3] |
高雪, 尼玛扎西, 刘国一, 谭海运. PEG模拟干旱胁迫对白菜型春油菜芽期生长特性的影响[J]. 广东农业科学, 2020, 47(7): 9-17. DOI:10.16768/j.issn.1004-874X.2020.07.002 GAO X, NIMA Z X, LIU G Y, TAN H Y. Effects of PEG simulation drought stress ongrowth characteristics of spring rapeseed(Brassica campestris L.)at bud stage[J]. Guangdong Agricultural Sciences, 2020, 47(7): 9-17. DOI:10.16768/j.issn.1004-874X.2020.07.002 |
| [4] |
田宏先, 王瑞霞, 施毅, 李小玉. 油菜根系对苗期水分胁迫的形态及生理响应[J]. 农业科技通讯, 2020(8): 148-153. DOI:10.13597/j.cnki.maize.science.20200514 TIAN H X, WANG R X, SHI Y, LI X Y. Morphological and physiological responses of rapeseed root system to water stress at seedling stage[J]. Agricultural Science and Technology Bulletin, 2020(8): 148-153. DOI:10.13597/j.cnki.maize.science.20200514 |
| [5] |
LEVITT J. Responses of plant to environmental stresses[M]. New York: Academic Press, 1972.
|
| [6] |
TURNER N C. Drought resistance and adaptation to water deficits in crop plants//MUSSEL H, STAPES R C. Stress physiology in crop plants[M]. New York: Wiley, 1979: 343-372.
|
| [7] |
王海军, 朱宏慧. 林木根系研究方法概述[J]. 内蒙古林业科技, 2015, 41(1): 42-46. WANG H J, ZHU H H. Summary on research methods of tree root[J]. Inner Mongolia Forestry Science and Technology, 2015, 41(1): 42-46. |
| [8] |
TIERNEY G L, FAHEY T J. Fine root turnover in a northern hardwood forest: A direct comparison of the radiocarbon and minirhizotron methods[J]. Canadian Journal of Forest Research, 2002, 32(9): 1692-1697. DOI:10.1139/x02-123 |
| [9] |
TIERNEY G L, FAHEY T J. Evaluating minirhizotron estimates of fine root longevity and production in the forest floor of a temperate broadleaf forest[J]. Plant and Soil, 2001, 229: 167-176. DOI:10.1023/A:1004829423160 |
| [10] |
BALOGIANNI V G, WILSON S D, FARRELL R E, MACDOUGALL A S. Rapid root decomposition decouples root length from increased soil C following grassland invasion[J]. Ecosystems, 2015, 18: 1307-1318. DOI:10.1007/s10021-015-9900-y |
| [11] |
ARNONE J A, ZALLER J G. Earthworm effects on native grassland root system dynamics under natural and increased rainfall[J]. Frontiers in Plant Science, 2014, 5: 1-8. DOI:10.3389/fpls.2014.00152 |
| [12] |
BONIN C, FLORES J, LAL R, TRACY B. Root characteristics of perennial warm-season grasslands managed for grazing and biomass production[J]. Agronomy, 2013, 3: 508-523. DOI:10.3390/agronomy3030508 |
| [13] |
TAYLOR B N, BEIDLER K V, STRAND A E, PRITCHARD S G. Improved scaling of minirhizotron data using an empirically-derived depth of field and correcting for the underestimation of root diameters[J]. Plant and Soil, 2014, 374(1/2): 941-948. DOI:10.1007/s11104-013-1930-7 |
| [14] |
GRAY S B, STRELLNER R S, PUTHUVAL K K, CHRISTOPHER N, SHULMAN R E, SIEBERS M H, LEAKEY A D B. Minirhizotron imaging reveals that nodulation of field-grown soybean is enhanced by free-air CO2 enrichment only when combined with drought stress[J]. Functional Plant Biology, 2013, 40(2): 137-147. DOI:10.1071/FP12044 |
| [15] |
洪文俊, 郑美扬, 涂津鹏, 苏焕焕. 新建高速公路边坡植物根系生长特征研究[J]. 公路, 2018, 63(3): 227-230. HONG W J, ZHENG M Y, TU J P, SU H H. Study of the root growth characteristics for slope plant of new built expressway[J]. Highway, 2018, 63(3): 227-230. |
| [16] |
LIU Q, CUI X, LIU X, JIN C, XIN C. Detection of root orientation using ground-penetrating radar[J]. IEEE Transactions on Geoscience and Remote Sensing, 2018, 56(1): 93-104. DOI:10.1109/TGRS.2017.2737003 |
| [17] |
张开伟, 聂庆科, 吴园平, 牛禾. 基于探地雷达技术的植物根系探测应用研究[J]. 工程地球物理学报, 2018, 15(1): 86-91. ZHANG K W, NIE Q K, WU Y P, NIU H. Application research of plant root detection based on GPR technology[J]. Journal of Engineering Geophysics, 2018, 15(1): 86-91. |
| [18] |
张璐云, 崔喜红, 全振先, 张政, 陈晋. 野外自然条件下探地雷达识别植物根系的有效性研究[J]. 地球物理学进展, 2021, 1-13. ZHANG L Y, CUI X H, QUAN Z X, ZHANG Z, CHEN J. The availability of ground penetrating radar in recognizing plant roots in field[J]. Progress in Geophysics, 2021, 1-13. |
| [19] |
郝彤, 赵杰. 面向双曲线形态的探地雷达图像识别技术综述[J]. 电子学报, 2019, 47(6): 1366-1372. HAO T, ZHAO J. A brief review of the hyperbola signature recognition techniques for ground penetrating radar[J]. Electronic Journals, 2019, 47(6): 1366-1372. |
| [20] |
秦天元, 孙超, 毕真真, 王瀚, 李鑫, 曾文婕, 白江平. 植物根系成像技术研究进展及马铃薯根系研究应用前景[J]. 核农学报, 2019, 33(2): 412-419. QIN T Y, SUN C, BI Z Z, WANG H, LI X, ZENG W J, BAI J P. Progresses of root imaging technology and the perspectiveapplication on potato root analysis[J]. Acta Agriculturae Nucleatae Sinica, 2019, 33(2): 412-419. |
| [21] |
陈文岭, 靳孟贵, 刘延锋, 鲜阳, 黄金瓯. 微根管法监测膜下滴灌棉花根系生长动态[J]. 农业工程学报, 2017, 33(2): 87-93. CHEN W L, JIN M G, LIU Y F, XIAN Y, HUANG J O. Monitoring cotton root growth dynamics under mulched drip irrigation using monirhizotron technique[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(2): 87-93. |
| [22] |
BOX J E, RAMSUER E L. Minirhizotron wheat root data: Comparisons to soil core root data[J]. Agronomy Journal, 1993, 85(5): 1058-60. DOI:10.2134/agronj1993.00021962008500050019x |
| [23] |
廖荣伟, 刘晶淼, 安顺清, 牛俊丽, 梁宏. 基于微根管技术的玉米根系生长监测[J]. 农业工程学报, 2010, 26(10): 156-161. LIAO R W, LIU J M, AN S Q, NIU J L, LIANG H. Monitor of corn root growth in soil based on minirhizotron technique[J]. Transactions of the Chinese Society of Agricultural Engineering, 2010, 26(10): 156-161. |
| [24] |
李燕丽, 王昌昆, 卢碧林, 李继福, 潘贤章. 基于微根管技术的盐胁迫下小麦根系生长原位监测方法[J]. 土壤学报, 2020, 58(3): 1-12. LI Y L, WANG C K, LU B L, LI J F, PAN X Z. In-situ monitoring method of wheat root growth under salt stress using minirhizotron technique[J]. Acta Pedologica Sinica, 2020, 58(3): 1-12. |
| [25] |
李彦彬, 冯娅, 边泽鹏, 李道西, 朱亚南. 花前干旱胁迫对冬小麦生长指标的影响[J]. 灌溉排水学报, 2021, 40(3): 23-30. DOI:10.13522/j.cnki.ggps.2020399 LI Y B, FENG Y, BIAN Z P, LI D X, ZHU Y N. Effect of drought stress before anthesis on growth indexes of winter wheat[J]. Journal of Irrigation and Drainage, 2021, 40(3): 23-30. DOI:10.13522/j.cnki.ggps.2020399 |
| [26] |
侯丹平, 谭金松, 毕庆宇, 张安宁, 刘毅. 水分胁迫对节水抗旱稻产量形成和根系形态生理特性的影响[J]. 中国水稻科学, 2021, 35(1): 27-37. DOI:10.16819/j.1001-7216.2021.0507 HOU D P, TAN J S, BI Q Y, ZHANG A N, LIU Y. Effects of water stress on yield formation and root morphological and physiological effects of water stress on yield formation and root morphological and physiological[J]. Chinese Journal of Rice Science, 2021, 35(1): 27-37. DOI:10.16819/j.1001-7216.2021.0507 |
(责任编辑 邹移光)
 2022, Vol. 49
2022, Vol. 49