文章信息
基金项目
- 广东省科技计划项目(2021A0505030050);广东省农业科学院科技创新战略专项资金(高水平农科院建设)-人才项目(R2020PY-JX019)
作者简介
-
李秀梅,植物学博士,助理研究员。主要从事作物品质性状的遗传解析研究,主持国家自然科学基金青年项目、广东省自然科学基金面上项目等科技项目6项,参与国家自然科学基金、农业农村部、广东省农业农村厅等多项科技项目。以第一作者(含共同第一作者)在《Plant Journal》《Gene》《EvoDevo》等杂志发表论文5篇,以第一发明人获得授权发明专利2项。
李秀梅(1986—),女,博士,助理研究员,研究方向为作物品质性状的遗传解析,E-mail:xixixiu72@163.com; 李文燕,遗传学博士,副研究员,硕士研究生导师,比利时根特大学访问学者。现任中国农业科技华南创新中心公共实验室副主任。主要从事作物品质性状关键基因挖掘、遗传解析与新种质创制研究,主持国家自然科学基金、省自然科学基金、省科技计划项目等科技项目6项,承担NSFC-广东联合基金、国家重大转基因专项调增课题任务、广东省重点领域研究专项等省部级以上项目5项。先后发表学术论文18篇,其中以第一作者或通信作者(含并列)在《Frontiers in Plant Science》《Genome Biology and Evolution》等领域内重要期刊发表论文9篇.
通讯作者
- 李文燕(1982—),男,博士,副研究员,研究方向为作物品质性状的遗传解析,E-mail:liwy1023@foxmail.com.
文章历史
- 收稿日期:2022-09-04
α-半乳糖苷酶(α-galactosidase,α-Gal;EC 3.2.1.22)广泛存在于动物、植物及微生物(古细菌、细菌和真菌)中,是一类专一性催化α-半乳糖苷键水解的外切糖苷酶,属于糖苷水解酶家族;该酶能专一性识别底物末端α-连接的非还原性D-半乳糖残基并催化其水解,大部分α-Gal主要催化半乳低聚糖、半乳甘露聚糖、半乳糖脂及糖蛋白中α-1, 6-半乳糖苷键的水解,少数α-Gal专一性的催化α-1, 3-或α-1.4-半乳糖苷键的水解[1-2]。除水解酶活性外,一些α-Gal还具有半乳糖基转移酶的活性[3]。不同来源的α-Gal已广泛应用于食品、饲料、化工、农业及医药领域[4-6]。例如,在食品及饲料工业领域,α-Gal被广泛用于消除豆制品、饲用豆粕及其他饼粕中致使人和动物胃肠胀气的含有α-1, 6-半乳糖苷的产气因子——棉子糖家族寡糖,进而促进人体对豆制品的消化和吸收,消除棉子糖家族寡糖的抗营养性,提高畜禽对豆粕等饲料的利用率[5, 7]。在化工领域,利用α-Gal与β-甘露聚糖酶协同对富含半乳甘露聚糖类植物(如瓜儿豆、槐豆等)多糖胶的水解与修饰作用,水解支链末端半乳糖基,改变半乳甘露聚糖性质,显著提高其凝胶特性[8];在医药方面,利用α-Gal糖基转移酶的特性改造环糊精及其衍生物,增加其包埋药物的稳定性[9];利用α-Gal可专一性水解血红细胞表面抗原α-1, 3-半乳糖苷键的特性,可用于B→O血型改造、克服异种器官移植超应急排斥反应等[10-11]。因此,α-Gal被认为是最具应用潜力的酶制剂之一。
微生物是α-Gal的主要来源,国内外关于α-Gal的研究大多来自细菌、真菌等微生物,其研究重点还更多局限于酶学性质应用领域的探讨,主要包括催化活性、最适pH值、最适底物、最适温度等[1, 4, 6, 12]。尽管当前利用基因工程等手段可以实现α-Gal在大肠杆菌、酵母菌等异源生物中的高效表达,但是无论天然提取或异源表达的α-Gal在催化活性、最适pH值、热稳定性、表达效率等方面仍存在诸多问题,极大限制了其规模化产业应用[6, 12]。与微生物相比,植物来源的α-Gal研究报道则相对较少,主要集中在豆类、葫芦科、禾本科等少数物种的研究。尽管已有研究表明α-Gal参与植物生长发育[13]、种子萌发[14]、糖的运输与卸载[15-16]、逆境胁迫应答[17-19]等重要生理过程,但其作用机制仍不清楚,这也极大限制了α-Gal在作物遗传改良中的应用。鉴于α-Gal的广阔应用前景和巨大市场经济价值,以产业化应用为最终目标的基础研究已成为α-Gal领域的研究热点和新的发展趋势[4, 6, 12]。因此,亟需开展不同物种来源的α-Gal基因发掘、克隆与鉴定、酶催化机理以及功能作用的分子机制研究,进而通过分子设计手段改造具有高催化活性和热稳定性的α-Gal以满足潜在的巨大市场需求,并为拓宽α-Gal在食品工业、作物育种等领域的应用奠定理论基础。本文主要就α-Gal的来源与分类、催化特性、家族系统进化及其在植物中的生物学功能等方面的研究现状、热点及发展趋势进行综述。
1 α-Gal的来源、种类与催化特性 1.1 α-Gal的来源及分布α-Gal是一类能特异性识别非还原末端α-半乳糖残基,并催化含有α-半乳糖苷的低聚糖(如蜜二糖、棉子糖、水苏糖等)以及半乳甘露聚糖、半乳糖脂和糖蛋白水解的外切糖苷水解酶类[1-2]。α-Gal广泛存在于自然界的动物、植物和微生物中,从古细菌、细菌等低等原核生物,到被子植物、哺乳动物等高等真核生物中均有分布,尤其在细菌、真菌等微生物中分布最为广泛、研究最为深入[1, 4, 6, 12]。目前已报道α-Gal的细菌来源有嗜热芽孢杆菌、极端嗜热杜氏杆菌等,真菌来源有里氏木霉、米曲霉等,植物来源有咖啡豆、拟南芥、水稻、玉米、黄瓜等,动物来源有人等。
1.2 α-Gal的种类糖苷水解酶(Glycoside hydrolases,GH)是一类水解糖苷键(glycosidic bonds)的酶,在生物体糖和糖缀合物的水解与合成过程中扮演着重要角色。根据蛋白序列的相似性及催化特性的不同[20-21],CAZy(Carbohydrate Active Enzymes database,http://www.cazy.org/)将糖苷水解酶分为173个GH家族,即GH1~GH173。其中,具有α-Gal活性的GH家族有GH4、GH27、GH31、GH36、GH57、GH97和GH110等7个家族(表 1)。从表 1可以看出,不同GH家族的来源与分布存在不均衡性。在原核微生物中,7个GH家族在细菌中均有分布,而在古细菌中仅有GH36和GH57两个GH家族分布;在真菌、动植物等真核生物中,仅有GH27和GH36两个家族分布。目前已鉴定的α-Gal大部分属于GH27和GH36家族。根据酶的最适pH,可将α-Gal分为酸性α-Gal(AGAL, 最适pH 4.0~7.0)、碱性α-Gal(AGA, 最适pH 7.0~9.0)和中性α-Gal(最适pH 7.0)。(古)细菌、真菌等微生物来源的α-Gal大多呈酸性,如GH27、GH31、GH57、GH110;少部分呈中性,如GH4、GH97。而植物来源的α-Gal大部分为酸性(如GH27)或碱性(如GH36),极少部分为中性。
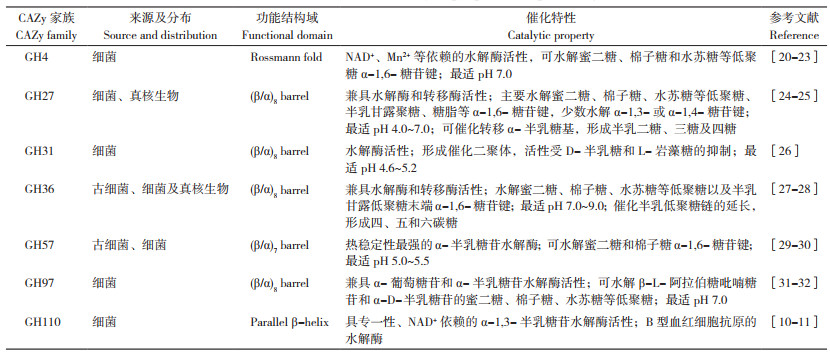
|
1.3 α-Gal的催化特性
α-Gal的催化特性与蛋白氨基酸序列、功能结构域及活性中心密切相关[20-21, 33],不同来源的GH家族在蛋白功能结构域及催化特性方面存在显著差异。根据GH催化作用机制的不同分为两类:构型保持酶(Retaining enzymes)和构型翻转酶(Inverting enzymes)[20-21, 33]。GH4家族蛋白功能结构域由罗斯曼折叠(Rossmann fold)结构基序(即3个平行的β折叠与两对α螺旋形成β-α-β-α-β结构)组成,其催化反应依赖NAD+和Mn2+等二价金属离子作为辅助因子,属于构型保持酶[22-23]。GH27、GH31和GH36同属于GH-D水解酶家族,其蛋白功能结构域在进化上相对保守,核心功能结构域均由(β/α)8桶状拓扑结构组成,催化中心具有保守的D-D-x-[WY] 特征性序列,亦属于构型保持酶[25, 27-28]。尽管GH27、GH31和GH36在功能结构域上存在保守性,但在具体功能特性(如蛋白酶聚集状态、最适pH、底物特异性等)方面仍存在明显差异(表 1)。例如,不同来源的GH27水解酶呈现单体(如水稻α-Gal)、二聚体(如人源α-Gal)和四聚体(如酿酒酵母α-Gal)3种聚合状态,并在pH 4.0~7.0时具有较高的催化活性,主要催化蜜二糖、棉子糖、水苏糖等半乳低聚糖,半乳甘露聚糖、半乳糖脂等α-1, 6-半乳糖苷键的水解[24-25]。GH31通常形成二聚体,并在pH 4.6~5.2时具有最高活性,可催化蜜二糖、棉子糖、水苏糖等低聚糖的α-1, 6-半乳糖苷键水解。GH36则大多以四聚体形式存在,通常在pH 7.0~9.0时呈现较高活性,可催化蜜二糖、棉子糖、水苏糖等低聚糖,以及半乳甘露低聚糖末端的α-1, 6-半乳糖苷键水解[27-28, 34]。此外,除GH31仅具有糖苷水解酶活性外,GH27和GH36兼具糖苷水解酶和糖基转移酶活性,催化半乳糖基转移形成半乳二糖、三糖和四糖,或者催化半乳低聚糖链延长形成四碳糖、五碳糖和六碳糖[35-36]。GH57家族仅存在于少数(古)细菌中,热稳定性强,如从海栖热袍菌Thermotoga neapolitana和激烈火球菌Pyrococcus furiosus分离获得迄今为止最耐热的的α-半乳糖苷酶,其最适温度分别为100~103、115 ℃[29-30];该家族蛋白功能结构域由(β/α)7桶状拓扑结构组成,亦属于构型保持酶,且在pH 5.0~5.5时可水解蜜二糖和棉子糖,但不能水解半乳甘露低聚糖[29-30]。GH97家族则属于双功能酶——构型翻转酶和构型保持酶,兼具α-葡萄糖苷和α-半乳糖苷水解酶活性;其功能结构域由(β/α)8桶状拓扑结构组成,可催化β-L-阿拉伯糖吡喃糖苷和α-D-半乳糖苷水解[31-32, 37]。GH110家族具有高度专一性的NAD+依赖的α-1, 3-半乳糖苷水解酶活性,其功能结构域由5~6个平行β-螺旋(Parallel β-helix)组成,专一催化B型血红细胞特异抗原表面α-1, 3-半乳糖残基水解,可用于B→O的血型改造[10-11]。
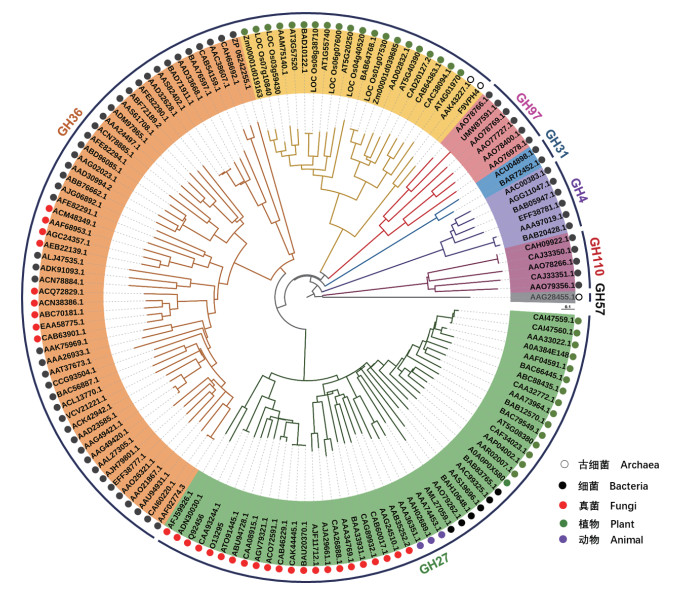
2 植物α-Gal的进化分析 2.1 α-Gal家族的进化关系尽管CAZy公共数据库已对α-Gal进行功能分类,针对各GH家族的催化功能亦有相关研究报道(表 1),但是目前有关α-Gal的7个家族(GH4、GH27、GH31、GH36、GH57、GH97和GH110)之间的进化关系仍不清楚。利用生物信息学方法对公共数据库已报道的7个α-Gal家族基因进行系统进化分析,结果(图 1)表明:α-Gal由共同祖先演化而来,且α-Gal在古细菌等低等原核生物中早已存在并保留至今,如GH57和GH36家族;细菌等原核生物来源的α-Gal种类显著多于真菌、动植物等真核生物,如细菌具有全部的7个α-Gal家族,而真菌等真核生物仅有GH27和GH36两个GH家族(表 1、图 1);α-Gal蛋白催化功能结构域在进化上相对保守,其核心结构由保守的(β/α)n (n=7、8)桶装结构组成[25, 27-28],并在进化过程中分化出具有特定功能的结构域,如GH4家族罗斯曼折叠(Rossmann fold)[20-23]和GH110家族平行β-螺旋(Parallel β-helix)结构基序[10-11](表 1)。α-Gal在进化过程中发生功能分化可能与特定功能或适应特殊环境有关,如激烈火球菌Pyrococcus furiosus来源的α-Gal(GH57)具有极端耐热性(最适温度高达115 ℃,半衰期在100 ℃下长达15 h)相关[30],而Bacteroides fragilis等来源的α-Gal(GH110)则专一性催化水解α-1, 3-半乳糖苷键、非α-1, 6-半乳糖苷键,其核心催化结构域由6个平行β-螺旋(Parallel β-helix)结构组成(表 1)[10-11]。
2.2 植物α-Gal家族的进化分析在植物基因组中,α-Gal仅存在于GH27和GH36家族,分布范围从低等藻类到高等被子植物,家族同源基因的数量因物种而异,表明α-Gal家族基因在植物进化过程中发生了基因扩增和基因丢失[38]。低等单细胞藻类植物大多仅含1个α-Gal编码基因,而多细胞藻类及苔藓等陆生植物含有多个α-Gal编码基因,如拟南芥中GH27和GH36家族分别有4个和5个基因编码α-Gal,而水稻中则分别有5个和6个基因编码α-Gal[38]。Yan等[38]对植物来源的GH27家族进行系统进化分析发现,GH27家族可分为3个亚家族,其中亚家族I存在于所有植物中,而亚家族I、IIII则分别分布于绿色藻类植物和陆生植物。值得注意的是,亚家族I中筋骨草Ajuga reptans来源的α-Gal基因(图 1,AAR02007.1)编码蛋白具有RFO合成酶/半乳糖水解酶活性,不仅可以催化棉籽糖水解产生蔗糖和半乳糖,而且可以催化RFOs的链伸长,产生水苏糖、毛蕊花糖[3, 39]。通过植物来源的GH36家族系统发育分析发现,GH36家族可分为多个亚家族,且各亚家族在进化过程中发生功能分化,演化出具有特定功能的RS/STS(Raffinose synthase/Stachyose synthase)亚家族。且RS/STS亚家族编码蛋白被证实也具有RFO合成酶/半乳糖水解酶活性。例如,玉米ZmRS(图 1,Zm00001d039685)同时具有棉子糖合成和半乳糖醇水解活性[40],而拟南芥AtRS4和AtSTS(图 1, AT4G01970)不仅具有水苏糖合成活性,而且具有水苏糖和半乳糖醇特异性水解活性[36]。与细菌等原核生物不同的是,植物来源的GH27和GH36家族在进化过程中发生功能分化可能与适应陆生干旱环境有关[38]。
|
| 基于CAZy数据库中已报道的7个α-Gal家族蛋白氨基酸序列比对结果构建ML(Maximum likelihood)系统发育树 Maximum likelihood (ML) phylogenetic tree is inferred from the amino acid sequences alignment of 7 α-Gal family proteins reported in the CAZy database 图 1 α-半乳糖苷酶家族系统进化关系 Fig. 1 Phylogenetic relationship of α-galactosidase family |
3 植物α-Gal的生物学功能 3.1 α-Gal参与RFO生物合成、卸载与及解代谢
在植物中,α-Gal参与植物棉子糖系列寡糖(Raffinose family oligosaccharides, RFOs)的生物合成及代谢过程[38]。RFOs是在α-半乳糖转移酶作用下,将半乳糖基单元转移至蔗糖或更高级的寡糖(如棉子糖、水苏糖等)上合成的,最终可以得到聚合度高达15碳糖的一系列低聚糖[41]。迄今为止,已经确定了两种RFOs生物合成途径。一种是肌醇半乳糖苷依赖途径。该途径第一个关键步骤是由肌醇半乳糖苷合酶(Galactinol synthase,GolS)催化UDP-半乳糖和L-肌醇合成肌醇半乳糖苷,然后在棉子糖合酶(Raffinose synthase,RS)催化下,将半乳糖苷的半乳糖单元添加到蔗糖中形成棉子糖;在部分植物中,棉子糖可在水苏糖合酶(Stachyose synthase, STS)催化下,将半乳糖单元添加到棉子糖中合成水苏糖、毛蕊花糖[42]。另一种是非肌醇半乳糖苷依赖途径。该途径的关键酶是半乳糖体:半乳糖体半乳糖基转移酶(Galactan: galactan galactosyltransferase, GGT),属于酸性α-Gal的GH27家族[24, 39],该酶通过将RFO分子末端的半乳糖基转移到另一个RFO分子上,从而催化RFO的链延长。例如,当与水苏糖孵育时,GGT能够催化产生棉子糖和毛蕊花糖[24, 39]。但值得注意的是,目前人们发现叶片中有GGT酶活性,但尚未在种子中检测到,这说明不依赖半乳糖苷的RFO合成途径可能存在于植物叶片中,而不存在于植物种子中。
植物中的RFO分解代谢虽然与生物合成反应一样重要,但却很少受到关注。而α-Gal是催化α-半乳糖苷键水解的酶类,它能水解非还原末端以α-1, 6糖苷键结合的半乳糖苷化合物,半乳糖基被依次移动,可将RFOs水解为蔗糖和D-半乳糖;此外,α-Gal还能水解含有α-半乳糖苷键的杂多糖,如半乳甘露聚糖、半乳糖脂及糖蛋白[1-2]。RFO水解所得的蔗糖和D-半乳糖既可作为能量来源,也可被重新利用形成RFOs。作为能量来源,蔗糖可以通过转化酶降解为葡萄糖和果糖,也可以通过蔗糖合酶降解为UDP-葡萄糖和果糖[43]。随后,葡萄糖、果糖和D-半乳糖可以轻易进入其他代谢途径。半乳糖的累积能对α-Gal起到反馈抑制作用,但游离的D-半乳糖可通过细胞溶质中的半乳糖激酶(Galactokinase, GalK)迅速转化为半乳糖-1-磷酸,并通过传统的Leloir途径或焦磷酸酶依赖途径进一步代谢[42-43],通过降解RFO释放半乳糖并促进其转变为淀粉或其他产物。有趣的是,所有RFO生物合成和分解代谢反应都是可逆的。
此外,α-Gal还参与部分植物RFO在韧皮部的卸载[38]。植物叶片光合作用产生的碳水化合物只有不到80% 被输出到异养组织和器官用于生长发育[44-45]。蔗糖是大部分植物长途运输的主要碳水化合物。蔗糖从“源”到“库”转运的第一步是韧皮部运输,即光合作用所生成的糖从叶肉细胞(Mesophyll cells,MCs)到伴生细胞(Companion cells,CCs),再到小叶脉筛分子(Sieve elements,SEs)的转运,主要采取质外体装载(Apoplasmic loading)和被动的共质体装载(Passive symplasmic loading)两种策略[46-47]。前者是一个转运体介导的能量耦合过程,而后者是一个渗透驱动过程,通过胞间连丝将蔗糖从MCs转运到CCs[46-47]。在通过SEs进行长距离运输并到达库组织后,蔗糖被直接用于提供生长发育所需的碳和能量,或者被代谢成RFOs或淀粉储存在库组织中。另外,部分植物韧皮部运输的主要碳水化合物是棉子糖和水苏糖,而不是蔗糖,如南瓜科、唇形科和木樨科。除了上述两种转运策略外,这些植物还采用第3种韧皮部加载策略——聚合物诱捕装载(Polymer-trapping loading)[46-47]。在聚合物诱捕装载模型中,叶片光合作用产生的蔗糖通过特化的胞间连丝从MCs扩散到特化的CCs,然后聚合形成RFOs,即棉子糖和水苏糖。在库组织中,RFOs从韧皮部卸载,α-Gal将RFOs水解为蔗糖和半乳糖,这些半乳糖也可以通过质外体途径进行分离。这就可以解释为什么早期研究虽然发现这些植物韧皮部中的碳水化合物主要以RFOs的形式进行运输,但在库组织中却几乎检测不到RFOs[48]。最近研究表明在甜西瓜和黄瓜中编码α-Gal的基因ClAGA2[49]和CsAGA2[16]是控制水苏糖和棉子糖水解的关键因素,并在维管束中特异性高表达;敲除ClAGA2后,SWEET3(Sugars will eventually be exported transporter 3)和TST2(Tonoplast sugar transporter 2)会影响甜西瓜的果糖积累[49]。
3.2 α-Gal参与种子发育、脱水耐受及萌发α-Gal参与种子发育及脱水耐受过程。种子发育过程也是可溶性糖等物质积累及种子活力形成的过程,而在此过程中,种子承受脱水的能力,以减少脱水的有害影响,减缓其代谢活动,最终在干燥状态下长期保持生存能力,这种性质被称为“脱水耐受性”[50]。脱水耐受性是正常种子在发育过程中获得的,在种子萌发后丧失。RFOs随着种子的发育而积累,在种子成熟失水过程中形成玻璃态以维持膜和蛋白质的结构完整性,从而发挥保护剂的作用,并且RFOs也可以作为种子的贮藏化合物[51-53]。从种子脱水干燥到种子萌发后,可能需要α-Gal活性和RFOs维持一个稳定的还原性单糖水平。Lahuta等[54]通过研究羽扇豆种子发育过程,发现α-Gal降低了RFOs与蔗糖的比例,而且发育种子和成熟种子中具有较高的α-Gal活性,可能是导致种子贮藏期间活力下降的原因之一。玉米ZmAGA1在发育过程、成熟和干燥的种子中转录量较低,在吸胀24~36 h后有所增加[55]。种子贮藏性即种子贮藏后寿命,与种子的脱水耐受性部分相关,种子活力也与种子贮藏寿命密切相关。因此,具有良好脱水耐受性的种子往往具有较长的寿命和较高的活力。在拟南芥中过表达玉米的ZmAGA1会降低成熟种子中RFOS和半乳糖苷的含量,从而导致种子发芽率更高,但种子衰老耐受性下降[14]。进一步分析表明,吸胀后ZmAGA1过表达种子的RFO水平最低,α-Gal活性迅速增加[14]。
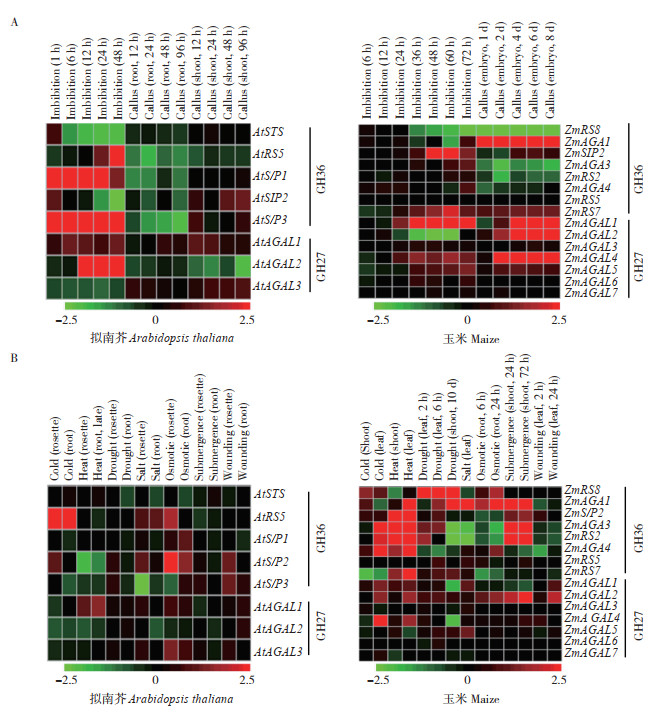
此外,α-Gal还参与种子萌发调控。虽然RFOs从种子发育时便开始积累,但种子在萌发过程中不能直接使用RFOs,需要α-Gal将RFOs分解为蔗糖和半乳糖,再进一步水解为单糖。这些单糖可能被吸收到生长的茎尖和根尖细胞膜或细胞壁中并为其提供能量,从而提高种子萌发活力[14]。例如,在豌豆(Pisum sativum)中过表达咖啡豆的α-Gal能降低种子内的棉子糖和水苏糖含量,同时种子仍然保持90% 以上的萌发率[56]。有研究表明,在芝麻种子成熟和早期萌发过程中,α-Gal活性逐渐增加。当用α-Gal特异性抑制剂DGJ(Deoxygalactono jirimycin)处理豌豆种子时,种子的RFOs分解受阻,发芽率显著降低,并伴有GalK和UDP-半乳糖焦磷酸化酶活性下降[57]。添加外源半乳糖可以解除对种子萌发的抑制,添加外源蔗糖可以部分解除抑制[57],说明半乳糖含量与种子萌发呈正相关。研究表明酸性α-Gal和碱性α-Gal在萌发中的表达也有先后,在豌豆种子中分离得到的酸性α-Gal在种子成熟期间转录显著增加,在萌发过程中也保持活性,而碱性α-Gal在胚根突起后表达。酸性α-Gal活性增加水解RFOs或半乳甘露聚糖已在豆科植物中得到证实。酸性α-Gal活性在番茄[58]和椰枣[59]萌发过程中的胚乳珠孔区显著增加,然而,对玉米种子的研究发现酸性α-Gal与种子萌发时的寡糖分解没有关系,可能是3种碱性α-Gal发挥主要作用,这3种α-Gal与种子吸胀蛋白SIP(Seed imbibition protein)具有同源性,催化含有半乳糖基的RFOs水解[55]。利用Genevestigator (https://genevestigator.com/) 公共转录组数据对拟南芥和玉米α-Gal家族基因(GH27和GH36)进行基因表达分析,发现拟南芥AtSIP1、AtSIP3、AtAGAL2和玉米ZmSIP2、ZmRS7、ZmAGAL4、ZmAGAL5等α-Gal编码基因在种子吸胀萌发过程中呈显著上调表达(图 2A)。此外,在玉米胚诱导愈伤组织中,ZmAGA1、ZmRS7、ZmAGAL1/2/4也呈显著上调表达(图 2A)。
|
| 拟南芥和玉米GH27和GH36家族基因在吸胀种子和愈伤组织中的表达谱(A),以及在冷、热、旱、盐、渗透、水淹、损伤等非生物胁迫下的表达谱(B) The expression profiles of GH27 and GH36 family genes of Arabidopsis thaliana and maize in imbibition seeds and callus tissues (A), and under abiotic stresses including cold, heat, drought, salt, osmosis, submergence and wounding (B) 图 2 拟南芥和玉米GH27和GH36家族基因表达谱 Fig. 2 Expression profiles of GH27 and GH36 family genes in Arabidopsis thaliana and maize |
从瓜尔豆(Cyampsis tetragonaloba)萌发种子的糊粉细胞中分离到一个编码α-Gal的基因,表明α-Gal被分泌到胚乳中降解贮存的半乳甘露聚糖[60]。对列当属植物酸性α-Gal亚家族成员OmAGAL2的研究表明,车前糖贮藏在干种子胚外,在种子萌发时,被质外体中的OmAGAL2水解成蔗糖,为胚萌发提供必需的己糖[61]。这些结果进一步证实,α-Gal参与多种植物胚乳中贮藏碳水化合物的代谢,促进种子的萌发。
3.3 α-Gal参与植物非生物逆境胁迫响应α-Gal通过调节植物细胞内RFOs含量间接参与植物非生物逆境胁迫响应。高等植物通过可溶性糖的合成、运输和降解,协同调控胞内可溶性糖的浓度,以响应外界环境条件。目前,RFOs在植物非生物胁迫应答中主要存在3种不同的调控机制:(1)棉子糖可在风干过程中保持细胞膜的稳定性,防止复水后细胞内溶物的泄漏和膜融合[62];(2)半乳糖醇和棉子糖可作为渗透保护剂和ROS清除剂,减轻不利条件下产生的氧化损伤[52, 63];(3)棉子糖可运输到叶绿体中保护类囊体,稳定光系统Ⅱ,在不利条件下维持植物的光合作用[64]。
极低温(寒冷、寒冷或霜冻)和高温会对植物生长和作物产量产生极其有害的影响。研究表明,冷处理可诱导拟南芥和水稻的棉子糖积累,并且在耐寒材料中的棉子糖水平显著高于冷敏感材料[65-67]。Keller等[68]研究表明,在抗冻甜菜中,棉子糖在肉质根髓组织中的积累与抗冻性相关。在低温胁迫下,水稻幼苗和葡萄藤木本组织中,GolS和RS基因的转录明显增加,并出现棉子糖积累[69]。Han等[70]研究表明,完全消除棉子糖的玉米zmrs突变株系对低温胁迫的耐受性相较对照株下降。进一步的分析也证实了玉米ZmDREB1A蛋白可以直接与ZmRS的启动子结合,激活ZmRS表达,从而导致棉子糖积累并提高玉米的耐寒性[70]。类似地,乙烯响应因子108(ERF108)可以直接靶向RS酶基因来调节三叶橙(Poncirus trifoliata)的冷胁迫反应[71]。此外,钙调素类蛋白42(MtCML42)已被证明可以正向调节C-repeat binding factor(CBF)通路,进而增加MtGolS1和MtGolS2的转录,导致棉子糖积累并增强苜蓿的耐寒性[72]。在矮牵牛中过表达α-Gal则会导致植物内源棉子糖的减少和抗冻性降低,反之,下调α-Gal会使植株抗冻性提高[17]。这些结果表明RFOs在植物冷胁迫响应中具有积极作用,α-Gal活性增加会降低棉子糖含量,从而降低植物的抗冻性。
与冷驯化相比,去冷驯化也是一种重要的调节机制,它可以保证植物在去除胁迫条件后恢复到正常生长状态。尽管人们研究了RFOs在胁迫条件下的积累及其生理意义,但对胁迫消除后RFOs的分解机理却很少关注。α-Gal负责在RFOs分解代谢过程中去除非还原末端半乳糖残基。Gu等[73]研究发现,黄瓜酸性α-Gal(CsAGAL1)蛋白存在于液泡中,而碱性α-Gal(CsAGA2和CsAGA3)蛋白分别存在于细胞质和叶绿体中[73]。当去除冷胁迫后,酸性和碱性α-Gal在RNA水平和蛋白活性水平均上调,而且冷胁迫期间积累在黄瓜叶片不同亚细胞的RFOs在冷胁迫缓解后可被不同的α-Gal原位分解。
盐胁迫也是植物生长面临的重要非生物胁迫之一。研究表明,碱性α-Gal转基因烟草植株在盐胁迫下的种子发芽率和生长性能均高于野生型烟草[74];而在玉米研究中发现,玉米碱性α-Gal家族基因ZmAGA1在种子萌发过程中却不响应盐胁迫[55]。此外,Genevestigator转录组数据分析发现,ZmAGA1在热、旱、盐、渗透等非生物胁迫下呈现显著上调(图 2B),表明该基因在玉米苗期对上述非生物胁迫敏感。类似地,同属GH36家族的ZmRS8基因在干旱胁迫下呈现显著上调,而ZmSIP2、ZmAGA3/4、ZmRS2则在冷、热及水淹胁迫下呈明显上调;在GH27家族中,除ZmAGAL2在上述胁迫下呈现不同程度上调外,其他该家族同源基因表达变化不明显(图 2B)。上述研究结果表明,植物α-Gal家族基因在响应非生物逆境胁迫中的功能可能已经发生了分化,需要更进一步的深入研究。
3.4 α-Gal参与植物细胞壁重塑细胞壁是存在于植物细胞外围的一层厚壁,主要起保护作用,同时也是影响细胞生长与分化的主要障碍[75-76]。植物细胞壁主要由纤维素、半纤维素和果胶等多糖组成,这些大分子的组成和结构调控了细胞壁的拉伸强度和稳定性[77-78]。在细胞生长和分化过程中,植物细胞壁韧度不断受到冲击,并发生松弛和软化[79]。质外体α-Gal通过参与细胞壁代谢(细胞壁解离和扩张)在叶发育[13]、果实成熟[80]或通气组织形成[81]中发挥重要作用。过度软化是限制水果货架期和储存的主要因素,而α-Gal可以通过影响果实的硬度来缩短采后寿命[82]。一般认为,果实成熟过程中发生的软化现象是由α-Gal、果胶甲酯酶、纤维素酶、β-甘露聚糖酶等多种酶协同水解细胞壁多糖所致[83]。其中,α-Gal定位在细胞壁和细胞质,参与细胞壁半纤维素成分半乳甘露聚糖支链末端α-半乳糖基的水解,从而调控果实软化。随着果实成熟,不同软硬程度的番茄品种α-Gal活性变化不同,其中,在果皮软的番茄品种中,α-Gal活性显著增加[84]。Soh等[80]研究发现,木瓜中含有3个α-Gal,其中α-Gal2是主要的活性来源,且该酶在生长期木瓜中表达量很低,但是随着果实成熟该酶的表达量和活性显著增加,同时果皮的硬度逐渐减弱,表明在这一过程中,α-Gal2对细胞壁的调控可能不仅起水解酶的作用,还具有聚糖酶和转糖苷酶的活性。类似地,在黄瓜成熟过程中,CsGAL2可通过解离细胞壁促进果实快速生长[85]。
α-Gal除参与果实成熟外,还与种子发育和萌发过程中种胚和胚乳细胞壁的形成和降解密切相关。在枣椰树种子中,α-Gal与胚乳细胞壁的形成和萌发时的降解息息相关[86]。在细胞壁形成中,该酶参与甘露聚糖的合成;在休眠种子中,绝大部分甘露聚糖存储在占胚乳体积65% 的细胞壁里,此时α-Gal则定位在胚乳的蛋白体中;但是当种子开始萌发,该酶被释放到细胞壁,在细胞壁解离的过程中酶活性提高10倍[86]。类似地,在种子萌发过程中,α-Gal也发挥调控细胞壁解离的作用。例如,生菜的胚乳细胞壁富含半乳甘露聚糖,种胚萌发后胚乳细胞壁开始降解,为种子后续生长提供能量,这一过程是由α-Gal和endo-β-甘露聚糖酶协同完成的[87]。另外,研究发现,α-Gal活性在番茄[58]和椰枣[59]萌发过程中的胚乳珠孔区增加,使胚乳细胞壁发生松弛和软化,有利于种子胚根突破胚乳完成萌发。此外,与大多数有胚乳的种子一样,咖啡的胚乳也含有大量的细胞壁储备多糖(Cell wall storage polysaccharides),作为种子萌发和幼苗建成的能量,而这些储备多糖一般是半乳甘露聚糖[88]。α-Gal通过沉积后半乳糖取代的方式(Post-depositional degree of galactose substitution)参与半乳甘露聚糖的生物合成[88]。而在椰子胚乳中α-Gal活性的缺乏会导致胚乳中细胞壁定位的半乳甘露聚糖的水解障碍,从而造成凝乳椰子表型[89]。
植物细胞的不可逆伸长由两个方面调控:一是细胞膨胀,二是细胞壁的延伸限制。在豇豆下胚轴里,α-Gal的特异性抑制剂可以通过约束细胞壁的延伸从而抑制下胚轴的伸长[90]。在拟南芥中,α-Gal的T-DNA插入嵌合体呈现莲座叶的突变体叶片形态,根据GUS染色实验发现该酶定位在叶片细胞壁上,说明该酶可在叶片发育过程中影响叶片细胞壁的有序扩张[13]。综上所述,α-Gal在果实成熟、种子萌发、叶片发育及衰老等生理过程发挥作用主要是通过参与细胞壁重塑(合成、修饰与水解)实现。
4 结语与展望α-Gal广泛存在于动物、植物和微生物中,不同来源的α-Gal其理化特性存在明显差异[56-58]。根据其序列相似性及催化特性,α-Gal可分为7个GH家族,由共同祖先演化而来,其催化的功能结构域在进化上相对保守。近年来,随着国内外对α-Gal的研究不断深入,越来越多不同物种来源和不同家族的α-Gal被鉴定出来,并广泛应用于食品工业、饲料工业、化工、农业及生物医药等多个领域。因此,α-Gal亦被认为是最有应用前景的酶制剂之一。然而,与一些应用较为成熟的纤维素酶、脂肪酶等酶制剂相比,α-Gal在其催化的高级结构、催化活性位点、酶与底物结合机制、酶的热稳定性等方面的研究仍非常有限,极大地限制了α-Gal的进一步应用。因此,亟需从不同来源物种中发掘、鉴定更多具有α-Gal酶活的编码基因,并深入研究其催化分子机理,尤其是蛋白的高级机构与构效关系,进而通过分子设计手段对酶分子和表达宿主进行改造,消除基因表达、蛋白修饰和分泌等方面障碍,实现具有高催化活性和热稳定性的α-Gal高效表达,以满足潜在的巨大市场需求,并为拓宽α-Gal在食品等领域的应用奠定理论基础。
在植物中,α-Gal仅有GH27和GH36两个家族,均具有α-1, 6-半乳糖苷水解酶活性,少数兼具水解酶和半乳糖基转移酶活性。已有研究表明,α-Gal广泛参与植物叶片发育与衰老、果实成熟、种子发育与萌发以及逆境胁迫响应等重要生理过程,然而目前有关其参与上述过程的生理及分子机制仍不清楚。细胞壁重塑在植物生长发育、果实成熟、种子萌发等过程中发挥重要作用。尽管已有研究表明,α-Gal参与植物细胞壁的修饰及半乳甘露聚糖支链末端α-半乳糖基的水解,但在种子萌发过程中α-Gal是否也通过水解细胞壁半乳甘露聚糖使细胞壁松弛软化,进而促进种子胚根突破种皮完成萌发,仍需更多直接相关实验数据。这是因为,一方面,不同物种种子细胞壁组成成分及种子种胚结构存在较大差异。对于胚乳包被且胚乳富含半乳甘露聚糖的种子(如咖啡豆),在萌发早期α-Gal与β-甘露聚糖酶、β-甘露糖苷酶协同作用水解半乳甘露聚糖促使细胞壁软化,进而促进胚根突破形成萌发;而对于一般作物种子,是否也存在类似机制仍有待实验证实。另一方面,若α-Gal参与细胞壁水解,那么α-Gal应该属于质外体定位酶,但通过对模式植物拟南芥和玉米等α-Gal基因编码蛋白氨基酸进行信号肽预测分析,并未发现细胞外(质外体)定位的信号肽,那么非经典分泌蛋白α-Gal是如何转运至质外体的,这也有待深入研究。综上所述,利用包括基因编辑在内的遗传学、分子生物学等多种手段,深入研究α-Gal家族基因的生物学功能及分子机理,将有助于上述问题的解决,这也是未来有关植物α-Gal研究的热点和发展方向。
| [1] |
KATROLIA P, RAJASHEKHARA E, YAN Q, JIANG Z. Biotechnological potential of microbial α-galactosidases[J]. Critical Reviews in Biotechnology, 2014, 34(4): 307-17. DOI:10.3109/07388551.2013.794124 |
| [2] |
SONG Y, SUN W, FAN Y, XUE Y, LIU D, MA C, LIU W, MOSHER W, LUO X, LI Z, MA W, ZHANG T. Galactomannan degrading enzymes from the mannan utilization gene cluster of alkaliphilic Bacillus sp. N16-5 and their synergy on galactomannan degradation[J]. Journal of Agricultural and Food Chemistry, 2018, 66(42): 11055-11063. DOI:10.1021/acs.jafc.8b03878 |
| [3] |
BACHMANN M, MATILE P, KELLER F. Metabolism of the raffinose family oligosaccharides in leaves of Ajuga reptans L. (Cold acclimation, translocation, and sink to source transition: discovery of chain elongation enzyme)[J]. Plant Physiology, 1994, 105(4): 1335-1345. DOI:10.1104/pp.105.4.1335 |
| [4] |
闫巧娟, 刘瑜, 江正强. 微生物α-半乳糖苷酶的研究进展[J]. 微生物学杂志, 2017, 37(3): 1-9. DOI:10.13344/j.microbiol.china.2002.02.020 YAN Q J, LIU Y, JIANG Z Q. Advances in microbial α-galactosidase[J]. Journal of Microbiology, 2017, 37(3): 1-9. DOI:10.13344/j.microbiol.china.2002.02.020 |
| [5] |
陈国参, 王佰涛, 徐文涛, 王一雯, 李寒冰, 刘德海. α-半乳糖苷酶及其在饲料中的应用[J]. 中国饲料, 2019(7): 53-58. DOI:10.15906/j.cnki.cn11-2975/s.20190710 CHEN G S, WANG B T, XU W T, WANG Y W, LI H B, LIU D H. α-galactosidase and its application in feed[J]. China Feed, 2019(7): 53-58. DOI:10.15906/j.cnki.cn11-2975/s.20190710 |
| [6] |
ANISHA G S. Molecular advances in microbial α-galactosidases: challenges and prospects[J]. World Journal of Microbiology and Biotechnology, 2022, 38(9): 148. DOI:10.1007/s11274-022-03340-2 |
| [7] |
郝桂娟, 张凯, 王学智, 张景艳, 孟嘉仁, 杨志强, 李建喜. α-半乳糖苷酶的研究进展[J]. 中国畜牧兽医, 2013, 40(3): 149-154. HAO G J, ZHANG K, WANG X Z, ZHANG J Y, MENG J R, YANG Z Q, LI J X. Research progress on α-galactosidase[J]. China Animal Husbandry and Veterinary Medicine, 2013, 40(3): 149-154. |
| [8] |
MALGAS S, VAN DYK J S, PLETSCHKE B I. A review of the enzymatic hydrolysis of mannans and synergistic interactions between β-mannanase, β-mannosidase and α-galactosidase[J]. World Journal of Microbiology and Biotechnology, 2015, 31(8): 1167-1175. DOI:10.1007/s11274-015-1878-2 |
| [9] |
KITAHATA S, HARA K, FUJITA K, KUWAHARA N, KOIZUMI K. Synthesis of 6-O-α-D-galactosylα-cyclodextrin by coffee bean α-galactosidase[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(9): 1518-1519. DOI:10.1271/bbb.56.1518 |
| [10] |
LIU Q P, YUAN H, BENNETT E P, LEVERY S B, NUDELMAN E, SPENCE J, PIETZ G, SAUNDERS K, WHITE T, OLSSON M L, HENRISSAT B, SULZENBACHER G, CLAUSEN H. Identification of a GH110 subfamily of alpha 1, 3-galactosidases: novel enzymes for removal of the alpha-1, 3-Gal xenotransplantation antigen[J]. Journal of Biological Chemistry, 2008, 283(13): 8545-54. DOI:10.1074/jbc.M709020200 |
| [11] |
MCGUIRE B E, HETTLE A G, VICKERS C, KING D T, VOCADLO D J, BORASTON A B. The structure of a family 110 glycoside hydrolase provides insight into the hydrolysis of alpha-1, 3-galactosidic linkages in lambda-carrageenan and blood group antigens[J]. Journal of Biological Chemistry, 2020, 295(52): 18426-18435. DOI:10.1074/jbc.RA120.015776 |
| [12] |
ANISHA G S. Microbial α-galactosidases: Efficient biocatalysts for bioprocess technology[J]. Bioresource Technology, 2022, 344(Pt B): 126293. DOI:10.1016/j.biortech.2021.126293 |
| [13] |
CHROST B, KOLUKISAOGLU U, SCHULZ B, KRUPINSKA K. An alpha-galactosidase with an essential function during leaf development[J]. Planta, 2007, 225(2): 311-20. DOI:10.1007/s00425-006-0350-9 |
| [14] |
ZHANG Y, LI D, DIRK L M A, DOWNIE A B, ZHAO T. ZmAGA1 Hydrolyzes RFOs late during the lag phase of seed germination, shifting sugar metabolism toward seed germination over seed aging tolerance[J]. Journal of Agricultural and Food Chemistr y, 2021, 69(39): 11606-11615. DOI:10.1021/acs.jafc.1c03677 |
| [15] |
ZHANG J, GU H, DAI H, ZHANG Z, MIAO M. Alternative polyadenylation of the stacyose synthase gene mediates source-sink regulation in cucumber[J]. Journal of Plant Physiology, 2020, 245: 153111. DOI:10.1016/j.jplph.2019.153111 |
| [16] |
LIU H, LIU X, ZHAO Y, NIE J, YAO X, LV L, YANG J, MA N, GUO Y, LI Y, YANG X, LIN T, SUI X. Alkaline α-galactosidase 2 (CsAGA2) plays a pivotal role in mediating source-sink communication in cucumber[J]. Plant Physiology, 2022, 189(3): 1501-1518. DOI:10.1093/plphys/kiac152 |
| [17] |
PENNYCOOKE J C, JONES M L, STUSHNOFF C. Down-regulating alpha-galactosidase enhances freezing tolerance in transgenic petunia[J]. Plant Physiology, 2003, 133(2): 901-9. DOI:10.1104/pp.103.024554 |
| [18] |
ZHAO T Y, MARTIN D, MEELEY R B, DOWNIE B. Expression of the maize galactinol synthase gene family: (Ⅱ) Kernel abscission, environmental stress and myo-inositol influences accumulation of transcript in developing seeds and callus cells[J]. Physiologia Plantar um, 2004, 121(4): 647-655. DOI:10.1111/j.1399-3054.2004.00368.x |
| [19] |
ZHAO T Y, THACKER R, CORUM Ⅲ J W, SNYDER J C, MEELEY R B, OBENDORF R L, DOWNIE B. Expression of the maize galactinol synthase gene family: (I) expression of two different genes during seed development and germination[J]. Physiologia Plantarum, 2004, 121(4): 634-646. DOI:10.1111/j.1399-3054.2004.00367.x |
| [20] |
HENRISSAT B. A classification of glycosyl hydrolases based on amino acid sequence similarities[J]. Biochemical Journal, 1991, 280(2): 309-316. DOI:10.1042/bj2800309 |
| [21] |
HENRISSAT B, BAIROCH A. Updating the sequence-based classification of glycosyl hydrolases[J]. Biochemical Journal, 1996, 316(2): 695-696. DOI:10.1042/bj3160695 |
| [22] |
CHAKLADAR S, CHENG L, CHOI M, LIU J, BENNET A J. Mechanistic evaluation of MeJA α-galactosidase from Citrobacter freundii: A family 4 glycosyl hydrolase in which oxidation is rate-limiting[J]. Biochemistry, 2011, 50(20): 4298-308. DOI:10.1021/bi101808h |
| [23] |
MORABBI HERAVI K, WATZLAWICK H, ALTENBUCHNER J. The melREDCA operon encodes a utilization system for the raffinose family of oligosaccharides in Bacillus subtilis[J]. Journal of Bacteriology, 2019, 201(15). DOI:10.1128/jb.00109-19 |
| [24] |
TAPERNOUX-LüTHI E M, B HM A, KELLER F. Cloning, functional expression, and characterization of the raffinose oligosaccharide chain elongation enzyme, Galactan: galactan galactosyltransferase, from common bugle leaves[J]. Plant Physiology, 2004, 134(4): 1377-87. DOI:10.1104/pp.103.036210 |
| [25] |
WANG H, MA R, SHI P, HUANG H, YANG P, WANG Y, FAN Y, YAO B. Insights into the substrate specificity and synergy with mannanase of family 27 α-galactosidases from Neosartorya fischeri P1[J]. Applied Microbiology and Biotechnology, 2015, 99(3): 1261-72. DOI:10.1007/s00253-014-6269-3 |
| [26] |
MIYAZAKI T, ISHIZAKI Y, ICHIKAWA M, NISHIKAWA A, TONOZUKA T. Structural and biochemical characterization of novel bacterial alpha-galactosidases belonging to glycoside hydrolase family 31[J]. Biochemical Journal, 2015, 469(1): 145-58. DOI:10.1042/BJ20150261 |
| [27] |
GOULAS T, GOULAS A, TZORTZIS G, GIBSON G R. A novel alpha-galactosidase from Bifidobacterium bifidum with transgalactosylating properties: Gene molecular cloning and heterologous expression[J]. Applied Microbiology and Biotechnology, 2009, 82(3): 471-7. DOI:10.1007/s00253-008-1750-5 |
| [28] |
PETERS S, EGERT A, STIEGER B, KELLER F. Functional identification of Arabidopsis ATSIP2 (At3g57520) as an alkaline α-galactosidase with a substrate specificity for raffinose and an apparent sink-specific expression pattern[J]. Plant and Cell Physiology, 2010, 51(10): 1815-9. DOI:10.1093/pcp/pcq127 |
| [29] |
DUFFAUD G D, MCCUTCHEN C M, LEDUC P, PARKER K N, KELLY R M. Purification and characterization of extremely thermostable beta-mannanase, beta-mannosidase, and alpha-galactosidase from the hyperthermophilic eubacterium Thermotoga neapolitana 5068[J]. Applied and Environmental Microbiology, 1997, 63(1): 169-177. DOI:10.1128/aem.63.1.169-177.1997 |
| [30] |
VAN LIESHOUT J F T, VERHEES C H, ETTEMA T J G, VAN DER SAR S, IMAMURA H, MATSUZAWA H, VAN DER OOST J, DE VOS W M. Identification and molecular characterization of a novel type of α-galactosidase from Pyrococcus furiosus[J]. Biocatalysis and Biotransformation, 2003, 21(4-5): 243-252. DOI:10.1080/10242420310001614342 |
| [31] |
OKUYAMA M, KITAMURA M, HONDOH H, KANG M S, MORI H, KIMURA A, TANAKA I, YAO M. Catalytic mechanism of retaining alpha-galactosidase belonging to glycoside hydrolase family 97[J]. Journal of Molecular Biology, 2009, 392(5): 1232-41. DOI:10.1016/j.jmb.2009.07.068 |
| [32] |
KIKUCHI A, OKUYAMA M, KATO K, OSAKI S, MA M, KUMAGAI Y, MATSUNAGA K, KLAHAN P, TAGAMI T, YAO M, KIMURA A. A novel glycoside hydrolase family 97 enzyme: Bifunctional beta-l-arabinopyranosidase/alpha-galactosidase from Bacteroides thetaiotaomicron[J]. Biochimie, 2017, 142: 41-50. DOI:10.1016/j.biochi.2017.08.003 |
| [33] |
DAVIES G, HENRISSAT B. Structures and mechanisms of glycosyl hydrolases[J]. Structure, 1995, 3(9): 853-859. DOI:10.1016/S0969-2126(01)00220-9 |
| [34] |
BROUNS S J, SMITS N, WU H, SNIJDERS A P, WRIGHT P C, DE VOS W M, VAN DER OOST J. Identification of a novel alpha-galactosidase from the hyperthermophilic archaeon Sulfolobus solfataricus[J]. Journal of Bacteriology, 2006, 188(7): 2392. DOI:10.1128/jb.188.7.2392-2399.2006 |
| [35] |
HAAB C I, KELLER F. Purification and characterization of the raffinose oligosaccharide chain elongation enzyme, galactan : Galactan galactosyltransferase (GGT), from Ajuga reptans leaves[J]. Physiologia Plantarum, 2002, 114(3): 361-371. DOI:10.1034/j.1399-3054.2002.1140305.x |
| [36] |
GANGL R, BEHM LLER R, TENHAKEN R. Molecular cloning of AtRS4, a seed specific multifunctional RFO synthase/galactosylhydrolase in Arabidopsis thaliana[J]. Frontiers in Plant Science, 2015, 6: 789. DOI:10.3389/fpls.2015.00789 |
| [37] |
SHIN Y J, WOO S H, JEONG H M, KIM J S, KO D S, JEONG D W, LEE J H, SHIM J H. Characterization of novel alpha-galactosidase in glycohydrolase family 97 from Bacteroides thetaiotaomicron and its immobilization for industrial application[J]. International Journal of Biological Macromolecules, 2020, 152: 727-734. DOI:10.1016/j.ijbiomac.2020.02.232 |
| [38] |
YAN S, LIU Q, LI W, YAN J, FERNIE A R. Raffinose family oligosaccharides: crucial regulators of plant development and stress responses[J]. Critical Reviews in Plant Sciences, 2022, 41(4): 286-303. DOI:10.1080/07352689.2022.2111756 |
| [39] |
BACHMANN M, KELLER F. Metabolism of the raffinose family oligosaccharides in leaves of Ajuga reptans L. (Inter-and Intracellular Compartmentation)[J]. Plant physiology, 1995, 109(991): 998. DOI:10.1104/pp.109.3.991 |
| [40] |
LI T, ZHANG Y, LIU Y, LI X, HAO G, HAN Q, DIRK L M A. Raffinose synthase enhances drought tolerance through raffinose synthesis or galactinol hydrolysis in maize and Arabidopsis plants[J]. Journal of Biological Chemistry, 2020, 295(23): 8064-8077. DOI:10.1074/jbc.RA120.013948 |
| [41] |
PETERBAUER T, RICHTER A. Biochemistry and physiology of raffinose family oligosaccharides and galactosyl cyclitols in seeds[J]. Seed Science Research, 2007, 11(3): 185-197. DOI:10.1079/SSR200175 |
| [42] |
SENGUPTA S, MUKHERJEE S, BASAK P, MAJUMDER A L. Significance of galactinol and raffinose family oligosaccharide synthesis in plants[J]. Frontiers in Plant Science, 2015, 6(656). DOI:10.3389/fpls.2015.00656 |
| [43] |
RUAN Y L. Sucrose metabolism: Gateway to diverse carbon use and sugar signaling[J]. Annual Review of Plant Biology, 2014, 65: 33-67. DOI:10.1146/annurev-arplant-050213-040251 |
| [44] |
AINSWORTH E A, BUSH D R. Carbohydrate export from the leaf: A highly regulated process and target to enhance photosynthesis and productivity[J]. Plant Physiology, 2011, 155(1): 64-9. DOI:10.1104/pp.110.167684 |
| [45] |
BRAUNER K, BIRAMI B, BRAUNER H A, HEYER A G. Diurnal periodicity of assimilate transport shapes resource allocation and whole-plant carbon balance[J]. Plant Journal, 2018, 94(5): 776-789. DOI:10.1111/tpj.13898 |
| [46] |
RENNIE E A, TURGEON R. A comprehensive picture of phloem loading strategies[J]. Proceedings of the National Academy of Sciences, 2009, 106(33): 14162-7. DOI:10.1073/pnas.0902279106 |
| [47] |
MA S, LI Y, LI X, SUI X, ZHANG Z. Phloem unloading strategies and mechanisms in crop fruits[J]. Journal of Plant Growth Regulation, 2019, 38(2): 494-500. DOI:10.1007/s00344-018-9864-1 |
| [48] |
HANDLEY L W, PHARR D M, MCFEETERS R F. Carbohydrate changes during maturation of cucumber fruit: Implications for sugar metabolism and transport[J]. Plant Physiology, 1983, 72(2): 498-502. DOI:10.1104/pp.72.2.498 |
| [49] |
REN Y, SUN H, ZONG M, GUO S, REN Z, ZHAO J, LI M, ZHANG J, TIAN S, WANG J, YU Y, GONG G, ZHANG H, HE H. Localization shift of a sugar transporter contributes to phloem unloading in sweet watermelons[J]. New Phytologist, 2020, 227(6): 1858-1871. DOI:10.1111/nph.16659 |
| [50] |
JING Y, LANG S, WANG D, XUE H, WANG X F. Functional characterization of galactinol synthase and raffinose synthase in desiccation tolerance acquisition in developing Arabidopsis seeds[J]. Journal of Plant Physiology, 2018, 230: 109-121. DOI:10.1016/j.jplph.2018.10.011 |
| [51] |
BERNAL-LUGO I, LEOPOLD A C. Seed stability during storage: Raffinose content and seed glassy state[J]. Seed Science Research, 1995, 5(2): 75-80. DOI:10.1017/s0960258500002646 |
| [52] |
NISHIZAWA A, YABUTA Y, SHIGEOKA S. Galactinol and raffinose constitute a novel function to protect plants from oxidative damage[J]. Plant Physiology, 2008, 147(3): 1251-63. DOI:10.1104/pp.108.122465 |
| [53] |
OBENDORF R L. Oligosaccharides and galactosyl cyclitols in seed desiccation tolerance[J]. Seed Science Research, 2008, 7(2): 63-74. DOI:10.1017/S096025850000341X |
| [54] |
LAHUTA L, RYBI SKI W, BOCIANOWSKI J, NOWOSAD K, B RNER A. Raffinose family oligosaccharides in seeds of common vetch (Vicia sativa L. ssp. sativa)[J]. Legume Research, 2019, 43: 512-517. DOI:10.18805/LR-491 |
| [55] |
ZHAO T Y, CORUM J, MULLEN J, MEELEY R B, HELENTJARIS T, MARTIN D, DOWNIE B. An alkaline α-galactosidase transcript is present in maize seeds and cultured embryo cells, and accumulates during stress[J]. Seed Science Research, 2006, 16(2): 107-121. DOI:10.1079/ssr2006243 |
| [56] |
POLOWICK P, BALISKI D, BOCK C, RAY H, GEORGES F. Over-expression of α-galactosidase in pea seeds to reduce raffinose oligosaccharide content[J]. Botany, 2009, 87: 526-532. DOI:10.1139/B09-020 |
| [57] |
BL CHL A, PETERBAUER T, RICHTER A. Inhibition of raffinose oligosaccharide breakdown delays germination of pea seeds[J]. Journal of Plant Physiology, 2007, 164(8): 1093-1096. DOI:10.1016/j.jplph.2006.10.010 |
| [58] |
FEURTADO J A, BANIK M, BEWLEY J D. The cloning and characterization of alpha-galactosidase present during and following germination of tomato (Lycopersicon esculentum Mill.) seed[J]. Journal of Experimental Botany, 2001, 53(359): 1239-49. DOI:10.1093/jxb/52.359.1239 |
| [59] |
SEKHAR K N, DEMASON D A. Identification and immunocytochemical localization of α-galactosidase in resting and germinated date palm (Phoenix dactylifera L.) seeds[J]. Planta, 1990, 181(1): 53-61. DOI:10.1007/bf00202324 |
| [60] |
HUGHES S G, OVERBEEKE N, ROBINSON S, POLLOCK K, SMEETS F L M. Messenger RNA from isolated aleurone cells directs the synthesis of an alpha-galactosidase found in the endosperm during germination of guar (Cyamopsis tetragonaloba) seed[J]. Plant Molecular Biology, 1988, 11(6): 783-789. DOI:10.1007/BF00019518 |
| [61] |
OKAZAWA A, BABA A, OKANO H, TOKUNAGA T, NAKAUE T, OGAWA T, SHIMMA S, SUGIMOTO Y, OHTA D. Involvement of α-galactosidase OmAGAL2 in planteose hydrolysis during seed germination of Orobanche minor[J]. Journal of Experimental Botany, 2022, 73(7): 1992-2004. DOI:10.1093/jxb/erab527 |
| [62] |
VANDENENDE W, VALLURU R. Sucrose, sucrosyl oligosaccharides, and oxidative stress: Scavenging and salvaging?[J]. Journal of Experimental Botany, 2009, 60(1): 9-18. DOI:10.1093/jxb/ern297 |
| [63] |
VANDENENDE W. Multifunctional fructans and raffinose family oligosaccharides[J]. Frontiers in Plant Science, 2013, 4: 247. DOI:10.3389/fpls.2013.00247 |
| [64] |
KNAUPP M, MISHRA K B, NEDBAL L, HEYER A G. Evidence for a role of raffinose in stabilizing photosystem Ⅱ during freeze–thaw cycles[J]. Planta, 2011, 234(3): 477-486. DOI:10.1007/s00425-011-1413-0 |
| [65] |
KLOTKE J, KOPKA J, GATZKE N, HEYER A G. Impact of soluble sugar concentrations on the acquisition of freezing tolerance in accessions of Arabidopsis thaliana with contrasting cold adaptation-evidence for a role of raffinose in cold acclimation[J]. Plant, Cell and Environment, 2004, 27(11): 1395-1404. DOI:10.1111/j.1365-3040.2004.01242.x |
| [66] |
MORSY M R, JOUVE L, HAUSMAN J F, HOFFMANN L, STEWART J M. Alteration of oxidative and carbohydrate metabolism under abiotic stress in two rice (Oryza sativa L.) genotypes contrasting in chilling tolerance[J]. Journal of Plant Physiology, 2007, 164(2): 157-67. DOI:10.1016/j.jplph.2005.12.004 |
| [67] |
N GELE T, HEYER A G. Approximating subcellular organisation of carbohydrate metabolism during cold acclimation in different natural accessions of Arabidopsis thaliana[J]. New Phytologist, 2013, 198(3): 777-787. DOI:10.1111/nph.12201 |
| [68] |
KELLER I, MUDSAM C, RODRIGUES C M, KISCHKA D, ZIERER W, SONNEWALD U, HARMS K, CZARNECKI O, FIEDLER-WIECHERS K, KOCH W, NEUHAUS H E, LUDEWIG F, POMMERRENIG B. Cold-triggered induction of ROS-and raffinose metabolism in freezing-sensitive taproot tissue of sugar beet[J]. Frontiers in Plant Science, 2021, 12: 715767. DOI:10.3389/fpls.2021.715767 |
| [69] |
SAITO M, YOSHIDA M. Expression analysis of the gene family associated with raffinose accumulation in rice seedlings under cold stress[J]. Journal of Plant Physiology, 2011, 168(18): 2268-2271. DOI:10.1016/j.jplph.2011.07.002 |
| [70] |
HAN Q, QI J, HAO G, ZHANG C, WANG C, DIRK L M A, DOWNIE A B, ZHAO T. ZmDREB1A regulates raffinose synthase controlling raffinose accumulation and plant chilling stress tolerance in maize[J]. Plant Cell Physiology, 2020, 61(2): 331-341. DOI:10.1093/pcp/pcz200 |
| [71] |
KHAN M, HU J, DAHRO B, MING R, ZHANG Y, WANG Y, ALHAG A, LI C, LIU J H. ERF108 from Poncirus trifoliata L. Raf. functions in cold tolerance by modulating raffinose synthesis through transcriptional regulation of PtrRafS[J]. Plant Journal, 2021, 108(3): 705-724. DOI:10.1111/tpj.15465 |
| [72] |
SUN Q, HUANG R, ZHU H, SUN Y, GUO Z. A novel Medicago truncatula calmodulin-like protein (MtCML42) regulates cold tolerance and flowering time[J]. Plant Journal, 2021, 108(4): 1069-1082. DOI:10.1111/tpj.15494 |
| [73] |
GU H, LU M, ZHANG Z, XU J, CAO W, MIAO M. Metabolic process of raffinose family oligosaccharides during cold stress and recovery in cucumber leaves[J]. Journal of Plant Physiology, 2018, 224-225: 112-120. DOI:10.1016/j.jplph.2018.03.012 |
| [74] |
DALDOUL S, AMAR A B, GARGOURI M, LIMAM H, MLIKI A, WETZEL T. A Grapevine-inducible gene Vv-α-gal/SIP confers salt and desiccation tolerance in escherichia coli and tobacco at germinative stage[J]. Biochemical Genetics, 2018, 56(1-2): 78-92. DOI:10.1007/s10528-017-9831-8 |
| [75] |
ZHANG B, GAO Y, ZHANG L, ZHOU Y. The plant cell wall: Biosynthesis, construction, and functions[J]. Journal of Integrative Plant Biology, 2021, 63(1): 251-272. DOI:10.1111/jipb.13055 |
| [76] |
肖京林, 覃美, 凌桂芝, 黎晓峰. 植物细胞壁对有害金属与盐分耐受性作用研究进展[J]. 广东农业科学, 2020, 47(9): 73-80. DOI:10.16768/j.issn.1004-874X.2020.09.010 XIAO J L, QIN M, LING G Z, LI X F. Advances in studies on the resistance of plant cell walls to harmful metals and salt[J]. Guangdong Agricultural Sciences, 2020, 47(9): 73-80. DOI:10.16768/j.issn.1004-874X.2020.09.010 |
| [77] |
HOUSTON K, TUCKER M R, CHOWDHURY J, SHIRLEY N, LITTLE A. The plant cell wall: A complex and dynamic structure as revealed by the responses of genes under stress conditions[J]. Frontiers in Plant Science, 2016, 7: 984. DOI:10.3389/fpls.2016.00984 |
| [78] |
AMOS R A, MOHNEN D. Critical review of plant cell wall matrix polysaccharide glycosyltransferase activities verified by heterologous protein expression[J]. Frontiers in Plant Science, 2019, 10. DOI:10.3389/fpls.2019.00915.eCollection2019 |
| [79] |
吴建阳, 何冰, 陈妹, 武爱龙, 李伟才, 魏永赞. 果实裂果机理研究进展与展望[J]. 广东农业科学, 2017, 44(4): 38-45. DOI:10.16768/j.issn.1004-874X.2017.04.007 WU J Y, HE B, CHEN M, WU A L, LI W C, WEI Y Z. Progress and prospects of mechanisms in fruit cracking[J]. Guangdong Agricultural Sciences, 2017, 44(4): 38-45. DOI:10.16768/j.issn.1004-874X.2017.04.007 |
| [80] |
SOH C P, ALI Z M, LAZAN H. Characterisation of an alpha-galactosidase with potential relevance to ripening related texture changes[J]. Phytochemistry, 2006, 67(3): 242-254. DOI:10.1016/j.phytochem.2005.09.032 |
| [81] |
GRANDIS A, LEITE D C C, TAVARES E Q P, ARENQUE-MUSA B C, GAIARSA J W, MARTINS M C M, DE SOUZA A P, GOMEZ L D, FABBRI C, MATTEI B, BUCKERIDGE M S. Cell wall hydrolases act in concert during aerenchyma development in sugarcane roots[J]. Annals of Botany, 2019, 124(6): 1067-1089. DOI:10.1093/aob/mcz099 |
| [82] |
SOZZI G, CAMPERI S A, CASCONE O, FRASCHINA A A. Galactosidases in tomato fruit ontogeny: decreased galactosidase activities in antisense ACC synthase fruit during ripening and reversal with exogenous ethylene[J]. Australian Journal of Plant Physiology, 1998, 25: 237-244. DOI:10.1071/PP97124 |
| [83] |
陶爱群, 易干军, 石雪晖, 姜小文. 柑橘留树保鲜研究进展[J]. 广东农业科学, 2012, 39(24): 45-49. DOI:10.16768/j.issn.1004-874X.2012.24.056 TAO A Q, YI G J, SHI X H, JIANG X W. Overview of citrus storage on tree[J]. Guangdong Agricultural Sciences, 2012, 39(24): 45-49. DOI:10.16768/j.issn.1004-874X.2012.24.056 |
| [84] |
KONOZY E H E, CAUSSE M, FAUROBERT M. Cell wall glycosidase activities and protein content variations during fruit development and ripening in three texture contrasted tomato cultivars[J]. Saudi Journal of Biological Sciences, 2012, 19(3): 277-283. DOI:10.1016/j.sjbs.2012.04.006 |
| [85] |
ACHARJEE S, ZHANG Z P, LIU Y C, DAI H B, MIAO M M. Characteristics and expression patterns of six α-galactosidases in cucumber (Cucumis sativus L.)[J]. PLOS One, 2021, 16(1): e0244714. DOI:10.1371/journal.pone.0244714 |
| [86] |
DEMASON D A, MADORE M A, SEKHAR K N C, HARRIS M. Role of α-galactosidase in cell wall metabolism of date palm[J]. Protoplasma, 1992, 166: 177-184. DOI:10.1007/BF01322780 |
| [87] |
LEUNG D W, BEWLEY J D. A role for α-galactosidase in the degradation of the endosperm cell walls of lettuce seeds, cv. Grand Rapids[J]. Planta, 1983, 157: 274-277. DOI:10.1007/BF00405194 |
| [88] |
JO T T, LAFFARGUE A, SALMONA J, DOULBEAU S, DESCROIX F, BERTRAND B, LASHERMES P, DUSSERT S. Regulation of galactomannan biosynthesis in coffee seeds[J]. Journal of Experimental Botany, 2014, 65(1): 323-337. DOI:10.1093/jxb/ert380 |
| [89] |
PHOEURK C, SOMANA J, SORNWATANA T, UDOMPAISARN S, TRAEWACHIWIPHAK S, SIRICHAIYAKUL P, PHONGSAK T, ARTHAN D. Three novel mutations in α-galactosidase gene involving in galactomannan degradation in endosperm of curd coconut[J]. Phytochemistry, 2018, 156: 33-42. DOI:10.1016/j.phytochem.2018.08.015 |
| [90] |
OKAMOTO-NAKAZATO A. Implications of the galactosidase activity of yieldin in the regulatory mechanism of yield threshold that is fundamental to cell wall extension[J]. Physiologia Plantarum, 2018, 163(2): 259-266. DOI:10.1111/ppl.12687 |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49




