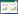文章信息
基金项目
- 广东省自然科学基金(2021A1515012490,2020A1515011330);广东省现代农业产业技术体系(2021KJ106,2021KJ110);广东省农业科学院项目(R2020PY-JX003,R2021YJ-YB3019,KTP20210064)
作者简介
- 梅文宇(1997—), 男, 在读硕士生, 研究方向为设施园艺学, E-mail: 513230810@qq.com.
通讯作者
- 李涛(1982—), 男, 博士, 副研究员, 研究方向为茄果类蔬菜抗性机理, E-mail: tianxing84@163.com; 孙光闻(1968—), 女, 博士, 副教授, 研究方向为设施园艺生理生态, E-mail: sungw1968@scau.edu.cn.
文章历史
- 收稿日期:2022-08-27
2. 华南农业大学园艺学院, 广东 广州 510642
2. College of Horticulture, South China Agricultural University, Guangzhou 510642, China
【研究意义】TCP转录因子是植物中特有的一类转录因子,能够响应激素、营养元素、生物和非生物逆境胁迫,在激素介导的植物细胞增殖及器官发育中起着重要作用[1]。【前人研究进展】 1999年Cubas等通过分析金鱼草草(Antirrhinum majus)中的CYC(CYCLOIDEA)蛋白与玉米中的TB1(TEOSINTE BRANCHED1)蛋白保守区域的二级结构,确定了一个相对保守的碱性螺旋- 环- 螺旋(basic helixloop-helix, bHLH)结构域,并利用首批成员金鱼草CYC、玉米TB1及水稻的PROLIFERATING CELL FACTOR 1和2(PCF1/ 2)将该家族正式命名为TCP家族[2]。TCP家族基因都具备由59个氨基酸组成的bHLH结构,该结构也被称为TCP结构域,TCP结构域主要参与DNA结合、蛋白互作[3]。根据核定位序列以及bHLH结构域第二个螺旋的长度等方面的差异,可将TCP转录因子分为Class Ⅰ TCP和Class Ⅱ TCP[4],I类和II类都包含转录激活因子和转录抑制因子[1]。根据TCP结构域内序列的不同,Class Ⅱ TCP又可以进一步分为CYC/TB1类TCP与CINCINNATA(CIN)类TCP[5]。相关研究已经证明TCP家族在各种植物中普遍存在,目前已经在拟南芥、水稻[5]、玉米[6]、小麦[7]、苹果[8]、黄瓜[9]、番茄[10]等多种植物中对TCP家族成员完成了鉴定。近年来,随着相关研究的开展发现TCP转录因子在植物的整个生长周期都有着重要作用,从种子萌发、器官分化发育、胁迫响应到激素调节等都离不开TCP家族的参与[11]。在拟南芥中,UP1是调节拟南芥腋芽生长的必须顺式元件,AtTCP14能够直接激活维管组织UP1介导的与发芽相关的基因表达调控胚胎生长[12]。AtTCP4能够通过调控转录激活抑制因子GIS(GLABROUS INFLORESCENCE STEMS) 基因的表达抑制调节南芥叶片和花序茎的毛状细胞的分支[13]。TCP蛋白能够直接与MYB-bHLHWD40(MBW)中关键成分GLABRA3(GL3)相互作用,干扰拟南芥子叶毛状体的发育[14]。高温下,拟南芥AtTCP5、AtTCP13、AtTCP17能与PIF4(PHYTOCHROMEINTER ACTING FACTOR 4)互作,增强其活性,促进拟南芥的热形态建成(下胚轴和叶柄的伸长)来适应高温[15-16]。在激素通路上,TCP转录因子在生长素[17]、赤霉素[18]、细胞分裂素[19]、脱落酸[20]、茉莉酸[21]、油菜素内酯[22]及水杨酸[23]等多种激素的生物合成、运输及信号转导途径上存在调控作用。【本研究切入点】茄子(Solanum melongena L.),一年生草本植物,原产温带与亚热带,其营养丰富,具有较高的食用与药用价值,也是仅位于马铃薯、番茄、辣椒后的第四大茄科作物[24]。随着茄果类基因组测序计划的完成,使得从基因组水平对茄果类重要基因家族及重要功能基因的分析和分子标记的开发成为可能,鉴于TCP家族在植物生长发育及环境适应上的重要性,深入研究TCP家族在逆境下的表达情况及不同器官间的表达差异,将有利于解析TCP家族逆境响应机制及其在植物生长发育过程中的重要作用。【拟解决的关键问题】本研究利用生物信息学方法对茄子TCP基因进行预测、挖掘,并对茄子TCP基因在胁迫及激素处理下进行表达分析,以期为深入研究茄子TCP基因的功能分析提供基础信息,进而为分子植物育种提供候选基因。
1 材料与方法 1.1 试验材料试验在广东省蔬菜新技术研究重点实验室进行,挑选饱满的茄子R06112种子,10% 次氯酸钠消毒20 min,随后用无菌水冲洗干净,播种于1/2MS固体培养基中,放置于光照培养箱,每日设置光照16 h、黑暗8 h,温度25 ℃,20 d后,茄子植株生长至四片真叶阶段时对植株进行胁迫及激素处理。不同器官组织表达材料种植于广东省农业科学院白云基地,约2~3个月后结出幼果,对同一发育时期的根、茎、叶、花及果各器官进行采样。
1.2 试验方法在1/2MS培养基的基础上开展胁迫处理和激素处理。非生物胁迫处理包括42 ℃高温处理、4 ℃低温处理、NaCl处理(浓度为200 mmol/L)、CdCl2处理(浓度为100 μmol/L);生物胁迫处理包括青枯菌处理,所有对照均为未经任何处理的茄子苗。激素处理包括ABA(100 μmol·/L)和SA(5 mmol/L)处理:分别将ABA、SA两种溶液喷洒于叶片,以喷施蒸馏水的叶片为对照,对所有处理的植株分0、1、2、8 h时间段的整株取样,3次重复取样,取样后立即置于液氮中,–80 ℃保存,用于激素及胁迫下的茄子TCP基因的响应表达。器官组织取样于播种后约60 d的茄子植株,分别取同一发育时期根、茎、叶、花、果等5个器官组织,用纯净水洗净,置于液氮中,用于进行茄子TCP基因的器官组织表达。
1.3 茄子基因家族序列检索和鉴定番茄和拟南芥的TCP基因家族成员下载自茄果类数据库SGN(https://solgenomics.net/)、拟南芥生物信息库TAIR(https://www.arabidopsis.org/),利用已知的拟南芥和番茄的蛋白序列为参考在茄子的全基因组数据库中进行blastp,设置E-value参数为0.001,得到候选的茄子TCP蛋白序列。并利用Pfam(http://pfam.xfam.org/)和SMART(http://smart.embl-heidelberg.de/)对其去除无DNA结合结构域和激活或抑制结构域的基因。在SGN(https://solgenomics.net/)中的茄子基因信息GFF3文件(assembly gff3 file)中提取SmTCP的染色体位置,并使用MapChart软件绘制家族基因的染色体位置。利用在线工具ProtParam(https://web.expasy.org/protparam/)和BUSCA(http://busca.biocomp.unibo.it/)预测蛋白的理化性质,SOPMA2.0软件预测二级结构,采用Phyre2.0进行同源建模分析。利用茄子TCP成员各自对应氨基酸序列,在网站BUSCA(http://busca.biocomp.unibo.it/)和网站Expasy的ProtParam工具(https://web.expasy.org/protparam/)分别得到茄子TCP成员的亚细胞定位和茄子TCP成员的等电点(pI)和分子量(Mw)。
1.4 茄子TCP的分类及系统进化分析使用默认设置的ClustalX(Version 2.1)软件对茄子、番茄和拟南芥的序列进行比对,再运用MEGA7中的邻近法(Neighbor Joining,NJ),构建茄子、番茄与拟南芥的TCP基因的系统进化树,使用1 000个重复进行bootstrap分析,并根据拟南芥的分类方法为茄子TCP成员进行分类。
1.5 保守基序的鉴定及结构分析利用MEME 4.6.1(http:meme.nbcr.net/meme/intro.html)在线平台进行茄子TCP蛋白中保守基序(motif)分析,最大motif检索数值定为20。并确定基序的P值、E值和基序在茄子TCP家族基因中出现的次数。
1.6 TCP家族基因的表达分析分子生物学试验在广东省蔬菜新技术研究重点实验室完成。采用Trizol(Invitrogen)法提取总RNA,经DNase I处理去除基因组DNA,使用NanoDrop 2000c分光光度计(Thermo)检测RNA样品的浓度和纯度。吸取1 μg RNA,反转录合成第1链cDNA,稀释4倍后做qRT- PCR模板。根据获得的SmTCP基因的cDNA序列及SGN数据库基因序列的比对结果,利用Oligo6.0设计引物(表 1),由英潍捷基(上海)生物公司合成。荧光实时定量PCR反应采用SYBR Green Realtime PCR Master Mix(Takara,大连)试剂盒,在Roche LightCycler 480仪器进行。反应体系为总体积10.0 μL,含SYBR Premix ExTaqTM Ⅱ(TliRNaseH Plus)(2×)5 μL、引物(10 μmol/L)各0.4 μL、cDNA模板1.0 μL、无菌双蒸馏水3.2 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火20 s,循环40次;融解曲线分析95 ℃ 0 s,65 ℃ 15 s,95 ℃ 0 s。采用2-∆∆CT方法计算非生物胁迫、激素处理以及各器官组织中的基因相对表达量,每个基因的表达反应3次重复,以SmActin作为内参基因。
|
2 结果与分析 2.1 茄子TCP基因家族成员的鉴定及理化特性
通过对茄子TCP基因家族成员进行筛选,最终确定32个SmTCP基因,暂将其命名为SmTCP1~SmTCP32(表 1)。编码SmTCP蛋白的氨基酸数目从111个(SmTCP3)到850个(SmTCP20),分子量从14 924.09 Da(SmTCP7)到89 598.03 Da(SmTCP3),等电点为5.25~10.03。这些蛋白的氨基酸长度和蛋白特性差异均较大,表明TCP家族成员特性不同,在生物学进程中发挥不同的作用。二级结构分析显示,这些蛋白α- 螺旋所占蛋白序列比例范围是24.48%,β- 折叠所占蛋白序列比例范围是7.38%,无规则卷曲所占蛋白序列比例范围是50.30%,延伸链的范围是17.84%,表明这些蛋白由这4种结构组成,且无规则卷曲是主要的存在形式。
SmTCP基因所在的染色体物理位置定位分析显示,32个基因随机不均匀分布在茄子12条染色体上(4号染色体除外)。分析发现,SmTCP基因大多位于染色体两端,仅3号染色体上的基因位于染色体中部。此外,1号染色体上的基因1和基因2所在的物理位点较近。
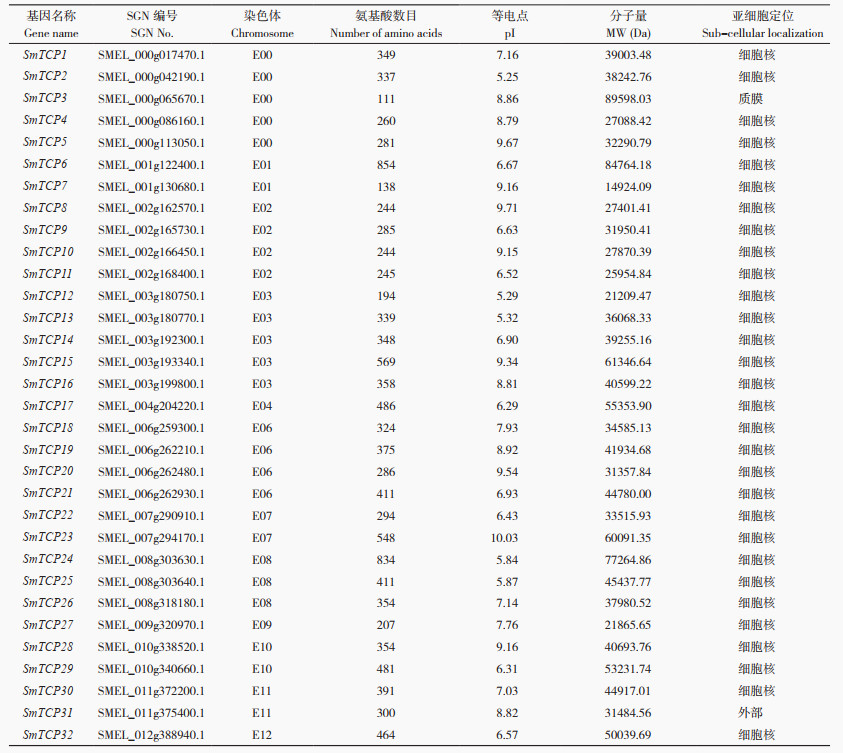
2.2 茄子TCP家族基因蛋白质系统进化分析为研究茄子TCP家族蛋白的进化关系,对拟南芥、番茄和茄子TCP家族氨基酸进行系统进化分析(图 1),TCP家族整体分为Class Ⅰ和Class Ⅱ两类,Class Ⅱ又分为CIN亚家族和CYC/ TB1亚家族,相同类型的TCP基因在进化树图中更相近,拟南芥的基因各亚类中基本聚类在一起,而番茄和茄子的TCP基因间的聚类较拟南芥相离较近;在Class Ⅰ中,茄子和番茄TCP基因有4个聚类在一起的分支(如SmTCP7和SmTCP13、SmTCP15和SmTCP21、SmTCP1和SmTCP15、SmTCP1和SmTCP21)。茄子和拟南芥TCP基因之间有3个聚类在一起的分支(如SmTCP11和AtTCP20、SmTCP18和AtTCP6、SmTCP32和AtTCP8)。茄子TCP基因之间有5个聚类在一起的分支(如SmTCP7和SmTCP13、SmTCP15和SmTCP21、SmTCP1和SmTCP15、SmTCP1和SmTCP21)。
|
| 图 1 茄子、拟南芥和番茄中TCP基因家族进化树 Fig. 1 Phylogenetic tree of TCP gene families in eggplant, Arabidopsis and tomato |
在Class Ⅱ中CIN亚家族中,茄子和番茄TCP基因有11个聚类在一起的分支(如SmTCP22和SlTCP10、SmTCP29和SlTCP3、SmTCP23和SlTCP2、SmTCP2和SlTCP1、SmTCP17和SlTCP30、SmTCP8和SlTCP28、SmTCP9和SlTCP5、SmTCP14和SlTCP4、SmTCP20和SlTCP6、SmTCP24和SlTCP24、SmTCP25和SlTCP29);茄子和拟南芥中只有3个聚类在一起的分支(SmTCP22和AtTCP10、SmTCP29和AtTCP10)。茄子TCP基因之间也只有3个聚类在一起的分支,如SmTCP2和SmTCP17、SmTCP14和SmTCP20、SmTCP24和SmTCP25;在Class Ⅱ中YC/TB1亚家族中,有6个SmTCP基因。其中茄子和番茄TCP基因中,包含3个聚类在一起的分支,如SmTCP16和SlTCP9、SmTCP30和SlTCP22、SmTCP28和SlTCP25;茄子和拟南芥的没有聚类在一起的分支。茄子TCP基因中SmTCP5和SmTCP10二者聚类在一起。
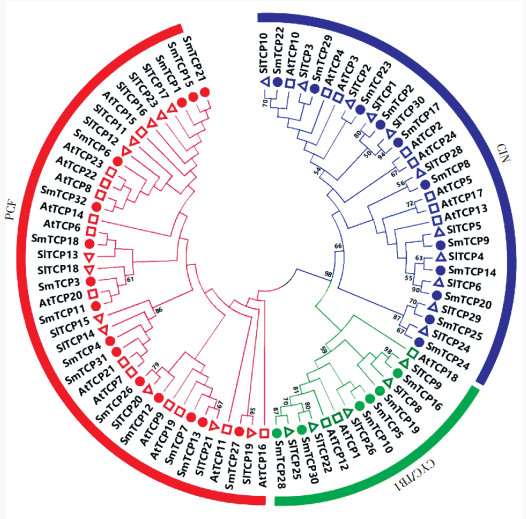
2.3 茄子TCP家族蛋白基序分析为进一步分析茄子TCP蛋白质氨基酸的保守性,利用MEME 4.6.1保守基序(motif)分析结果表明,在TCP家族家族中含有20个保守基序(表 2),通常聚类分析在一个亚族的蛋白质有着相似的motif组成,其中基序1~3共同组成TCP结构域(图 2),基本出现在所有茄子的TCP家族中;本研究根据拟南芥的分类标准将茄子TCP家族分为两类,其中Class Ⅱ又分为CIN亚家族和CYC/ TB1亚家族;根据拟南芥中Class Ⅰ的保守基序,预测茄子中该基序对应MEME预测的基序1,共有30个成员;本研究发现在番茄中CIN亚家族和CYC/TB1亚家族分别对应茄子的基序2和基序3;根据拟南芥TCP家族基序将茄子TCP分为Class Ⅰ和Class Ⅱ两类,Class Ⅱ又分为CIN亚家族(对应茄子基序2)和CYC/TB1亚家族(对应茄子基序3);其中这两个亚家族含有TCP蛋白序列数目不同,CIN亚家族含有的蛋白序列最多(图 1、表 2)。
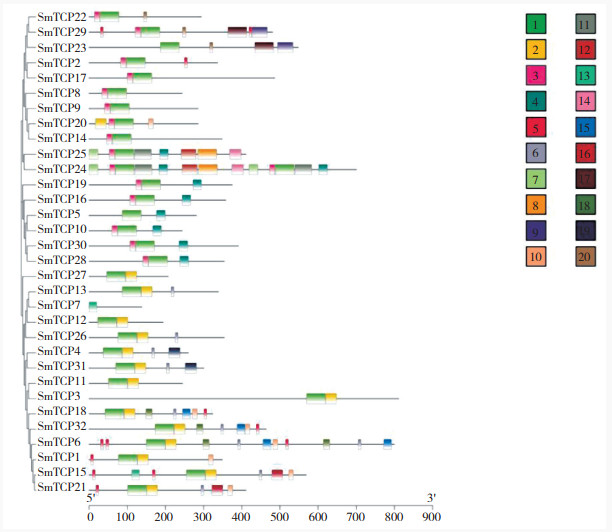
|
| 图 2 茄子TCP家族基因结构及保守基序 Fig. 2 Gene structure and conserved motifs of TCP family genes in eggplant |
2.4 茄子TCP基因家族在非生物胁迫、生物胁迫及激素处理下的表达
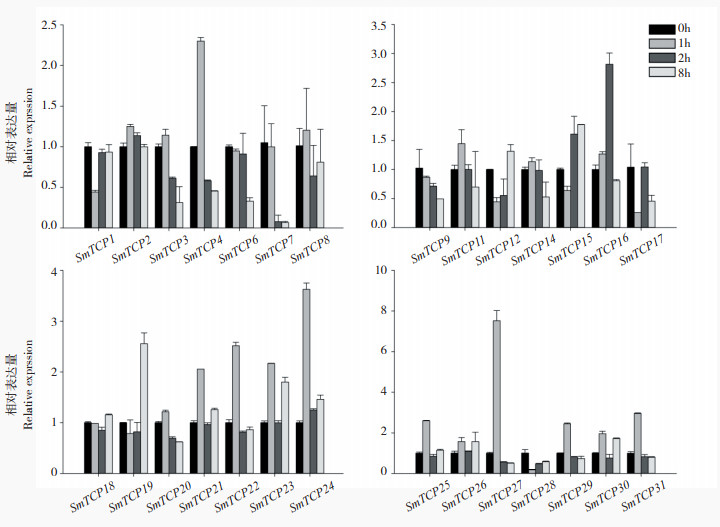
为检测茄子TCP基因对胁迫和激素处理的应答反应,本文利用Q-PCR分析了28个SmTCP基因(SmTCP5、SmTCP10、SmTCP32在样品中表达量过低、SmTCP12在全部样品中没有表达数据可能为假基因),在低温(4 ℃)、高温(42 ℃)、盐、重金属镉、青枯菌胁迫处理(图 3~ 图 7)以及ABA和SA的处理下的表达模式(图 8、图 9)。结果显示,在非生物胁迫处理的0~8 h,茄子TCP家族的表达均出现一些不同的趋势,其中高温处理相对于低温处理对茄子TCP家族表达影响更大(图 3)。在低温处理条件下,大多数TCP家族成员表达量并未出现明显变化,仅存在部分成员存在短暂升高后趋于正常的趋势(SmTCP4、SmTCP16、SmTCP21、SmTCP22、SmTCP24、SmTCP27、SmTCP29、SmTCP31)。
|
| 图 3 茄子TCP家族成员在低温胁迫下的表达分析 Fig. 3 Expression analysis of TCP family members in eggplant under low temperature stress |
|
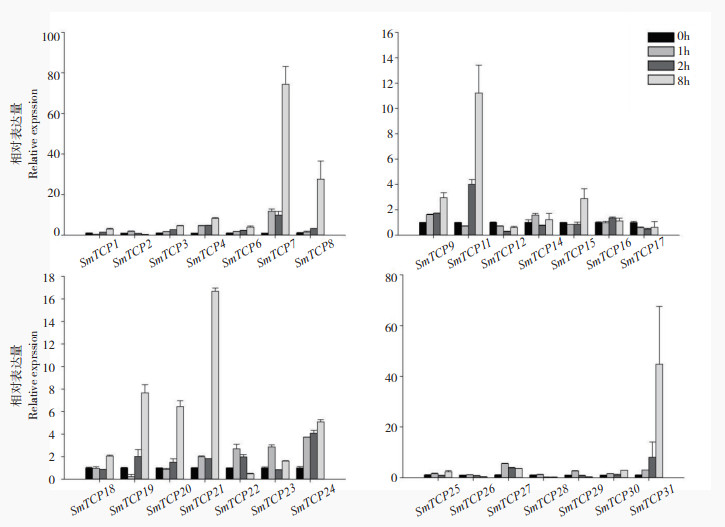
| 图 4 茄子TCP家族成员在高温胁迫下的表达分析 Fig. 4 Expression analysis of TCP family members in eggplant under high temperature stress |
|
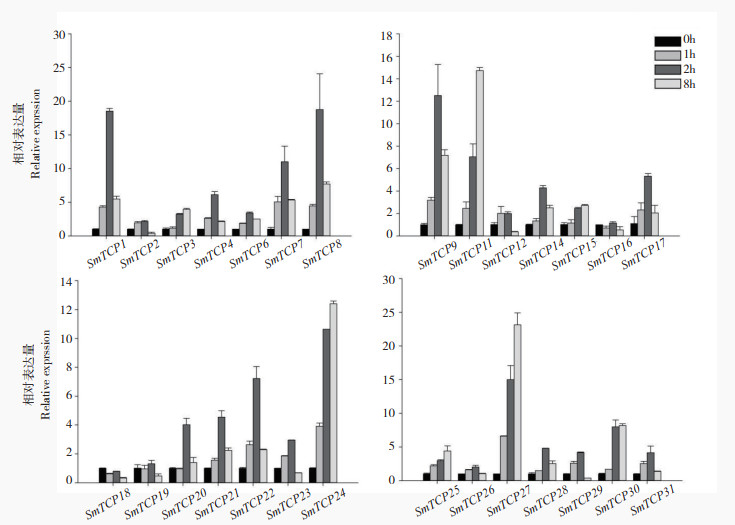
| 图 5 茄子TCP家族成员在盐胁迫下的表达分析 Fig. 5 Expression analysis of TCP family members in eggplant under salt stress |
|
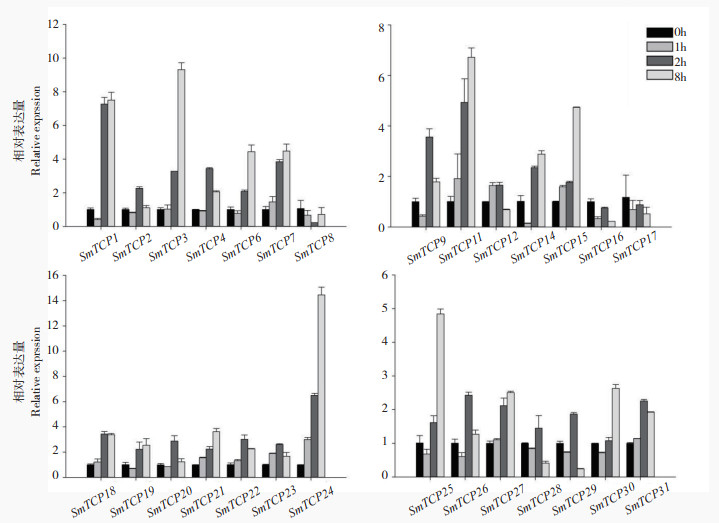
| 图 6 茄子TCP家族成员在镉胁迫下的表达分析 Fig. 6 Expression analysis of TCP family members in eggplant under cadmium stress |
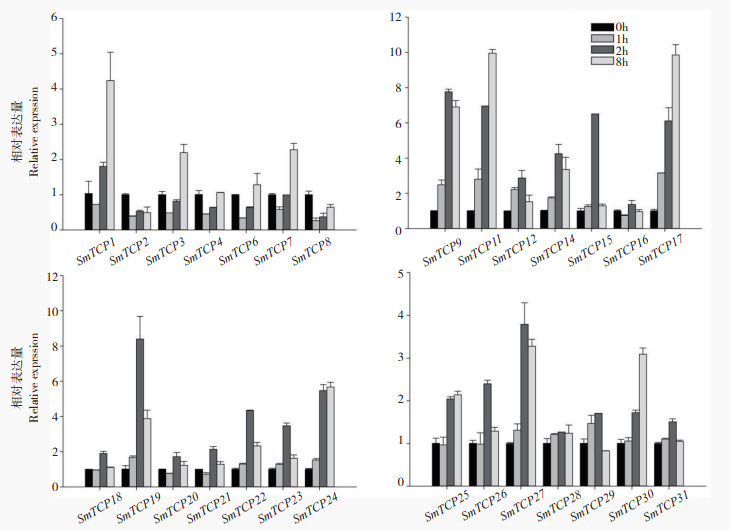
|
| 图 7 茄子TCP家族成员在青枯菌处理下的表达分析 Fig. 7 Expression analysis of TCP family members in eggplant under Pseudomonas a solanacearum treatment |
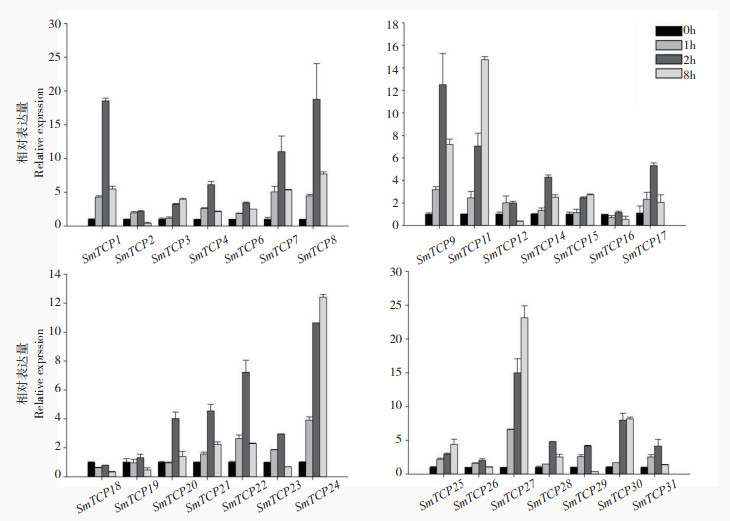
|
| 图 8 茄子TCP家族成员在ABA处理条件下的表达分析 Fig. 8 Expression analysis of TCP family members in eggplant under ABA treatment |
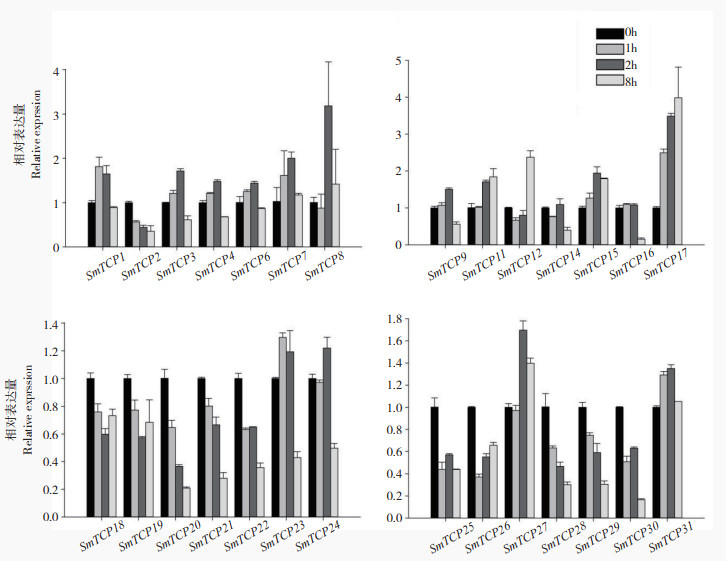
|
| 图 9 茄子TCP家族成员在SA处理条件下的表达分析 Fig. 9 Expression analysis of TCP family members in eggplant under SA treatment |
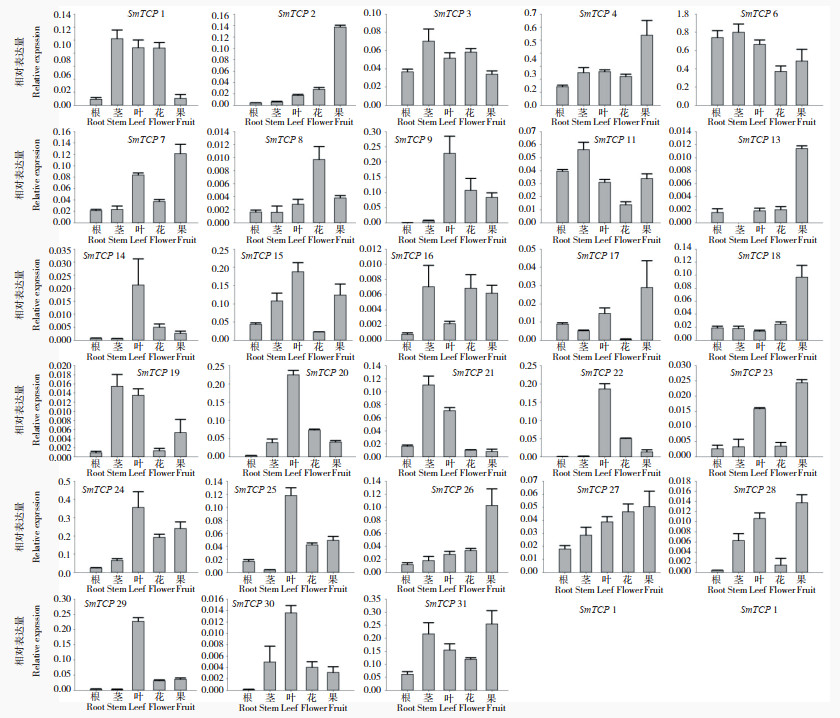
|
| 图 10 SmTCPs基因在茄子器官中的表达分析 Fig. 10 Expression analysis of SmTCPs genes in various organs of eggplant |
如图 4所示,在高温处理下多数成员呈现表达量持续增加的趋势(SmTCP1、SmTCP3、SmTCP4、SmTCP6、SmTCP7、SmTCP8、SmTCP11、SmTCP19、SmTCP20、SmTCP21、SmTCP24、SmTCP31),还有部分成员表达量呈先升高后降低的趋势(SmTCP2、SmTCP22、SmTCP26、SmTCP27、SmTCP29)。
与冷、热处理不同的是,盐处理与重金属镉处理后的茄子TCP家族成员表达趋势较为相近。如图 5所示,盐处理下,SmTCP1、SmTCP2、SmTCP4、SmTCP6、SmTCP8、SmTCP9、SmTCP13、SmTCP21、SmTCP22、SmTCP23、SmTCP26、SmTCP28、SmTCP29在0~8 h内表现出先增加后减少的趋势,SmTCP3、SmTCP11、SmTCP24、SmTCP25、SmTCP27、SmTCP30则表现出持续上调的趋势。
如图 6所示,镉处理下,SmTCP1、SmTCP4、SmTCP9、SmTCP13、SmTCP23、SmTCP26、SmTCP28、SmTCP29的相对处理表达量在0~8 h内表现出先增加后减少的趋势,SmTCP3、SmTCP6、SmTCP11、SmTCP15、SmTCP24、SmTCP25、SmTCP30表现出持续上调的趋势。
对茄子进行青枯菌处理下TCP家族成员表达的结果显示(图 7),茄子TCP家族在青枯菌处理下,SmTCP1、SmTCP9、SmTCP11、SmTCP17、SmTCP19、SmTCP24、SmTCP27、SmTCP30均存在较为明显的上调,SmTCP2、SmTCP3、SmTCP4、SmTCP6、SmTCP7、SmTCP8、SmTCP16等则短暂下调后逐渐恢复正常,其余成员在青枯菌处理下表达并未受到较大波动。
对茄子进行激素(ABA和SA)处理下TCP家族表达的结果显示(图 8、图 9),茄子TCP家族整体表达变化并不如胁迫处理明显。其中ABA处理下SmTCP1、SmTCP3、SmTCP6、SmTCP7、SmTCP11、SmTCP19、SmTCP24、SmTCP27存在持续上调的表现,SmTCP13、SmTCP16持续下调。
与ABA处理不同的是,SA处理后的茄子TCP家族表达量整体呈现下降趋势,其中仅SmTCP8、SmTCP17存在上调表现,SmTCP2、SmTCP20、SmTCP21、SmTCP22、SmTCP28、SmTCP29、SmTCP30则呈现持续下调。
2.5 茄子TCP基因家族在不同器官的表达对28个SmTCP成员进行组织表达分析发现,除SmTCP13在茎中没有表达外,其他27个SmTCP在根、茎、叶、花、果中均有表达,但在不同器官内表达情况存在明显差异。其中在根中SmTCP成员表达量明显低于其他器官,仅SmTCP6、SmTCP11在根中表达较高,SmTCP1、SmTCP3、SmTCP6、SmTCP11、SmTCP16、SmTCP19、SmTCP21、SmTCP31在茎中的表达量较高,SmTCP1、SmTCP7、SmTCP9、SmTCP14、SmTCP15、SmTCP19、SmTCP20、SmTCP22、SmTCP24、SmTCP25、SmTCP27、SmTCP29、SmTCP30在叶中的表达量较高,SmTCP1、SmTCP3、SmTCP8、SmTCP16、SmTCP27在花中的表达量较高,SmTCP2、SmTCP4、SmTCP7、SmTCP13、SmTCP17、SmTCP18、SmTCP23、SmTCP26、SmTCP27、SmTCP28、SmTCP31在果中的表达量较高。可见,SmTCPs在茄子的叶与果中表达量更高,这些基因可能与茄子叶片以及果实的发育相关。
3 讨论自1999年Cubus首次提出TCP家族以来,随着相关研究的开展,目前TCP转录因子已经在多种植物中完成鉴定。本研究通过对茄子全基因组数据库进行检索,共鉴定出32个茄子TCP基因家族成员,进一步对茄子TCP蛋白的理化性质分析发现,氨基酸数量最少的为SmTCP3,由111个氨基酸组成;氨基酸数量最多的为SmTCP20、由850个氨基酸组成。茄子TCP蛋白平均氨基酸数量为315,19位家族成员等电点大于7,13位成员等电点小于7,证明茄子TCP蛋白中碱性氨基酸数量多于酸性氨基酸。通过拟南芥、番茄、茄子TCP转录因子家族基因的进化树分析,发现茄子与番茄的TCP基因序列相似性较高,茄子与番茄TCP成员中有14个聚类分支,而茄子与拟南芥中只出现5个聚类分支。番茄中的SlTCP26与茄子的SmTCP5及SmTCP26聚类在同一分支,Wei等[25]发现SlTCP26基因在调控番茄的分支中具有必不可少的作用,该基因与ABA与IAA参与的侧枝分枝相关。可见茄子中的SmTCP5和SmTCP26与IAA与ABA的信号途径之间可能存在关联。
TCP转录因子在植物的生长发育过程中,起重要调控作用,不仅与植物生长相关,还影响器官发育、环境适应性的形态建成等。叶片是植物进行光合作用的主要场所,由茎尖分生组织生成,拟南芥中的AtTCP3能够直接调控miR164、AS1等基因的表达,从而抑制茎分生组织的形成,拟南芥中CIN类TCP在产生不同叶片形态的信号通路中发挥重要作用,且该类基因在调控叶片形状的功能上高度冗余[26-27]。TCP家族不仅参与叶片器官的发育,在花、侧枝的发育中也发挥作用,在金鱼草中CYC基因能够调控花器官的对称性发育,CYC突变体的金鱼草花朵会产生半幅射状的花朵[28]。在豌豆中TCP转录因子PsBRC1能够作用于独脚金内酯下游控制枝条的分支[29]。在自然环境中,随着环境改变,植物需要通过改变自身的形态从而适应环境,例如避荫反应、热形态建成等从而顺利地完成整个生活史[30]。在阴暗条件下,拟南芥中AtTCP5、AtTCP13、AtTCP17能够通过直接介导光敏色素相互作用因子(PIFs)和生长素合成基因的表达促进下胚轴伸长,其三重突变体在阴暗条件下的下胚轴伸长长度明显降低[31]。AtTCP2能够响应蓝光,正向调控拟南芥HY5(ELONGATED HYPOCOTYL 5)/HYH(HY5-HOMOLOG)表达,并且AtTCP2能够与拟南芥隐色素蛋白(cryptochrome, CRY)互作,影响植物的光形态建成[32]。在高温下,AtTCP5、AtTCP13、AtTCP17通过与PIF4互作,促进拟南芥的热形态建成[15-16]。本研究表明,各处理中茄子TCP基因在热胁迫、盐胁迫及ABA处理下各成员响应较为明显,考虑到已有的报道中TCP家族在胁迫响应中的形态建成作用,推测TCP家族成员可能参与茄子应对不良环境的形态改变。器官组织表达结果显示,在茄子叶片与果实中SmTCP表达量较其他组织更高,联系已报道TCP家族在植物叶片发育中的重要作用,SmTCP可能参与茄子叶片以及果实的发育。
植物在多种胁迫反应下,会产生花青素作为保护色素[33],例如强光条件下,花青素能够保护细胞避免受损,在强光照射下,拟南芥AtTCP15及相关Class Ⅰ类TCP能够调节花青素的积累。此外,AtTCP15的TCP结构域中20号半胱氨酸在氧化胁迫条件下能够发生氧化,暗示TCP蛋白可能参与ROS介导的信号转导过程[34]。在高温环境下,植物茎部伸长从而适应热环境,这种反应与PIF4、生长素、热形态建成之间存在紧密的联系[35],SAUR(Small auxin up-regulated RNA)是一类生长素早期响应基因,生长素的升高会引起拟南芥下胚轴中SAUR靶基因的表达,促进下胚轴的伸长[36]。正常温度下,拟南芥AtTCP14、AtTCP15突变体中,SAUR19亚家族中的SARU20、SAUR21表达不受影响,但在高温环境下,突变体中该基因的表达会下调且下胚轴伸长长度会明显短于野生型,证明SAUR基因在高温环境下的响应依赖AtTCP14与AtTCP15的表达[37]。综合前文中提到Class Ⅱ TCP中的AtTCP5、AtTCP13、AtTCP17与PIF4发生互作,增强其转录活性促进拟南芥的热形态建成,表明TCP是植物的热形态建成过程中重要的调控因子。然而到目前为止,有关TCP转录因子的研究仍然处于初始阶段,大多数成员的功能尚不清晰。尽管越来越多的证据显示,TCP家族在植物应对环境变化、生物胁迫等方面存在重要作用,但TCP家族成员高度冗余的特性也增加了相关研究进一步开展的难度[38-39]。
4 结论本研究发现,茄子TCP蛋白的蛋白序列信息、二级结构存在较大差别,茄子32个TCP家族成员广泛而非均匀分布于茄子的12条染色体上;亲缘关系相近的番茄和茄子具有更多的聚类分支;本研究中,茄子TCP家族能够响应4种非生物胁迫及青枯菌胁迫。尤其在高温处理下,Class Ⅰ类TCP中多数成员包括SmTCP1、SmTCP3、SmTCP4、SmTCP6、SmTCP7、SmTCP11 、SmTCP15、SmTCP18 SmTCP21、SmTCP27、SmTCP31均存在较为明显的上调,因此茄子Class Ⅰ类TCP在高温及相关胁迫响应中可能具有重要作用。激素处理下,茄子TCP对ABA处理存在一定上调响应,SA处理下则整体出现下调表现。不同器官与组织间SmTCP表达量存在较大区别,整体而言SmTCP在叶片与果实中的表达量较高。但截至目前,有关TCP转录因子与植物耐逆性方面的研究仍然处于起步阶段。研究发现有关TCP家族在胁迫处理下的表现暗示TCP家族与植物逆境响应之间存在密切联系,研究结果为进一步探究茄子TCP基因的生物学功能及茄子的分子生物育种具有一定参考作用。
| [1] |
MANASSERO N G, VIOLA I L, WELCHEN E, GONZALEZ D H. TCP transcription factors: architectures of plant form[J]. Biomolecular Concepts, 2013, 4(2): 111-127. DOI:10.1515/bmc-2012-0051 |
| [2] |
CUBAS P, LAUTER N, DOEBLEY J, COEN E. The TCP domain: a motif found in proteins regulating plant growth and development[J]. The Plant Journal, 1999, 18(2): 215-222. DOI:10.1046/j.1365-313X.1999.00444.x |
| [3] |
MARTÍN-TRILLO M, CUBAS P. TCP genes: a family snapshot ten years later[J]. Trends in Plant Science, 2010, 15(1): 31-39. DOI:10.1016/j.tplants.2009.11.003 |
| [4] |
DANISMAN S. TCP transcription factors at the interface between environmental challenges and the plant's growth responses[J]. Frontiers in Plant Science, 2016, 7: 1930. DOI:10.3389/fpls.2016.01930 |
| [5] |
YAO X, MA H, WANG J, ZHANG D. Genome-wide comparative analysis and expression pattern of TCP gene families in Arabidopsis thaliana and Oryza sativa[J]. Journal of Integrative Plant Biology, 2007, 49(6): 885-897. DOI:10.1111/j.1744-7909.2007.00509.x |
| [6] |
CHAI W, JIANG P, HUANG G, JIANG H, LI X. Identification and expression profiling analysis of TCP family genes involved in growth and development in maize[J]. Physiology and Molecular Biology of Plants, 2017, 23(4): 779-791. DOI:10.1007/s12298-017-0476-1 |
| [7] |
ZHAO J, ZHAI Z, LI Y, GENG S, SONG G, GUAN J, JIA M, WANG F, SUN G, FENG N, KONG X, CHEN L, MAO L, LI A. Genome-wide identification and expression profiling of the tcp family genes in spike and grain development of wheat (Triticum aestivum L.)[J]. Frontiers in Plant Science, 2018, 9: 1282. DOI:10.3389/fpls.2018.01282 |
| [8] |
XU R, SUN P, JIA F, LU L, LI Y, ZHANG S, HUANG J. Genomewide analysis of TCP transcription factor gene family in Malus domestica[J]. Journal of Genetics, 2014, 93(3): 733-746. DOI:10.1007/s12041-014-0446-0 |
| [9] |
WEN H, CHEN Y, DU H, ZHANG L, ZHANG K, HE H, PAN J, CAI R, WANG G. Genome-wide identification and characterization of the tcp gene family in cucumber (Cucumis sativus L.) and their transcriptional responses to different treatments[J]. Genes, 2020, 11(11): 1379. DOI:10.3390/genes11111379 |
| [10] |
PARAPUNOVA V, BUSSCHER M, BUSSCH ER-LANGE J, LAMMERS M, KARLOVA R, BOVY A G, ANGENENT G C, DE MAAGD R A. Identification, cloning and characterization of the tomato TCP transcription factor family[J]. BMC Plant Biology, 2014, 14(1): 1-17. DOI:10.1186/1471-2229-14-157 |
| [11] |
NICOLAS M, CUBAS P. TCP factors: new kids on the signaling block[J]. Current Opinion in Plant Biology, 2016, 33: 33-41. DOI:10.1016/j.pbi.2016.05.006 |
| [12] |
TATEMATSU K, NAKABAYASHI K, KAMIYA Y, NAMBARA E. Transcription factor AtTCP14 regulates embryonic growth potential during seed germination in Arabidopsis thaliana[J]. The Plant Journal, 2008, 53(1): 42-52. DOI:10.1111/j.1365-313X.2007.03308.x |
| [13] |
VADDE B V L, CHALLA K R, NATH U. The TCP4 transcription factor regulates trichome cell differentiation by directly activating GLABROUS INFLORESCENCE STEMS in Arabidopsis thaliana[J]. The Plant Journal, 2018, 93(2): 259-269. DOI:10.1111/tpj.13772 |
| [14] |
LAN J, ZHANG J, YUAN R, YU H, AN F Y, SUN L H, CHEN H D, ZHOU Y, QIAN W Q, HE H, QIN G J. TCP transcription factors suppress cotyledon trichomes by impeding a cell differentiation-regulating complex[J]. Plant Physiology, 2021, 186(1): 434-451. DOI:10.1093/plphys/kiab053 |
| [15] |
HAN X, YU H, YUAN R, YANG Y, AN F, QIN G. Arabidopsis transcription factor TCP5 controls plant thermomorphogenesis by positively regulating PIF4 activity[J]. Iscience, 2019, 15: 611-622. DOI:10.1016/j.isci.2019.04.005 |
| [16] |
ZHOU Y, XUN Q, ZHANG D, LV M, OU Y, LI J. TCP transcription factors associate with PHYTOCHROME INTERACTING FACTOR 4 and CRYPTOCHROME 1 to regulate thermomorphogenesis in Arabidopsis thaliana[J]. Iscience, 2019, 15: 600-610. DOI:10.1016/j.isci.2019.04.002 |
| [17] |
LI S, ZACHGO S. TCP 3 interacts with R2R3-MYB proteins, promotes flavonoid biosynthesis and negatively regulates the auxin response in Arabidopsis thaliana[J]. The Plant Journal, 2013, 76(6): 901-913. DOI:10.1111/tpj.12348 |
| [18] |
RESENTINI F, FELIPO-BENAVENT A, COLOMBO L, BLAZQUEZ RODRIGUEZ M A, ALABADÍ DIEGO D, MASIERO S. TCP14 and TCP15 mediate the promotion of seed germination by gibberellins in Arabidopsis thaliana[J]. Molecular Plant, 2015, 8(3): 482-485. DOI:10.1016/j.molp.2014.11.018 |
| [19] |
LUCERO L E, UBERTI-MANASSERO N G, ARCE A L, COLOMBATTI F, ALEMANO S G, GONZALEZ D H. TCP15 modulates cytokinin and auxin responses during gynoecium development in Arabidopsis[J]. The Plant Journal, 2015, 84(2): 267-282. DOI:10.1111/tpj.12992 |
| [20] |
MUKHOPADHYAY P, TYAGI A K. OsTCP19 influences developmental and abiotic stress signaling by modulatingABI4-mediated pathway[J]. Scientific Reports, 2015, 5(1): 9998. DOI:10.1038/srep12381 |
| [21] |
SCHOMMER C, PALATNIK J F, AGGARWAL P, CHÉTELAT A, CUBAS P, FARMER E E, NATH U, WEIGEL D. Control of jasmonate biosynthesis and senescence by miR319 targets[J]. Plos Biology, 2008, 6(9): e230. DOI:10.1371/journal.pbio.0060230 |
| [22] |
GAO Y, ZHANG D, LI J. TCP1 modulates DWF4 expression via directly interacting with the GGNCCC motifs in the promoter region of DWF4 in Arabidopsis thaliana[J]. Journal of Genetics and Genomics, 2015, 42(7): 383-392. DOI:10.1016/j.jgg.2015.04.009 |
| [23] |
WANG X, GAO J, ZHU Z, DONG X, WANG X, REN G, ZHOU X, KUAI B. TCP transcription factors are critical for the coordinated regulation of isochorismate synthase 1 expression in Arabidopsis thaliana[J]. The Plant Journal, 2015, 82(1): 151-162. DOI:10.1111/tpj.12803 |
| [24] |
李涛, 孙保娟, 李植良, 黎振兴, 罗少波, 徐小万, 衡周, 宫超, 游倩. 茄子对青枯病的抗性机制研究现状与展望[J]. 广东农业科学, 2021, 48(9): 40-50. DOI:10.16768/j.issn.1004-874X.2021.09.005 LI T, SUN B J, LI Z L, LI Z X, LUO S B, XU X W, HENG Z, GONG C, YOU Q. Research status and prospects of resistance mechanism of eggplant to bacterial wilt[J]. Guangdong Agricultural Sciences, 2021, 48(9): 40-50. DOI:10.16768/j.issn.1004-874X.2021.09.005 |
| [25] |
WEI X, YANG J, LEI D, FENG H, YANG Z, WEN G, HE Z, ZENG W, ZOU J. The SlTCP26 promoting lateral branches development in tomato[J]. Plant Cell Reports, 2021, 1-12. DOI:10.1007/s00299-021-02694-5 |
| [26] |
KOYAMA T, MITSUDA N, SEKI M, SHINOZAKI K, OHME-TAKAGI M. TCP transcription factors regulate the activities of ASYMMETRIC LEAVES1 and miR164, as well as the auxin response, during differentiation of leaves in Arabidopsis[J]. The Plant Cell, 2010, 22(11): 3574-3588. DOI:10.1105/tpc.110.075598 |
| [27] |
AGUILAR MARTINEZ J A, SINHA N R. Analysis of the role of Arabidopsis class Ⅰ TCP genes AtTCP7, AtTCP8, AtTCP22, and AtTCP23 in leaf development[J]. Frontiers in Plant Science, 2013, 4: 406. DOI:10.3389/fpls.2013.00406 |
| [28] |
LUO D, CARPENTER R, VINCENT C, COPSEY L, COEN E. Origin of floral asymmetry in Antirrhinum[J]. Nature, 1996, 383(6603): 794-799. DOI:10.1038/383794a0 |
| [29] |
BRAUN N, DE SAINT GERMAIN A, PILLOT J P, BOUTET M S, DALMAIS M, ANTONIADI I, LI X, MAIA G A, LE SIGNOR C, BOUTEILLER N. The pea TCP transcription factor PsBRC1 acts downstream of strigolactones to control shoot branching[J]. Plant Physiology, 2012, 158(1): 225-238. DOI:10.1104/pp.111.182725 |
| [30] |
周峰. 植物避荫反应信号转导途径研究进展[J]. 广东农业科学, 2014, 41(22): 141-145. DOI:10.16768/j.issn.1004-874x.2014.22.006 ZHOU F. Research progress on signal transduction pathways of plant shade avoidance response[J]. Guangdong Agricultural Sciences, 2014, 41(22): 141-145. DOI:10.16768/j.issn.1004-874x.2014.22.006 |
| [31] |
ZHOU Y, ZHANG D, AN J, YIN H, FANG S, CHU J, ZHAO Y, LI J. TCP transcription factors regulate shade avoidance via directly mediating the expression of both PHYTOCHROME INTERACTING FACTORs and auxin biosynthetic genes[J]. Plant Physiology, 2018, 176(2): 1850-1861. DOI:10.1104/pp.17.01566 |
| [32] |
HE Z, ZHAO X, KONG F, ZUO Z, LIU X. TCP2 positively regulates HY5/HYH and photomorphogenesis in Arabidopsis[J]. Journal of Experimental Botany, 2016, 67(3): 775-785. DOI:10.1093/jxb/erv495 |
| [33] |
聂鑫, 陈国平, 张利, 李再新, 谢万如, 赵志平. 花青素合成转录因子表达载体的构建及遗传转化油菜研究[J]. 广东农业科学, 2014, 41(11): 149-153, 237. DOI:10.16768/j.issn.1004-874X.2014.11.018.j.issn.1004-874X.2014.11.018 NIE X, CHEN G P, ZHANG L, LI Z X, XIE W R, ZHAO Z P. Construction of expression vector of anthocyanin synthesis transcription factor and study on genetic transformation of rapeseed[J]. Guangdong Agricultural Sciences, 2014, 41(11): 149-153, 237. DOI:10.16768/j.issn.1004-874X.2014.11.018.j.issn.1004-874X.2014.11.018 |
| [34] |
VIOLA I L, CAMOIRANO A, GONZALEZ D H. Redox-dependent modulation of anthocyanin biosynthesis by the TCP transcription factor TCP15 during exposure to high light intensity conditions in Arabidopsis[J]. Plant Physiology, 2016, 170(1): 74-85. DOI:10.1104/pp.15.01016 |
| [35] |
STAVANG J A, GALLEGO-BARTOLOMÉ J, GÓMEZ M D, YOSHIDA S, ASAMI T, OLSEN J E, GARCÍA-MARTÍNEZ J L, ALABADÍ D, BLÁZQUEZ M A. Hormonal regulation of temperature-induced growth in Arabidopsis[J]. The Plant Journal, 2009, 60(4): 589-601. DOI:10.1111/J.1365-313X.2009.03983.X |
| [36] |
FRANKLIN K A, LEE S H, PATEL D, KUMAR S V, SPARTZ A K, GU C, YE S, YU P, BREEN G, COHEN J D. Phytochrome-interacting factor 4 (PIF4) regulates auxin biosynthesis at high temperature[J]. Proceedings of the National Academy of Sciences, 2011, 108(50): 20231-20235. DOI:10.1073/pnas.1110682108 |
| [37] |
FERRERO L V, GASTALDI V, ARIEL F D, VIOLA I L, GONZALEZ D H. Class I TCP proteins TCP14 and TCP15 are required for elongation and gene expression responses to auxin[J]. Plant Molecular Biology, 2021, 105(1): 147-159. DOI:10.1007/s11103-020-01075-y |
| [38] |
DANISMAN S, VAN DIJK A D, BIMBO A, VAN DER WAL F, HENNIG L, DE DER WAL S, ANGENENT G C, IMMINK R G. Analysis of functional redundancies within the Arabidopsis TCP transcription factor family[J]. Journal of Experimental Botany, 2013, 64(18): 5673-5685. DOI:10.1093/jxb/ert337 |
| [39] |
陈博雯, 肖玉菲, 李军集, 张烨, 覃子海, 张晓宁, 刘海龙. EuCAD基因小片段RNAi对烟草木质素合成的影响[J]. 广东农业科学, 2020, 47(6): 1-7. DOI:10.16768/j.issn.1004-874X.2020.06.001 CHEN B W, XIAO Y F, LI J J, ZHANG Y, QIN Z H, ZHANG X N, LIU H L. Effect of RNA interference triggered by small fragment of EuCAD Gene on lignin synthesis in tobacco[J]. Guangdong Agricultural Sciences, 2020, 47(6): 1-7. DOI:10.16768/j.issn.1004-874X.2020.06.001 |
(责任编辑 白雪娜)
 2022, Vol. 49
2022, Vol. 49