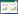文章信息
基金项目
- 云南省重大科技专项计划项目(202002AE32005,202102AE090021)
作者简介
- 魏茂琼(1987—),女,硕士,助理研究员,研究方向为快速检测技术,E-mail:295765999@qq.com.
通讯作者
- 刘宏程(1975—),男,博士,研究员,研究方向为污染物分析,E-mail:liuro@163.com.
文章历史
- 收稿日期:2022-08-05
2. 农业农村部农产品质量安全风险评估实验室(昆明),云南 昆明 650223;
3. 大理州烟草公司祥云县分公司芮家烟站,云南 大理 672100
2. Laboratory of Quality and Safety Risk Assessment for Agro-product, Ministry of Agriculture and Rural Affairs (Kunming), Kunming 650223, China;
3. Ruijia Cigarette Station, Xiangyun County Branch of Dali Tobacco Company, Dali 672100, China
【研究意义】环境中残留的农药直接影响人体健康[1]。有机磷农药使用量大[2-3],且毒性强,是环境中残留农药检出较高的农药之一[4]。毒死蜱,即O, O -二乙基-O-(3, 5, 6-三氯-2-吡啶基)硫代磷酸酯,又名氯吡硫磷,是一种中等毒性的有机磷农药。由于毒死蜱广泛使用及具有较好的稳定性,因此在很多国家和地区的环境介质中均已检测到其残留[3],可见,快速检测毒死蜱对保障人类身体健康非常重要。【前人研究进展】土壤是毒死蜱的主要环境介质[5],在土壤中毒死蜱可以发生吸附作用及光降解、微生物降解等作用。土壤中毒死蜱的半衰期为6.3 h至100 d,半衰期期间带来了毒死蜱在环境中的积累。农药在田间施用后约10% 作用于作物,80%~90% 将进入土壤。曾阿莹等[6]研究了我国福州某蔬菜基地43个土壤样品中有机磷类农药残留,检测结果显示,毒死蜱的最大残留量为9.77 mg/kg,检出率高达97.7%。在美洲附近的海洋沉积物,甚至在北极圈土壤样品中均检出毒死蜱[7-8]。毒死蜱可通过地表径流或田面主动排水进入河流湖泊,从而造成水体污染。调查发现,太湖水体的毒死蜱质量浓度区间为nd(未检出)~13.6 μg/L,平均值达4.8 μg/L[9]。我国《生活饮用水卫生标准》 (GB5749-2006)规定毒死蜱的限值是0.03 mg/L。目前,毒死蜱农药的检测方法主要有色谱法[10-11]、色谱-质谱联用法[12]、光谱分析法[13]、电化学法[14-15]、免疫分析法[16-17]和酶抑制法[18]等。这些检测方法存在一些缺点,如色谱法仪器成本高、操作复杂、对专业人员要求高、检测周期长、前处理复杂等[19],不能应对田间地头等检测场景;光谱分析法虽然操作简单,但仪器设备昂贵;电化学法检测灵敏快速,但检测物中的氨基酸、蛋白质等成分会干扰农药检测效果[20]。【本研究切入点】酶联免疫吸附法(ELISA)以血清和抗原的特异性结合为基础,方法灵敏度高、反应时间短、专一性强,对检测人员专业性和环境的要求不高,检测装置价格低,更加适合现场大量样品的筛查。【拟解决的关键问题】本研究采用ELISA方法快速检测环境中的毒死蜱,从灵敏度、交叉反应及有机溶剂对抗体的影响等方面研究建立间接竞争ELISA酶联免疫检测法。通过快速检测方法实现对土壤、水体等基质中毒死蜱残留的现场监测,保障环境质量安全,为环保部门提供一种低成本、快速简便的分析方法。
1 材料与方法 1.1 试验材料甲醇(色谱纯,德国Merck公司),96孔板(Costar公司),TMB双组份显色试剂盒(北京索莱宝科技有限公司),活性炭(DIKMA公司),毒死蜱抗原、毒死蜱抗体(深圳市科捷实业发展有限公司),羊抗鼠IgG-HRP(Biosharp公司),毒死蜱标准品(农业农村部环境保护科研监测所,100 μg/mL),无水醋酸钠、磷酸氢二钠、磷酸二氢钾、氯化钾、无水硫酸钠、氯化钠、硫酸、吐温-20、乙酸乙酯、二氯甲烷、二甲基亚砜、乙酸(分析纯,国药集团化学试剂有限公司)。标准溶液配制:用无水甲醇溶解毒死蜱原药,配制成1 000 mg/L储备液,用PBS缓冲液稀释成1 000、500、100、10、5、1 μg/L的梯度工作溶液。
主要仪器设备:PL-9602G酶标仪(北京普朗新技术有限公司),QY-300电动匀浆机(江苏江阴周庄科研器械厂),N-EVAP氮吹仪(Organomation公司),DNP-9162型恒温箱(上海精宏实验设备有限公司)。
土壤样品采集布点、采样要求依据《土壤环境监测技术规范》(HJ/T166),采集样品后密封、避光,可于冷冻条件下保存40 d。除去样品中的异物(枝棒、叶片、石子等)后完全混匀,过孔径250 μm筛备用。地下水的采集及保存参考《地下水质分析方法第2部分:水样的采集和保存》 (DZ/T0064.2-2021),饮用水的采集及保存参考《生活饮用水标准检验方法水样的采集和保存》(GB/T5750.2 -2006)。采集的水样保存于4℃冰箱中,存储时间在3 d以内。
1.2 试验方法1.2.1 样品中毒死蜱的提取 (1) 土样中毒死蜱的提取:土样为未污染的蔬菜田土壤。样品前处理与检测供试土壤为潮土,供试土壤中毒死蜱未检出。称取土壤样品15 g,置于250 mL锥形瓶中,加入50 mL乙酸乙酯-乙酸混合液(体积比99 ∶ 1),振荡1 h,收集上清液于250 mL锥形瓶中,加入20% NaCl溶液20 mL,振荡10 min,静置30 min后取上层有机相,使用无水硫酸钠脱水并浓缩至10 mL,浓缩液置于50 mL离心管中并加入40 mg活性炭。振荡一定时间,用滤纸过滤、浓缩至近干,用含有5% 甲醇的PBS溶液定容至2.0 mL,备用。
(2) 水样中毒死蜱的提取:取水样200 mL于500 mL分液漏斗中,加入二氯甲烷30 mL,振荡提取3 min。静置分层,取下层提取液用无水硫酸钠玻璃漏斗过滤,收集。重复上述提取步骤,合并两次萃取液。将二氯甲烷萃取液置于旋转蒸发器中40 ℃水浴蒸发至近干,用含有5% 甲醇的PBS溶液定容至2.0 mL,备用。
1.2.2 ELISA操作 采用间接竞争酶联免疫方法检测。将包被抗原稀释,加100 μL/孔,4 ℃冷藏过夜;洗涤3次,250 μL/孔(下同),加入封闭液200 μL/孔,37 ℃恒温放置2 h;洗涤,加稀释好的不同梯度毒死蜱工作溶液(待测样本液)50 μL/孔,加一定稀释倍数的抗血清50 μL/孔,37 ℃反应1 h;洗涤,加入稀释的酶标二抗100 μL/孔,37 ℃放置30 min;洗涤,加入显色液100 μL/孔,室温避光显色10 min;加50 μL/孔终止液,测定OD450nm吸光值。加样孔(加有竞争物)测得的OD450nm值(B)与空白孔(不加竞争物)测得的OD450nm值(B0)之间的比值即为结合率。
1.3 试验条件优化1.3.1 抗原、抗体最适工作浓度 用方阵试验法优化抗原、抗体最适工作浓度。包被抗原用pH9.6的碳酸盐缓冲液稀释成不同质量浓度,包被于酶标板,同一个包被质量浓度对应不同的一抗质量浓度,每个处理3次重复。
1.3.2 最佳包被条件 包被抗原吸附于酶标板的稳定程度与时间、温度有关,时间增加和温度升高在一定区间内能增加固定效果。但若过长时间的高温孵育会造成蛋白变性,可能降低包被抗原的固定效果。虽然低温不利于包被原与酶标板之间的固定效果,但低温下延长包被时间,既不影响蛋白活性,又可以增加固定效果。本试验选择了4、25(室温)、37、43 ℃共4个温度条件,其中4 ℃包被时间要长,设12、24 h;室温下包被1、2、4 h;37℃包被l、2、3 h;43 ℃包被l、2、3 h。用ELISA法检测后测定OD450nm值,以最高OD450nm值的包被条件作为最佳包被温度和时间。
1.3.3 最佳封闭时间及竞争反应时间 为了减少非特异性,封闭中的蛋白会非特异性将ELISA板中没有结合包被物的位点封闭,这样后续加入的抗原或抗体就不会再与ELISA板发生非特异性结合,使ELISA结果更加准确。因此选择37℃下加入BSA溶液,封闭30 min、1 h、2 h,经过间接竞争ELISA法操作,确定最佳封闭时间。竞争反应时间控制为5、15、30、45、60 min等5个梯度,测定OD450nm值。
1.3.4 有机溶剂最佳浓度 一抗加入前,添加含有不同体积分数甲醇的PBS溶液于已包被的酶标板中,对照添加纯的PBS溶液,计算抑制率,通过抑制率分析不同甲醇体积分数对结合反应的影响程度。
抑制率(I,%)=〔(ODmax-ODmin)-(ODx-ODmin)〕/(ODmax -ODmin)
式中,ODmax为无甲醇时的吸光度值,ODx为加入甲醇时的吸光度值,ODmin为空白对照孔的吸光度值。
1.3.5 酶标二抗最佳浓度 将抗原、抗体按照最佳稀释度进行ELISA操作,酶标二抗用PBS缓冲液稀释成不同比例(1∶ 4 000、1 ∶ 8 000、1 ∶ 16 000、1 ∶ 32 000、1 ∶ 64 000、1 ∶ 128 000)。反应结束后通过多功能酶标仪读取OD450nm,选取吸光度值在1.0左右的稀释度为最佳浓度。
1.4 方法的准确性与精密度试验1.4.1 标准曲线建立、灵敏度及线性范围确定 在上述优化工作条件的基础上,按照ELISA方法进行操作,建立该方法的标准曲线。经过线性拟合得出该方法的标准曲线及检测限(灵敏度) 和线性范围。
1.4.2 添加回收试验 将毒死蜱标准品分别添加到3种土壤、3种水样中,使毒死蜱最终质量浓度在土壤中为10、100、1 000 μg/kg。用建立的方法和LC-MS/MS测定样品中的毒死蜱质量浓度,计算回收率和变异系数。
1.4.3 精密度测定 由两个试验人员使用相同的仪器设备,在1 d内向土壤、水、蔬菜中添加100 μg/L标样并测定3次。由相同试验人员使用相同的试剂盒,在添加农药的当天及第1、3、5、7天,通过向3种土壤、3种水样中添加100 μg/L标样并测定3次。
1.4.4 特异性测定 对5种毒死蜱的类似结构化合物(甲基毒死蜱、2-羟基-3, 4, 6-三氯-吡啶、杀螟硫磷、对硫磷、马拉硫磷)进行试验,以明确本试验方法的特异性。
1.5 方法的稳定性试验将同一次配制的抗体及包被了抗原的板分别保存于4 ℃和-20 ℃,于保存0、1、l0、20、30、60、90、120、150、180 d进行间接竞争ELISA检测,OD450nm变化 < 0.05,则检测结果有效。
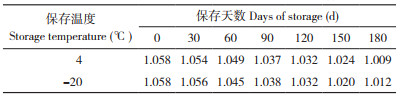
2 结果与分析 2.1 试验条件优化结果2.1.1 抗原、抗体最适工作浓度 以OD450nm值在1.0附近的数值作为选择,同时参考抗原、抗体用量相对较少的质量浓度组合,作为抗原、抗体的最优工作质量浓度。根据试验结果(表 1),确定包被抗原质量浓度为3.56 mg/L,抗血清(抗体) 的稀释倍数为3 200倍。在进行实际样本测定时,样品前处理的提取液可能会影响ELISA测定结果。
|
2.1.2 最佳包被条件 采用ELISA法测定OD450nm值,选择最高OD450nm值的包被条件作为最佳包被温度和时间。其中,4 ℃下包被12 h的OD450nm值为1.132,室温下包被4 h的OD450nm值为0.936,37 ℃下包被3 h的OD450nm值为0.985,可见,抗原包被效果最好的是4 ℃下包被12 h。
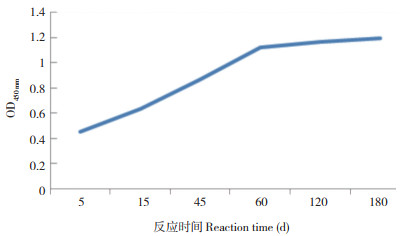
2.1.3 最佳封闭时间及竞争反应时间 进行封闭处理时,OD450nm值随着封闭时间的延长先增加后急速降低,这可能因为蛋白在长时间的孵育温度下发生变性。吸光度值在封闭1 h和1.5 h的吸光度值较高,分别为1.208、1.214,考虑到时间因素,以封闭1 h较合适。控制竞争反应时间,测定各孔OD450nm值。由图 1可知,当反应时间超过60 min,OD450nm值基本趋于稳定,因此选择60 min为最佳反应时间。
|
| 图 1 竞争反应时间的选择 Fig. 1 Selection of competitive reaction times |
2.1.4 有机溶剂最佳浓度 结果(表 2)显示,甲醇浓度超过5% 时,抗原抗体结合反应发生明显的抑制作用,说明过量的甲醇会抑制抗体抗原结合。因此,选择5% 为最佳甲醇浓度。
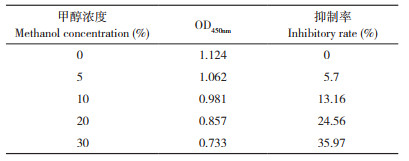
|
2.1.5 酶标二抗最佳浓度 根据抗原最佳包被质量浓度与血清最佳稀释度的确定结果,反应结束后通过多功能酶标仪读取OD450nm,选取吸光度值在1.0左右的稀释度为最佳质量浓度。当酶标二抗稀释度为64 000时,吸光度值为1.089,以该稀释度为二抗工作质量浓度。
2.2 方法的准确性及精密度2.2.1 标准曲线及灵敏度 在上述优化的体系条件下,将一系列毒死蜱标准溶液进行间接竞争抑制试验。本方法毒死蜱的标准工作曲线在质量浓度范围5.0~1 000 μg/L间均呈良好的线性关系。以结合率B/B0为纵坐标,以不同标准溶液的质量浓度对数为横坐标,绘制标准曲线(图 2)并进行回归分析,回归方程为B/B0= -24.87 logC + 97.55,相关系数R2>0.99,毒死蜱的IC50=81.65 μg/L,检出限IC20为5.1 μg/L。
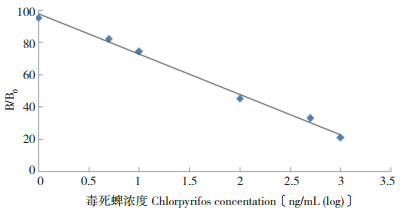
|
| 图 2 竞争反应时间的选择 Fig. 2 Selection of competitive reaction times |
2.2.2 样品添加回收试验 选择不含毒死蜱的土壤和水,添加10、100、1 000 μg/L毒死蜱标准品,经过简单前处理后进行回收试验。结果(表 3)显示,采用ELISA方法测定土壤空白与PBST空白得到的OD值无显著差异,说明基质空白对抗原抗体结合反应不产生干扰,回收率在70%~110% 之间,相对偏差在11% 以内,符合检测方法的需求。同样的样品经过前处理后,用常规气相色谱法进行测定,结果回收率在70%~115% 之间,相对偏差在11% 以内。可见,ELISA方法结果准确,操作简单,适用于土壤、水中毒死蜱的检测。
2.2.3 精密度分析 由两个试验人员使用相同的测定方法,在1 d内通过向土壤和纯净水中添加100 μg/kg的标样,测定3次。不同人员重复测定土壤和水基质中的毒死蜱,相对偏差为4.04% 和2.82%(表 4)。从表 5可以看出,不同时间重复性测定不同土壤中毒死蜱的相对标准偏差在3.37%~8.23% 之间;不同时间重复性测定不同水质毒死蜱的相对偏差在3.01%~6.59% 之间。测试结果均符合检测方法中对相对偏差的规定。
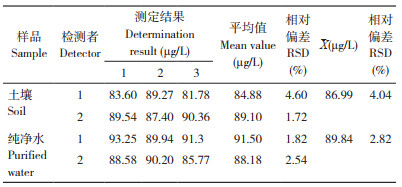
|
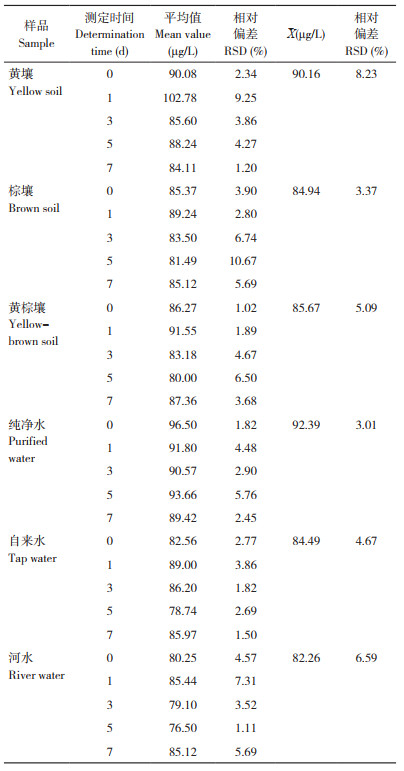
|
2.2.4 特异性分析 在最佳条件下测定5种毒死蜱的类似结构物,结果显示,抗体与甲基毒死蜱的交叉反应率为62.58%,与2-羟基-3, 4, 6-三氯-吡啶的交叉反应率为11.1%,与杀螟硫磷、对硫磷、马拉硫磷的交叉反应率分别为0.09%、0.14%、0.05%。可见,甲基毒死蜱与毒死蜱的抗原决定簇结构相近,而其他农药不会对该抗体造成太明显干扰。
2.3 方法的稳定性将同一次配制的抗体及包被了抗原的板分别保存于4 ℃和-20 ℃下,随着保存时间的增加,间接ELISA法测定结果(表 6)显示,OD450nm的变化值均小于0.05,因此,在180 d内试剂盒储存在4 ℃或-20 ℃下都不影响使用。
3 讨论
酶联免疫法具有特异性强、灵敏度高、操作简单等优点,但影响因素也很多,因此需要优化反应体系中的各种条件。本研究通过优化抗原、抗体及酶标二抗的最适浓度,在用量最少的前提下,选择OD450nm值在1.0左右的质量浓度组合,抗体浓度过高会造成浪费及结果不稳定,浓度过低则反应结果不准确。由于反应体系涉及到蛋白,因此体系反应时间很关键,本试验研究了封闭时间及竞争时间,吸光度值随着时间的延长先增加后急速降低,这可能是因为蛋白在长时间的孵育温度下发生变性,因此选取封闭时间和反应时间均为1 h。样品提取液中的有机溶剂会影响抗原抗体的结合率,试验发现样品提取液中甲醇体积分数增加,抗原抗体结合反应没有明显被抑制,但甲醇体积分数超过5%,抗原抗体结合反应发生了明显的抑制作用,这与魏松红等[21]的研究结果一致。OD450nm在5% 体积分数时取得最大值,说明过量的甲醇会降低抗体和包被抗原的结合率,使吸光度降低。TMB与辣根过氧化物酶的浓度及反应时间对检测也有影响,后续试验将对显色方面的试剂浓度及反应时间进行研究。
土壤及水等不同基质存在的干扰物质有所差异,需要根据基质间的差异选择不同的提取方法进行毒死蜱的提取,才能更准确地检测样品中的实际农药含量[22-23]。张超等[24]研究水、土壤中毒死蜱的提取方法,认为水样采用石油醚提取、土壤采用乙酸乙酯-石油醚提取并净化为佳。本试验前期对土壤及水中毒死蜱农药的提取进行了方法摸索,选择相对简单快捷的前处理方法与酶联免疫法结合,本试验方法的建立适合黄壤、棕壤、黄棕壤,纯净水、自来水、河水等环境样品的毒死蜱检测。毒死蜱的结构类似物不会干扰检测体系,保障了方法的特异性;通过保存条件的研究明确了方法的稳定性;通过回收试验、不同人员操作及灵敏度试验确定方法的精密度。
4 结论本试验酶优化了可快速检测环境中毒死蜱的间接竞争ELISA试验条件,选择甲醇含量5% 的PBS提取液提取环境样品,在最佳反应条件(包被抗原质量浓度为3.56 mg/L,抗血清(抗体)的稀释倍数为3 200倍,抗原包被效果最好的是4 ℃下包被12 h、封闭1 h,酶标二抗稀释度为64 000)基础上,建立了毒死蜱的标准曲线,毒死蜱质量浓度对数与吸光度值成线性关系,回归方程为B/B0= -24.87 logC + 97.55,相关系数R2>0.99,毒死蜱的IC50=81.65 μg/L,检出限IC20为5.1 μg/L。本试验建立的间接竞争ELISA法具有一定的特异性、稳定性和精确性,可应用于检测不同类型的土壤及水样中的毒死蜱,能够实现快速、灵敏的毒死蜱农药残留检测。
| [1] |
AZAM S, MA H, XU B, DEVI S, ZHU J. Efficacy of ultrasound treatment in the and removal of pesticide residues from fresh vegetables: Areview[J]. Trends Food Sci Technol, 2010, 97: 417-432. DOI:10.1016/j.tifs.2020.01.028 |
| [2] |
张叶翠, 李翎, 胡晨阳, 贾强, 郭启明, 薄存香, 张玉, 于功昌, 李超, 赛林霖. 毒死蜱生殖毒性与神经毒性研究进展[J]. 中国职业医学, 2019, 46(5): 628-632. DOI:10.11763/j.issn.2095-2619.2019.05.022 ZHANG Y C, LI X, HU C Y, JIA Q, GUO Q M, FU C X, ZHANG Y, YU G C, LI C, SAI L L. Advances of the reproductive toxicity and neurotoxicity of chlorpyrifos[J]. China Occupational Medicine, 2019, 46(5): 628-632. DOI:10.11763/j.issn.2095-2619.2019.05.022 |
| [3] |
BURKE R D, TODD S W, LUMSDEN E, MULLINS R J, MAMCZARZ J, FAWCETT W P, GULLAPALLI R P, RANDALL W R, PEREIRA E F, ALBUQUERQUE E X. Developmental neurotoxicity of the organophosphorus insecticide chlorpyrifos: From clinical findings to preclinical models and potential mechanisms[J]. Journal of Neurochemistry, 2017, 142(S2): 162-177. DOI:10.1111/jnc.14077 |
| [4] |
SARKER S, AKBOR M A, NAHAR A, HASAN M, SIDDIQUE M A B. Level of pesticides contamination in the major river systems: A review on South Asian countries perspective[J]. Heliyon, 2021, 7(6): e07270. DOI:10.1016/j.heliyon.2021.e07270 |
| [5] |
SUPREETH M, CHANDRASHEKAR M A, SACHIN N, RAJU N S. Effect of chlorpyrifos on soil microbial diversity and its biotransformation by Streptomyces sp. HP-11[J]. Biotech, 2016, 6(2): 2-6. DOI:10.1007/s13205-016-0462-2 |
| [6] |
曾阿莹, 翁玲玲, 王珍, 肖清碧, 杨柳明, 倪进治. 福州蔬菜基地土壤中有机磷农药残留状况调查[J]. 亚热带水土保持, 2015, 27(1): 27-31. DOI:10.3969/j.j.issn.1002-2651.2015.01.007 ZENG A Y, WENG L L, WANG Z, XIAO Q B, YANG L M, NI J Z. Investigation on the organophosphorus pesticides residues in the soil of vegetable cultivation bases in Fuzhou Municipality[J]. Subtropical Soil and Water Conservation, 2015, 27(1): 27-31. DOI:10.3969/j.j.issn.1002-2651.2015.01.007 |
| [7] |
READMAN J W, KWONG L L W, MEE L D, BARTOCCI J, NILVE G, RODRIGUEZ-SOLANO J A, GONZALEZ-FARIAS F. Persistent organophosphorus pesticides in tropical marine environments[J]. Marine Pollution Bulletin, 1992, 24(8): 398-402. DOI:10.1016/0025-326X(92)90500-6 |
| [8] |
TUNCEL S G, ÖZTAS N B, ERDURAN M S. Air and groundwater pollution in an agricultural region of the Turkish Mediterranean coast[J]. Journal of the Air & Waste Management Association, 2008, 58(9): 1240-1249. DOI:10.3155/1047-3289.58.9.1240 |
| [9] |
曹莹, 张亚辉, 闫振广, 朱岩, 刘征涛. 太湖水体中毒死蜱的污染特征及其生态风险评估[J]. 农业环境科学学报, 2016, 35(12): 2413-2419. DOI:10.11654/jaes.2016-0884 CAO Y, ZHANG Y H, YAN Z G, ZHU Y, LIU Z T. Pollution characteristics and ecological risk assessment of chlorpyrifos in Taihu Lake[J]. Journal of Agro-Environment Science, 2016, 35(12): 2413-2419. DOI:10.11654/jaes.2016-0884 |
| [10] |
张晓燕, 黄力, 沈娜, 杨静, 李滑滑, 邓树华. 气相色谱法检测饮料中毒死蜱残留前处理技术研究[J]. 粮食科技与经济, 2021, 46(6): 94-101. DOI:10.16465/j.gste.cn431252ts.20210621 ZHANG X Y, HUANG L, SHEN N, YANG J, LI H H, DENG S H. Study on the pretreatment process for determination of chlorpyrifos in beverages by gas chromatography[J]. Grain Science And Technology And Economy, 2021, 46(6): 94-101. DOI:10.16465/j.gste.cn431252ts.20210621 |
| [11] |
李艳芳, 叶瑜霏, 罗华建, 梁卫驱, 胡珊, 黄皓, 陈仕丽. 气相色谱法快速检测韭菜中15种有机磷农药残留[J]. 广东农业科学, 2011(5): 140-141. DOI:10.16768/j.issn.1004-874X.2011.05.031 LI Y F, YE Y F, LUO H J, LIANG W Q, HU S, HUANG H, CHEN S L. A rapid method of GC-FPD-detection of 15 kinds of organophosphorus pesticidesin leek[J]. Guangdong Agricultural Sciences, 2011(5): 140-141. DOI:10.16768/j.issn.1004-874X.2011.05.031 |
| [12] |
阳曦, 陈慧斐, 向世杰. QuEChERS-气相色谱-串联质谱法测定结球甘蓝中甲基毒死蜱农药残留不确定度评估[J]. 食品安全质量检测学报, 2021, 12(3): 1136-1141. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.03.056 YANG X, CHEN H F, XIANG S J. Uncertainty evaluation for determination of chlorpyrifos-methyl residues in cabbage by QuEChERS-gas chromatographytandem mass spectrometry[J]. Journal of Food Safet y and Qualit y, 2021, 12(3): 1136-1141. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.03.056 |
| [13] |
冯镇, 刘馨, 张震, 任双鹤, 郭增旺, 郭亚男, 殷东, 郭丽媛, 王中江. 基于近红外光谱技术对小麦中毒死蜱农药残留测定方法的研究[J]. 食品工业科技, 2022, 43(4): 271-277. DOI:10.13386/j.issn1002-0306.2021020221 FENG Z, LIU X, ZHANG Z, REN S H, GUO Z W, GUO Y N, YIN D, GUO L Y, WANG Z J. Determination of chlorpyrifos pesticide residues in wheat based on near infrared spectroscopy[J]. Science and Technology of Food Industry, 2022, 43(4): 271-277. DOI:10.13386/j.issn1002-0306.2021020221 |
| [14] |
王金, 李在均. 天冬氨酸功能化石墨烯量子点-金复合物的制备及用于毒死蜱、多菌灵和啶虫脒电化学检测[J]. 分析试验室, 2021, 41(4): 1-10. DOI:10.1395/j.cnki.issn1000-0720.2021.052104 WANG J, LI Z J. Synthesis of aspartic acid-functionalized graphene quantum dot-gold composite and its application in electrochemical detection of chlorpyrifos, carbendazim and acetamiprid in apple[J]. Chinese Journal of Analysis Laboratory, 2021, 41(4): 1-10. DOI:10.1395/j.cnki.issn1000-0720.2021.052104 |
| [15] |
MARIYAPPAN V, KEERTHI M, CHEN SM. Highly selective electrochemical sensor based on gadolinium sulfide rod-embedded rGO for the sensing of carbofuran[J]. Journal of Agricultural and Food Chemistry, 2021, 69: 2679-2688. DOI:10.1021/acs.jafc.0c07522 |
| [16] |
赵颖, 王双节, 柳颖, 焦沙沙, 邹茹冰, 方一画, 郭逸蓉, 朱国念. 毒死蜱等10种农药多残留快速检测芯片研究[J]. 分析化学研究报告, 2019, 47(11): 1759-1766. DOI:10.19756/j.issn.0253-3820.191068 ZHAO Y, WANG S J, LIU Y, JIAO S S, ZOU R B, FANG Y H, GUO Y R, ZHU G N. Immunochip assay for multi-residue rapid detection of ten kinds of common pesticides[J]. Chinese Journal of Analytical Chemistry, 2019, 47(11): 1759-1766. DOI:10.19756/j.issn.0253-3820.191068 |
| [17] |
崔雪妍, 金茂俊, 杜鹏飞, 陈鸽, 张婵, 张秀苑, 王静. 水果中毒死蜱农药残留生物条形码免疫分析方法研究[J]. 农产品质量与安全, 2019(2): 35-38. DOI:10.3969/j.issn.1674-8255.2019.02.007 CUI X Y, JIN M J, DU P F, CHEN G, ZHANG C, ZHANG X Y, WANG J. Study on biological barcode immunoassay of chlorpyrifos residues in fruit[J]. Quality and Safety of Agroproducts, 2019(2): 35-38. DOI:10.3969/j.issn.1674-8255.2019.02.007 |
| [18] |
YANG X, GU Y, WU S. E3S Web of Conferences[C]. Research on a rapid detection method of pesticide residues in milk by enzyme inhibition, 2019.
|
| [19] |
LI D, HE M, CHEN B B, HU B. Metal organic frameworks-derived magnetic nanoporous carbon for preconcentration of organophosphorus pesticides from fruit samples followed by gas chromatography-flame photometric detection[J]. Journal of Chromatography A, 2019, 1583: 19-27. DOI:10.1016/j.chroma.2018.11.012 |
| [20] |
LI N N, LI R Y, SUN X L, YANG Y Q, LI Z J. Dual amplification in a fluorometric acetamiprid assay by using an aptamer, G-quadruplex/hemin DNAzyme, and graphene quantum dots functionalized with D-penicill amine and histidine[J]. Microchim Acta, 2020, 187-158. DOI:10.11007/s00604-020-4127-9 |
| [21] |
魏松红, 刘冰, 纪明山, 谷祖敏, 王英姿. 毒死蜱残留检测间接竞争ELISA试剂盒的研制[J]. 食品科学, 2010, 31: 246-249. WEI S H, LIU B, JI M S, G U Z M, WANG Y Z. Development of an indirect elisa kit for detecting chlorpyrifos residue in plant-derived foods[J]. Food Science, 2010, 31: 246-249. |
| [22] |
王慧卿, 于劲松, 徐斐, 张建国. 食品农药残留检测中样品前处理技术研究进展[J]. 广东农业科学, 2013(8): 111-114. DOI:10.16768/j.issn.1004-874X.2013.08.014 WANG H Q, YU J S, XU F, ZHANG J G. Sample preparation techniques for detection of pesticide residues in foods[J]. Guangdong Agricultural Sciences, 2013(8): 111-114. DOI:10.16768/j.issn.1004-874X.2013.08.014 |
| [23] |
刘正华, 熊文明, 李拥军, 李谦. 稻田土壤、植株和大米中的农药残留分析[J]. 广东农业科学, 2012(1): 102-104. DOI:10.16768/issn.1004-874X.2012.01.012 LIU Z H, XIONG W M, LI Y J, LI Q. Study on pesticide residues analysis in paddy soil, rice straw and grain[J]. Guangdong Agricultural Sciences, 2012(1): 102-104. DOI:10.16768/issn.1004-874X.2012.01.012 |
| [24] |
张超, 杨红. 水、土壤和蔬菜中毒死蜱、甲基毒死蜱残留检测前处理方法[J]. 农药, 2010, 49(5): 367-370. ZHANG C, YANG H. Preparation for determination of chlorpyrifos and chlorpyrifos-methyl in water, soil and vegetable[J]. Agrochemicals, 2010, 49(5): 367-370. |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49