文章信息
基金项目
- 仲恺农业工程学院人才项目(KA2005408C7);江苏省环洪泽湖生态农业生物技术重点实验室开放基金(HZHL1006)
作者简介
- 郑丽(1984—),女,博士,助理研究员,研究方向为植物病害生物防治,E-mail:bluestar183@163.com.
通讯作者
- 郭坚华(1966—),女,博士,教授,研究方向为植物病害生物防治,jhguo@njau.edu.com.
文章历史
- 收稿日期:2021-09-15
2. 南京农业大学植物保护学院/江苏省生物源农药工程中心,江苏 南京 210095;
3. 淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏 淮安 223001
2. College of Plant Protection, Nanjing Agricultural University/Jiangsu Biological Pesticide Engineering Center, Nanjing 210095, China;
3. College of Life Sciences, Huaiyin Normal University/Jiangsu Key Laboratory for Eco-Agruicultural Biotechnology around Hongze Lake, Huaian 223001, China
【研究意义】随着人们对环境问题的重视程度增加以及化学农药带来的弊端日益凸显,具备健康、安全、无毒等优点且对环境和人类友好的生物防治已经成为今后防治植物病害的一种趋势,生防菌作为生物防治的一种手段已被广泛应用于防治植物病害[1-2]。与此同时,在实际生产中,难以避免低毒温和型化学药剂的使用,那么生防制剂和化学药剂的相容性研究显得非常重要。
【前人研究进展】生防菌可以通过竞争、诱导抗性、颉颃、水解酶等发挥生防的作用[3],而发挥生防效果的第一步是稳定定殖,这也是生防菌有效重置微环境的关键一步。重置后的微生物能形成类似自然微生物群的群落,且对各自的生态位具有专一性和适应性[4-5]。BBS(Bacillus cereus AR156, B.subtilis SM21 and Serratia sp. XY21)处理土壤后抑制甜菜疫病的发生[6];接种B.amyloliquefaciens FZB42可抵御青枯病的发生[7];施加B.amyloliquefaciens NJN-6可减轻香蕉枯萎病的发生[8];近缘毛壳菌(Chaetomium subaffine)LB-1可有效抑制黄瓜白粉病发生,且促进黄瓜种子萌发和植株生长[9];假蕈状芽孢杆菌(Bacillus pseudomycoides)NX-2可在黄瓜植株定殖,诱导黄瓜叶片EIN-3、ETR-1等抗病基因表达上调,从而控制黄瓜角斑病的发生[10]。另一方面,将化学杀菌剂与生防制剂混合,虽是目前植物保护制剂采用的主要方法之一,但利用化学杀菌剂时,没有区分有害病原菌与非目标生物,使有益微生物数量减少,导致生物防治无效[11]。荧光假单胞菌属(Pseudomonadaceae)Ps和Ap与化学药剂多菌灵、戊唑醇+肟菌酯、丙环唑的推荐使用剂量有较高相容性,且经复配后表现出对菊花枯萎病更高的防效[12];甲基营养型芽孢杆菌(Bacillus methylotrophicus)TA-1的体外生长不受0.1 mg/mL氟吡咪胺的影响,且在其联合处理下,对番茄灰霉病的防效比任一单一处理都高[13];Wylie等通过体外试验检测ACT(Aerated vermicompost tea)对枯草芽孢杆菌(Bacillus subtilis)QST 713和玫瑰炭疽菌(Clonostachys rosea f.catenulata)J1446抑制黄瓜枯萎病菌(Fusarium oxysporum f.sp.raciscucumerinum, Forc)的研究,结果发现ACT与玫瑰炭疽菌J1446复配对病原菌的抑制作用更强,而ACT对芽孢杆菌QST713有一定毒副作用,其混合产物抵御病原菌能力减弱[14];因此,寻求与化学杀菌剂有较高相容性的生防菌,对提高植物防病能力具有重要意义[15]。
【本研究切入点】将实验室前期筛选获得的6株生防菌处理黄瓜植株,分析化学药剂使用情况下生防菌在黄瓜根围土和叶片上的定殖。【拟解决的关键问题】在日光温室大棚的蔬菜种植过程中,筛选和化学药剂相容性程度较好的生防菌,降低黄瓜霜霉病等在生产过程中的损失。
1 材料与方法 1.1 试验材料1.1.1 供试菌株 生防菌来自香蕉生境,参照郑颖的方法[16],6个菌株鉴定的结果分别为:Bacillus cereus 1BS4(香蕉土壤)、Bacillus sp.2BS5(香蕉土壤)、Bacillus meqaterium 3BS3(香蕉土壤)、Bacillus cereus 3BY4(香蕉叶围)、Enterobacter sp.3BJN7(香蕉假茎内)、Pantoea dispersa 5BJN1(香蕉假茎内)。
1.1.2 供试植物 供试黄瓜品种为津优35,实验室盆栽黄瓜培育方法:将黄瓜种子进行表面消毒(70%无水乙醇表面消毒1~2 min,0.05%次氯酸钠溶液浸泡10 min,灭菌水润洗5次),播种于育苗盘中后放置于28 ℃、16 h/8 h光周期、70%相对湿度以上温室中进行培育。待黄瓜苗长到3~4片真叶(25 d左右)时进行移栽。将黄瓜幼苗移栽入装满基质的盆钵(上口外径14.7 cm、内径12.8 cm,底径9.3 cm,高11 cm)中,每钵1株,置于28 ℃、相对湿度85%以上、16h/8h光周期温室。黄瓜霜霉病为日光温室大棚自然发病。试验在江苏省淮安市丁集镇共和六组日光温室大棚进行。黄瓜种植连续15年以上。土壤质地为黄潮土类,轻壤质土。土壤有机质含量1.8%~1.9%,土壤pH值6.5。
1.2 试验方法1.2.1 生防菌菌悬液制备 将-70 ℃保存的菌株在LB固体培养基上划线活化,于32 ℃培养12 h,挑取单菌落接种到LB培养液中,32 ℃、180 r/min培养16 h,每隔2 h取样测量600 nm处的OD值,直至OD值为0.8,并将此浓度的菌液作为种子菌液。以1∶500体积比将种子菌液接种至LB发酵培养液,32 ℃、180 r/min培养48 h后4 000 r/min离心15 min,去除上清液,用同等体积灭菌水重悬浮,采用液滴法测得生防菌的活菌浓度为109 CFU/mL。
1.2.2 生防菌菌株的利福平抗性标记 将活化后的生防菌菌液涂在含1 μg/mL利福平平板上培养,挑取单菌落(Rif1)至含1 μg/mL利福平的LB培养液中培养24 h,得到的菌液涂在含2.5 μg/mL利福平的平板上培养。重复上述步骤,直至菌株抗性标记至100 μg/mL。纯化,并经过多代培养稳定其性状后保存备用。抗生素标记菌株稳定性试验参照郑颖的方法[16],野生型及抗生素标记菌株基因组DNA采用BOX-PCR指纹图谱分析。
1.3 测定项目及方法实验室温室条件下,将10片真叶黄瓜植株(未接种黄瓜霜霉病原菌,未使用化学药剂,2011-04-17)进行喷雾(108 CFU/mL的菌液60 mL,空白对照喷施等体积灭菌水)和灌根处理,每个处理3次重复,每个重复8棵苗;田间日光温室条件下,将14片真叶黄瓜植株喷施生防菌菌悬液,5 d后不喷施(2011-05-14)和喷施化学药剂百菌清(2011-03-24)于叶片上,每个处理4次重复,每个重复10棵苗。
采样时间为接菌后0、3、7、14、21、30 d。根围土取样时,从盆钵中收集根系以及紧密黏附于根系上的土壤;叶片取样时,用灭菌剪刀剪取喷施生防菌的叶子。获得的样品按照1∶10比例浸没于灭菌的0.85% NaCl中,室温下200 r/min离心30 min,得到10-1稀释液,再用0.85% NaCl进行梯度稀释,从合适浓度的稀释液中吸取100 μL涂布于含有利福平(100 μg/mL)、放线菌酮(100 μg/mL)的LB平板。对照样品处理同上。平板置于30 ℃培养箱培养2 d后记录菌落数。
在SPSS 25.0软件中对定殖量数据进行单因素方差分析,并用LSD text比较数据间的差异显著性,在GraphPad Prism 8.0对相关数据进行绘图。
2 结果与分析 1.1 生防菌在温室条件(无药剂、无病原菌)下的定殖量在无化学药剂和无霜霉病病原菌的温室条件下,6种生防菌在黄瓜叶片和根围的定殖量总体上呈现降-增-稳定的趋势,即在接菌后0~3 d下降,接菌后3~7 d上升,接菌后7~30 d趋于稳定。接菌后30 d,6种生防菌(1BS4、2BS5、3BS3、3BY4、3BJN7、5BJN1)在叶片上的定殖量依次为105.21、104.86、105.00、108.00、103.92、105.41 CFU/g(FW),在根围上的定殖量依次为105.65、104.38、103.76、105.35、103.86、103.76 CFU/g(FW)。接菌后30 d,生防菌1BS4、2BS5、3BS3在叶片和根围的定殖量相较于初始接种量(107CFU/g,FW)均有所下降,菌株2BS5、3BS3和3BJN7的定殖量保持在104 CFU/g(FW)左右,而菌株1BS4和3BY4在叶片和根围的定殖量菌均接近106 CFU/g(FW),定殖情况较为理想(图 1)。
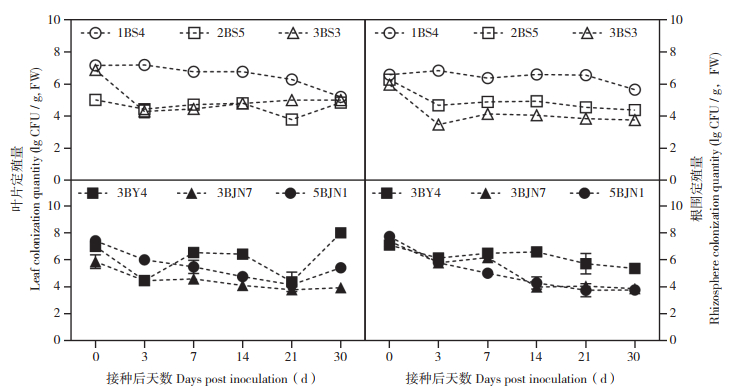
|
| 图 1 温室条件下6种生防菌在黄瓜叶片与根围的定殖情况 Fig. 1 Colonization of six biocontrol bacteria in cucumber leaves and roots under greenhouse conditions |
2.2 生防菌在日光温室条件(无药剂、有病原菌)下的定殖量
在无化学药剂胁迫和存在霜霉病病原菌的田间条件下,6种生防菌在黄瓜叶片和根围的定殖量总体上呈现降-增-降-稳定的趋势,即在接菌后0~3 d下降,接菌后3~7 d上升,接菌后7~14 d下降,接菌后14~30 d趋于稳定。接菌后30 d,6种生防菌(1BS4、2BS5、3BS3、3BY4、3BJN7、5BJN1)在叶片上的定殖量依次为103.92、103.70、103.66、103.83、103.85、105.92 CFU/g(FW),在根围上的定殖量依次为104.56、104.71、103.62、102.44、104.57、104.95 CFU/g(FW)。可知接菌后30 d,菌株3BJN7和5BJN1的定殖量最高,3BY4定殖量最低,菌株1BS4、2BS5和3BS3介于两者之间。其中,3BY4定殖量受病原菌影响较大,而3BJN7和5BJN1在病原菌出现时还有助于定殖,1BS4、2BS5和3BS3定殖量不受病原菌影响或影响较弱(图 2)。
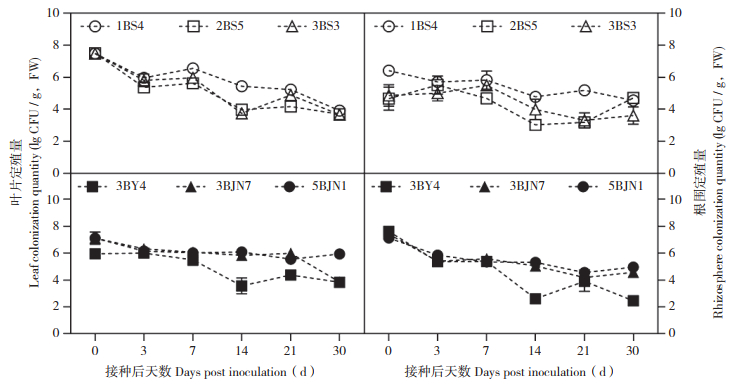
|
| 图 2 田间条件下6种生防菌在黄瓜叶片与根围的定殖情况(无药剂胁迫) Fig. 2 Colonization of six biocontrol bacteria in cucumber leaves and roots under field conditions (without fungicide stress) |
2.2 生防菌在大田条件(有药剂、有病原菌)下的定殖量
在化学药剂和霜霉病病原菌存在的田间条件下,6种生防菌在黄瓜叶片和根围的定殖量总体上呈现降-增-降-稳定的趋势,即在接菌后0~3 d下降,接菌后3~7 d增加,接菌后14~30 d趋于稳定。接菌后30 d,6种生防菌(1BS4、2BS5、3BS3、3BY4、3BJN7、5BJN1)在叶片上的定殖量依次为103.14、102.58、102.83、102.75、103.88、104.23 CFU/g(FW),在根围上的定殖量依次为103.65、102.40、102.68、102.63、102.80、103.00 CFU/g(FW)。可知接菌后30 d,多数菌株在叶片和根围的定殖量分布在102~103 CFU/g(FW),与初始接种量相比均有较大幅度降低(约103 CFU/g,FW)。相较于无药剂胁迫和存在病原菌的的田间条件下,定殖量均略有下降,但菌株3BJN7和5BJN1在叶片的定殖量仍可保持在104 CFU/g(FW)左右(图 3)。
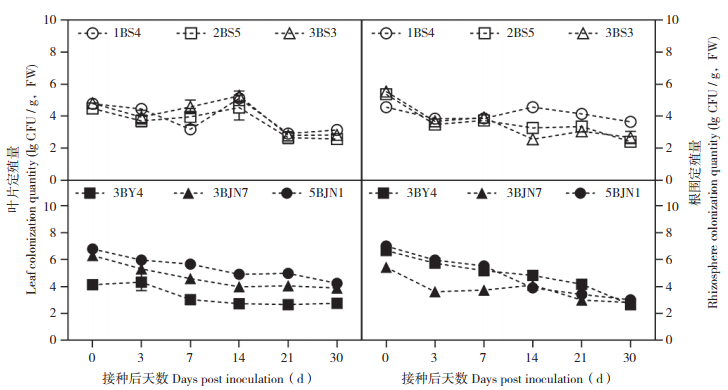
|
| 图 3 田间条件下6种生防菌在黄瓜叶片与根围的定殖情况(有药剂胁迫) Fig. 3 Colonization of six biocontrol bacteria in cucumber leaves and roots under field conditions (fungicide stress) |
2.3 3种不同条件生防菌在黄瓜叶片的定殖量比较
在无药剂胁迫条件下,病原菌的出现一定程度上影响了生防菌在黄瓜叶片上的定殖,如菌株1BS4、2BS5和3BY4在黄瓜叶片的定殖量在多个时间点与无病菌出现时相比具有显著差异,定殖量降幅在102 CFU/g(FW)左右;而病原菌对生防菌3BS3和5BJN1在叶片定殖量的影响相对较小,大部分时间点的定殖量有较小程度的降低(约101 CFU/g,FW),甚至基本持平;菌株5BJN1在接菌后0、3、7、14、21 d,定殖量均比无病原菌存在时高出许多(图 4箭头),表明当病原菌出现时,该菌株的定殖能力有所提升。在病原菌存在的条件下,使用化学药剂对绝大多数菌株(如1BS4、2BS5、3BS3、3BY4、3BJN7)在黄瓜叶片上的定殖较为不利,它们在各时间点的定殖量均有所下降,只有菌株5BJN1对药剂的耐受能力相对较强,且其和3BJN7在叶片的定殖量在各时间点均可保持在104 CFU/g(FW)。

|
| A:温室(无药剂+无病原菌);B:日光温室(无药剂+病原菌);C:日光温室(百菌清+病原菌)。同组柱上小写英文字母不同者表示差异显著 A: Greenhouse (drug-free plus no pathogen); B: Field in a large plastic tent (drug-free plus pathogen Pseudoperonospora cubensis naturally occurring); C: Field in a large plastic tent (chlorothalonil plus pathogen Pseudoperonospora cubensis naturally occurring) Different letters above the bar charts represent significant differences 图 4 不同条件下6种生防菌在黄瓜叶片的定殖量比较 Fig. 4 Comparison of colonization quantities of six biocontrol bacteria in cucumber leaves under different conditions |
2.4 3种不同条件生防菌在黄瓜根围的定殖量比较
3种不同条件下,6种生防菌株在黄瓜根围的定殖与在叶片的定殖情况类似。即在无药剂胁迫条件下,病原菌出现与否,对部分菌株(1BS4、2BS5、3BY4)的定殖都较为不利,在多个时间点的定殖量与无病菌出现时均有所下降,降幅在102 CFU/g(FW)左右,与无病菌时的定殖量差异显著,而病原菌对3BS3、3BJN7和5BJN1在根围上的定殖受到这种影响程度较小,甚至病原菌出现还有助于它们在根围上定殖。在病原菌存在的条件下,使用化学药剂,多数菌株(如1BS4、2BS5、3BS3)在根围上的定殖量都有一定程度的降低,降幅在101 CFU/g(FW)左右,这种影响随着菌株的不同而有所差异。部分对药剂耐受性较好的菌株(3BJN7和5BJN1),在接种30 d后,定殖量仍可保持在104 CFU/g(FW)左右(图 5)。
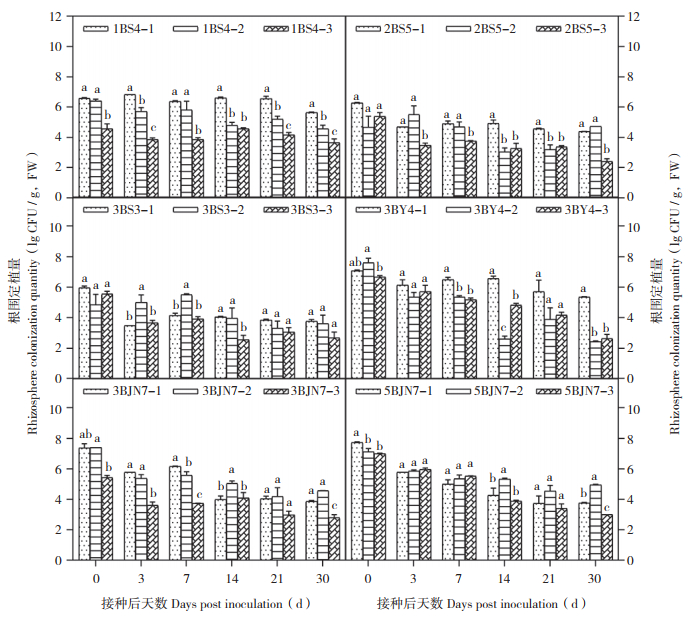
|
| A:温室(无药剂+无病原菌);B:日光温室(无药剂+病原菌);C:日光温室(百菌清+病原菌)。同组柱上小写英文字母不同者表示差异显著 A: Greenhouse (drug-free plus no pathogen); B: Field in a large plastic tent (drug-free plus pathogen Pseudoperonospora cubensis naturally occurring); C: Field in a large plastic tent (chlorothalonil plus pathogen Pseudoperonospora cubensis naturally occurring) Different letters above the bar charts represent significant differences 图 5 不同条件下6种生防菌在黄瓜根围的定殖量比较 Fig. 5 Comparison of colonization quantities of six biocontrol bacteria in cucumber roots under different conditions |
3 讨论
目前,黄瓜霜霉病生防因子的筛选研究已成为关注的热点,寻找稳定有效且能大规模生产开发的潜力微生物方面成功的报道也屡见不鲜[17-19]。本实验也发现,多种生防菌株如短小芽孢杆菌、地衣芽孢杆菌和枯草芽孢杆菌等发挥生防功效的关键在于它们能否在植株上稳定定殖,只有对外界胁迫耐受能力强的的菌株才可进一步作为潜力的生防因子推广应用,这与报道[19-21]的结果一致。
应用微生物及其制剂进行农作物防病增产的研究工作,已经有数十年的历史。而生防菌在田间的防治效果是否稳定,影响的因素很多。Kolepper认为,植物病害生物防治的第一步是拮抗微生物能在植物上成功定殖,只有具有较强的与常驻微生物竞争、定殖能力好的菌株才能增殖,否则,会被常驻微生物取代。已有的研究结果显示,定殖能力也许是生防菌能否成功控制病害的决定性因子[22-23]。
本实验选择先前防效趋于稳定的6个生防菌株测定其在不同条件下的定殖能力,发现呈现相似的变化趋势,喷施后7 d其定殖量变化幅度微小,喷施后30 d在黄瓜叶片的定殖量由初始的107 CFU/g(FW)左右下降到104 CFU/g(FW)。在化学药剂存在条件下,生防菌仍可定殖于黄瓜叶片,后期化学药剂对生防菌的影响逐渐消失。该结果与Palazzini等研究数据相似,在不同杀真菌剂存在下,3种生防单菌在小麦植株上定殖能力的改变程度有所差异;受药剂影响程度小的组合,对小麦赤霉病菌Fusarium head blight的抑制作用更强[24];联合使用化学药剂有助于提高荧光假单胞菌(Pseudomonas fluorescens)Pf1在辣椒叶片上的存活率,并对辣椒炭疽病和白粉病的防效更明显[25];此外,使用无毒抗菌化合物(如有机酸、生物调节剂和挥发性精油)对BCA发挥生防功效也有促进作用[26];以上研究表明,在植物疾病防治的管理策略中,综合z使用生防菌剂与较小剂量的化学药剂是控制植物病害的有效手段。
推测预先使用颉颃菌,再使用化学药剂,可能颉颃菌面对胁迫,改变生存战略,产生一些代谢物能协同化学药剂发挥防病效果,而不被化学药剂杀死,使得其定殖量仍能保持相当数量。本研究的发现,在日后开展筛选到的生防菌大规模大田示范推广过程中,如何选择合适的低毒低残留化学药剂与生防菌复配提供了一定的理论依据。
4 结论6种菌株定殖规律趋于相似:①降—增—稳定,②降—增—降—稳定,③降—增—降—稳定,生防菌的定殖量大多呈现降—增—稳定的趋势。病原菌的出现,较大程度影响了菌株3BY4在黄瓜叶片的定殖,使其在接菌后30 d定殖量由108.00 CFU/g(FW)减少至103.83 CFU/g(FW),但也增加了菌株5BJN1在黄瓜叶片的定殖能力,使其在接菌后30 d定殖量由105.41 CFU/g(FW)增加至105.92 CFU/g(FW);使用化学药剂对生防菌在黄瓜叶片的定殖较为不利,各菌株的定殖量降低约101 CFU/g(FW),但在30 dpi时各菌株的定殖量仍可保持在102~104 CFU/g(FW),说明化学药剂与这些菌株间存在一定相容性。相关机制将在后续实验中探究。
| [1] |
张臻. 两株生防菌对小麦赤霉病和茎基腐病防治效果的评价[D]. 武汉: 华中农业大学, 2018. ZHANG Z. Evaluation of control effects of two biocontrol bacteria against wheat scab and stem rot[D]. Wuhan: Huazhong Agricultural University,, 2018. |
| [2] |
唐中发. 海南菠萝叶部三种病原真菌的分离鉴定及两种生防菌的抑菌效果初探[D]. 海口: 海南大学, 2019. TANG Z F. Isolation and identification of three pathogenic fungi from pineapple leaves in Hainan and preliminary study on the antibacterial effect of two biocontrol bacteria[D]. Haikou: Hainan University, 2019. |
| [3] |
L ASTOCHK INA O, SEIFIK ALHOR M, AL INI AEIFARD S, BAYMIEV A, PUSENKOVA L, GARIPOVA S, KULABUHOVA D, MAKSIMOV I. Bacillus spp.: Efficient biotic strategy to control postharvest diseases of fruits and vegetables[J]. Plants, 2019, 8(4): 97. DOI:10.3390/plants8040097 |
| [4] |
BAI Y, MⅡLL ER D B, SR INIVAS G, GARRIDO-OT ER R, POTTHOFF E, ROTT M, DOMBROWSKI N, MUNCH P C, SPAEPEN S, REMUS-EMSERMANN M, HUITTEL B, MCHARDY A C, VORHOLT J A, SCHULZE-LEFERT P. Functional overlap of the Arabidopsis leaf and root microbiota[J]. Nature, 2015, 528(7582): 364-369. DOI:10.1038/nature16192 |
| [5] |
郑丽. 黄瓜霜霉病的生物防治研究[D]. 南京: 南京农业大学, 2012. ZHENG L. Biological control of cucumber downy mildew[D]. Nanjing: Nanjing Agricultural University, 2012. |
| [6] |
ZHANG L N, WANG D C, HU Q, DAI X Q, XIE Y S, LI Q, LIU H M, GUO J H. Consortium of plant growth-promoting rhizobacteria strains suppresses sweet pepper disease by altering the rhizosphere microbiota[J]. Frontiers in Microbiology, 2019, 10: 1668. DOI:10.3389/fmicb.2019.01668 |
| [7] |
ER L ACH ER A, CARDINAL E M, GRO S CH R.GRU BE M, BERG G. The impact of the pathogen Rhizoctonia solani and its beneficial counterpart Bacillus amyloliquefaciens on the indigenous lettuce microbiome[J]. Frontiers in Microbiology, 2014, 5: 175. DOI:10.3389/fmicb.2014.00175 |
| [8] |
XUE C, RYAN PENTON C, SHEN Z Z, ZHANG R F, HUANG Q W, LI R, RUAN Y Z, SHEN Q R. Manipulating the banana rhizosphere microbiome for biological control of Panama disease[J]. Scientific Reports, 2015, 5(1): 11124. DOI:10.1038/srep11124 |
| [9] |
刘彩云, 赵静. 生防菌株LB-1培养液对黄瓜的抑病促生作用[J]. 植物病理学报, 2020, 50(6): 93-100. DOI:10.13926/j.cnki.apps.000338 LIU C Y, ZHAO J. The growth-promoting effect of biocontrol strain LB-1 on cucumber[J]. Phytopathology report, 2020, 50(6): 93-100. DOI:10.13926/j.cnki.apps.000338 |
| [10] |
张明宇, 王远宏, 张斌, 常若葵, 于玮玮, 李卓然. 生防菌NX-2筛选及其防治黄瓜细菌性角斑病机理初探[J]. 中国植保导刊, 2021, 41(4): 9. DOI:10.3969/j.issn.1672-6820.2021.04.002 ZHANG M Y, WANG Y H, ZHANG B, CHANG R K, YU W W, LI Z R. Screening of biocontrol bacteria NX-2 and its mechanism in controlling cucumber bacterial leaf spot[J]. China Plant Protection Journal, 2021, 41(4): 9. DOI:10.3969/j.issn.1672-6820.2021.04.002 |
| [11] |
ONS L, BYLEMANS D, THEVISSEN K, CAMMUE BPA. Combining biocontrol agents with chemical fungicides for integrated plant fungal disease control[J]. Microorganisms, 2020, 8(12): 1930. DOI:10.3390/microorganisms8121930 |
| [12] |
PRIYA D S, AIYANATHAN K E, HARISH S. Efficacy of bacterial biocontrol agents and commercial fungicides against fusarium wilt of chrysanthemum[J]. Journal of Pharmacognosy and Phytochemistry, 2019, 8(3): 874-880. |
| [13] |
JI X, LI J, MENG Z, ZHANG S, QIAO K. Synergistic effect of combined application of a new fungicide fluopimomide with a biocontrol agent Bacillus methylotrophicus TA-1 for management of gray mold in tomato[J]. Plant Disease, 2019, 103(8): 1991-1997. DOI:10.1094/PDIS-01-19-0143-RE |
| [14] |
WYLIE A C, PUNJA Z K. Assessing aerated vermicompost tea(ACT)combined with microbial biological control agents for suppression of Fusarium and Rhizoctonia[J]. Phytopathology, 2021, 111(7): 1137-1151. DOI:10.1094/PHYTO-05-20-0156-R |
| [15] |
Biofungicides as alternative to synthetic fungicide control of grey mould(Botrytis cinerea)-prospects and challenges[J]. Biocontrol Science & Technology, 2018: 1-22. DOI: 10.1080/09583157.2018.1548574.
|
| [16] |
郑颖. 利用根围促生细菌防治香蕉枯萎病的筛选策略研究及大田防效验证[D]. 南京: 南京农业大学, 2010. DOI: 10.7666/d.Y2527526. ZHENG Y. Screening strategies for controlling banana wilt by rhizosphere bacteria and field control effect validation[D]. Nanjing: Nanjing Agricultural University, 2010. DOI: 10.7666/d.Y2527526. |
| [17] |
范瑛阁, 朱丽霞, 龚明福. 生防菌H1和H2对黄瓜霜霉病的防效测定[J]. 北方园艺, 2012(7): 149-150. FAN Y G, ZHU L X, GONG M F. Control effects of biocontrol strains H1 and H2 on cucumber downy mildew[J]. Northern horticulture, 2012(7): 149-150. |
| [18] |
刘爱荣, 陈双臣, 晋文娟. 哈茨木霉对接种尖孢镰刀菌后黄瓜根系次生代谢物的影响[J]. 中国生物防治学报, 2012, 28(4): 545-551. DOI:10.3969/j.issn.2095-039X.2012.04.016 LIU A R, CHEN S C, JIN W J. Effects of Trichoderma harzianum on secondary metabolites of cucumber roots after inoculation with Fusarium oxysporum[J]. Chinese Journal of Biological Control, 2012, 28(4): 545-551. DOI:10.3969/j.issn.2095-039X.2012.04.016 |
| [19] |
陈颖潇, 何胥, 施洁君, 张丽娜, 谷春, 王光, 郭坚华. 黄瓜霜霉病生防菌株的筛选及防病促生研究[J]. 安徽农业科学, 2015, 43(23): 121-124. DOI:10.3969/j.issn.0517-6611.2015.23.050 CHEN Y X, HE X, SHI J J, ZHANG L N, GU C, WANG G, GUO J H. Screening of biocontrol strains against cucumber downy mildew and study on disease prevention and growth promotion[J]. Anhui Agricultural Sciences, 2015, 43(23): 121-124. DOI:10.3969/j.issn.0517-6611.2015.23.050 |
| [20] |
潘江禹, 汪军, 毛超, 戴青冬, 黄俊生. 不同肥料对生防菌淡紫拟青霉E7定殖的影响[J]. 广东农业科学, 2012, 39(19): 61-63. DOI:10.3969/j.issn.1004-874X.2012.19.020 PAN J Y, WANG J, MAO C, DAI Q D, HUANG J S. Effects of different fertilizers on the colonization of Paecilomyces lilacinus E7[J]. Guangdong Agricultural Sciences, 2012, 39(19): 61-63. DOI:10.3969/j.issn.1004-874X.2012.19.020 |
| [21] |
金鑫, 张英俊, 刘霞, 于莉. 生防菌株白g1在香蕉体内的定殖动态及其促生效果[J]. 广东农业科学, 2012, 39(24): 82-84, 88. DOI:10.16768/j.issn.1004-874X.2012.24.032 JIN X, ZHANG Y J, LIU X, YU L. Colonization dynamics and growth promoting effect of biocontrol strain white g1 in banana[J]. Guangdong Agricultural Sciences, 2012, 39(24): 82-84, 88. DOI:10.16768/j.issn.1004-874X.2012.24.032 |
| [22] |
蔡学清. 荔枝采后主要病原菌的特性及内生细菌对其防治保鲜研究[D]. 福州: 福建农林大学, 2010. DOI: 10.7666/d.d116579. CAIX Q. The characteristics of main pathogenic bacteria after litchi harvest and the effect of endophytic bacteria on its prevention and preservation[D]. Fuzhou: Fujian Agriculture and Forestry University, 2010. DOI: 10.7666/d.d116579. |
| [23] |
ZHENG L, GU C, CAO J, LI S M, WANG G, LUO Y M, GUO J H. Selecting bacterial antagonists for cucurbit downy mildew and developing an effective application method[J]. Plant Disease, 2018, 102(3): 628-639. DOI:10.1094/PDIS-01-17-0058-RE |
| [24] |
PALAZZINI J M, TORRES A M, CHULZE S N. Tolerance of triazolebased fungicides by biocontrol agents used to control fusarium head blight in wheat in Argentina[J]. Letters in Applied Microbiology, 2018. |
| [25] |
ANAND T, CHANDRASEKARAN A, KUTTALAM S, SENTHILRAJA G, SAMIYAPPAN R. Integrated control of fruit rot and powdery mildew of chilli using the biocontrol agent Pseudomonas fluorescens and a chemical fungicide[J]. Biological Control, 2010, 52(1): 1-7. DOI:10.1016/j.biocontrol.2009.09.010 |
| [26] |
ROSELLO G, FRANCES J, DARANAS N, MONTESINOSET E, BONATERRA A. Control of fire blight of pear trees with mixed inocula of two lactobacillus plantarum strains and lactic acid[J]. Journal of Plant Pathology, 2017, 99: 111-120. |
(责任编辑 杨贤智)
 2022, Vol. 49
2022, Vol. 49




