文章信息
基金项目
- 广东省农业科学院创新基金(202128);广东省自然科学基金(2021A1515010498);广州市科技计划项目(201906040005)
作者简介
- 王片片(1989—),女,硕士,助理研究员,研究方向为动物疫病防控,E-mail:970311660@qq.com.
通讯作者
- 刘春(1982—),男,博士,副教授,研究方向为水产动物病害防控,E-mail:Lc5173483@163.com.
文章历史
- 收稿日期:2021-11-17
2. 中国水产科学研究院珠江水产研究所,广东 广州 510380;
3. 仲恺农业工程学院动物科学学院,广东 广州 510225
2. Pearl River Fisheries Research Institute, Chinese Academy of Fishery Science, Guangzhou 510380, China;
3. College of Animal Science, Zhongkai University of Agricultural and Engineering, Guangzhou 510225, China
【研究意义】免疫系统是机体执行免疫应答及免疫功能的重要系统。机体受到抗原刺激后,淋巴细胞发生分化增殖,在B淋巴细胞的介导下产生免疫球蛋白(Immunoglobulin,Ig)。根据Ig重链恒定区(Constant region,C区)肽链氨基酸组成的不同,免疫球蛋白被划分为多种类型,哺乳动物中的Ig类型主要有IgM、IgD、IgG、IgE和IgA[1]。相比于哺乳动物,鱼类Ig研究起步较晚,目前在硬骨鱼类中已发现的Ig主要有IgM、IgD、IgZ、IgT、IgM- Z等[2]。其中,IgD在人类免疫系统中兼具受体和配体的双重身份,可以在B细胞发育早期替代IgM的作用,同时在调剂免疫应答和维持免疫系统的平衡中也发挥重要作用[3]。目前对鱼类IgD的研究较少,探究鱼类IgD的功能与作用,对于完善鱼类免疫蛋白功能研究具有重要意义。嗜水气单胞菌(Aeromonas hydrophila)是一种严重影响水产动物健康生长的病原菌,对水产养殖业造成很大威胁,疫苗免疫是动物疫病有效防控的手段之一,也是鱼病防治中的首选方式[4-5]。研究嗜水气单胞菌疫苗免疫鱼类后IgD的表达变化,对于进一步认识鱼类免疫应答机制具有重要意义。
【前人研究进展】Wilson等[6]在斑点叉尾鮰(Ictalurus punctatus)中第一次报道了一种类似于哺乳动物IgD重链的嵌合基因,随后在牙鲆(Paralichthys olivaceus)[7]、鳜(Siniperca chuatsi)[8]、斜带石斑鱼(Epinephelus coioides)[9]、大菱鲆(Scophthalmus maximus)[10]等鱼类中均发现了IgD的存在。目前IgD在除鸟类外的其他脊索动物中均有报道,但对于IgD免疫学功能方面的研究较少。有研究显示,IgD可能在鱼类系统免疫监视以及免疫应答调节中起重要作用,且其免疫应答表现一定的组织特异性[4]。
【本研究切入点】剑尾鱼(Xiphophorus helleri)属鳉形目(Cyprinodontiformes)花鳉科(Cyprinodontidae)剑尾鱼属,是我国首个通过审定的鱼类实验动物,多年来被应用于动物疾病检验模型、水环境监测等领域[11]。作为实验动物,剑尾鱼具备均质化和标准化的优势,从而保证实验的可重复性、结果的精确度和可比性。目前在剑尾鱼免疫球蛋白研究方面,IgM和IgZ均已得到克隆并进行免疫相关研究,但IgD还未有相关研究报道。【拟解决的关键问题】本研究拟对剑尾鱼IgD进行基因克隆,并研究其在剑尾鱼中的组织表达分布以及在嗜水气单胞菌(Aeromonas hydrophila)疫苗免疫后的表达变化,初步探讨IgD在剑尾鱼免疫系统中的功能作用,丰富其在实验动物领域中对免疫球蛋白基因的研究,进一步认识鱼类免疫应答分子机制,为剑尾鱼作为鱼类疾病研究的模式动物和疫苗免疫评价模型奠定基础。
1 材料与方法 1.1 试验材料1.1.1 实验动物 供试鱼为5~6月龄剑尾鱼(RR-B系),体长5~8 cm,体重3.5~4.8 g,由中国水产科学研究院珠江水产研究所培育,已通过全国水产原种和良种审定委员会审定。本试验于2015年在珠江水产研究所开展。试验开始前,剑尾鱼暂养水产动物房,14 d后免疫,免疫后取11 d内各时期样品。养殖玻璃缸体积为100 L,水温28(±2)℃,每天用经24 h曝气的自来水换水1/4,实验鱼房间上午8:00开启照明,以14 h/10 h进行昼夜明暗交替。
1.1.2 主要试剂与仪器 DNA提取试剂盒Tissue DNA Kit Ⅱ、总RNA提取试剂盒Total RNA Kit Ⅱ和胶回收试剂盒Gel Extraction Kit为OMEGA公司(美国)产品,M-MLV Reverse Transcriptase购自Promega公司(美国),pMD-18T vector、PrimeScriptTM RT Reagent Kit(Prefect Real Time)和荧光定量试剂盒SYBR® Premix EX TapTM Ⅱ(Tli RNaseH plus)、DNA消化酶DNase I均购自TaKaRa公司(日本),大肠杆菌DH5α感受态细胞为北京天根生化科技有限公司产品,PCR引物由上海生物工程技术服务有限公司合成。嗜水气单胞菌株(GYK1)由鱼病实验室保存,嗜水气单胞菌疫苗来自广州普麟生物制品有限公司。
主要仪器:ABI 7500实时荧光定量PCR检测仪(Applied Biosystems,美国)、GelDoc凝胶成像系统(Bio-RAd,美国)、DYY-7C电泳仪器(北京六一仪器厂)、BPH-9052电热恒温培养箱(上海一恒科技有限公司)、I-4离心机(Sigma,德国)等。
1.2 试验方法1.2.1 脾脏总DNA和RNA的提取 选取6尾健康剑尾鱼腹腔注射嗜水气单胞菌株(GYK1)60~80 μL(菌悬液浓度104 cfu/mL),2 d后取脾脏提取DNA和RNA。于冰上剪开腹腔取出脾脏放入EP管,液氮冻存,按照OMEGA公司试剂盒说明书提取DNA与RNA用于IgD基因DNA及cDNA的克隆。取5 μL总RNA样品用1.2%琼脂糖凝胶电泳检测其质量和完整性,用核酸蛋白测定仪测定RNA样品的浓度和纯度。
1.2.2 IgD基因DNA及cDNA克隆 将提取的总RNA按照逆转录M-MLV说明书合成cDNA第一链。参照实验室已建立的剑尾鱼EST库的基因序列和已知鱼类IgD基因序列,设计DNA扩增引物(表 1),以剑尾鱼DNA为模板进行PCR扩增。扩增产物经过1.0%琼脂糖凝胶电泳后,将目的条带切下用胶回收试剂盒纯化,纯化产物连接pMD18-T载体后转化进大肠杆菌DH5a感受态细胞,37 ℃倒置培养过夜(12 h),挑取阳性克隆测序。对获得的片段进行拼接得到基因全长,对拼接的全长DNA序列分析,预测其cDNA序列。根据预测序列设计引物(表 1),以cDNA第一链为模板进行PCR扩增,经测序和拼接后获得其全长cDNA序列。
1.2.3 生物信息学分析 利用DNAstar分析软件对获得的片段进行全长拼接。用DNAman 5.1分析剑尾鱼IgD基因DNA序列以及开放阅读框(Open Reading Frame,ORF),通过与其他种类的核苷酸和氨基酸序列比对,最终确定ORF。应用Clustalx进行多序列比对,根据氨基酸序列,用MEGA4.0中的邻位相联法(Neighborjoining,NJ)构建进化树。
1.2.4 IgD基因组织表达分析 采用实时荧光定量PCR(qRT-PCR)技术检测IgD基因在不同组织中的相对表达量。根据已知剑尾鱼β-actin序列(登录号:DQ060278)和获得的IgD基因cDNA序列设计内参引物β-actinF、β-actinR和检测引物IgD-F、IgD-R(表 1)。选取3尾健康的剑尾鱼,分别取其鳃、脑、心脏、肝、脾、头肾、肠、肌肉和表皮组织,按照1.2.2中方法提取RNA,用SYBR PrimeScript RT-PCR Kit进行反转录,合成cDNA第一链。以合成的cDNA第一链为模板,按照荧光定量试剂盒步骤在ABI 7500实时荧光定量PCR仪进行荧光定量PCR检测。反应体系为:SYBR®Premix ExTaq TM Ⅱ(2×)10 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,10 μmol/L上下游引物各0.4 μL,cDNA 2 μL,加去离子水补足反应总体积至20 μL。反应条件为:95 ℃预变性30 s;95 ℃ 5 s、60 ℃ 34 s,40个循环;60 ℃延伸时采集荧光信号。反应结束后对扩增产物进行溶解曲线分析,以确保特异性扩增。采用2−ΔΔCt法计算样品中IgD基因mRNA的相对表达量。
1.2.5 嗜水气单胞菌疫苗免疫 选取120尾健康的剑尾鱼,分为3个平行试验组和1个对照组,每组30尾(水温保持在28 ℃±2 ℃)。试验组每尾剑尾鱼按说明书腹腔注射嗜水气单胞菌疫苗进行免疫,对照组注射等量0.65%生理盐水。免疫后分别在6 h、12 h、1 d、2 d、4 d、7 d、11 d,每组各取3尾鱼的脾、头肾和肠组织,采用qRTPCR检测各组织不同时间IgD基因mRNA的相对表达量。
采用SPSS 26软件单因素方差分析对IgD相对表达量进行差异显著性比较。
2 结果与分析 2.1 剑尾鱼IgD基因扩增结果本研究对剑尾鱼IgD基因进行扩增,测序获得的DNA片段用DNAstar进行拼接后获得长为6 970 bp的序列。通过RT-PCR,得到IgD基因的完整ORF,长为3 897 bp的cDNA序列,该序列编码1 298个氨基酸(图 1),预测其编码蛋白质分子量为145.5 ku,等电点pI为7.23。氨基酸序列分析结果(图 1)显示,剑尾鱼IgD基因结构由可变区和恒定区组成,恒定区由CH1-CH2- CH3-CH4-CH5-CH6-CH7和1个跨膜区(TM)组成。

|
| 起始密码子(ATG)和终止密码子(TAA)下划线标出,VH表示可变区,CH1~CH7表示7个恒定区,TM灰色部分表示跨膜区,*表示终止密码子不翻译氨基酸 The start codon (ATG) and the stop codon (TAA) of open reading frame are underlined, VH represents variable region, CH1-CH7 represent the 7 constant regions, TM represents transmembrane region, * represents no translation amino acid 图 1 剑尾鱼IgD基因ORF序列及推导的氨基酸序列 Fig. 1 ORF sequence and deduced amino acid sequence of IgD from Xiphophorus helleri |
2.2 剑尾鱼与不同鱼类IgD基因的进化关系
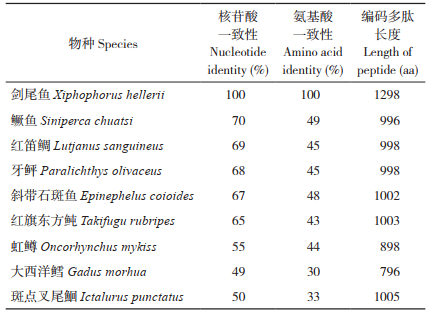
将剑尾鱼与其他鱼类IgD基因ORF核苷酸序列及其编码的氨基酸序列进行一致性比较,结果(表 2)显示,剑尾鱼与鳜、红笛鲷、牙鲆、斜带石斑鱼、红旗东方鲀和虹鳟的IgD核苷酸序列和氨基酸序列相似性稍高,核苷酸序列一致性为65~70%,氨基酸序列一致性为43~49%;与大西洋鳕和斑点叉尾鮰的一致性较低,核苷酸序列一致性分别为49%和50%,氨基酸序列一致性为30%和33%。构建剑尾鱼IgD氨基酸序列与其他鱼类IgD氨基酸序列系统进化树(图 2)发现,剑尾鱼与鳜、红笛鲷、斜带石斑鱼、牙鲆、红旗东方鲀聚为一支,然后与虹鳟和大西洋鳕鱼聚为一大支,与斑点叉尾鮰分属两支,其中剑尾鱼与鲀形目的红旗东方鲀亲缘关系最近,其分子分类地位与生物学分类一致。
|

|
| 图 2 剑尾鱼与其他鱼类IgD氨基酸序列的系统进化树 Fig. 2 Phylogenic tree of IgD amino acid sequence from Xiphophorus helleri and other species of fishes |
2.3 剑尾鱼IgD基因的组织表达分析
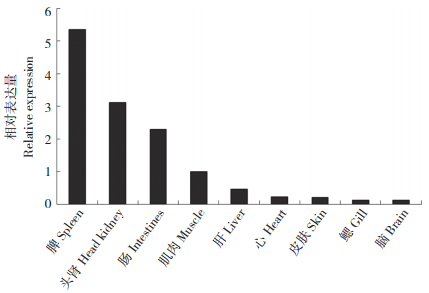
应用RT-PCR技术,以β-actin为内参基因,用设计的荧光定量检测引物检测剑尾鱼鳃、脑、心脏、肝、脾、头肾、肠、肌肉和表皮9个组织中IgD基因的组织表达分布特征。结果(图 3)表明,IgD在脾中分布最高,其次是头肾、肠和肌肉,在肝脏、皮肤、心、鳃和脑中表达较低。
|
| 图 3 剑尾鱼不同组织中IgD基因的组织特异性表达 Fig. 3 Tissue-specific expression of IgD gene in different tissues of Xiphophorus helleri |
2.4 嗜水气单胞菌疫苗免疫后IgD基因的表达规律
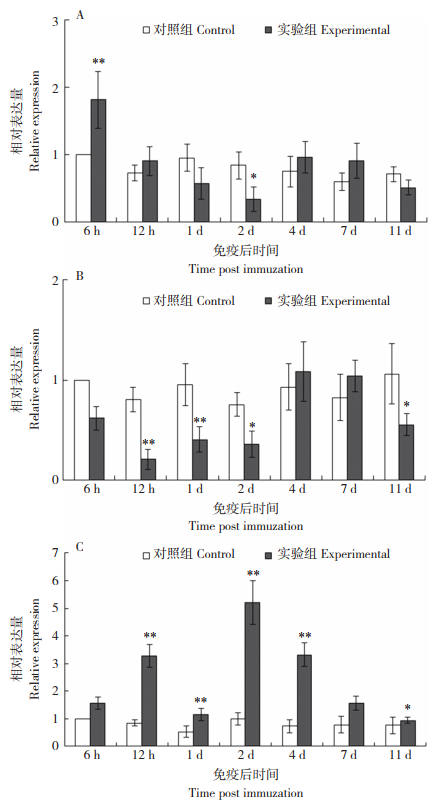
通过RT-PCR检测嗜水气单胞菌疫苗免疫剑尾鱼6 h、12 h、1 d、2 d、4 d、7 d和11 d后IgD在其脾脏、头肾和肠中的表达变化。结果(图 4)显示,剑尾鱼头肾、脾脏和肠中的IgD mRNA表达量在嗜水气单胞菌疫苗免疫后均发生明显变化,其中头肾中IgD在免疫后6 h时表达量显著上调后开始下调,并在免疫后2 d时达到最低值;脾脏中IgD在免疫后12 h表达量显著下调,并一直持续至第2天,至免疫后11 d表达量仍然显著低于对照;与脾脏IgD不同的是,肠道中IgD在免疫后12 h显著上调,为对照的4倍,并在第2天达到峰值,为对照的5.2倍,随后表达量下调,至第11天时逐渐恢复至正常水平。
|
| A:头肾;B:脾;C:肠*、**:分别表示差异显著、差异极显著 A: Head kidney; B: Spleen; C: Intestine *, ** represents significant difference and extremely significant difference, respeotively 图 4 嗜水气单胞菌疫苗免疫后IgD在各器官中的表达变化 Fig. 4 Expression of IgD mRNA in different organs after vaccination with Aeromonas hydrophila vaccine |
3 讨论
本研究通过基因克隆获得剑尾鱼IgD cDNA,其ORF序列3 897 bp,编码1 298个氨基酸。该序列具有鱼类IgD的经典结构域,包含可变区和恒定区域,恒定区包含鱼类IgD典型的CH1-CH2-CH3-CH4-CH5-CH6-CH7和1个跨膜区,其ORF与斜带石斑鱼、牙鲆红笛鲷和鳜的一致性为67%~70%,表明本试验成功克隆到剑尾鱼IgD cDNA序列。
本研究发现,剑尾鱼IgD基因主要在头肾、脾脏中高表达。这种现象在牙鲆[7]、鳜鱼[8]、斜带石斑鱼[9]、大菱鲆[10]、团头鲂[12]等鱼类中也有类似报道。头肾和脾脏是鱼类重要的免疫器官,是免疫应答的主要场所。IgD在剑尾鱼头肾和脾脏中大量分布,表明其作为鱼类重要的免疫球蛋白,在鱼类的免疫应答过程中发挥重要作用。鱼类IgD表达具有一定的组织特异性,不同鱼体之间也有一定差异。牙鲆IgD基因在心脏和肝脏内未检测到表达[7],鳜IgD基因在心脏、肠、肝脏、鳃和脑中未检测到表达[8],大菱鲆IgD基因在鳃、肠道和心脏中有检测到表达[10],欧洲海鲈(Dicentrarchus labrax L.)IgD嵌合体在鳃、肠和头肾中有较高表达[13]。本试验中,剑尾鱼IgD基因在肠、肌肉、肝、心脏、鳃和脑中均检测到表达,且在肠中的表达量仅低于头脾脏和头肾。肠是营养物质消化吸收的主要场所,也是重要的免疫组织,IgD在剑尾鱼肠道中有较高表达,表明其可能参与肠道相关免疫反应。
由于剑尾鱼IgD在肠中的水平较高,本研究选取头肾、脾脏和肠3类组织来研究疫苗免疫后IgD的表达变化情况。目前关于鱼类IgD的研究较少,初步认为IgD主要作为成熟B淋巴细胞膜上的一种特异性抗原受体而存在,可能在细胞发育和信号传递过程以及刺激、诱导其他细胞因子分泌发挥作用[14]。在用灭活柱状黄杆菌免疫鳜后,其IgD基因在头肾和脾脏内表达量显著上升[15],用灭活的无乳链球菌免疫吉富罗非鱼(Oreochromis niloticus)后,其肾、脾脏、胸腺中的IgD基因表达量也上调[16]。外界病原菌刺激印度淡水鲤鱼(Catla catla)后,其肾脏和脾脏中IgD表达也明显上调,但其原代细胞培养物经抑制剂处理后,肾脏和脾脏中IgD表达出现明显下调,表明其可能存在信号传导作用[17]。在对人体和小鼠的研究中发现,IgD受到免疫原刺激后,其细胞表面IgD出现迅速下调[12],类似地,在灭活鳗弧菌免疫大菱鲆后,其头肾中的IgD也出现迅速下调,之后逐渐恢复[10]。牙鲆在注射免疫灭活鳗弧菌后,肾和脾脏中IgD的表达量均出现快速显著下调,之后逐渐恢复到对照水平[1]。类似于以上现象,本研究中,剑尾鱼头肾IgD在嗜水气单胞菌疫苗免疫后6 h明显上调表达,之后出现下调并在11 d时基本恢复对照水平;脾脏中IgD在免疫后出现明显下调,且一直持续到免疫后第2天。表明剑尾鱼IgD参与了免疫应答反应,并具有免疫组织特异性,IgD可能在剑尾鱼的免疫应答中存在某些调控和补偿作用。
反之,剑尾鱼肠中IgD在嗜水气单胞菌疫苗免疫后出现显著上调。与在头肾和脾脏中相比,肠中IgD相对变化最为明显,第2天时表达为对照的5.2倍,且后期表达量一直处于较高水平。鱼类肠道除具有消化功能外,也是鱼类粘膜免疫系统的重要组成部分,其构成的局部免疫应答环境可以保护鱼类免受病原体感染[19]。肠中的免疫球蛋白,在通过其上皮抵抗潜在病原体入侵方面起着重要作用[5, 20]。在前人研究中发现,肠道表面的微生物群大部分被IgT包裹,但IgM和IgD也与部分相似比例的肠道共生细菌进行了结合[21]。有研究表明,鱼类IgD可以覆盖粘膜组织中的一部分共生微生物群,包括肠粘膜、鳃粘膜等,表明鱼类IgD可能也参与粘膜内稳态[22-24]。本研究中,IgD在剑尾鱼肠中有较高分布,以及嗜水气单胞菌疫苗免疫后肠中IgD明显上调表达并一直处于较高表达水平,表明IgD可能在剑尾鱼肠道粘膜免疫中发挥一定作用,具体作用及机制有待进一步研究。
4 结论本研究成功克隆获得剑尾鱼IgD基因序列,其cDNA序列开放读码框长为3 897 bp,编码1 298个氨基酸,且具有鱼类IgD的经典结构域。系统进化分析显示,剑尾鱼IgD基因与鳜IgD基因序列一致性最高,为70%。IgD在剑尾鱼的组织器官中均有分布,主要分布于剑尾鱼的脾、头肾和肠中,经嗜水气单胞菌疫苗免疫后,剑尾鱼头肾、脾脏和肠中IgD基因的表达量发生明显表达变化,在头肾和脾脏中先下调后上升,表明IgD可能参与了剑尾鱼的免疫应答,并具有一定的免疫组织特异性。肠道中IgD高水平分布及在疫苗免疫后显著上调表达,表明其可能参与了对抗外来病原入侵的粘膜免疫。本研究结果为进一步研究鱼类IgD的功能及作用机制奠定基础。
| [1] |
SUN Y, HUANG T, HAMMARSTRM L, HAMMARSTRM L, ZHAO Y. The Immunoglobulins: new insights, implications, and applications[J]. Annual Review of Animal Biosciences, 2020, 8(1): 145-169. DOI:10.1146/annurev-animal-021419-083720 |
| [2] |
FLAJNIK M F. Comparative analyses of immunoglobulin genes: surprises and portents[J]. Nature Reviews Immunology, 2018, 18(7): 438-453. DOI:10.1038/s41577-018-0003-9 |
| [3] |
GUTZEIT C, CHEN K, CERUTTI A. The enigmatic function of IgD: some answers at last[J]. European Journal of Immunology, 2018, 48(7): 1101-1113. DOI:10.1002/eji.201646547 |
| [4] |
陈信锦, 王忠良, 黄瑜, 樊博琳, 简纪常, 王蓓. 纳米材料在渔用疫苗中的研究进展[J]. 广东农业科学, 2021, 48(1): 134-141. DOI:10.16768/j.issn.1004-874X.2021.01.017 CHEN X J, WANG Z L, HUANG Y, FAN B L, JIAN J C, WANG B. Research progress in application of nanomaterials in fish vaccine[J]. Guangdong Agricultural Sciences, 2021, 48(1): 134-141. DOI:10.16768/j.issn.1004-874X.2021.01.017 |
| [5] |
黎源, 王蓓, 汪志文, 汤菊芬, 鲁义善, 简纪常. 罗非鱼无乳链球菌传播途径与逃避宿主免疫防御策略[J]. 广东农业科学, 2017, 44(7): 132-140. DOI:10.16768/j.issn.1004-874X.2017.07.021 LI Y, WANG B, WANG Z W, TANG J F, LU Y S, JIAN J C. Transmission routes of Streptococcus agalactiae and the strategy of immune evasion in tilapia[J]. Guangdong Agricultural Sciences, 2017, 44(7): 132-140. DOI:10.16768/j.issn.1004-874X.2017.07.021 |
| [6] |
WILSON M, BENGTEN E, MILLER N W, CLEM L W, WARR P. A novel chimeric Ig heavy chain from a teleost fish shares similarities to IgD[J]. Proceedings of the National Academy of the Sciences of the United States of America, 1997, 94(9): 4593-4597. DOI:10.1073/pnas.94.9.4593 |
| [7] |
HIRONO I, NAM B H, ENOMOTO J, UCHINO K, AOKI T. Cloning and characterization of a cDNA encoding Japanese flounder Paralichthy solivaceus IgD[J]. Fish & Shellfish Immunology, 2003, 15(1): 63-70. DOI:10.1016/S1050-4648(02)00139-0 |
| [8] |
王改玲, 骆彦萍, 孙宝剑, 徐镇, 许巧情, 聂品. 鳜免疫球蛋白D重链基因的克隆与表达分析[J]. 中国水产科学, 2010, 17(1): 11-20. WANG G L, LUO Y P, SUN B J, XU Z, XU Q Q, NIE P. Cloning and expression of immunoglobulin D heavy chain in mandarin fish, Siniperca chuatsi[J]. Journal of Fishery Sciences of China, 2010, 17(1): 11-20. |
| [9] |
黄贝, 陈善楠, 徐镇, 聂品. 斜带石斑鱼IgM、IgZ和IgD重链基因的克隆[J]. 水产学报, 2012, 36(7): 1000-1010. DOI:10.3724/SP.J.1231.2012.27973 HANG B, CHEN S N, XU Z, NIE P. Molecular characterization of IgM, IgZ and IgD heavy chain genes in orange-spotted grouper (Epinephelus coioides)[J]. Journal of Fishries China, 2012, 36(7): 1000-1010. DOI:10.3724/SP.J.1231.2012.27973 |
| [10] |
陈孔茂, 唐小千, 绳秀珍, 邢婧, 战文斌. 大菱鲆mIgD重链基因的克隆与表达分析[J]. 中国海洋大学学报(自然科学版), 2014, 44(3): 26-33. CHEN K M, TANG X Q, SHEN X Z, ZH W B. Cloning and expression analysis of immunoglobulin heavy chain gene of Scophthalmus maximus[J]. Periodical of Ocean University of China, 2014, 44(3): 26-33. |
| [11] |
吴淑勤, 黄志斌, 石存斌, 李凯彬, 潘厚军, 常藕琴. 水生实验动物-剑尾鱼[M]. 北京: 中国农业出版社, 2005: 7-9, 93-108. WU S Q, HUANG Z B, SHI C B, LI K B, PAN H J, CHANG O Q. Aquatic laboratory animals-swordtail fish[M]. Beijing: China Agriculture Press, 2005: 7-9, 93-108. |
| [12] |
XIA H, WU K, LIU W, WANG W, ZHANG X. Spatio-temporal expression of blunt snout bream (Megalobrama amblycephala) mIgD and its immune response to Aeromonas hydrophila[J]. Central European Journal of Immunology, 2015, 40(2): 132-141. DOI:10.5114/ceji.2015.52825 |
| [13] |
FRANCESCO B, GIUSEPPE S, ALBERTO P, GERDO M. Identification of an IgD/IgT chimera in the European sea bass (Dicentrarchus labrax L.)[J]. Fish & Shellfish Immunology, 2020, 105: 224-232. DOI:10.1016/j.fsi.2020.07.041 |
| [14] |
WAN Z, ZHAO Y, SUN Y. Immunoglobulin D and its encoding genes: An updated review[J]. Developmental & Comparative Immunology, 2021, 124: 104198. DOI:10.1016/j.dci.2021.104198 |
| [15] |
TIAN J, SUN B, LUO Y, ZHANG Y, NIE P. Distribution of IgM, IgD and IgZ in mandarin fish, Siniperca chuatsi lymphoid tissues and their transcriptional changes after Flavobacterium columnare stimulation[J]. Aquaculture, 2009, 288(1/2): 14-21. DOI:10.1016/j.aquaculture.2008.11.023 |
| [16] |
王培. 无乳链球菌诱导吉富罗非鱼sIgM、mIgD重链基因的克隆及表达分析[D]. 湛江: 广东海洋大学, 2014. DOI: 10.7666/d.D522201. WANG P. Expression and function analysis of sIgM and mIgD heavy chain gene in GIFT Strain of Nile Tilapia (Oreochromis niloticus) induced by Streptococcus agalactiae[D]. Zhanjiang: Guangdong Ocean University, 2014. DOI: 10.7666/d.D522201. |
| [17] |
BANERJEE R, SAMANTA M, DAS S. NF-κB signaling induces inductive expression of the downstream molecules and IgD gene in the freshwater carp, Catla catla[J]. 3 Biotech, 2020, 10(10): 445. DOI:10.1007/s13205-020-02435-7 |
| [18] |
薛洁, 宋晓青, 邢婧, 战文斌. 牙鲆注射免疫鳗弧菌灭活疫苗后13种免疫相关基因表达的变化[J]. 中国海洋大学学报(自然科学版), 2016, 46(2): 42-53. DOI:10.16441/j.cnki.hdxb.20150022.hdxb.20150022 XUE J, SONG X Q, XING J, ZHAN W B. Expression analysis of 13 immune related genes of Flounder (Paralichthys olivaceus) vaccinated with formalin-inactivated Vibrio anguillarum[J]. Periodical of Ocean University of China, 2016, 46(2): 42-53. DOI:10.16441/j.cnki.hdxb.20150022.hdxb.20150022 |
| [19] |
YU Y Y, WANG Q C, HUANG Z Y, DING L, XU Z. Immunoglobulins, mucosal immunity and vaccination in teleost fish[J]. Frontiers in Immunology, 2020, 11: 567941. DOI:10.3389/fimmu.2020.567941 |
| [20] |
SOMMER F, BACKHED F. The gut microbiota-masters of host development and physiology[J]. Nature Reviews Microbiology, 2013, 11: 227-238. |
| [21] |
PERDIGUERO P, MARTIN-MARTIN A, BENEDICENTI O, P DIAZROSALES, MOREL E, MUOZ-ATIENZA E. Teleost IgD+ IgM B cells mount clonally expanded and mildly mutated intestinal IgD responses in the Absence of lymphoid follicles[J]. Cell Reports, 2019, 29(13): 223-235. DOI:10.1016/j.celrep.2019.11.101 |
| [22] |
ZHEN X, TAKIZAWA F, PARRA D, D GOMEZ, JRGENSEN L V G, LAPATRA S E, SNUYER J O. Mucosal immunoglobulins at respiratory surfaces mark an ancient association that predates the emergence of tetrapods[J]. Nature Communications, 2016, 7(1): 10728. DOI:10.1038/ncomms10728 |
| [23] |
YU Y Y, KONG W G, XU H Y, HUANG Z Y, XU Z. Convergent evolution of mucosal immune responses at the buccal cavity of teleost fish[J]. iScience, 2019, 19: 821-835. DOI:10.1016/j.isci.2019.08.034 |
| [24] |
KONG W G, YU Y Y, DONG S, HUANG Z Y, XU Z. Pharyngeal immunity in early vertebrates provides functional and evolutionary insight into mucosal homeostasis[J]. Immunology, 2019, 230(11): 3054-3067. DOI:10.4049/jimmunol.1900863 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49





