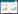文章信息
基金项目
- 广东省现代农业产业技术体系创新团队项目(2019KJ124);广东省重点领域研发计划项目(2020B020225005)
作者简介
- 陈文凯(1997-), 男, 在读硕士生, 研究方向为家蚕丝素蛋白及其生物材料, E-mail: chenwenkai@stu.scau.edu.cn.
通讯作者
- 陈芳艳(1971-), 女, 博士, 副教授, 研究方向为蚕业资源高值化利用, E-mail: chenfangyan@scau.edu.cn.
文章历史
- 收稿日期:2021-12-31
2. 华南农业大学公共基础课实验教学中心, 广东 广州 510642
2. Center of Experimental Teaching for Common Basic Courses, South China Agricultural University, Guangzhou 510642, China
【研究意义】短纤维是指长度介于厘米和纳米之间的纤维段[1],在药物控释、组织工程、诊断检测等生物医学领域应用广泛[2-6]。例如,在肿瘤治疗阶段以微创治疗的方式将功能化短纤维注入肿瘤部位,可通过发挥靶向识别、缓释给药等多重作用来抑制肿瘤生长[7-8];机体出现组织缺损需要填补时,可将短纤维制备的仿生三维立体支架材料填补缺损部位[9-10]。蚕丝是天然蛋白质纤维,具有良好的力学性能、可降解性和良好的生物相容性,易于加工和修饰[11],将其加工成短纤维,在食品添加剂、造纸基材、药物缓释载体、生物支架材料等领域具有广阔的应用前景[12-14]。
【前人研究进展】短纤维的制备方法有物理法、化学法以及物理化学相结合的方法。物理法是直接将长纤维通过物理切断、粉碎等处理方法得到特定长度的纤维段,该法生产成本低,但难以获得尺寸较小的短纤维[15]。化学法是利用化学溶剂将纤维水解成短的纤维段,该法易生产,但短纤维尺寸不易控制[16-17]。魏子凯等[16]采用氢氧化钠尿素混合液制备出长度为2~3 mm的桑蚕丝素短纤维,该短纤维内部结构基本没有破坏,可满足后续对短纤维改性的要求;李淋倍等[17]采用氢氧化钠超声辅助法溶解桑蚕丝素制备短纤维,获得均一性相对较好的短纤维。物理化学法是将物理法与化学法相结合,先将丝素用化学方法溶解获得丝素溶液,然后再利用静电纺丝法通过设定不同参数,将丝素溶液进行加工从而得到纳米级尺寸的纤维[18-19],该法可实现纤维取向、结构、形貌的调控[20],但增加了处理步骤,对设备有较高要求。柞蚕丝素蛋白富含有精氨酸- 甘氨酸- 天门冬氨酸(arginine-glycine-aspartic acid, RGD)三肽序列[21],与桑蚕丝相比在细胞黏附性方面更有优势[22]。柞蚕丝与桑蚕丝相比,虽然氨基酸组成相同,但溶解性相差极大,由于柞蚕丝纤维含有大量聚丙氨酸β- 折叠结构,内部大分子排列紧密,取向度高,结晶度高,因此难以溶解和水解[23-24]。例如氯化钙- 乙醇混合液、溴化锂等溶液可以很容易将桑蚕丝素水解,但对柞蚕丝素却显得无能为力[25-27]。
【本研究切入点】目前虽有桑蚕丝素短纤维制备的研究报道,但未见有关柞蚕丝素短纤维(Tussah Silk Fibroin, TSF)制备方法的研究报道。为了填补当前柞蚕丝素短纤维制备方法的空白,进一步提升柞蚕丝更高的附加值,特开展本试验研究。【拟解决的关键问题】本研究采用酸水解、碱水解和盐水解3种方法,设置不同的水解温度、水解时间和溶剂浓度等条件制备柞蚕丝素短纤维,通过对柞蚕丝素短纤维制备率和形貌结构比较,筛选出制备柞蚕丝素短纤维的适宜方法,所得短纤维可作为一种载体为今后新型生物材料的研发提供更好的选择。
1 材料与方法 1.1 试验材料试验于2020年9月在华南农业大学亚太地区蚕桑培训中心进行。供试的柞蚕茧壳来源于辽宁丹东。试验所用的盐酸、三氯化铁、氢氧化钠、碳酸钠均为市售分析纯试剂。试验主要仪器有37XC型倒置显微镜(上海永亨光学仪器制造有限公司)。
1.2 柞蚕丝素纤维的制备参照Li等[28]的方法,称取柞蚕茧壳10 g,置于500 mL 0.5% Na2CO3溶液中,于100 ℃条件下搅拌30 min,脱胶结束后用60 ℃蒸馏水冲洗干净。以上过程重复3次,然后在75 ℃条件下干燥2.5 h,得到干燥的脱胶柞蚕丝素。
1.3 柞蚕丝素短纤维的制备1.3.1 HCl制备柞蚕丝素短纤维 准确称取0.3 g脱胶柞蚕丝素置于50 mL圆底烧瓶中,加入20 mL HCl溶液,然后进行恒温水浴加热冷凝回流处理,选择HCl浓度、水解温度、水解时间进行单因素试验,设置HCl浓度为1、1.5、2、2.5、3 mol/L,水解温度为70、80、85、90、95 ℃,水解时间为20、30、35、40、45 min。反应结束后,用孔径为38 μm的尼龙滤布过滤去除杂质,得到含短纤维的滤液,滤液再经中速滤纸过滤,收集滤纸上的短纤维,用去离子水洗至中性,置于60 ℃下干燥至恒重,得到柞蚕丝素短纤维。分别考查各因素对柞蚕丝素短纤维制备率的影响。短纤维制备率计算公式为:

|
1.3.2 NaOH制备柞蚕丝素短纤维 准确称取0.3 g脱胶柞蚕丝素置于50 mL圆底烧瓶中,加入20 mL NaOH溶液,然后进行恒温水浴加热冷凝回流处理,选择NaOH浓度、水解温度、水解时间进行单因素试验,设置NaOH浓度为10、12、14、16、18 mol/L,水解温度为70、75、80、85、90 ℃,水解时间为10、15、20、25、30 min。反应结束的后续处理参照1.3.1,得到柞蚕丝素短纤维。分别考查各因素对柞蚕丝素短纤维制备率的影响。
1.3.3 FeCl3制备柞蚕丝素短纤维 准确称取0.3 g脱胶柞蚕丝素置于50 mL圆底烧瓶中,加入20 mL FeCl3溶液,然后进行恒温油浴加热冷凝回流处理,选择FeCl3浓度、水解温度、水解时间进行单因素试验,设置FeCl3浓度为0.1、0.12、0.14、0.16、0.18、0.2 mol/L,水解温度为90、95、100、105、110 ℃,水解时间为1、2、3、4、5、6 h。反应结束的后续处理参照1.3.1,得到柞蚕丝素短纤维。分别考查各因素对柞蚕丝素短纤维制备率的影响。
1.4 柞蚕丝素短纤维的形貌分析将3种方法制备得到的柞蚕丝素短纤维均匀平铺在载玻片上,滴加甘油,然后在倒置显微镜下观察短纤维的形貌特征。随机选取若干视野,测量并记录其中各短纤维的长度,统计短纤维的主要长度分布区域。
1.5 数据处理与统计分析试验数据用Excel软件进行处理,用SPSS 22.0和Design-Expert V8.0.6.1软件对结果进行单因素方差分析以及LSD检验和Duncan检验。
2 结果与分析 2.1 不同溶剂对柞蚕丝素短纤维制备率的影响2.1.1 HCl对柞蚕丝素短纤维制备率的影响 采用HCl制备柞蚕丝素短纤维,固定水解温度为90 ℃,水解时间为40 min,从图 1A可知,短纤维制备率随着HCl浓度增加显著提高,HCl浓度为3 mol/L时达到最大值(26.50%),继续增加HCl浓度时,柞蚕丝素出现碳化现象。因此,HCl浓度以3 mol/L为宜。
|
| 图中小写英文字母不同者表示差异显著 Different lowercase letters in the small figures represent significant differences 图 1 HCl浓度(A)、水解温度(B)、水解时间(C)对柞蚕丝素短纤维制备率的影响 Fig. 1 Effects of HCl concentration (A), hydrolysis temperature (B) and hydrolysis time (C) on the preparation rate of tussah silk short fiber |
从图 1B可知,在HCl浓度为3 mol/L、水解时间为40 min条件下,水解温度低于70 ℃时,反应进程缓慢,短纤维制备率低。温度从70 ℃增加至85 ℃时,随着温度提升,短纤维制备率显著增加。特别是当温度从80 ℃升至85 ℃时,短纤维制备率增加了11.48%,这可能是由于温度的提升使得溶剂分子动能增加,加快了蚕丝纤维溶解,增加温度为氢键断裂提供更多键能,使其更容易断裂。90 ℃时短纤维制备率达到最大值(24.22%),之后变化不大。因此,水解温度以90 ℃较为适宜。
从图 1C可知,在恒温90 ℃、HCl浓度为3 mol/L条件下,水解20 min起,随着时间延长,短纤维制备率显著提升,当水解时间为40 min时,短纤维制备率达到最大值(24.35%),再继续延长水解时间,制备率出现下降。这可能随着时间延长,越来越多高分子丝素被降解为蛋白肽、胨和氨基酸,溶液中多为小分子肽链,导致短纤维制备率有所降低[29]。因此,水解时间以40 min较为适宜。
综上所述,利用HCl在浓度3 mol/L、水解时间40 min、水解温度90 ℃的工艺条件下,柞蚕丝素短纤维制备率最大可达26.50%。
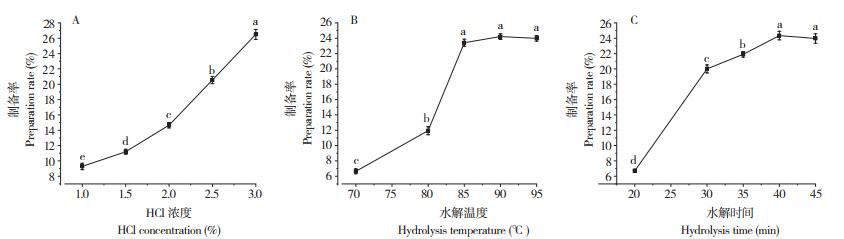
2.1.2 NaOH对短纤维制备率的影响 采用NaOH制备柞蚕丝素短纤维,在80 ℃恒温下水解20 min,当NaOH浓度从10 mol/L逐步提升至16 mol/L时,短纤维制备率显著提升(图 2A)。这是由于碱液浓度提高加速了蚕丝蛋白结构中氢键的断裂,促进蚕丝蛋白纤维溶解。NaOH浓度为16 mol/L时达到最大值(22.65%),继续增加NaOH浓度则短纤维制备率出现降低。这可能由于柞蚕丝素降解为短纤维后又进一步降解为肽、胨和氨基酸所致[30]。因此,NaOH浓度以16 mol/L较为适宜。
|
| 图中小写英文字母不同者表示差异显著 Different lowercase letters in the small figures represent significant differences 图 2 NaOH浓度(A)、水解温度(B)、水解时间(C)对柞蚕丝素短纤维制备率的影响 Fig. 2 Effects of NaOH concentration (A), hydrolysis temperature (B) and hydrolysis time (C) on the preparation rate of tussah silk short fiber |
从图 2B可知,在NaOH浓度为16 mol/L、水解时间为20 min条件下,水解温度低于70 ℃时,短纤维制备率较低,说明NaOH水解柞蚕丝素需要在一定温度条件下进行,温度太低,丝素纤维的内部结构未被充分打开,碱液不容易进入。当水解温度处于70~80 ℃区间,短纤维制制备率随着水解温度的增加显著提升,温度为80 ℃时制备率达到最大值(23.22%),继续加温变化不大。因此,水解温度以80 ℃较为适宜。
从图 2C可知,固定水解温度为80 ℃、NaOH浓度为16 mol/L,水解10~20 min时间段内,短纤维制备率随着水解时间的增加显著提升,当水解20 min时达到最大值(23.56%),继续延长时间的制备率变化不大。因此,水解时间以20 min较为适宜。
综上所述,利用NaOH在浓度16 mol/L、水解时间20 min、水解温度80 ℃的工艺条件下,柞蚕丝素短纤维制备率最大可达23.56%。
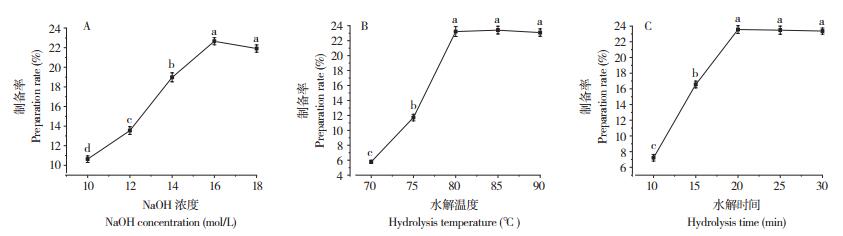
2.1.3 FeCl3对短纤维制备率的影响 FeCl3为强酸弱碱盐,强酸弱碱盐类在水中可电离出氢离子,在水中生成的氢离子和其他离子会促使水分子极性增加,破坏丝素蛋白分子间作用力,从而促进丝素膨润水解[31]。采用NaOH制备柞蚕丝素短纤维,固定水解温度为100 ℃、水解时间为5 h,从图 3A可见,当FeCl3浓度从0.14 mol/L增加到0.18 mol/L时,短纤维制备率较大幅提升,FeCl3浓度达到0.18 mol/L时,制备率达到最大值(21.8%),继续增加FeCl3浓度则制备率略微降低。因此,FeCl3浓度以0.18 mol/L较为适宜。
|
| 图中小写英文字母不同者表示差异显著 Different lowercase letters in the small figures represent significant differences 图 3 FeCl3浓度(A)水解温度(B)、水解时间(C)对柞蚕丝素短纤维制备率的影响 Fig. 3 Effects of FeCl3 concentration (C), hydrolysis temperature (B) and hydrolysis time (C) on the preparation rate of tussah silk short fiber |
从图 3B可知,在FeCl3浓度为0.18 mol/L、水解时间为5 h条件下,降解温度低于90 ℃时丝素纤维缠绕为团状,水解反应较慢,短纤维制备率极低。当温度从90 ℃逐步提升到100 ℃时,特别是从95 ℃提升至100 ℃时,短纤维制备率显著增加。可见高温有利于大分子运动,柞蚕丝素纤维的内部结构被打开,盐和水等小分子更容易进入,从而使柞蚕丝素水解[24]。105 ℃时,短纤维制备率达到最大值(19.34%),继续升温其制备率基本保持不变。因此,水解温度以105 ℃较为适宜。
从图 3C可知,在恒温105 ℃、FeCl3浓度为0.18 mol/L条件下,水解2~4 h,短纤维制备率得到显著提升。当水解5 h时短纤维制备率达到最大值(19.94%),继续延长水解时间的制备率呈现下降趋势。因此,水解时间以5 h较为适宜。
综上所述,利用FeCl3在浓度0.18 mol/L、水解时间5 h、水解温度105 ℃的工艺条件下,柞蚕丝素短纤维制备率最大可达21.8%。
2.2 不同方法制备的柞蚕丝素短纤维形貌特征比较分析取上述3种方法制备的等体积柞蚕丝素短纤维悬浊液在倒置显微镜下观察。FeCl3水解法制备的短纤维(图 4A)呈细长短杆状,长短不一,两端切口为平面或斜面,颜色较深,可能是吸附了少量Fe3+离子所致。HCl水解法制备的柞蚕丝素短纤维(图 4B)两端切口平整,呈细长杆状,长短不一,短纤维颜色较浅,外表未观察到裂痕,即水解过程中反应未对柞蚕丝素表面造成明显破坏,一定程度上保持了纤维原本结构。NaOH水解法制备的柞蚕丝素短纤维(图 4C)颜色较浅且透明,呈无规则片状,短纤维表面形态与原纤维相比发生较大变化,显示出制备过程中NaOH对柞蚕丝素表面造成明显破坏。

|
| A、B、C分别为FeCl3、HCl、NaOH制备的短纤维 A, B, C show short fibers prepared by FeCl3, HCl and NaOH solutions, respectively 图 4 不同方法制备的柞蚕丝素短纤维形貌 Fig. 4 Morphologies of tussah silk short fibers prepared by different methods |
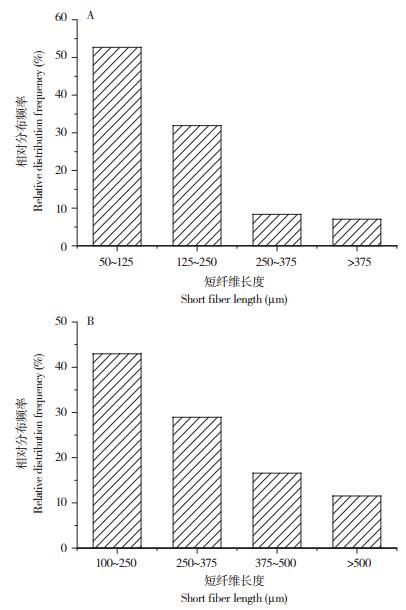
由于经NaOH处理后的柞蚕丝已不成纤维状,故只统计HCl和FeCl3制备的柞蚕丝素短纤维长度分布。HCl制备的短纤维长度较短且分布较为集中,长度50~125 μm的短纤维占比52.68%,125~250 μm的短纤维占比31.91%,250~375 μm的短纤维占比8.35%,大于375 μm的短纤维占比7.70%(图 5A)。FeCl3制备的短纤维长度为100~250 μm的占比42.97%,250~375 μm占比28.93%,375~500 μm占比16.57%,500 μm以上的占比11.52%(图 5B)。
|
| A、B分别为HCl、FeCl3制备的短纤维长度分布 A, B show length distribution of short fibers prepared by HCl and FeCl3, respectively 图 5 不同方法制备的柞蚕丝素短纤维长度分布 Fig. 5 Length distribution of tussah silk short fiber prepared by different methods |
3 讨论
柞蚕丝含有大量的聚丙氨酸β- 折叠结构,溶解难度大,从而限制了柞蚕丝的再生和加工成型。柞蚕丝水解工艺可分为盐水解、碱水解和酸水解(包括盐酸水解、磷酸水解、硫酸水解)[32]。李岩亮等[33]研究发现,对柞蚕丝水解影响最显著的因素是硫酸浓度和水解温度,料酸比和水解时间对提高水解率影响不大。吕明霞等[34]研究表明对柞蚕丝水解影响最大的为溶剂浓度和水解温度,其次是水解时间。本研究选取溶剂种类、溶剂浓度、水解温度、水解时间这几个对柞蚕丝水解以及短纤维制备率影响较大的因素作为变量,探究酸、碱和盐处理对柞蚕丝素短纤维制备率和形貌特征的影响。对试验中制备柞蚕丝素短纤维的3种方法进行综合比较。3种方法的柞蚕丝素短纤维制备率在23% 左右,其中HCl法和NaOH法的制备率相近,FeCl3法次之。在制备条件和短纤维质量方面,采用NaOH法制备柞蚕丝素短纤维,反应温度较低(80 ℃),处理时间短(20 min),但所需NaOH浓度过高(16 mol/L),柞蚕丝素表面受破坏严重,处理后已不成纤维状。邓婷婷等[35]研究表明蚕丝对碱性物质敏感,因而蚕丝的加工处理应尽可能避免使用强碱物质;采用FeCl3法制备柞蚕丝素短纤维,反应温度高(105 ℃),处理时间长(5 h),但反应易控制,纤维表面未受明显破坏,短纤维长度主要分布在100~250 μm,该长度范围占短纤维的比重为42.97%;采用HCl法制备柞蚕丝素短纤维的工艺简单,条件温和,所需HCl浓度较低。研究发现,HCl浓度为3 mol/L时,原本淡黄色的柞蚕丝有逐渐碳化的趋势,继续增加HCl浓度,柞蚕丝纤维碳化严重,整个水解液随着蚕丝的碳化而变黑。在HCl浓度为3 mol/L、水解时间40 min、水解温度90 ℃的工艺条件下,制备的柞蚕丝素短纤维表面并没有明显裂痕,说明其纵向受破坏少,短纤维长度较短且分布较为集中,50~125 μm的短纤维占比52.68%。由此可见,采用HCl法制备的柞蚕丝素短纤维形态较优且制备率相对最高。与魏子凯等[16]利用尿碱混合液制备的蚕丝短纤维相比,HCl法制备的短纤维更短,长度范围更加集中。此外,利用HCl容易挥发的特点,反应完成后采用真空抽除HCl,再通入氨水中,还可以生成氯化铵肥料,方法简单,对环境污染低,能满足当今绿色化学的主题。对蚕丝纤维资源进行基础性研究是促进其广泛应用的重要前提。本研究采用不同浓度和不同种类的酸、碱和盐溶液对柞蚕丝进行处理制备柞蚕丝素短纤维,该研究赋予了柞蚕丝更高的附加值,对今后拓展柞蚕丝用途具有一定参考意义。
4 结论本研究采用NaOH、FeCl3和HCl方法制备柞蚕丝素短纤维,其中HCl法简单易控制,所得的短纤维长度形态较优,且制备率相对最高。HCl法制备短纤维的工艺条件为:HCl浓度为3 mol/L,水解时间为40 min,水解温度为90 ℃,短纤维制备率最大可达26.5%,所得的短纤维表面光滑,无明显裂痕,长度分布较为集中且尺寸较短,长50~125 μm的短纤维占比52.68%。在本试验设计条件下,不需要复杂工艺,通过适当的酸处理即可使短纤维保留柞蚕丝纤维原有形态,制备所得的短纤维可作为添加材料应用于建筑、造纸、生物医学等领域,能为开发新型生物材料提供更多选择。
| [1] |
魏玉娟. 纺织应用化学[M]. 北京: 中国纺织出版社, 2007. WEI Y J. Chemistry in textile application[M]. Beijing: China Textiles Press, 2007. |
| [2] |
ZHAO J W, CUI W G. Functional electrospun fibers for local therapy of cancer[J]. Advanced Fiber Materials, 2020, 2(5): 229-245. DOI:10.1007/s42765-020-00053-9 |
| [3] |
HUANG W, XIAO Y C, SHI X Y. Construction of electrospun organic/inorganic hybrid nanofibers for drug delivery and tissue engineering applications[J]. Advanced Fiber Materials, 2019(1): 32-45. DOI:10.1007/s42765-019-00007-w |
| [4] |
LIU H, SUN N, DING P, CHEN C C, WU Z, ZHU W P, LIU L F, WANG Z L, PEI R J. Fabrication of aptamer modified TiO2 nanofibers for specific capture of circulating tumor cells[J]. Colloids and Surfaces B: Biointerfaces, 2020, 191: 110985. DOI:10.1016/j.colsurfb.2020.110985 |
| [5] |
FAN Z Y, ZHAO Y L, ZHU X Y, LUO Y, SHEN M W, SHI X Y. Folic acid modified electrospun poly(vinyl alcohol)/polyethyleneimine nanofibers for cancer cell capture applications[J]. Chinese Journal of Polymer Science, 2016, 34(6): 755-765. DOI:10.1007/s10118-016-1792-6 |
| [6] |
YANG G, LI X L, HE Y, XIONG X, WANG P, ZHOU S B. Capturing circulating tumor cells through a combination of hierarchical nanotopography and surface chemistry[J]. ACS Biomaterials Science & Engineering, 2018, 4(6): 2081-2088. DOI:10.1021/acsbiomaterials.7b00683 |
| [7] |
HE N, CHEN Z J, YUAN J, ZHAO L, CHEN M H, WANG T, LI X H. Tumor pH-responsive release of drug-conjugated micelles from fiber fragments for intratumoral chemotherapy[J]. ACS Applied Materials & Interfaces, 2017, 9(38): 32534-32544. DOI:10.1021/acsami.7b09519 |
| [8] |
CHEN Z J, LIU W P, ZHAO L, XIE S Z, CHEN M H, WANG T, LI X H. Acid-labile degradation of injectable fiber fragments to release bioreducible micelles for targeted cancer therapy[J]. Biomacromolecules, 2018, 19(4): 1100-1110. DOI:10.1021/acs.biomac.7b01696 |
| [9] |
YU H, CHEN X J, CAI J, YE D D, WU Y X, FAN L F, LIU P F. Novel porous three-dimensional nanofibrous scaffolds for accelerating wound healing[J]. Chemical Engineering Journal, 2019, 369: 253-262. DOI:10.1016/j.cej.2019.03.091 |
| [10] |
WANG T Y, BRUGGEMAN K F, KAUHAUSEN J A, RODRIGUEZ A L, NISBET D R, PARISH C L. Functionalized composite scaffolds improve the engraftment of transplanted dopaminergic progenitors in a mouse model of Parkinson's disease[J]. Biomaterials, 2016, 74: 89-98. DOI:10.1016/j.biomaterials.2015.09.039 |
| [11] |
LIU Y W, REN J, LING S J. Bioinspired and biomimetic silk spinning[J]. Composites Communications, 2019, 13: 85-96. DOI:10.1016/j.coco.2019.03.004 |
| [12] |
朱友胜, 张俊苗, 伍安国, 刘怡. 废蚕丝纤维抄造书画纸的生产工艺研究[J]. 丝绸, 2021, 58(7): 27-31. DOI:10.3969/j.isn.1001-7003.2021.07.005 ZHU Y S, ZHANG J M, W U A G, L IU Y. Research on the production process of painting and calligraphy paper with waste silk fiber[J]. Journal of Silk, 2021, 58(7): 27-31. DOI:10.3969/j.isn.1001-7003.2021.07.005 |
| [13] |
马艳, 李智, 冉瑞龙, 李康. 蚕丝在生物医用材料领域的应用研究[J]. 材料导报, 2018, 32(1): 86-92. DOI:10.11896/j.issn.1005-023X.2018.01.010 MA Y, LI Z, RAN R L, LI K. Research on application of silk in biomaterial field[J]. Materials Reports, 2018, 32(1): 86-92. DOI:10.11896/j.issn.1005-023X.2018.01.010 |
| [14] |
YUAN Q Q, YAO J R, CHEN X, HUANG L, SHAO Z Z. The preparation of high performance silk fiber/fibroin composite[J]. Polymer, 2010, 51(21): 4843-4849. DOI:10.1016/j.polymer.2010.08.042 |
| [15] |
杨瑞玲, 曾新. 负离子涤纶短纤维的研制[J]. 合成纤维, 2002(5): 29-31. DOI:10.16090/j.cnki.hcxw.2002.05.009 YANG R L, ZENG X. Trial production of anion polyester staple fiber[J]. Synthetic Fiber in China, 2002(5): 29-31. DOI:10.16090/j.cnki.hcxw.2002.05.009 |
| [16] |
魏子凯, 丁绍敏, 陆敏兴, 林海涛, 宁晚娥. 蚕丝蛋白短纤维的制备方法[J]. 丝绸, 2019, 56(7): 28-33. DOI:10.3969/j.issn.1001-7003.2019.07.005 WEI Z K, DING S M, LU M X, LIN H T, NING W E. Preparation methods of silk protein short fibers[J]. Jour nal of Silk, 2019, 56(7): 28-33. DOI:10.3969/j.issn.1001-7003.2019.07.005 |
| [17] |
李淋倍, 郑祚福, 林海涛. 超声辅助低浓度碱溶液溶解丝素的研究[J]. 轻纺工业与技术, 2021, 50(4): 1-3. DOI:10.3969/j.issn.2095-0101.2021.04.001 LI L B, ZHENG Z F, LIN H T. Ultrasonic assisted dissolution of silk fibroin in low concentration alkali solution[J]. Light and Textile Industry and Technology, 2021, 50(4): 1-3. DOI:10.3969/j.issn.2095-0101.2021.04.001 |
| [18] |
SCHOLTEN E, DHAMANKAR H, BROMBERG L, RUTLEDGE G C, HATTON T A. Electrospray as a tool for drug micro-and nanoparticle patterning[J]. Langmuir, 2011, 27(11): 6683-6688. DOI:10.1021/la201065n |
| [19] |
FATHONA I W, YABUKI A. A simple one-step fabrication of short polymer nanofibers via electrospinning[J]. Journal of Materials Science, 2014, 49(9): 3519-3528. DOI:10.1007/s10853-014-8065-y |
| [20] |
张蓓蕾, 沈明武, 史向阳. 静电纺短纤维的制备及其生物医学应用[J]. 纺织学报, 2021, 42(5): 1-8. DOI:10.13475/j.fzxb.20210106008 ZHANG B L, SHEN M W, SHI X Y. Preparation and biomedical applications of electrospun short fibers[J]. Journal of Textile Research, 2021, 42(5): 1-8. DOI:10.13475/j.fzxb.20210106008 |
| [21] |
MINOURA N, AIBA S, HIGUCHI M, GOTOH Y, TSUKADA M, IMAI Y. Attachment and growth of fibroblast cells on silk fibroin[J]. Biochemical and Biophysical Research Communications, 1995, 208(2): 511-516. DOI:10.1006/bbrc.1995.1368 |
| [22] |
SOFIA S, MCCARTHY M B, GRONOWICZ G, KAPLAN D L. Functionalized silk-based biomaterials for bone formation[J]. Journal of Biomedical Materials Research, 2001, 54(1): 139-148. DOI:10.1002/1097-4636(200101)54:1<139::AID-JBM17>3.0.CO;2-7 |
| [23] |
TAO W, LI M Z, ZHAO C X. Structure and properties of regenerated Antheraea pernyi silk fibroin in aqueous solution[J]. International Journal of Biological Macromolecules, 2007, 40(5): 472-478. DOI:10.1016/j.ijbiomac.2006.11.006 |
| [24] |
KWEON H, PARK Y H. Dissolution and characterization of regenerated Antheraea pernyi silk fibroin[J]. Journal of Applied Polymer Science, 2001, 82(3): 750-758. DOI:10.1002/app.1901 |
| [25] |
肖露, 杨旭超, 余卫华, 王佳丽, 唐仕成. 桑/柞蚕丝不同溶解体系再生丝素蛋白性能研究[J]. 纺织科技进展, 2017(11): 13-16. DOI:10.19507/j.cnki.1673-0356.2017.11.005 XIAO L, YANG X C, YU W H, WANG J L, TANG S C. Properties of regenerated silk fibroin from mulberry/tussah silk in different solvent systems[J]. Progress in Textile Science & Technology, 2017(11): 13-16. DOI:10.19507/j.cnki.1673-0356.2017.11.005 |
| [26] |
杨陈. 柞蚕丝结构性能分析[J]. 国际纺织导报, 2016, 44(4): 18-20. YANG C. Analysis of structure properties of tussah silk[J]. Melliand China, 2016, 44(4): 18-20. |
| [27] |
NAMITA M, 周官山, 帅亚俊, 何文, 闵思佳, 杨明英, 朱良均. 利用尿素溶剂体系制备再生柞蚕丝素蛋白粉及样品的性能表征[J]. 蚕业科学, 2013, 39(2): 346-350. DOI:10.13441/j.cnki.cykx.2013.02.031 NAMITA M, ZHOU G S, SHUAI Y J, HE W, MIN S J, YANG M Y, ZHU L J. Preparation and property characterization of regenerated tussah silk fibroin power by urea solvent system[J]. Science of Sericulture, 2013, 39(2): 346-350. DOI:10.13441/j.cnki.cykx.2013.02.031 |
| [28] |
LI M Z, TAO W, LU S Z, KUGA S. Compliant film of regenerated Antheraea pernyi silk fibroin by chemical crosslinking[J]. International Journal of Biological Macromolecules, 2003, 32(3): 159-163. DOI:10.1016/S0141-8130(3)00049-7 |
| [29] |
吴章伟, 冯新星, 朱海霖, 刘娜, 孙斌, 吴斌伟, 陈建勇. 不同溶解体系的丝素蛋白分子质量及对再生丝素膜性能的影响[J]. 蚕业科学, 2010, 36(4): 707-712. DOI:10.13441/j.cnki.cykx.2010.04.022.cykx.2010.04.022 WU Z W, FENG X X, ZHU H L, LIU N, SUN B, WU B W, CHEN J Y. Effects of different solvent systems on molecular mass of silk fibroin and properties of the regenerated silk fibroin membranes[J]. Science of Sericulture, 2010, 36(4): 707-712. DOI:10.13441/j.cnki.cykx.2010.04.022.cykx.2010.04.022 |
| [30] |
LUE A, LIU Y, ZHANG L, POTTHAS A. Light scattering study on the dynamic behaviour of cellulose inclusion complex in LiOH/urea aqueous solution[J]. Polymer, 2011, 52(17): 3857-3864. DOI:10.1016/j.polymer.2011.06.034 |
| [31] |
王鹏, 左保齐. 不同盐/甲酸溶解体系下丝素膜的制备及性能表征[J]. 丝绸, 2016, 53(7): 18-22. DOI:10.3969/j.issn.1001-7003.2016.07.004 WANG P, ZUO B Q. Preparation of silk fibroin films in different salt/formic acid dissolution system and its property characterization[J]. Journal of Silk, 2016, 53(7): 18-22. DOI:10.3969/j.issn.1001-7003.2016.07.004 |
| [32] |
米锐, 李学军, 马淑慧, 孟楠, 李树英, 都兴范. 响应面法优化水解制备柞蚕丝素肽及其性能[J]. 日用化学工业, 2021, 51(7): 612-619. DOI:10.3969/j.issn.1001-1803.2021.07.005 MI R, LI X J, MA S H, MENG N, LI S Y, DU X F. Optimization of hydrolysis preparation of tussah fibroin peptides by response surface methodology and the performance thereof[J]. China Surfactant Detergent & Cosmetics, 2021, 51(7): 612-619. DOI:10.3969/j.issn.1001-1803.2021.07.005 |
| [33] |
李岩亮, 刘颖, 贾延华. 硫酸水解制备柞蚕丝素肽的研究[J]. 辽宁丝绸, 2004(4): 8-9. LI Y L, LIU Y, JIA Y H. Preparation of sericin peptide by sulfuric acid hydrolysis[J]. Liaoning Tussah Silk, 2004(4): 8-9. |
| [34] |
吕明霞, 张皓, 赵海明, 鲁奇林. 磷酸催化水解柞蚕丝制备柞蚕丝素粉[J]. 渤海大学学报(自然科学版), 2010, 31(2): 121-124. DOI:10.13831/j.cnki.issn.1673-0569.2010.02.015 LV M X, ZHANG H, ZHAO H M, LU Q L. Preparation of Tussah sericin powder by phosphoric acid catalyzed hydrolysis[J]. Journal of Bohai University (Natural Science Edition), 2010, 31(2): 121-124. DOI:10.13831/j.cnki.issn.1673-0569.2010.02.015 |
| [35] |
邓婷婷, 郭囊括, 彭云武, 程岚, 童晓玲, 鲁成, 代方银. 酸和碱处理对野桑蚕丝结构与性能的影响[J]. 蚕业科学, 2017, 43(1): 88-94. DOI:10.13441/j.cnki.cykx.2017.01.013 DENG T T, GUO N K, PENG Y W, CHENG L, TONG X L, LU C, DAI F Y. Influence of acid and alkali treatment on structure and property of bombyx mandarina silk[J]. Science of Sericulture, 2017, 43(1): 88-94. DOI:10.13441/j.cnki.cykx.2017.01.013 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49