文章信息
基金项目
- 广东省动物疫病野外科学观测研究站项目(2021B1212050021);广东省重点领域研发计划项目(2019B020217002);广东省农业科学院院长基金(202044)
作者简介
- 蒋智勇(1974—),男,硕士,副研究员,研究方向为动物免疫与生物安全,E-mail:jiangzy01@sina.com.
通讯作者
- 蔡汝健(1979—),男,博士,副研究员,研究方向为动物免疫与生物安全,E-mail:466866569@qq.com.
文章历史
- 收稿日期:2022-02-04
【研究意义】猪繁殖与呼吸综合征病毒(Porcine Reproductive and Respiratory Syndrome Virus, PRRSV)主要感染猪的呼吸系统和生殖系统,可引发高度传染性疾病,造成重大经济损失。PRRSV自1987年在美国发现以来,迅速蔓延至全世界频繁暴发。我国于1996年分离到该病毒[1],2006年夏秋季南方多个省区暴发高致病性PRRSV (HP-PRRSV)造成了大量猪只死亡,引起猪价大幅波动,对生猪产业的持续健康发展构成严重威胁。PRRSV分子流行病学的调查与研究对制定以PRRSV疫苗免疫和生物安全防控为基础的综合防控措施具有重要意义。
【前人研究进展】PRRSV分为两个基因型,即欧洲型(PRRSV 1)和美洲型(PRRSV 2),它们感染猪的临床症状和病理变化相似,但抗原特性和遗传学特征却存在显著差异。目前我国的流行株主要为PRRSV 2。2010年从广东地区使用MLV疫苗的猪场中分离到属于Lineage 3谱系毒株QYYZ和GM2,重组分析表明GM2是野毒株QYYZ与疫苗毒株Resp /PRRS的重组病毒[2]。2013年周峰等[3]分离获得1株Nsp2区与2008年美国学者分离的NADC30株[4]具有相同缺失特征的毒株,命名为NADC30-like,此后该毒株逐渐成为我国北方地区的主要流行毒株。2014年以来我国报道了基因组出现明显变异和易重组的NADC30-like毒株[5-6]。分子流行病学研究发现,我国流行的PRRSV可分为4个谱系:Lineage 8 (JXA1-like和CH-1a-like)、Lineage 5(VR-2332-like)、Lineage 3(QYYZ-like)和Lineage 1 (NADC30-like)[7]。
【本研究切入点】PRRSV为单股正链RNA病毒,基因组长度约为15 kb,其长度变化主要决定于Nsp2区域缺失与插入片段长度。ORF2-7以亚基因组形式编码病毒的8种结构蛋白,其中以GP5变异最大,是PRRSV最主要的保护性抗原蛋白,因此在病毒分子遗传变异分析中ORF5基因常作为基因分型依据用于PRRSV分子流行病学监测[8]。【拟解决的关键问题】为了监测PRRSV在广东省的流行动态和进化趋向,本研究2021年采集了广东地区规模猪场临床疑似PRRS症状的猪只组织样品,通过对ORF5基因测序进行遗传变异分析,探查广东省内各地区流行毒株的分布情况,为制定PRRSV防控措施提供科学依据。
1 材料与方法 1.1 试验材料病料为521份肺脏组织样品,采于2021年广东省不同地区37个规模猪场疑似PRRS症状的仔猪和流产胎儿。
病毒DNA/RNA提取试剂盒(Magen)购自广州美基生物科技有限公司;PrimeScriptTM One Step RT-PCR Kit购自宝生物工程(大连)有限公司(TaKaRa)。
1.2 引物设计参照GenBank中不同谱系PRRSV代表株基因组序列设计1对特异性引物扩增ORF5基因,具体序列如下,ORF5-F:5'-CATTTCATGACACCTGAGAC-3',ORF5-R:5'-CGGCATCTGGAGGTGATGA-3',预期扩增长度为970 bp,引物由生工生物工程(上海)股份有限公司合成。
1.3 PRRSV ORF5基因的RT-PCR扩增与测序分别取少量肺脏加入500 μL PBS匀浆、离心取200 μL上清按照病毒DNA/RNA提取试剂盒说明书提取病毒RNA,然后按照一步法RT-PCR试剂盒配制RT-PCR反应体系并进行RT-PCR扩增,反应结束后将电泳检测为阳性的PCR产物送生工生物工程(上海)股份有限公司测序。
1.4 PRRSV ORF5基因及编码蛋白的序列比对与遗传进化树构建对双向测序结果截取完整的ORF5基因,用DNAStar与GenBank中的16株国内外代表株(表 1)作为参考毒株,对其基因序列以及推导的氨基酸序列进行比对。使用ClustalX 2.1和Mega 7.0软件基于Neighbor-Joining方法绘制系统遗传进化树。
2 结果与分析 2.1 PRRSV ORF5基因RT-PCR扩增及序列测定
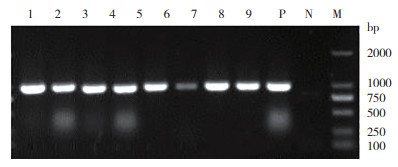
对供试的37个猪场521份疑似PRRS症状的组织样品提取病毒RNA,经RT-PCR扩增后,产物电泳结果见图 1,扩增产物约1 000 bp,与预期大小一致。其中检出PRRSV阳性样品127份,来自17个猪场,样品阳性率为24.4 %,猪场阳性率为45.9%。每个阳性样品双向重复测序2次,测序结果表明同一阳性猪场的阳性样品测序结果一致,获得了来自17个不同猪场的PRRSV ORF5基因序列,其中有3株(GD MM、GD FS和GD LN)在同一位置缺失3个碱基,其他ORF5基因全长均为603 bp,并根据样品来源地进行命名。
|
| M:DL2000 Marker;N:阴性对照,P:阳性对照;1~9:临床样品 M: DL-2 000 Marker; N: Negative control; P: Positive control; 1-9: Clinical samples 图 1 PRRSV ORF5基因的RT-PCR产物 Fig. 1 RT-PCR products of PRRSV ORF5 gene |
2.2 PRRSV ORF5基因序列遗传进化分析
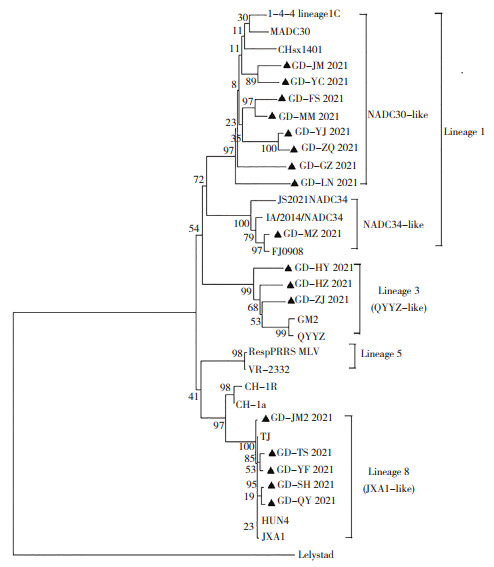
将17株PRRSVORF5基因序列与表 1的16株PRRSV参考序列用Mega 7.0构建遗传进化树,结果(图 2)显示,17株PRRSV分别属于PRRSV 2的3个谱系。Lineage 1谱系分为2个分支(NADC30-like和NADC34-like),分别包含了近几年美国流行的ORF5 RFLP 1-4-4代表株1-4-4 lineage 1c和ORF5 RFLP 1-7-4代表株IA/2014NADC34。本研究得到的8株PRRSV(GD YC、GD FS、GD MM、GD YJ、GD ZQ、GD GZ、GD LN和GD JM)属于Lineage 1(NADC30-like)谱系,1株PRRSV(GD MZ)属于Lineage 1(NADC34-like)谱系;3株PRRSV(GD HY、GD HZ、和GD ZJ)属于Lineage 3谱系(QYYZ-like);5株PRRSV (GD JM2、GD TS、GD YF、GD QY和GD SH)属于Lineage 8(JXA1-like和CH-1a-like)谱系。17株PRRSV中Lineage 1、Lineage 8和Lineage 3占比分别为52.94%、29.41% 和17.65%,没有检测到Lineage 5(VR2332-like)谱系的毒株。
|
| 图 2 PRRSV基于ORF5基因的系统遗传进化树 Fig. 2 Phylogenetic tree of PRRSV based on ORF5 gene |
采用DNAstar对17株PRRSV ORF5基因及参考序列进行核苷酸同源性分析,结果(图 3)显示,ORF5基因核苷酸序列同源性为81.3%~99. 5%;与HP-PRRSV中的JXA 1株、Hu4株、TJ株核苷酸同源性为81.1%~98.5%;与美国VR-2332株的核苷酸同源性为83.1%~89.7%;与欧洲型LV株的核苷酸同源性为61.8%~64.3%。属于Lineage 1 (NADC30-like和NADC34-like) 谱系的9株分离株之间的核苷酸同源性为84.8%~95.8%;属于Lineage 3(QYYZ-like)谱系的3株分离株之间核苷酸同源性为92.9%~94.4%;属于Lineage 8 (JXA1-like和CH-1a-like)谱系的5株分离株之间核苷酸同源性为97.8%~99.5%,与JXA1株核苷酸同源性为98.7%~99.5%。

|
| 图 3 PRRSV ORF5基因核苷酸序列同源性分析结果 Fig. 3 Results for homology analysis of nucleotide sequence of PRRSV ORF5 gene |
2.3 PRRSV ORF5基因推导的氨基酸序列分析
通过DNAstar分析ORF5基因编码蛋白GP5推导的氨基酸序列同源性,结果(图 4)显示,17株PRRSV GP5氨基酸序列同源性为78.5%~98.5%;与Lineage 1中NADC30株的氨基酸同源性为84.6%~94.5%;与Lineage 3中GM2株的氨基酸同源性为77.5%~93.5%;与Lineage 5中VR-2332株的氨基酸同源性为80.5%~88.1%;与Lineage 8中JXA 1株、Hu4株、TJ株氨基酸序列同源性为83.0%~98.5%;与欧洲型LV株的氨基酸同源性为50.7%~57.7%。属于Lineage 1 (NADC30-like和NADC34-like) 谱系的9株分离株之间的氨基酸同源性为85.0%~95.0%;属于Lineage 3(QYYZ-like)谱系的3株分离株之间的氨基酸同源性为92.9%~94.4%。

|
| 图 4 PRRSV ORF5基因编码蛋白GP5推导的氨基酸序列同源性分析结果 Fig. 4 Results for homology analysis of the deduced amino acid sequence of protein GP5 encoded by PRRSV ORF5 gene |
ORF5基因编码蛋白GP5推导的氨基酸序列比对结果如图 5所示,有3株(GD MM、GD FS和GD LN)缺失了第33位氨基酸,其氨基酸突变位点主要位于GP5的信号肽(Signal peptide)、中和位点(PNE)、2个高变区(HVR)、B细胞抗原位点(B cell epitop)和2个T细胞抗原位点附近[9]。GP5的N- 糖基化位点在病毒感染、免疫逃避方面起重要作用,GP5有2个保守的糖基化位点(第44、51位)[10],而位于高变区的第32、33、34、35位N- 糖基化位点容易突变,HP-PRRSV第32位突变为S,而第35位又由S突变为N;Lineage 3谱系第33位N突变为G。有些氨基酸位点的突变具有谱系特异性,Lineage 1特异的突变位点有第47位L突变I、第57位A突变N/R/D、第168位E突变D和第192位V突变I;HP-PRRSV特异的氨基酸位点第9、13、24、25、32、35、161、189、191位分别为C、R、Y、L、S、N、V、L和R;Lineage 3特异的氨基酸位点第34、38、39、66、92、170位分别为G、Y、S、C、S和G。

|
| 图 5 推导的GP5氨基酸序列比对分析 Fig. 5 Alignment analysis of the deduced amino acid sequence of GP5 |
3 讨论
PRRSV的聚合酶复制保真度差、点突变、重组和免疫压力选择促进PRRSV不断演化,被认为是产生病毒变异性和多样性的潜在分子机制。自2006年我国首次报道HP-PRRSV毒株(以JXA1为代表)以来,在随后的几年中,JXA1-like毒株成为我国流行的优势毒株。但随着2010年和2013年在我国大陆分别出现QYYZ-like和NADC30-like毒株,RPRSV的多样性显著扩大,使得PRRS的防控日趋复杂。同时多种弱毒活疫苗在全国范围内广泛使用,无疑加大了猪群的免疫选择压力,外来新毒株的入侵以及与疫苗株间重组进一步加剧了PRRSV的多样化。
广东省内PRRSV优势流行毒株与我国北方地区不一致,2014—2016年从广东省内分离的毒株测序结果表明以Lineage 8(JXA1-like和CH-1a-like)谱系和Lineage 3(QYYZ-like)谱系为主[11];2019—2020年监测结果表明广东省内PRRSV以Lineage 3(QYYZ-like)谱系为主,其次为Lineage 8(JXA1-like和CH-1a-like)谱系和Lineage 1(NADC30-like)谱系[12]。本研究对2021年广东省内不同猪场的PRRSV测序分析结果显示,有52.94%(9/17)属于Lineage 1 (NADC30-like和NADC34-like)谱系、29.41%(5/17)属于Lineage 8(JXA1-like和CH-1a-like) 谱系和17.65%(3/17)属于Lineage 3(QYYZ-like)谱系。由此可见,2021年广东省内PRRSV流行毒株以Lineage 1谱系为主,Lineage 3谱系在广东省内流行比前几年大幅缩小,流行毒株的变化可能与近年来种猪的频繁调运有关。从临床PRRS症状检测属于Lineage 8(JXA1-like和CH-1a-like)谱系的毒株核苷酸序列与JXA1株同源性为98.7%~99.5%,可能与疫苗使用不当有关,疫苗免疫以弱毒疫苗免疫后再以灭活疫苗加强免疫可以获得较好的免疫效果[13]。
2014年首次报道在美国至少5个州检测到RFLP 1-7-4 PRRSV,其代表毒株为IA/2014/NADC34株,感染仔猪后可引起严重的临床症状[14]。2017年在我国辽宁省首次监测到NADC34-like PRRSV[15],随后在黑龙江、福建、江苏和四川均有报道[16-19]。本研究从广东梅州地区分离的毒株GD MZ 2021株ORF5基因具有RFLP1-7-4模式特点,与IA/2014/NADC34株同源性为97.3%,且NSP2区域有100 aa的连续缺失,还需要通过全基因组测序进一步验证。
2020年10月以来,美国猪场暴发由PRRSV 1-4-4 Lineage 1C新型变异株引起的疫情,该毒株具有更强的传播能力和致病性,且现有疫苗对其保护效果不佳[20]。美国PRRSV 1-4-4 Lineage1C变异株与我国PRRSV NADC34-like属于同一谱系分支(Lineage 1),其Nsp2区域存在100 aa连续缺失。鉴于NADC34-like已成为美国主要流行株,有可能成为我国PRRSV潜在流行株[21]。为了有效防控PRRS,需要对PRRSV流行株分子变异进行持续监测,以期为临床诊断、新型疫苗的研发提供参考。
4 结论为了监测广东省2021年PRRSV的分子流行动态,从省内生猪主产区采集37个规模猪场521份疑似PRRS患病猪的组织样本进行PRRSV检测。对阳性样品进行ORF5基因的RT-PCR扩增和测序,获得17株来自不同地区规模猪场的PRRSV ORF5基因序列并进行遗传进化分析,结果表明,所有毒株均属于PRRSV 2,在遗传进化树上分别属于3个谱系即Lineage 1(NADC30-like和NADC34-like)谱系、Lineage 8(JXA1-like和CH-1a-like)谱系和Lineage 3(QYYZ-like)谱系,所占比例分别为52.94%、29.41% 和17.65%,没有检测到Lineage 5(VR2332-like)谱系的毒株。与前几年的检测数据对比发现,2021年广东地区Lineage 1 (NADC30-like)谱系的PRRSV占比快速上升,而Lineage 3(QYYZ-like)谱系占比下降。17株PRRSV毒株ORF5基因之间核苷酸序列同源性为81.3%~99.5%,推导的GP5氨基酸序列同源性为80.0%~98.3%,GP5高变区的糖基化位点存在不同程度变异。
| [1] |
郭宝清, 陈章水, 刘文兴, 崔益洙. 从疑似PRRS流产胎儿分离PRRSV的研究[J]. 中国畜禽传染病, 1996(2): 3-7. GUO B Q, CHEN Z S, LlU W X, CUI Y Z. Isolation and identification of porcine reproductory and respiratory syndrome (PRRS) virus from aborted fetuses suspected of PRRS[J]. Chinese Journal of Animal and Poultry Infectious Diseases, 1996(2): 3-7. |
| [2] |
LU W H, TUN H M, SUN B L, MO J, ZHOU Q F, DENG Y X, XIE Q M, BI Y Z, LEUNG F C, MA J Y. Re-emerging of porcine respiratory and reproductive syndrome virus (lineage 3) and increased pathogenicity after genomic recombination with vaccine variant[J]. Veterinary Microbiology, 2015, 175(2/4): 332-40. DOI:10.1016/j.vetmic.2014.11.016 |
| [3] |
周峰, 常洪涛, 赵军, 陈陆, 王新卫, 刘红英, 姚慧霞, 王川庆, 杨霞. 2012―2013年猪繁殖与呼吸综合征病毒河南流行株的分离鉴定及分子流行病学调查[J]. 中国兽医学报, 2014, 34(9): 1398-1404. DOI:10.16303/j.cnki.1005-4545.2014.09.002 ZHOU F, CHANG H T, ZHAO J, CHEN L, WANG X W, LIU H Y, YAO H X, WANG C Q, YAN X. Identification and molecular epidemiology of porcine reproductive and respiratory syndrome virusprevailing in Henan province from 2012 to 2013[J]. Chinese Journal of Veterinary Science, 2014, 34(9): 1398-1404. DOI:10.16303/j.cnki.1005-4545.2014.09.002 |
| [4] |
BROCKMEIER S L, LOVING C L, VORWALD A C, KEHRLI JR M E, BAKER R B, NICHOLSON T L, LAGER K M, MILLER L C, FAABERG K S. Genomic sequence and virulencecomparison of four Type 2 porcine reproductive and respiratory syndrome virus strains[J]. Virus Research, 2012, 169(1): 212-221. DOI:10.1016/j.virusres.2012.07.030 |
| [5] |
ZHOU L, YANG B, XU L, JIN H, GE X, GUO X, HAN J, YANG H. Efficacy evaluation of three modified-live virus vaccines against a strain of porcine reproductive and respiratory syndrome virus NADC30-like[J]. Veterinary Microbiology, 2017, 207: 108-116. DOI:10.1016/j.vetmic.2017.05.031 |
| [6] |
JIANG Y, LI G, YU L, LI L, ZHANG Y, ZHOU Y, TONG W, LIU C, GAO F, TONG G. Genetic diversity of porcine reproductive and respiratory syndrome virus (PRRSV) from 1996 to 2017 in China[J]. Frontiers in Microbiology, 2020(11): 618. DOI:10.3389/fmicb.2020.00618.eCollection2020 |
| [7] |
GUO Z, CHEN X X, LI R, QIAO S, ZHANG G. The prevalent status and genetic diversity of porcine reproductive and respiratory syndrome virus in China: a molecular epidemiological perspective[J]. Virology Journal, 2018, 15(1): 1-14. DOI:10.1186/s12985-017-0913-3 |
| [8] |
ROQUES E, GIRARD A, ST-LOUIS M C, MASSIE B, GAGNON C A, LESARD M, ARCHAMBAULT D. Immunogenic and protective properties of GP5 and M structural proteins of porcine reproductive and respiratory syndrome virus expressed from replicating but nondisseminating adenovectors[J]. Veterinary Research (Paris), 2013, 44(1): 17. DOI:10.1186/1297-9716-44-17 |
| [9] |
曹宗喜, 师志海, 林哲敏, 焦培荣, 张桂红. PRRSV的病毒蛋白研究进展[J]. 广东农业科学, 2013, 40(16): 134-137. DOI:10.16768/j.issn.1004-874X.2013.16.003 CAO Z X, SHI Z H, LIN Z M, JIAO P R, ZHANG G H. Research progress on the viral proteins of PRRSV[J]. Guangdong Agricultural Sciences, 2013, 40(16): 134-137. DOI:10.16768/j.issn.1004-874X.2013.16.003 |
| [10] |
OSTROWSKI M, GALEOTA J A, JAR A M, PLATT K B, OSORIO F A, LOPEZ O J. Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5 ectodomain[J]. Journal of Vorology, 2002(5): 4241-4250. DOI:10.1128/JVI.76.9.4241-4250 |
| [11] |
蒋智勇, 蔡汝健, 李艳, 李春玲. 2014—2016年广东省PRRSV GP5基因遗传变异分析[J]. 广东农业科学, 2016, 43(12): 90-95. DOI:10.16768/j.issn.1004-874X.2016.12.016 JIANG Z Y, CAI R J, LI Y, LI C L. Genetic variation analysis of GP5 gene of PRRSV isolates in Guangdong province during 2014-2016[J]. Guangdong Agricultural Sciences, 2016, 43(12): 90-95. DOI:10.16768/j.issn.1004-874X.2016.12.016 |
| [12] |
ZHAO P, YU L, LIU Y, ZHANG L, LIANG P, WANG L, JING H, HUANG L, SONG C, DONG J. Genetic variation analysis of Type 2 porcine reproductive and respiratory syndrome virus in Guangdong Province from 2016 to 2018[J]. Acta Virologicl, 2021, 65(2): 221-231. DOI:10.4149/av_2021_213 |
| [13] |
蔡汝健, 蒋智勇, 勾红潮, 楚品品, 李艳, 宋帅, 徐志宏, 李春玲. 不同PRRS疫苗组合对仔猪免疫效果的研究[J]. 广东农业科学, 2019, 46(10): 93-98. DOI:10.16768/j.issn.1004-874X.2019.10.015 CAI R J, JIANG Z Y, GOU H C, CU P P, LI Y, SONG S, XU Z H, LI C L. Study on immune effect of different PRRS vaccine combinations on piglets[J]. Guangdong Agricultural Sciences, 2019, 46(10): 93-98. DOI:10.16768/j.issn.1004-874X.2019.10.015 |
| [14] |
VAN GEELEN A G M, ANDERSON T K, LAGER K M, DAS P B, OTIS N J, MONTIEL N A, MILLER L C. Porcine reproductive and respiratory disease virus: Evolution and recombination yields distinct ORF5 RFLP 1-7-4 viruses with individual pathogenicity[J]. Virology, 2018, 513: 168-179. DOI:10.1016/j.virol.2017.10.002 |
| [15] |
张洪亮, 张文立, 相丽润, 刘春晓, 宋帅杰, 汤艳东. 2017年我国输入性北美1-7-4分支PRRSV的基因组序列分析[J]. 中国预防兽医学报, 2018, 40(10): 875-879. ZHANG H L, ZHANG W L, XIANG L R, LIU C X, SONG S J, TANG Y D. The genomic analysis of imported North America 1-7-4 porcine reproductive and respiratory syndrome virus in China in 2017[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(10): 875-879. |
| [16] |
XIE C, HA Z, NAN F, ZHANG Y, ZHANG H, LI J, ZHANG P, HAN J, ZHANG H, ZHUANG X, ZHANG J, LU H, JIN N. Characterization of porcine reproductive and respiratory syndrome virus (ORF5 RFLP 1-7-4 viruses) in northern China[J]. Microbial Pathogenesis, 2020, 140: 103941. DOI:10.1016/j.micpath.2019.103941 |
| [17] |
LIU J, WEI C, LIN Z, XIA W, MA Y, DAI A, YANG X. Full genome sequence analysis of a 1-7-4-like PRRSV strain in Fujian Province, China[J]. PeerJ, 2019, 7: e7859. DOI:10.7717/peerj.7859 |
| [18] |
ZHU Z, YUAN L, HU D, LIAN Z, YAO X, LIU P, LI X. Isolation and genomic characterization of a Chinese NADC34-like PRRSV isolated from Jiangsu province[J]. Transboundary and Emerging Diseases, 2021. DOI:10.1111/tbed.14392 |
| [19] |
ZHAO J, XU L, XU Z, DENG H, LI F, SUN X, ZHOU Y, ZHU L. Emergence and spread of NADC34‐like PRRSV in Southwest China[J]. Transboundary and Emerging Diseases, 2022. DOI:10.1111/tbed.14463 |
| [20] |
TREVISAN G, LI G, MOURA C A, COLEMAN K, THOMAS P, ZHANG J, GAUGER P, ZELLER M, LINHARES D. Complete coding genome sequence of a novel porcine reproductive and respiratory syndrome virus 2 restriction fragment length polymorphism 1-4-4 Lineage 1C variant identified in Iowa, USA[J]. Microbiology Resource Announcements, 2021, 10(21): e44821. DOI:10.1128/MRA.00448-21 |
| [21] |
许浒, 李超, 相丽润, 汤艳东, 赵静, 龚帮俊, 李宛生, 付军, 彭金美, 王倩, 周国辉, 冷超粮, 安同庆, 蔡雪辉, 张洪亮, 田志军. 中国与美国(ORF5 RFLP1-4-4)Lineage1C同一分支PRRSV的全基因组序列分析[J]. 中国预防兽医学报, 2022, 44(2): 202-207. XU H, LI C, XIANG L R, TANG Y D, ZHAO J, GONG B J, LI W S, FU J, PENG J M, WANG Q, ZHOU G F, LEN C L, AN T Q, CAI X F, ZHANG H L, TIAN Z J. Whole genome sequence analysis of Lineage1C PRRSV (ORF5 RFLP1-4-4) between China and United States[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(2): 202-207. |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49