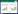文章信息
基金项目
- 国家现代农业产业技术体系专项(CARS-46);国家现代农业产业技术体系广西特色淡水鱼产业创新团队生态养殖功能专家(nycytxgxcxd-2021-08-03);广西水产遗传育种与健康养殖重点实验室项目(20-238-07);南宁市科学研究与技术开发计划项目(20194144)
作者简介
- 陈丽婷(1986—),女,硕士,农艺师,研究方向为水产动物营养与生态健康养殖,E-mail:chenlt3433@126.com.
通讯作者
- 梁军能(1970—),男,硕士,高级农艺师,研究方向为鱼类繁殖发育生物学与健康养殖,E-mail:1209930732@qq.com.
文章历史
- 收稿日期:2022-02-02
2. 广西诺亚生物科技发展有限公司,广西 柳州 545000
2. Guangxi Nuoya Biotechnology Development Co. Ltd., Liuzhou 545000, China
【研究意义】我国的水产养殖业正朝集约化方向发展[1],但高密度养殖带来的水质恶化、养殖动物免疫力下降、病害频发等问题,是制约我国集约化养殖高速发展的重要原因[2]。目前精养系统改善水质的办法通常是直接换水,但这会增加养殖动物的应激,同时给养殖尾水处理及水域环境造成较大压力。国务院在党的十八大后提出“全面加强生态环境保护,坚决打好污染防治攻坚战”的意见,明确提出了建设生态文明的重要举措。当前,世界各地水产养殖业正蓬勃发展,发展水资源节约型、环境友好型的生态健康养殖,将成为未来养殖业的焦点[3]。因此,开展水资源节约型、生态健康养殖研究,对指导水产养殖业的可持续发展具有重要意义。【前人研究进展】目前益生菌在畜牧业和人类健康中的应用已较为广泛,因其无耐药性、环保、安全等优点而受到关注,但在水产养殖中应用起步较晚。水质在水产养殖中起到至关重要的作用,在水体中直接添加益生菌,不仅可改善养殖水质,还能改善养殖动物的肠道健康。在养殖水体中添加益生菌用以改善水质、促进养殖动物的健康和生长的方法是目前较推崇的生态养殖方式之一[4-8]。Iribarren等[9]在水体中添加益生菌后,有效抑制了水体中病原微生物的生长繁殖,改善了水质;李咏梅等[10]在凡纳缤对虾养殖水体中添加益生菌后改善了水质并提高了对虾的生长性能;徐晨等[11]在生物絮团养殖模式下,养殖水体中添加益生菌能够促进异育银鲫的生长;Giatsis等[12]在罗非鱼养殖水体中添加芽孢杆菌7 d后,其肠道菌群变化显著;Xia等[13]在罗非鱼水体中添加乳酸乳球菌也产生同样效果,并且增强了机体对疾病的抵抗能力。在零换水条件下,学者们的研究多集中在添加不同碳源[14-15],或不同碳氮比所构建的生物絮团系统,对水质[16]及养殖动物的生长、体成分、消化酶[17]以及抗氧化和免疫[18]等的影响,或者在零换水构建的生物絮团条件下,研究不同营养水平对养殖动物生长及营养的贡献[19-21],以及研究在零换水条件下添加生物藻土[22]、碳水化合物[23]对养殖池中微生物菌落结构的影响。而在零换水条件下添加益生菌的研究报道较少。唐汇娟等[24]在饲料中添加糖蜜,并在养殖水体中泼洒芽孢杆菌,养殖周期55 d,全程不更换水体,结果表明这种方式在一定程度上改善了罗非鱼的生长成活率和生长速率;王淼等[25]等每周泼洒1次异养硝化细菌,维持10周,结果提高了尼罗罗非鱼的抗氧化能力,也维持了池塘水质;孙博超等[26]在凡纳滨对虾发育到蚤状幼体时开始投喂益生菌,直到发育成仔虾后5 d停止,整个过程中不换水,结果表明益生菌组合不仅能够抑制弧菌繁殖还能提高凡纳滨对虾幼体的成活率。【本研究切入点】上述研究结果表明,添加益生菌能增强鱼体的免疫力并且提高生长性能,而在水体中直接添加益生菌还能改善水质,但在零换水条件下添加益生菌的研究鲜有报道,且主要集中在单一菌种的研究上,而单一菌种往往在生态作用中不足以应对复杂多变的养殖水域环境[27],因此,探讨复合益生菌对养殖水质的影响,寻找在零换水条件下适合罗非鱼养殖的益生菌组合,对促进罗非鱼的健康、生态养殖发展具有重要意义。【拟解决的关键问题】以罗非鱼为养殖对象,全池泼洒复合益生菌,以正常更换养殖水的养殖模式为对照,研究添加复合益生菌对罗非鱼养殖水质、生长、肌肉品质的影响,以期为促进零水交换条件下的生态、健康养殖技术的发展提供参考。
1 材料与方法 1.1 试验材料供试罗非鱼(Oreochromis mossambicus)规格整齐,体质健壮,个体质量为12.1(±0.5)g,由广西壮族自治区水产科学研究院国家级广西南宁罗非鱼良种场提供,试验开始前驯化2周。商品饲料来源于南宁通威饲料有限公司,粗蛋白含量为36%。复合益生菌由广西诺亚生物科技发展有限公司提供,该复合益生菌组合包括细黄链霉菌、荚膜红假单胞菌、酵母菌、乳酸菌4个菌种,活菌含量≥ 3×109 CFU/mL。罗非鱼养殖于广西罗非鱼良种场的室内水泥池(长12 m,宽5 m,高1.8 m),水深1.5 m,养殖用水为曝气自来水。
1.2 试验方法试验处理水体中添加复合益生菌菌液(活菌含量≥ 3×109 CFU/mL),每90 m3水体添加菌液50 mL,试验开始的首月每隔1周按相同剂量补充添加1次菌液,试验第2个月开始至试验结束,每隔1个月按相同剂量补充添加1次菌液;以正常更换养殖水的养殖模式为对照,对照不添加益生菌,模拟正常的养殖管理,试验开始第1、2个月,每隔2周更换养殖水体的50%,第3个月开始到试验结束,每周更换养殖水体的50%。养殖试验设3个重复,一共6个池,每个池作为1个处理。
试验处理和对照的养殖池均使用微孔增氧进行24 h曝气后放养罗非鱼。试验开始后,将规格整齐的罗非鱼种2 700尾,随机分成6组,每组450尾,养殖密度7.5尾/ m2。每天投喂2次(8:00—9:00,17:00—18:00),投喂量按体重的3% 计,每15 d测量鱼体质量后调整1次投喂量。试验鱼经分组后驯养适应1周,养殖试验于2020年6月18日开始,至10月28日结束,共133 d。
1.3 测定指标及方法1.3.1 生长指标测定 试验结束后,罗非鱼停食24 h,统计成活率及饵料系数;每处理随机挑选6尾,测量质量、体长,计算增重率、特定生长率。

|
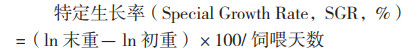
|

|

|
1.3.2 品质测定 取肌肉测量水分、粗灰分、粗脂肪以及氨基酸。每个处理选取3尾鱼,取每尾鱼体一侧第3~8肋骨之间的腹肌约7 g,测定肌肉氨基酸;取鱼体另一侧第3~8肋骨背鳍间的肌肉约10 g,测定常规成分。常规成分的水分测定参照GB 5009.3-2010,采用105℃烘箱恒重法;粗脂肪测定参照GB /T 5009.6- 2003,采用索氏抽提法;灰分测定参照GB 5009.4-2010,550℃马弗炉灼烧法;粗蛋白测定参照GB 5009.5-2010,采用凯氏定氮法。氨基酸测定釆用Hetach L-8800氨基酸自动分析仪,由四川威尔检测中心测定。
1.3.3 水质分析 试验第1天开始采集水样进行水质检测,之后每周于9:00采集1次直到试验结束。采样用对角线方式选择等距的3个点,采集上层水,3个点的水样混合后现场检测。温度和溶解氧使用雷磁便携式溶氧测定仪(JPB-607A型)检测,pH、氨氮、亚硝酸盐采用奥克丹水质分析仪(OCT-B型)检测。
1.3.4 生物菌落结构分析 将试验结束前最后1次采集的水体3 L,利用真空抽滤,水体全部经过0.22 μm滤膜,将滤膜含菌一面向内折叠后置于无菌EP管中,在液氮中速冻后,置于5 kg干冰中包埋后送实验室进行16S rRNA高通量测序。
用CTAB法提取滤膜中的DNA,PCR扩增使用Phusion®混合液和保真酶,引物区域为16S V4区,扩增区域包括16S V3~V4区。PCR产物目的条带利用Qiagen公司的胶回收试剂盒进行产物回收产物。
使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,检测合格后使用Novaseq PE250进行上机测序。
利用Qiime分析工具对测序数据进行质量控制,将一致性为97% 的序列进行OTUs聚类,对出现频率高的代表序列的物种进行注释。根据注释结果,选取每个样品在门水平最大丰度排名前10的物种生成物种相对丰度累加的柱形图;在属水平上,筛选相对丰度排名前35的物种绘制成热图。用Qiime(Version 1.7.0)计算观测条数(Observed-species)及α多样性指数(Shannon、Simpson、Chao1、ACE、Goods-coverage),采用R软件(Version 2.15.3)绘制稀释曲线(Rarefaction curve)、等级聚类曲线(Rank abundance)、维恩(Venn)图。
试验数据统计使用SPSS 15.0,采用单因素方差分析(One-way ANOVA)和Duncan氏法进行多重比较,检验组间差异的显著性。
2 结果与分析 2.1 添加益生菌对罗非鱼生长性能的影响试验结束时,添加益生菌的试验处理罗非鱼均重为485.32(±0.12)g,对照个体均重为455.93(±31.46)g,试验处理略高,但差异不显著;成活率方面,试验处理的成活率显著高于对照,而饵料系数显著低于对照。此外,试验处理的增重率和特定生长率均高于对照,但差异不显著(表 1)。
2.2 添加益生菌对罗非鱼肌肉品质的影响
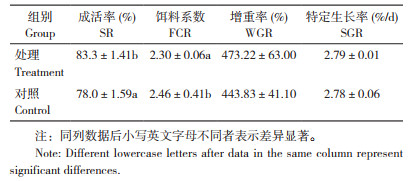
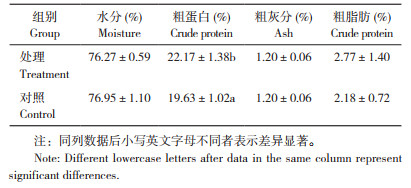
由表 2可知,试验处理罗非鱼的粗蛋白、粗脂肪水平均显著高于对照,但差异不显著;水分和粗灰分与对照相比差异不显著。由表 3可知,试验处理罗非鱼的肌肉氨基酸总量、必需氨基酸和鲜味氨基酸含量均高于对照,但差异不显著。
2.3 添加益生菌对养殖水体水质的影响
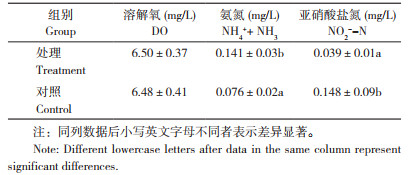
试验期间,养殖池水温为26.5~30.5℃,pH为7.0~8.0。试验处理水体的溶解氧为6.50 mg/L,对照为6.48 mg/L,差异不显著,而氨氮浓度显著高于对照,亚硝酸盐氮浓度显著低于对照(表 4)。
2.4 添加益生菌对养殖水体生物菌落的影响
Goods-coverage指数表明,本研究测序深度达99%,说明测序基本包含了所有物种。Simpson指数评估优势种群的集中程度,值越小,说明群落多样性越高;Shannon指数反映群落多样性,值越大,说明群落多样性越高[28],结合Observed-species、Chao1和ACE指数可知添加益生菌试验处理系统中的微生物物种丰富度较高(表 5)。
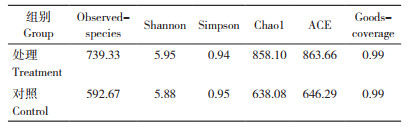
|
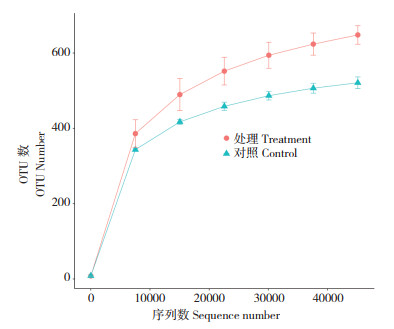
稀释曲线主要反映样品测序数据量的合理性,如果曲线已趋向平坦,说明测序数据量已渐进合理,后续没有必要进行更多数据量的测序。图 1显示试验处理与对照的稀释曲线均已趋于平坦,证明所得测序数据量已饱和且测序数据合理,具有代表性,可进一步作数据统计分析。
|
| 图 1 稀释曲线 Fig. 1 Rarefaction curve |
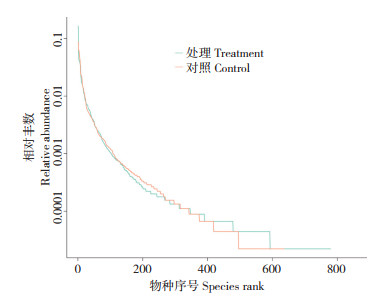
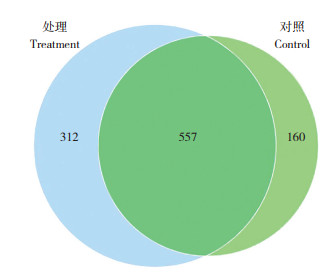
等级聚类曲线可反映测序物种的丰度和均匀度。从水平方向上看,曲线的宽度反映物种的丰富度,曲线在横坐标轴上跨度越大,代表越高的物种丰度;从垂直方向上看,物种的均匀度由曲线的平滑度反映,物种分布越均匀,则曲线越平缓[29]。由图 2可见,添加益生菌试验处理养殖水体的物种丰度大于对照。维恩图可比较直观地显示对照和试验处理之间共有、特有的OTUs,本研究从试验处理和对照分别检出OTUs数目869、717个,其中共有的OTUs数目为557个,试验处理特有的OTUs数目为312个,对照中特有的OTUs数目为160个(图 3)。
|
| 图 2 等级聚类曲线 Fig. 2 Rank abundance curve |
|
| 图 3 细菌数目的维恩分析 Fig. 3 Venn analysis of the number of bacteria |
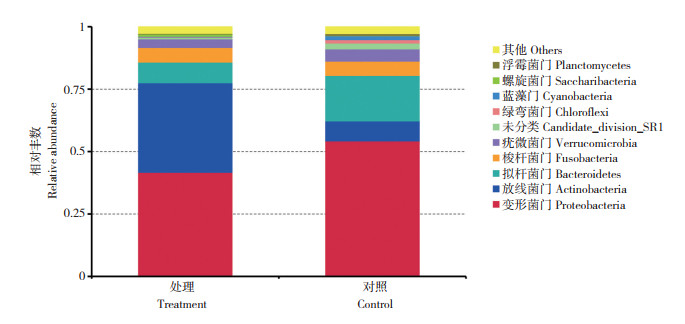
由图 4可知,在细菌门水平上,试验处理和对照中丰度较高的前10个门分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)、螺旋体菌门(Saccharibacteria)、未分类(Candidatedivision-SRI)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)。其中,试验处理的优势菌门(平均相对丰度 > 1%)[30]是变形菌门(41.41%)、放线菌门(35.99%)、拟杆菌门(8.28%)、梭杆菌门(5.8%)、疣微菌门(3.4%);对照的优势菌门为变形菌门(53.69%)、拟杆菌门(18.40%)、放线菌门(8.05%)、梭杆菌门(5.7%)、疣微菌门(4.9%)、未分类(2.36%)、绿弯菌门(1.39%)。
|
| 图 4 生物菌落在门水平上的相对丰度分析 Fig. 4 Analysis of relative abundance of biological colonies at phylum level |
3 讨论 3.1 添加益生菌对罗非鱼生长的影响
鱼类终生生活在水中,水质的好坏对其健康及生长至关重要,保持充足的溶解氧和适宜的pH值是维持水产养殖动物正常生长的基础。本试验过程中,添加益生菌的试验处理和对照养殖水体的溶解氧和pH值均保持相对稳定,且符合渔业水质标准[31],为罗非鱼的生长提供了有利条件。水体中的亚硝酸盐氮是主要污染源之一,亚硝酸盐氮通过影响养殖动物的耗氧、氨氮排泄以及渗透压等影响机体健康。周鲜娇等[32]用不同浓度的亚硝酸盐氮胁迫健康的凡纳滨对虾,结果发现,亚硝酸盐氮浓度升高,对虾死亡率随之增加;黄翔鹄等[33]、吴中华等[34]在研究亚硝酸盐氮对凡纳冰对虾的毒性实验中也同样发现高浓度的亚硝酸盐氮导致对虾免疫力下降,由此可见,维持水体中较低浓度的亚硝酸盐氮水平是保障养殖动物健康的条件之一。本研究中,添加益生菌试验处理的养殖水体亚硝酸盐氮显著低于对照,说明复合益生菌对降低亚硝酸盐氮方面起积极作用,从而提高罗非鱼的成活率,该研究结果与王梦亮等[35]、沈锦玉等[36]的报道相似。养殖水体中添加益生菌后,通过改变水体菌群结构,抑制病原菌生长繁殖,促进有益菌生长,从而增强养殖动物机体的免疫力[37],吸附霉菌毒素等[38-39]。本试验中,添加益生菌试验处理的罗非鱼成活率显著高于对照,认为与添加益生菌的作用效果有关。一般认为,在水体中添加益生菌后,可通过影响肠道功能等促进生长、降低饵料系数[24, 40],光合细菌能够分泌消化酶如蛋白酶、脂肪酶等帮助消化和吸收,促进营养物质吸收[41-42],还能够合成多种维生素和促生长因子[43],从而提高饲料利用率。本试验中添加的荚膜红单胞菌属于光合细菌,具有类似功能,试验处理添加该复合益生菌后,罗非鱼生长在一定程度上有所提高。细黄链霉菌能够产生木聚糖酶,而木聚糖酶在提高饲料利用率和防止动物结肠炎方面有利[44]。本试验中,试验处理的饵料系数显著低于对照,可能是添加益生菌起到了节约饲料的作用。
3.2 添加益生菌对罗非鱼肌肉品质的影响肠道作为鱼体与外界进行物质交换的主要场所之一,肠道微生物数量、群落结构与养殖的水体环境息息相关。王淼等[25]在养殖水体中泼洒复合益生菌改变了罗非鱼的肠道菌群结构。研究发现,益生菌进入肠道之后,通过抑制有害菌繁殖,促进有益菌生长,特别是改变厚壁菌门和拟杆菌门的比例,从而影响脂肪沉积,进而改善肌肉风味[45-46]。此外,益生菌还能够将脂肪氧化成为小分子物质,而肠道菌群中发生代谢反应产生的风味物质能够转移到肌肉中,增加肌肉中肌苷酸、脯氨酸、苯丙氨酸等滋味物质[47],从而提高风味。夏雨等[48]在饲料中添加乳酸菌饲喂凡纳滨对虾,增加了幼虾肌肉的弹性和咀嚼性。张天阳[49]用150 mL乳酸菌液饲喂育肥猪时,显著提高了最长肌的粗蛋白含量,邬理洋[50]研究发现单独或混合饲喂微生态制剂、牛膝多糖均可提高育肥猪背最长肌的粗蛋白含量和粗脂肪含量。本试验中,添加益生菌试验处理罗非鱼的粗蛋白含量显著高于对照,粗脂肪含量、氨基酸总量、必需氨基酸和鲜味氨基酸含量也高于对照,与上述报道相类似。可见,添加益生菌可改变水体的菌群结构,提高水体中有益菌的占比,也能通过影响罗非鱼肠道菌群结构的方式,改善罗非鱼的肌肉品质。
3.3 添加益生菌对养殖水质及菌群结构的影响本研究添加的复合益生菌组合包括细黄链球菌、荚膜红假单胞菌和酵母菌和乳酸菌。乳酸菌能改善养殖水质[51],在水体中通过发挥竞争性抑制的作用,防止有害菌大量繁殖[52];而且乳酸菌能够将水体中的大颗粒物质如残饵、粪便和死藻等通过氧化、氨化、固氮、硝化和反硝化等作用转化为磷酸盐、硝酸盐等物质[53]。荚膜红假单胞菌是光合细菌的一种,光合细菌被广泛应用于水产养殖,具有繁殖速度快、生命力强、营养要求低的特点,并且荚膜红假单胞菌含有天然胡萝卜素,可作为营养物质[54]。本研究中,添加复合益生菌后,在试验过程零换水的情况下,开展养殖试验133 d,与正常换水的对照相比,试验处理养殖水体的亚硝酸盐水平显著低于对照,说明使用益生菌组合能够有效降解水体中的亚硝酸盐含量。但在氨氮去除方面,试验处理养殖水体总的氨氮含量为0.141 mg/L,对照为0.076 mg/L。养殖水体中的氨氮分为离子氨(NH4+)和非离子氨(NH3),非离子氨对鱼鳃造成损害,而离子氨则被认为不易造成伤害,两者的相互转化受水体中pH和温度的影响。渔业水质标准要求非离子氨≤ 0.04 mg/L[31]。本试验过程中,养殖水体水温26.5~30.5℃,pH7.0~8.0,溶解氧6.50 mg/L,均在罗非鱼生长适宜范围内,使得氨氮主要以离子氨的形式存在,并未对养殖鱼造成严重影响[55]。添加益生菌试验处理在零换水条件下开展养殖,能够使养殖水质持续稳定,保持适宜的温度、pH和溶解氧,并且亚硝酸盐含量均持续低于更换水质的对照,说明该益生菌组合能够有效改善养殖水体环境,维持良好且持续稳定的水域生态环境,这可能得益于该益生菌组合能够有效建立一套完整的生态系统。但试验过程中,对养殖水体氨氮的去除效果仍不够理想,后续考虑补充芽孢杆菌等菌株作进一步试验。
维系养殖水体的动态平衡是生态健康养殖的必要条件,而水体中微生物在促进物质循环和能量流动中起关键作用[56]。在养殖水体中添加益生菌后可改善水体菌群的多样性,可能与益生菌不仅能抑制有害菌生长繁殖,还能在物质循环中起积极作用有关,如分解大分子有机物等,从而改善了水质,促进其他水体有益菌生长繁殖[40]。细菌群落的丰富度和均匀度多采用Simpson指数,而群落中较为常见的物种数目多样性则通过Shannon体现,Chaol指数越大,代表物种数量越多,群落丰富度越高。本研究中,添加益生菌试验处理的Chaol指数显著高于对照,Shannon指数和Simpson指数与对照无差异,Observed-species、Chao1和ACE指数也很好地验证了这一点,且试验处理中特有的OTUs数目远高于对照。这说明在零换水条件下,添加益生菌组合能够提高水体细菌菌落的多样性,为维持有效、稳定的养殖生态环境提供保障。郑佳佳等[57]在水体中添加复合益生菌改变了水体菌群结构,创造了良好的养殖环境,与本研究结果相似。
本研究中试验处理和对照的优势菌门存在一定差异,试验处理的优势菌门数量占比94.88%,以变形菌门、放线菌门为主要菌种;对照的优势菌门数量占比89.84%,以变形菌门、拟杆菌门为主。两种水体均为养殖水体中较常出现的有益菌种类,未出现弧菌等有害菌群,可能因为添加该复合益生菌后其在养殖水体中更能快速定植,占据有利地位,抑制有害菌生长繁殖,该研究结果与陈景豪等[58]的研究结论相类似。放线菌门、拟杆菌门和变形菌门等具有重要的脱氮功能[59],在试验处理养殖水体中占比85.68%,在对照中占比80.14%,且试验处理中的放线菌数量占比高于对照,说明添加益生菌后改变了原有的菌群结构。放线菌门可通过抗生等竞争性作用占据优势地位[60],从而抑制其他有害菌群的生长;变形菌门大部分属于异养型细菌,在COD降解和脱氮过程起主要作用[61-62],变形菌门中最主要的纲为β-变形菌纲,研究表明其与反硝化作用密切相关;拟杆菌门的细菌与DNA、脂类和蛋白质等有机物质的转换密切相关,在处理废水过程中发挥重要作用[57]。疣微菌门和绿弯菌门对有机质的降解和硝化发挥重要作用[63-64]。本研究中试验处理和对照养殖水体中均含有丰富的变形杆菌门、酸杆菌门和拟杆菌门,但在试验处理养殖水体中优势更明显,表明在零换水的条件下添加该益生菌组合,对有机物的转化利用以及维持水体稳定具有积极作用。
4 结论本研究针对传统水产养殖通过频繁更换水体的方式缓解养殖过程中出现的水质恶化问题,采用添加复合益生菌的方式进行零换水养殖,研究其对水质改善、菌群结构以及罗非鱼生长和肌肉品质的影响,结果显示,添加益生菌组合能够持续、有效地改善并维持良好、稳定的养殖水环境,养殖全程水温26.5~30.5 ℃,pH7.0~8.0,溶解氧6.50 mg/L,亚硝酸盐0.039 mg/L,均在罗非鱼生长适宜范围内,水体的菌群多样性提高,节约了换水产生的经济成本,同时减少了鱼类应激,维持机体稳定的生理健康,提高了成活率和肌肉品质,降低了饵料系数。此外,添加益生菌组合能够做到零换水,有效控制了养殖尾水的排放,为推进节约型和环境友好型的水域环境建设提供了新思路。
| [1] |
桂建芳, 张晓娟. 新时代水产养殖模式的变革[J]. 长江技术经济, 2018, 2(1): 25-29. DOI:10.19679/j.cnki.cjjsjj.2018.0105 GUI J F, ZHANG X J. The transformation of aquaculture model in the new era[J]. Technoligy and Economy of Changjiang, 2018, 2(1): 25-29. DOI:10.19679/j.cnki.cjjsjj.2018.0105 |
| [2] |
方金龙. 氨氮和亚硝基氮胁迫下凡纳滨对虾对WSSV的易感性研究[D]. 上海: 上海海洋大学, 2016. FANG J L. Susceptibility of shrimp Litopenaeus vannamei to WSSV under ammonia and nitrite stress[D]. Shanghai: Shanghai Ocean University, 2016. |
| [3] |
陈丽婷, 檀午芳, 肖俊, 郭忠宝, 罗永巨. 我国池塘养殖尾水处理技术研究进展[J]. 广西农学报, 2021, 36(4): 40-45. DOI:10.3969/j.issn.1003-4374.2021.04.011 CHEN L T, TAN W F, XIAO J, GUO Z B, LUO Y J. Research progress of tail water treatment technology of pond aquaculture in China[J]. Journal of Guangxi Agriculture, 2021, 36(4): 40-45. DOI:10.3969/j.issn.1003-4374.2021.04.011 |
| [4] |
邓茹, 孟顺龙, 陈家长, 陈春光. EM菌在水产养殖中的应用概述[J]. 中国农学通报, 2020, 36(11): 142-148. DOI:10.3969/j.issn.1673-1182.2014.07.018 DENG R, MEN S L, CHEN J C, CHEN C G. Application of EM bacteria in aquaculture[J]. Chinese Agricultural Science Bulletin, 2020, 36(11): 142-148. DOI:10.3969/j.issn.1673-1182.2014.07.018 |
| [5] |
苏艳莉, 孙盛明, 朱健, 谢骏, 戈贤平. 枯草芽孢杆菌在水产养殖中的研究进展[J]. 中国渔业质量与标准, 2016(6): 32-39. DOI:10.3969/j.issn.2095-1833.2016.06.006 SU Y L, SUN S M, ZHU J, XIE J, GE X P. Advances of Bacillus subtilis application in aquaculture[J]. Chinese Fishery Quality and Standards, 2016(6): 32-39. DOI:10.3969/j.issn.2095-1833.2016.06.006 |
| [6] |
郭同旺, 周书洪, 郑守伟, 吕志敏, 张云泽, 李炳乾, 辛乃宏. 几种常见水产养殖益生菌的应用研究现状及展望[J]. 盐科学与化工, 2020, 49(11): 3-7. DOI:10.16570/j.cnki.issn1673-6850.2020.11.002 GUO T W, ZHOU S H, ZHENG S W, LU Z M, ZHANG Y Z, LI B Q, XIM N H. Status and prospect of applied research on several common aquaculture probiotics[J]. Journal of Salt Science and Chemical Industry, 2020, 49(11): 3-7. DOI:10.16570/j.cnki.issn1673-6850.2020.11.002 |
| [7] |
宋华文, 王金才. 乳酸菌与酵母菌在水产养殖中的应用[J]. 江西水产科技, 2018(5): 12-15. DOI:10.3969/j.issn.1006-3188.2018.05.004 SONG H W, WANG J C. Application of lactic acid bacteria and yeast in aquaculture[J]. Jiangxi Fishery Science and Technology, 2018(5): 12-15. DOI:10.3969/j.issn.1006-3188.2018.05.004 |
| [8] |
李卫芬, 张小平, 宋文辉, 邓斌, 梁权, 傅罗琴, 郑佳佳, 余东游. 养殖水体中添加芽孢杆菌对草鱼免疫和抗氧化功能的影响[J]. 中国水产科学, 2012, 19(6): 1027-1033. DOI:10.3724/SP.J.1118.2012.01027 LI W F, ZHANG X P, SONG W H, DENG B, LIANG Q, FU L Q, ZHEANG J J, YU D Y. Effects of bacillus preparation added to culture water on immunity and antioxidant activities in grass carp (Ctenopharyngodon idella)[J]. Journal of Fishery Sciences of China, 2012, 19(6): 1027-1033. DOI:10.3724/SP.J.1118.2012.01027 |
| [9] |
IRIBARREN D, DAGÁ P, MOREIRA M T. Potential environmental effects of probiotics used in aquaculture[J]. Aquaculture International, 2012, 20(4): 779-789. DOI:10.1007/s10499-012-9502-z |
| [10] |
李咏梅, 李腾飞, 田相利, 罗凯, 王龙斌, 张盛坤, 魏聪, 刘杨. 添加益生菌和PHBV对凡纳滨对虾养殖系统水质和对虾生长、非特异免疫指标的影响[J]. 中国海洋大学学报(自然科学版), 2010, 51(11): 22-31. DOI:10.16441/j.cnki.hdxb.20200321 LI Y M, LI T F, TIAN X L, LUO K, WANG L B, ZHANG S K, WEI C, LIU Y. Effects of probiotics and polyhydroxybutyrate on growth and non-specific immunity of Litopenaeus vannamei and its culturing water quality[J]. Periodical of Ocean University of China, 2010, 51(11): 22-31. DOI:10.16441/j.cnki.hdxb.20200321 |
| [11] |
徐晨, 李烨, 孙启睿, 张明明, 王资生, 叶仕根, 乔帼, 李强. 生物絮团养殖模式下益生菌添加对异育银鲫生长、消化酶活性及肠道组织结构的影响[J]. 中国水产科学, 2018, 25(5): 1004-1011. DOI:10.3724/SP.J.1118.2018.17450 XU C, LI H, SUN Q R, ZHANG M M, WANG Z S, YE S G, QIAO G, LI Q. Effects of probiotic addition on the growth performance, digestive enzyme activity, and intestinal morphology of gibel carp (Carassius auratus gibelio) cultured using biofloc technology[J]. Journal of Fishery Sciences of China, 2018, 25(5): 1004-1011. DOI:10.3724/SP.J.1118.2018.17450 |
| [12] |
GIATSIS C, SIPKEMA D, RAMIRO-GARCIA J. Probiotic legacy effects on gut microbial assembly in tilapia larvae[J]. Scientific Reports, 2016, 6(1): 33965. DOI:10.1038/srep33965 |
| [13] |
XIA Y, CAO J M, WANG M, WANG M, LU M X, CHEN G, GAO F Y, LIU Z G, ZHANG D F, KE X L, YI M M. Effects of Lactococcus lactis subsp. lactis JCM5805 on colonization dynamics of gut microbiota and regulation of immunity in early ontogenetic stages of tilapia[J]. Fish & Shellfish Immunology, 2019, 86: 53-63. DOI:10.1016/j.fsi.2018.11.022 |
| [14] |
KHANJANI M H, ALIZADEH M, SAJADIM M, SORINEZHAD I. Effects of different carbon sources on water quality, growth performance and survival of western white shrimp (Litopenaeus vannamei Boone, 1931) in zero-water exchange system[J]. Iranian Fisheries Scientific Journal, 2015, 24(3): 77-91. |
| [15] |
MANSOUR A T, ÁNGELES ESTEBANM. Effects of carbon sources and plant protein levels in a biofloc system on growth performance, and the immune and antioxidant status of Nile tilapia (Oreochromis niloticus)[J]. Fish & Shellfish Immunology, 2017, 64: 202-209. DOI:10.1016/j.fsi.2017.03.025 |
| [16] |
WANG S Y, CUI X P, XU R Y, GAO M R, SUI L Y. Effect of carbon and nitrogen ratio control on Artemia growth, water quality, biofloc microbial diversity under high salinity and zero-water exchange culture condition[J]. Journal of Oceanology and Limnology, 2019, 37(5): 1768-1776. DOI:10.1007/s00343-019-8288-5 |
| [17] |
WANG G G, YU E M, XIE J, YU D G, LI Z F, LUO W, QIU L J, ZHENG Z L. Effect of C/N ratio on water quality in zero-water exchange tanks and the biofloc supplementation in feed on the growth performance of crucian carp, Carassius auratus C/N[J]. Aquaculture, 2015, 433: 98-104. DOI:10.1016/j.aquaculture.2015.03.015 |
| [18] |
XU W J, PAN L Q. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed[J]. Aquaculture, 2012, 356-357: 147-152. DOI:10.1016/j.aquaculture.2012.05.022 |
| [19] |
CASTRO L F, PINTO R C C, NUNES A J P. Nutrient value and contribution of microbial floc to the growth performance of juvenile shrimp, Litopenaeus vannamei, fed fatty acid and amino acid-restrained diets under a zero-water exchange intensive system[J]. Aquaculture, 2021, 531: 737589. DOI:10.1016/j.aquaculture.2020.735789 |
| [20] |
XU W J, PAN L Q. Evaluation of dietary protein level on selected parameters of immune and antioxidant systems, and growth performance of juvenile Litopenaeus vannamei reared in zero-water exchange biofloc-based culture tanks[J]. Aquaculture, 2017, 426-427: 181-188. DOI:10.1016/j.aquaculture.2014.02.003 |
| [21] |
XU W J, PAN L Q, ZHAO D H, HUANG J. Preliminary investigation into the contribution of bioflocs on protein nutrition of Litopenaeus vannamei fed with different dietary protein levels in zero-water exchange culture tanks[J]. Aquaculture, 2012, 350-353: 147-153. DOI:10.1016/j.aquaculture.2012.04.003 |
| [22] |
JOSEPH V, CHELLAPPAN G, APARAJITHA S, RAMYA R N, VRINDA S, REJISH K V J, BRIGHT S I S. Molecular characterization of bacteria and archaea in a bioaugmented zero-water exchange shrimp pond[J]. SN Applied Sciences, 2021, 3(4). DOI:10.1007/S42452-021-04392-Z |
| [23] |
SUJEET KUMAR P S, SHYNE ANAND D D E, SUNDARAY J K, RAJA R A, BISWAS G, PONNIAH A G, GHOSHALT K, DEOA D, PANIGRAHI A, MURALIDHAM R. Effects of carbohydrate supplementation on water quality, microbial dynamics and growth performance of giant tiger prawn (Penaeus monodon)[J]. Aquaculture International, 2014, 22(2): 901-912. DOI:10.1007/s10499-013-9715-9 |
| [24] |
唐汇娟, 张轩豪, 孔重敏, 郝乐, 李博星, 余祥勇, 刘丽. 零换水条件下枯草芽胞杆菌和糖蜜对水质和罗非鱼生长的影响[J]. 华中农业大学学报, 2018, 37(3): 82-86. DOI:10.13300/j.cnki.hnlkxb.2018.03.012 TANG H J, ZHANG X H, KONG Z M, HAO L, LI B X, YU X Y, LIU L. Effcets of Bacillus subtilis and molasses on water quality and growth of tilapia under zero-water ecchange[J]. Journal of Huanzhong Agricultural University, 2018, 37(3): 82-86. DOI:10.13300/j.cnki.hnlkxb.2018.03.012 |
| [25] |
王淼, 李忠徽, 衣萌萌, 卢迈新, 王瑞宁, 高风英, 刘志刚. 零换水条件下3种异养硝化细菌对底部充氧池塘水质和尼罗罗非鱼生长、抗氧化能力的影响[J]. 水产学报, 2020, 44(7): 1147-1155. DOI:10.11964/jfc.20190711892 WANG M, LI Z H, YI M M, LU M X, WANG R N, GAO F Y, LIU Z G. Effects of three heterotrophic nitrifying bacteria on water quality of Oreochromis niloticus pond with bottom aeration, and growth and antioxidative abilities of fish under zero water exchange condition[J]. Journal of Fisheries of China, 2020, 44(7): 1147-1155. DOI:10.11964/jfc.20190711892 |
| [26] |
孙博超, 杨运楷, 王海亮, 宋晓玲, 黄倢. 零换水条件下益生菌组合在凡纳滨对虾育苗生产中的应用[J]. 上海海洋大学学报, 2019, 28(1): 93-102. DOI:10.12024/are.20180502309 SUN B C, YANG Y K, WANG H L, SONG X L, HUANG J. Effects of probiotics combination on breeding of Litopenaeus vannamei under zero-water exchange condition[J]. Journal of Shanghai Ocean University, 2019, 28(1): 93-102. DOI:10.12024/are.20180502309 |
| [27] |
韩丽华, 张绍璐. 好氧脱氮菌群的筛选驯化及PCR-DGGE分析[J]. 东北林业大学学报, 2011, 39(8): 90-93. DOI:10.13759/j.cnki.dlxb.2011.08.005 HAN L H, ZHANG S L. Isolation and domestication of aerobic denitrifying effective microorganisms and PCR-DGGE analysis[J]. Journal of Northeast Forestry Univesity, 2011, 39(8): 90-93. DOI:10.13759/j.cnki.dlxb.2011.08.005 |
| [28] |
刘小改, 杨亚军, 廖秋菊, 徐红星, 刘映红, 吕仲贤. 稻纵卷叶螟肠道细菌群落结构与多样性分析[J]. 昆虫学报, 2016, 59(9): 965-976. DOI:10.16380/j.kcxb.2016.09.006.j.kcxb.2016.09.006 LIU X G, YANG Y J, LIAO Q J, XU H X, LIU Y H, LU Z X. Analysis of the bacterial community structure and diversity in the intestine of Cnaphalocrocis medinalis (Lepidoptera: Pyralidae)[J]. Acta Entomologica Sinica, 2016, 59(9): 965-976. DOI:10.16380/j.kcxb.2016.09.006.j.kcxb.2016.09.006 |
| [29] |
LUNDBERG D S, YOURSTONE S, MIECZKOWSKI P, JONES C D, DANGL J L. Practical innovations for high-throughput amplicon sequencing[J]. Nature Methods, 2013, 10(10): 999-1002. DOI:10.1038/NMETH.2634 |
| [30] |
常越亚. 农村生活污水处理生物生态组合技术优选及应用示范[D]. 上海: 华东师范大学, 2018. CHANG Y Y. The optimization of biological and ecological combinationg tchnology of rural domestic wastewater treatment and demonstration project[D]. Shanghai: East China Normal University, 2018. |
| [31] |
国家市场监督管理总局. 渔业水质标准[S]. 1979. State Administration for Market Regulation. Fisheries water quality Standard[S]. 1979. |
| [32] |
周鲜娇, 邱德泉. 亚硝酸氮和副溶血弧菌对凡纳滨对虾部分免疫指标的影响[J]. 水生态学杂志, 2009, 2(1): 49-53. ZHOU X J, QIU D Q. Effects of nitrite nitrogen and vibrio parahaemolyticu on some immunity indicators of Litopenaeus vannamei[J]. Journal of Hydroecology, 2009, 2(1): 49-53. |
| [33] |
黄翔鹄, 李长玲, 郑莲, 刘楚吾, 周洁. 亚硝酸盐氮对凡纳滨对虾毒性和抗病相关因子影响[J]. 水生生物学报, 2006, 30(4): 466-471. DOI:10.3321/j.issn:1000-3207.2006.04.016 HUANG X H, LI C L, ZHENG L, LIU C W, ZHOU J. The toxicity of NO2-N on Litopenaeus vannamei and effects of NO2-N on factors relating to the anti-disease ability[J]. Acta Hydrobiologica Sinca, 2006, 30(4): 466-471. DOI:10.3321/j.issn:1000-3207.2006.04.016 |
| [34] |
吴中华, 刘昌彬, 刘存仁, 王金星, 张红卫. 中国对虾慢性亚硝酸盐和氨中毒的组织病理学研究[J]. 华中师范大学学报(自然科学版), 1999, 33(1): 119-122. DOI:10.1017/S0266078400010713 WU Z H, LIU C B, LIU C R, WANG J X, ZHANG H W. Histopathological research on chronic poisoning of Penaeus chinensis by nitrite and ammonia[J]. Journal of Central China Normal University(Nat. Sci.), 1999, 33(1): 119-122. DOI:10.1017/S0266078400010713 |
| [35] |
王梦亮, 马清瑞, 梁生康. 光合细菌对鲤鱼养殖水体生态系统的影响[J]. 水生生物学报, 2001, 25(1): 98-101. WANG M L, MA Q R, LIANG S K. The effect of photosynthetic bacteria on aquatic ecosystem of carps production[J]. Acta Hydrobiologica Sinca, 2001, 25(1): 98-101. |
| [36] |
沈锦玉, 尹文林, 刘问, 沈智华, 钱冬, 曹峥, 吴颖蕾. 光合细菌HZPSB对水产养殖水质的改良和对鱼类促生长作用[J]. 科技通报, 2004, 20(6): 481-484. DOI:10.3969/j.issn.1001-7119.2004.06.003 SHEN J Y, YIN WEN L, LIU W, SHEN Z H, QIAN D, CAO Z, WU Y L. Improvement of fisheries water quality and fish growth of photosynthetic bacteria HZPSB[J]. Bulletin of Science and Technology, 2004, 20(6): 481-484. DOI:10.3969/j.issn.1001-7119.2004.06.003 |
| [37] |
刘树青, 江晓路, 牟海津, 王慧谧, 管华诗. 免疫多糖对中国对虾血清溶菌酶、磷酸酶和过氧化物酶的作用[J]. 海洋与湖沼, 1999, 30(3): 278-283. DOI:10.3321/j.issn:0029-814X.1999.03.009 LIU S Q, JIANG X L, MOU H J, WANG H M, GUAN H S. Effects of immunopoiysaccharide on LSZ, ALP, ACP, and POD activies of Penaeus chinensis serum[J]. Oceanologia et Limnologia Sinica, 1999, 30(3): 278-283. DOI:10.3321/j.issn:0029-814X.1999.03.009 |
| [38] |
NAGENDRA S, WU X. Aflatoxin B1 binding abilities of probiotic bacteria[J]. Bioscience of Microbiota Food & Health, 2010, 18(1): 43-48. DOI:10.12938/bifidus1996.18.43 |
| [39] |
李志刚, 杨宝兰, 姚景会, 徐进. 乳酸菌对黄曲霉毒素B1吸附作用的研究[J]. 中国食品卫生杂志, 2003(3): 212-215. DOI:10.13590/j.cjfh.2003.03.006 LI Z G, YANG B L, YAO J H, XU J. Surface of binding of aflatoxin B1 by lactic acid bacteria[J]. Chinese Journal of Food Hygiene, 2003(3): 212-215. DOI:10.13590/j.cjfh.2003.03.006 |
| [40] |
张小平, 王一冰, 邓斌, 郑佳佳, 胡彩虹, 吴学祥, 李卫芬. 添加不同益生菌对草鱼养殖水体菌群结构的影响[J]. 水生生物学报, 2014, 38(3): 459-466. DOI:10.7541/2014.65 ZHANG X P, WANG Y B, DENG B, ZHENG J J, HU C H, WU X X, LI W F. Comparative analysis of microbial community from grass carp culture water supplementation with different probiotics[J]. Acta Hydrobiologica Sinica, 2014, 38(3): 459-466. DOI:10.7541/2014.65 |
| [41] |
王芳芳, 刁华杰, 夏九龙, 武洪志, 刁新平. 乳酸菌及其发酵饲料在动物生产中的应用[J]. 饲料研究, 2016(1): 15-19. DOI: 10.13557/j.cnki.issn1002-2813.2016.01.005. WANG F F, DIAO H J, XIA J L, DIAO X P. Application of lactic acid bacteria and its fermented feed in animal production[J]. Feed Research, 2016(1): 15-19. DOI: 10.13557/j.cnki.issn1002-2813.2016.01.005. |
| [42] |
石青松. 乳酸菌发酵饲料的制作及其对断奶仔猪生长性能和肠道健康的影响[D]. 南京: 南京农业大学, 2016. SHI Q S. Production of lactic acid bacterla fermented solid feed and study on its effects on growth performance and intestine health in piglets[D]. Nanjing: Nanjing Agricultural University, 2016. |
| [43] |
VINE N G, LEUKES W D, KAISER H. Probiotics in marine larviculture[J]. FEMS Microbiology Reviews, 2006, 30(3): 404-427. DOI:10.1111/J.1574-6976.2006.00017.X |
| [44] |
吴萍, 罗许敏. 细黄链霉菌产木聚糖酶的研究[J]. 安徽科技学院学报, 2007, 21(1): 23-26. DOI:10.3969/j.issn.1673-8772.2007.01.006 WU P, LUO X M. Study on the production of xylanase from Streptomyces microflavus[J]. Journal of Anhui Science and Technology University, 2007, 21(1): 23-26. DOI:10.3969/j.issn.1673-8772.2007.01.006 |
| [45] |
臧凯丽, 贾彦, 崔文静, 马新颖, 王泳, 赵林森, 赵培, 叶雷, 阎亚丽, 陈庆森. 瑞士乳杆菌调控小鼠肠道菌群变化规律的研究[J]. 食品科学, 2018, 39(1): 156-164. DOI:10.7506/spkx1002-6630-201801024 ZHANG K L, JIA Y, CUI W J, MA X Y, WANG Y, ZHAO L S, ZHAO P, YE L, YAN Y L, CHEN Q S. Modulation of probiotic Lactobacillus helveticus on gut microbiota in mice[J]. Food Science, 2018, 39(1): 156-164. DOI:10.7506/spkx1002-6630-201801024 |
| [46] |
WANG H S, NI X Q, QING X D, ZENG D, LUO M, LIU L, LI G Y, PAN K C, JING B. Live probiotic Lactobacillus johnsonii BS15 promotes growth performance and lowers fat deposition by improving lipid metabolism, intestinal development, and gut microflora in broilers[J]. Frontiers in Microbiology, 2017(8): 1073. DOI:10.3389/fmicb.2017.01073 |
| [47] |
LI L, NI X Q, ZENG D, WANG H S, PAN K C. Effect of a dietary probiotic, Lactobacillus johnsonii BS15, on growth performance, quality traits, antioxidant ability, and nutritional and flavour substances of chicken meat[J]. Animal Production Science, 2016, 57(5): 920-926. DOI:10.1071/AN15344 |
| [48] |
夏雨, 易华西, 范荣波, 张冬, 亮晶晶, 蔡玉勇, 张兰威. 饲喂乳酸菌对凡纳滨对虾幼虾肉质的影响[J]. 中国水产科学, 2020, 27(1): 74-81. DOI:10.3724/SP.J.1118.2020.19104 XIA Y, YI H X, FAN R B, ZHANG D, LIANG J J, CAI Y Y, ZHANG L W. Effects of dietary lactic acid bacteria on the meat quality of juvenile Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2020, 27(1): 74-81. DOI:10.3724/SP.J.1118.2020.19104 |
| [49] |
张天阳. 饲喂乳酸菌对生长育肥猪生长, 胴体及肉质特性影响的研究[D]. 泰安: 山东农业大学, 2013. ZHANG T Y. Effects of feeding lactic acid bacteria on growth, carcass and meat quality of finishing pigs[D]. Taian: Shandong Agricultural University, 2013. |
| [50] |
邬理洋. 微生态制剂和牛膝多糖对猪生长性能和肉质品质影响研究[D]. 长沙: 湖南农业大学, 2011. WU L Y. Effects of probiotics and achyranthes bidentata polysaccharides on growth performance and meat quality of pigs[D]. Changsha: Hunan Agricultural University, 2011. |
| [51] |
陈营, 王福强, 邵占涛, 王斌. 乳酸菌对牙鲆稚鱼养殖水体和肠道菌群的影响[J]. 海洋水产研究, 2006(3): 37-41. DOI:10.3969/j.issn.1000-7075.2006.03.007 CHEN Y, WANG F Q, SHAO Z T, WANG B. Effects of lactic acid bacteria on the microflora in water and larvae guts of Japanese flounder (Paralichthys olivaceus)[J]. Marine Fisheries Research, 2006(3): 37-41. DOI:10.3969/j.issn.1000-7075.2006.03.007 |
| [52] |
许禔森. 短乳酸杆菌对草鱼幼鱼养殖水体和肠道菌群的影响[J]. 德州学院学报, 2008, 24(2): 60-63. DOI:10.3969/j.issn.1004-9444.2008.02.018 XU T S. Effects of Lactobacillus brevie on the microflora in water and larvae guts of grass carp[J]. Journal of Dezhou University, 2008, 24(2): 60-63. DOI:10.3969/j.issn.1004-9444.2008.02.018 |
| [53] |
高鹏飞, 张善亭, 赵树平, 李晶, 王晓伟, 张和平. 乳酸菌在水产养殖业中的应用[J]. 家畜生态学报, 2014, 35(7): 82-86. DOI:10.3969/j.issn.1673-1182.2014.07.018 GAO P F, ZHANG S T, ZHAO S P, LI J, WANG X W, ZHANG H P. The application of lactic acids bacteria in animal breeders[J]. Journal of Domestic Animal Ecology, 2014, 35(7): 82-86. DOI:10.3969/j.issn.1673-1182.2014.07.018 |
| [54] |
李福枝. 利用沼泽红假单胞菌生产类胡萝卜素的研究[D]. 长沙: 湖南工业大学, 2007. LI F Z. Research on carotenoids production by Rhodopseudomonas palustris[D]. Changsha: Hunan University of Technology, 2007. |
| [55] |
徐杨. 尼罗罗非鱼(Oreochromis niloticus)对氨氮和亚硝酸盐氮胁迫的生理响应[D]. 南京: 南京农业大学, 2005. XU Y. Physiological response to stress of ammonia and nitrite in tilapia, Oreochromis niloticus[D]. Nanjing: Nanjing Agricultural University, 2005. |
| [56] |
周金敏, 吴志新, 曾令兵, 王树云, 毕鹏, 陈孝煊. 黄颡鱼肠道及养殖水体中菌群的分析[J]. 华中农业大学学报, 2010, 29(5): 613-617. DOI:10.13300/j.cnki.hnlkxb.2010.05.026 ZHOU J M, WU Z X, ZENG L B, WANG S Y, BI P, CHEN X X. Microflora in digestive tract of yellow catfish (Pseudobagrus fulvidraco) and in the water[J]. Journal of Huazhong Agricultural University, 2010, 29(5): 613-617. DOI:10.13300/j.cnki.hnlkxb.2010.05.026 |
| [57] |
郑佳佳, 彭丽莎, 张小平, 孙健栋, 傅罗琴, 王一冰, 胡彩虹, 李卫芬. 复合益生菌对草鱼养殖水体水质和菌群结构的影响[J]. 水产学报, 2013, 037(3): 457-464. DOI:10.3724/SP.J.1231.2013.38105 ZHENG J J, PENG L S, ZHANG X P, SUN J D, FU L Q, WANG Y B, HU C H, LI W F. Effects of complex probiotics on water quality and microbial communities in grass carp (Ctenopharyngodon idellus) culture[J]. Journal of Fisheries of China, 2013, 037(3): 457-464. DOI:10.3724/SP.J.1231.2013.38105 |
| [58] |
陈锦豪, 郑锦滨, 毛勇, 苏永全, 王军. 益生菌和复合营养剂对鱼虾混养池塘水质及细菌群落结构的影响[J]. 热带生物学报, 2019, 10(1): 6-13. DOI:10.15886/j.cnki.rdswxb.2019.01.002 CHEN J H, ZHENG J B, MAO Y, SU Y Q, WANG J. Effects of probiotics and compound nutrients on water quality and community structure of bacteria in fish-shrimp farming pond[J]. Journal of Tropical Biology, 2019, 10(1): 6-13. DOI:10.15886/j.cnki.rdswxb.2019.01.002 |
| [59] |
马柯. 基于生物炭/零价铁强化的复合流人工湿地性能研究[D]. 杭州: 浙江大学, 2009. MA K. Recearch on the performance of hybrid constructed wetlands enhanced with biochar-ZVI[D]. Hangzhou: Zhejiang University, 2009. |
| [60] |
张超群, 戴建荣. 放线菌的研究现况与展望[J]. 中国病原生物学杂志, 2019, 14(1): 110-112. DOI:10.13350/j.cjpb.190124 ZHANG C Q, DAI J R. Status and prospects for research on actinomycetes[J]. Journal of Pathogen Biology, 2019, 14(1): 110-112. DOI:10.13350/j.cjpb.190124 |
| [61] |
胡晓娟, 文国樑, 李卓佳, 孙志伟, 杨铿, 张家松, 韩宁, 曹煜成. 养殖中后期高位池对虾水体微生物群落结构及水体理化因子[J]. 生态学杂志, 2018, 37(1): 171-178. DOI:10.13292/j.1000-4890.201801.019 HU X J, WEN G L, LI Z J, SUN Z W, YANG K, ZHANG J S, HAN N, CAO Y C. Microbial community structure and physicochemical factors in the water of upland pond of Litopenaeus vannamei during the middle and late stage of culture[J]. Chinese Journal of Ecology, 2018, 37(1): 171-178. DOI:10.13292/j.1000-4890.201801.019 |
| [62] |
李卓佳, 李烁寒, 杨莺莺, 文国樑, 李奕雯, 杨宇峰. 凡纳滨对虾高位池养殖水体细菌变动及其与理化因子的关系[J]. 南方水产科学, 2010, 6(4): 6-12. DOI:10.3969/.jissn.1673-2227.2010.04.002 LI Z J, LI S H, YANG Y Y, WEN G L, LI Y W, YANG Y F. Bacteria variation in Litopenaeus vannamei high level ponds and its relation with physical-chemical factors[J]. South China Fisheries Science, 2010, 6(4): 6-12. DOI:10.3969/.jissn.1673-2227.2010.04.002 |
| [63] |
LIN Y T, LIN Y F, TSAI I J, CHANG E D, JIEN S H, LIN Y J, CHIU C Y. Structure and diversity of soil bacterial communities in offshore islands[J]. Scientific Reports, 2019, 9(1). DOI:10.1038/s41598-019-41170-9 |
| [64] |
LIAO B Q, YAN X X, ZHANG J, CHEN M, LI Y L, HUANG J F, LEI M, HE H L, WANG J. Microbial community composition in alpine lake sediments from the Hengduan Mountains[J]. Microbiology Open, 2019, 8(9): 832. DOI:10.1002/mbo3.832 |
(责任编辑 崔建勋)
 2022, Vol. 49
2022, Vol. 49