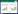文章信息
基金项目
- “十三五”国家重点研发计划项目(2017YFD060130602)
作者简介
- 邢君梅(1997—),女,在读硕士生,研究方向为天然资源化学与利用,E-mail:xjm123456202109@163.com.
通讯作者
- 马李一(1963—),男,博士,副研究员,研究方向为林产生物资源与利用,E-mail:maliyi@126.com.
文章历史
- 收稿日期:2022-02-22
2. 南京林业大学化学工程学院,江苏 南京 210037
2. College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China
【研究意义】辣木(Moringa oleifera Lam.)为辣木科辣木属多年生木本植物,具有独特的药用和食用价值,主要生长在亚热带以及热带,其生长速度快、营养价值高、全株可食用,因此是一种经济价值极高的植物[1]。辣木籽营养价值极高,富含酚类、多糖、油脂、蛋白质、微量元素等,其中辣木籽含油率为28.60%~41.00%,而辣木籽油中不饱和脂肪酸含量超过80.00%,其中油酸含量为62.00%~78.00%,已被使用作为一种高品质的植物油,并且在传统医药中有应治疗关节炎,风湿病和高血压等作用[2-3]。每公顷辣木每年可产辣木籽24 t,提取油后剩余辣木粕14.16~17.13 t,产生大量剩余物[4]。辣木粕中蛋白质含量(32.00%~62.80%)高于辣木籽的蛋白含量(18.60%~37.20%),成为人们消费中重要的植物蛋白补充来源[5-6]。目前这些剩余物主要应用于饲料添加剂[7],或作为絮凝剂处理工业废水等[8]。【前人研究进展】研究表明,生物活性肽具有抗氧化、降血压、抑菌、抗肿瘤和免疫调节等多种生物学功能[9]。生物活性肽通常通过酶水解、微生物发酵或化学水解制备,其中酶解法由于其特异性高,无残留有机溶剂和毒性的化学物质,已作为食品和制药行业生产生物活性肽最优选的方法[10]。目前已有研究报道,超声波辅助辣木粕的乙醇提取物具有抗氧化和抗菌活性[11]。菠萝蛋白酶将辣木叶经碱提酸沉得到的蛋白质在55 ℃酶解3.64 h,所得酶解物具有抗菌活性和优良的功能[12];胃蛋白酶、胰蛋白酶和碱性蛋白酶将辣木籽经碱提酸沉得到的蛋白质酶解3 h,所得酶解物具有抗高血压活性[13];通过水酶法酶解辣木籽蛋白经碱提酸沉得到的蛋白质酶解24 h,可同时提取辣木油和制备抗氧化多肽[14]。目前,大多数研究采用传统酶解方法酶解辣木叶和辣木籽中的蛋白质,并且测定酶解物的功能活性,而国内外鲜有针对辣木粕中的蛋白质及其酶解产物功能活性方面的研究,也鲜有采用一些特殊的方式辅助酶解,以提高酶解效率、优化酶解工艺方面的研究。【本研究切入点】目前有研究采用超声波和微波[15]、高静压[16]等方法辅助酶解,能够分离其中的多糖,提高水解度和多肽活性。其中使用最多的方法是微波辅助酶解,但采用的微波仪器功率普遍较大,导致溶液在快速变化的高频电磁场(微波)作用下快速升温,且当温度达到设定温度后即停止产生微波,只具备保温效果,使得酶解反应不能在其适宜温度下保持持续的微波作用,且温度过高容易导致酶失活。为了解决上述问题,本研究采用低功率微波控制源,将功率控制在0~100 W之间,能够较好地将酶解反应控制在适宜的温度范围内,低功率下能够持续产生微波作用,达到较好的酶解效果,缩短酶解时间,极大地提高酶解的效率。采用10 mL的PE管,缩小样品量,使试验更加方便快捷。【拟解决的关键问题】筛选酶解辣木粕清蛋白的最佳蛋白酶,通过单因素和响应面试验优化酶解条件,进一步通过低功率微波仪器优化,提高酶解效率,以Vc为阳性对照,测定辣木粕酶解物的抗氧化活性。通过微波辅助酶解制备辣木粕清蛋白制备抗氧化多肽用于化妆品、医药、保健食品等行业具有极大的开发潜力和市场价值,使辣木粕资源得到充分有效的利用。
1 材料与方法 1.1 试验材料试材:辣木籽采收于云南元阳,元阳属于云南干热河谷地带,气候高温、低湿、阳光充足。
试剂:波萝蛋白酶、风味蛋白酶、碱性蛋白酶、木瓜蛋白酶、胰蛋白酶等均购于索来宝公司,牛血清蛋白、1, 1- 二苯基-2- 三硝基苯脱(DPPH)、2, 2气联氮- 双-(3- 乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)购于Sigma公司,过硫酸钾、三氯化铁、铁氰化钾、三氯乙酸、氢氧化钠、无水乙醇等均为分析纯。
仪器:紫外可见光分光光度计,上海菁华科技仪器有限公司;超纯水系统D11931,Barnstead仪器公司;冷冻干燥系,Heto-Holten有限公司;全自动酶标仪CERES 900,美国;旋转蒸发仪,日本东京理化;数显恒温水浴锅,北京永光明医疗仪器厂;低功率微波控制源(0~100 W),云南民族大学;微波反应器,自制,采用RF射频座同轴连接器,N型母头L16四孔方板法兰,将法兰焊接上1.5 mm直径的漆包线,并把漆包线螺旋3圈作为反应器内芯,仪器外采用锡纸包好的铁盒罩住,防止微波泄漏。
1.2 试验方法1.2.1 辣木粕组分蛋白的提取 将辣木籽脱壳,通过粉碎机粉碎。称取辣木籽粉100 g,加入石油醚,室温下冷凝回流8 h,将提完油的辣木粕进行自然风干,过孔径0.425 mm的筛,制得辣木粕。采用Osborne分离分级法提取辣木粕清蛋白、谷蛋白、球蛋白和醇溶蛋白:称取2.00 g辣木粕,按料液比1 ∶ 10加入10 mL去离子水,50℃水浴中静置提取30 min,超声辅助提取20 min,8 000 r/min离心20 min,采用考马斯亮蓝法测定上清液中的清蛋白含量;向沉淀加入10 mL的2%NaCl溶液,与清蛋白的提取方法相同,采用考马斯亮蓝法测定上清液中的球蛋白含量;再向沉淀加入相同体积的75% 乙醇,同上操作,测定上清液中的醇溶蛋白含量;继续向沉淀加入pH 8.3的NaOH溶液,与清蛋白的提取方法相同,测定上清液中的谷蛋白含量。筛选出辣木粕最适合酶解的蛋白为清蛋白。
1.2.2 辣木粕清蛋白和抗氧化肽的制备 (1)辣木粕清蛋白(Moringa meal albumin,MMA)的制备。称取80 g辣木粕,加入10倍蒸馏水,50℃水浴静置提取30 min,然后50℃超声辅助提取20 min,过滤。所得上清液加入甲醇进行沉淀,将沉淀物即MMA冷冻干燥24 h,于-20 ℃保存备用,甲醇通过旋转蒸发仪回收利用。
(2)辣木粕抗氧化肽(Moringa meal antioxidant peptide,MMAP)的制备。以蒸馏水作溶剂,配制底物浓度为5% 的MMA溶液,加入蛋白酶(5 000 U/g)酶解4 h,沸水浴灭酶10 min,8 000 r/min、-4℃下离心10 min。将上清液用蒸馏水定容至10 mL,制得酶解产物液,将其冷冻干燥24 h,制备得到MMAP。
1.2.3 蛋白酶筛选试验 分别选取风味蛋白酶、复合蛋白酶、碱性蛋白酶、胰蛋白酶、木瓜蛋白酶以及菠萝蛋白酶对MMA进行酶解试验(表 1)。以蛋白水解度(Degree of hydrolysis,DH)为指标,根据表 1的条件进行酶解反应,以MMA作底物,筛选合适的试验用酶。
1.2.4 单因素试验 采用控制变量法,以蒸馏水为提取溶剂。以固定底物浓度5%、加酶量5 000 U/g、pH 7.0、酶解时间4 h、酶解温度50℃为单因素试验条件,DH为测定指标,分别考察加酶量(1 000、3 000、5 000、7 000、9 000 U/g),酶解时间(1、2、3、4、5 h),pH值(6.0、6.5、7.0、7.5、8.0、8.5),酶解温度(40、45、50、55、60、65 ℃),底物浓度(5%、7%、9%、11%、13%、15%、17%)等因素对酶解效果的影响。
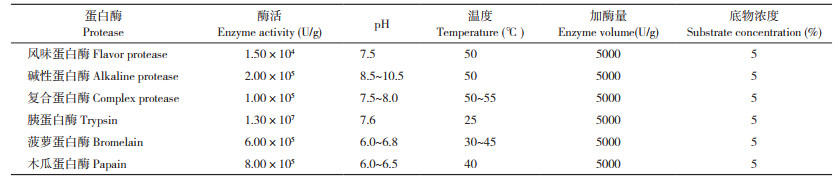
1.2.5 响应面试验 根据单因素试验结果,设计Box-Behnken响应面试验,其因素水平见表 2。
1.2.6 指标测定 辣木粕上清液中蛋白质含量的测定采用考马斯亮蓝法G-250[17]进行测定,根据标准曲线y=4.5264x+0.7211(R2=0.9987)计算蛋白提取率。将由1.2.2所制备已灭酶活的酶解液稀释100倍,采用茚三酮比色法[18]测定酶解液中的游离氨基酸含量,根据标准曲线y=2.5699x-0.5254(R2=0.9998)计算DH。采用双缩脲常量法[19]测定由1.2.2所制备已灭酶活的酶解液中的多肽含量,所测多肽含量范围为0~10 mg/mL,根据标准曲线y=0.0147x+0.0056(R2=0.9975)计算多肽得率。
1.2.7 微波辅助酶解试验 采用自制微波反应器,在10 mL PE管中插入温度传感器实时监控反应温度的变化。根据1.2.5筛选的最适条件,称取0.72 g MMA,加入8 mL蒸馏水,加入风味蛋白酶进行酶解,将微波控制源调节到60 W,将酶解温度控制在40~60℃。反应结束后沸水浴灭酶10 min,8 000 r/min、-4 ℃下离心10 min,上清液定容至10 mL,测量其蛋白水解度、多肽浓度和抗氧化活性。MMA酶解设4个处理:处理1为空白对照,不加蛋白酶,将MMA在45 ℃恒温水浴磁力搅拌锅中反应3.88 h;处理2:将其在低功率微波仪器(60 W)中酶解15 min,然后在45 ℃恒温水浴磁力搅拌锅中酶解1 h;处理3:将其在低功率微波仪器(60 W)中酶解30 min;处理4:将MMA在45 ℃恒温水浴磁力搅拌锅中酶解3.88 h。
1.2.8 体外抗氧化活性测定 将1.2.2所制备的MMAP用蒸馏水配制成0、2、4、6、8、10 mg/mL的多肽溶液,以相同浓度的Vc作为阳性对照,测定以下4个指标:O2-·清除能力参照孙立[20]的方法,用酶标仪在325 nm下进行测定;还原能力参照田旭静[21]的方法,采用紫外分光光度计在700 nm下进行测定;ABTS+·清除能力参照Arnao等[22]的方法,用酶标仪在734 nm下进行测定;DPPH·清除能力参照Ma等[23]的方法,用酶标仪在517 nm下进行测定。
试验数据采用SPSS软件进行统计分析,用Origin Pro 8绘图。
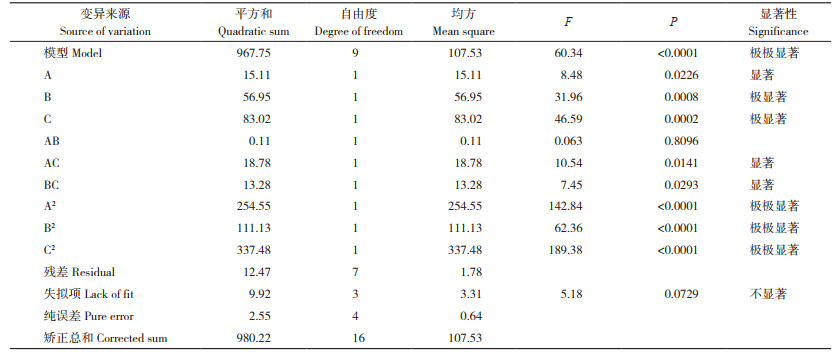
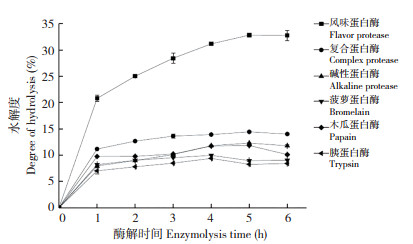
2 结果与分析 2.1 蛋白质和蛋白酶的筛选由Osborne分级提取结果(图 1)可知,辣木粕中清蛋白的提取率最高、为27.73%,谷蛋白次之、提取率为25.34%,醇溶蛋白和球蛋白含量较少、提取率分别为18.68% 和6.98%,因此选用辣木粕清蛋白进行酶解。由图 2可知,风味蛋白酶和复合蛋白酶的酶解效果明显高于碱性蛋白酶、菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶,因此选用风味蛋白酶和复合蛋白酶进行复酶筛选。由图 3可知,风味蛋白酶、复合蛋白酶、风味蛋白酶和复合蛋白酶(1 ∶ 1)、风味蛋白酶和复合蛋白酶(1 ∶ 2)、风味蛋白酶和复合蛋白酶(2 ∶ 1)酶解MMA的DH分别为31.18%、13.93%、28.28%、25.81%、30.73%,以风味蛋白酶单独酶解MMA的DH最高,因此选用风味蛋白酶作为MMA的酶解蛋白酶。

|
| 小写英文字母不同者表示差异显著 Different lowercase letters indicate significant differences 图 1 辣木粕谷蛋白、清蛋白、球蛋白和醇溶蛋白的提取率 Fig. 1 Extraction rates of gluten, albumin, globulin and gliadin in Moringa meal |
|
| 图 2 不同蛋白酶对MMA水解度的影响 Fig. 2 Effects of different proteases on DH of MMA |
|
| A: 风味蛋白酶;B: 复合蛋白酶。小写英文字母不同者表示差异显著 A: Flavor protease; B: Complex protease. Different lowercase letters indicate significant differences 图 3 商品蛋白酶复筛结果 Fig. 3 Re-screening result of commercial proteases |
2.2 单因素试验
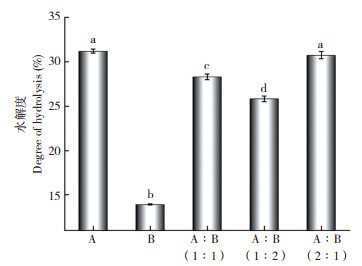
由图 4A可知,酶解时间在0~4 h之间,DH随时间几乎呈线性增加,4 h之后DH变化趋于平缓,DH无显著性差异,因此选择4 h为最佳酶解时间,其DH为31.18%。由图 4B可知,DH随加酶量增大而增大,当加酶量增大到7 000 U/g后,DH变化趋于平缓,DH无显著性差异,因此选择7 000 U/g为最适加酶量,此时DH为35.10%。由图 4C可知,MMA的浓度在5%~9% 范围内,DH陡然增加,而在9%~11% 范围内DH有所下降,但无显著性差异,在11%~17% 之间DH陡然下降,因此选用底物浓度9% 为最佳酶解底物浓度,此时DH为55.79%。由图 4D可知,在温度40~45℃之间DH随温度增加而增加,在温度在55~65℃之间DH随温度增加而减小,因此选取45℃时为最适反应温度,此时DH为67.28%。由图 4E可知,在pH 6.0~7.5之间DH随pH增加而增加,在pH为7.5~8.5之间DH随pH增加而减小,因此选择pH 7.5为最适pH,此时DH为69.28%。
|
| 图 4 酶解时间、加酶量、温度、底物浓度、pH对水解度的影响 Fig. 4 Effects of enzymolysis time, enzyme volume, temperature, substrate concentration and pH on DH |
2.3 响应面试验
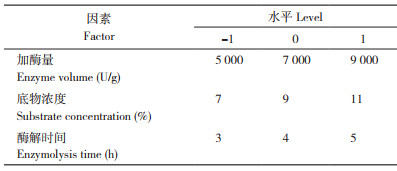
采用Design-Expert V8.0.6优化MMA酶解条件,选取水解时间、加酶量、底物浓度进行3因素3水平Box-Benhnken响应面试验,结果见表 3。
2.3.1 有效性及显著性分析 由表 4可知,响应面试验回归模型的P-Prob>P < 0.0001,表现为极显著,因此该模型具有显著性,表明该模型可信。残差主要由随机误差产生,通过检验虚拟项P-Prob>P=0.0729>0.05,说明未知因素对结果基本不产生显著影响,可以对后续结果进行分析。同时,试验模型相关系数为R2=0.9873,说明试验正确率达98.73%,通过矫正调整R2Adj=0.9709,说明试验的可信度高达97.09%,具有统计学意义。
由表 4还可知,影响因素从大到小为底物浓度(C)>加酶量(B)>酶解时间(A),其中底物浓度(C)和加酶量(B)对蛋白水解度的影响极显著(P < 0.01),酶解时间(B)对蛋白水解度的影响显著(P < 0.05),说明试验选取的3个因素对蛋白水解度影响均较大。模型中,AB(酶解时间和加酶量)之间的相互影响表现为不显著(P>0.05),AC(酶解时间和底物浓度)、BC(加酶量和底物浓度)之间的相互影响表现为显著。A2、B2、C2均表现为极极显著(P < 0.001),表明各因素之间不是简单的线性关系,而是具有交互作用[24]。通过分析得到多元回归方程:Y=68.89-1.37A+2.67B+3.22C+1.82AB-2.17AC- 0.17BC-7.78A2-5.14B2-8.95C2。
2.3.2 响应面及等高线分析 选用Design-Expert V8.0.6软件对响应面试验结果绘制三维曲面图以及等高线图。曲面和等高线的形状不同,交互效应的强弱也不同。交互项的等高线图越近似椭圆形,且曲面图越陡峭,表明交互作用越强[25]。由图 5可以看出,3组交互作用中,底物浓度和水解时间的交互作用最强,其次是加酶量和底物浓度的交互作用,而水解时间和加酶量的交互作用不显著,这与表 4显著性检验结果完全符合。
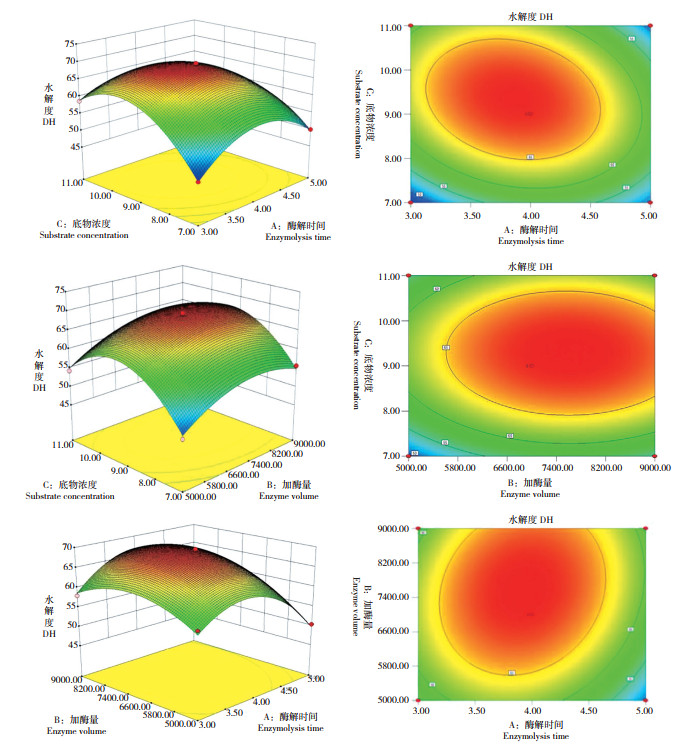
|
| (A-C)酶解时间和底物浓度、(B-C)加酶量和底物浓度以及(A-B)酶解时间和加酶量对DH的相互作用 Interaction of (A-C) Enzymolysis time and substrate concentration, (B-C) enzyme volume and substrate concentration, and (A-B) Enzymolysis time and enzyme volume on DH 图 5 三维曲面图和等高线图 Fig. 5 Three-dimensional surface diagram and contour diagram |
通过模型预测在水解时间3.88 h、加酶量7491.44 U/g、底物浓度9.36% 时,获得最大预测值DH为69.56%。通过验证试验测得实际DH为69.94(±0.68)%,多肽得率为19.09(±0.30)%,表明响应面试验预测结果可信度较高。
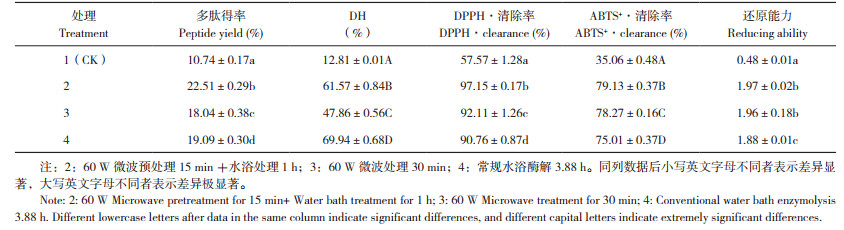
2.4 微波处理对MMA多肽、水解度和抗氧化活性的影响由表 5可知,各处理MMA的多肽得率表现为处理2 > 处理4 > 处理3 > 处理1,以空白对照最低,通过微波预处理15 min +常温水浴1 h的多肽得率最高;水解度表现为处理4 > 处理2 > 处3 > 处理1,以空白对照最低,常规水浴酶解处理的DH最高。当多肽浓度为30 mg/mL时,DPPH·的清除率表现为处理2 > 处理3 > 处理4 > 处理1,ABTS+·的清除率表现为处理2 > 处理3 > 处理4 > 处理1,还原能力表现为处理2 > 处理3 > 处理4 > 处理1,表明空白对照的抗氧化活性最低,采用微波预处理15 min+ 常温水浴酶解1 h的MMA的抗氧化活性最强。单独采用微波酶解的MMA,可能是由于微波功率相对较低,达不到较好的酶解效果;常规水解3.88 h的抗氧化活性略低,可能是较长时间反应对多肽的活性有一定影响。因此选取微波预处理15 min,再进行水浴酶解1 h,能够达到较好的酶解效果,且能够缩短酶解时间,提高酶解效率,所制备的MMAP抗氧化活性较强。
|
2.5 辣木粕多肽的抗氧化活性测定
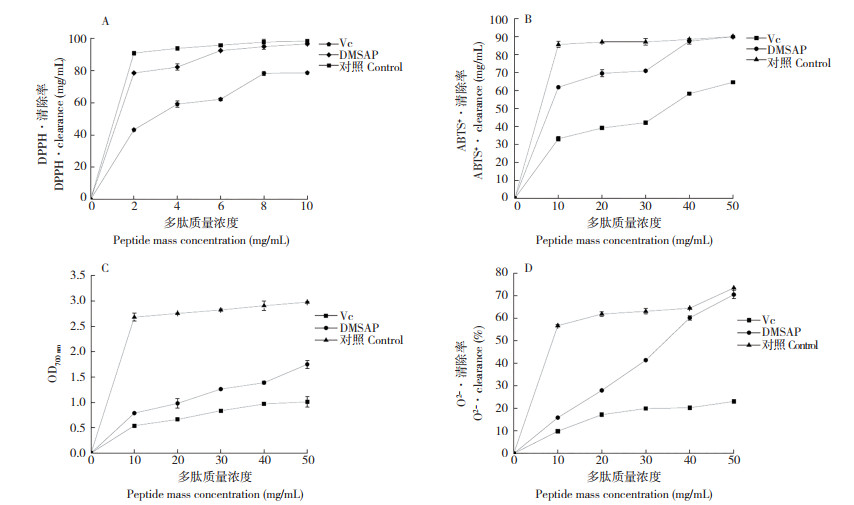
由图 6可知,MMAP的抗氧化活性明显高于对照,说明酶解有助于提高MMA的抗氧化活性,DPPH·、ABTS+·、O2-· 的清除率以及还原能力均随着MMAP质量浓度的增加而增强,两者存在一定的量效关系。当MMAP的质量浓度较低时,DPPH·、ABTS+·、O2-·的清除率以及还原能力与Vc相差较大,随着MMAP质量浓度的增大,差距越来越小。MMAP清除DPPH·的最佳质量浓度为10 mg/mL,清除率为96.67%,与阳性对照Vc相当;还原Fe3+的最佳质量浓度为50 mg/mL,还原能力为1.75,达到阳性对照Vc的58.76%;清除ABTS+·、O2-·的最佳质量浓度均为50 mg/mL,ABTS+·、O2-·的清除率分别为98.60% 和75.46 %,与阳性对照Vc相当。MMAP抗氧化活性强这一特性,使MMAP有望更好地被应用到天然抗氧化剂和功能性食品领域,进而研究开发,实现利用价值。
|
| 图 6 MMAP的抗氧化活性 Fig. 6 Antioxidant activity of MMAP |
3 讨论
籽粕用来酶解的蛋白主要有清蛋白和谷蛋白,碱提酸沉得到的谷蛋白广泛用于酶解技术中的蛋白质分离,涉及在碱性pH条件下(如pH 8~10)溶解植物蛋白质,然后在等电点(如pH 3~5)沉淀得到蛋白质[26]。也有研究采用溶于水的清蛋白和溶于NaCl的球蛋白用于酶解技术[27]。本研究中,辣木粕清蛋白和谷蛋白含量(27.73%、25.34%)差异不显著,大部分活性蛋白都属于谷蛋白或清蛋白,承载着生命体的新陈代谢,支撑着机体活动及功能,但清蛋白的提取工艺最为简单,因此选用清蛋白进行酶解[28]。酶解常有单一蛋白酶和复合蛋白酶两种方式,由于蛋白酶本身也是蛋白质,可能会使两种蛋白酶相互水解,从而使两种酶活性都不能达到最高,因此有的研究也采用单一蛋白酶进行酶解[29]。由于酶具有特异性,不同来源的酶与不同的底物酶解效果都大不相同,因此要对酶进行筛选。蛋白酶可分为内切酶和外切酶2种,外切酶专门作用于肽链末端的肽键,内切酶则作用于肽链内部特定区域。常用于动植物蛋白水解的中性蛋白酶、碱性蛋白酶、木瓜蛋白酶属于内切酶,在水解过程中内切酶切断多肽内部的肽键,形成短链肽,其中一些含有疏水氨基酸,因而成为苦味肽[30]。本研究采用的风味蛋白酶是利用米曲霉发酵,经先进的提取工艺微滤、超滤、真空冷冻干燥技术精制而得,风味酶包含内切蛋白酶与外切肽酶两种活性,可以用来去除低水解度产物的苦肽链,将其彻底降解为氨基酸,也可用于彻底水解蛋白质,增进和改善水解液的风味[31]。来源于微生物的蛋白酶相比来源于动物的蛋白酶成本更加便宜,且比来源于植物的蛋白酶专一性更强。采用单一风味蛋白酶酶解时,操作简单,成本低,因此选用风味蛋白酶为辣木粕清蛋白的酶解蛋白酶。
酶解初期,蛋白水解度随着时间增大而增大,一定酶解时间后,底物与酶结合基本反应完全,之后随着时间的延长蛋白水解度也无显著性差异;随着加酶量的增加,底物被酶解得越充分,当酶加到一定程度时,可能会由于底物不够而不能充分酶解,因此蛋白水解度无显著性差异;随着底物浓度的增加,蛋白水解度会随之增加,当底物达到“饱和”状态,风味蛋白酶不足以完全水解底物,导致底物过剩,蛋白水解度降低[32]。过高或者过低的温度和pH都会使酶失活,因此只有在每个酶的最适温度和pH时,能够达到较好的酶解效果。研究表明,许多籽粕经过酶解后都具有抗氧化活性,其原因可能是蛋白质通过酶解降解成为多肽和氨基酸,大分子的蛋白不具有活性,只有降解成为小分子多肽时才具有活性。传统酶解方法耗时长,酶解过程难以控制,近年来微波辅助蛋白酶解技术的发展有利于快速、高效、选择性制备生物活性肽[33]。微波辐射会导致蛋白质结构疏松,并暴露与酶的结合位点,而结合位点的暴露极大地加速了酶消化过程,增强酶对蛋白质的水解作用,在释放小分子量的生物活性肽时获得更高的产量[34]。在微波辅助酶解的研究中人们发现由于微波对样品具有快速加热作用,局部过高的温度容易造成蛋白变性及酶失活。本研究采用0~100 W的低功率微波控制源,使辣木粕清蛋白控制在最适反应温度的同时,还有连续的微波作用,由此提高了酶解效率。
4 结论本研究结果表明,辣木粕清蛋白、谷蛋白、醇溶蛋白和球蛋白的提取率分别为27.73%、25.34%、18.68%、6.98%,以清蛋白的提取率最高,因此选取清蛋白用于酶解;辣木粕清蛋白的酶解选用风味蛋白酶单独酶解时效果最佳,其水解度达31.18%。通过单因素和响应面试验,发现辣木粕清蛋白最优酶解条件为:时间3.88 h、加酶量7 491.44 U/g、底物浓度9.36%、温度45℃、pH 7.5,此条件下DH为68.90%,多肽得率为19.09%;低功率微波预处理15 min,将酶解时间缩短至1 h,可得到含量较高和抗氧化活性较强的多肽。辣木粕多肽具有较好的抗氧化活性,在最佳质量浓度时,其对DPPH·、ABTS+·、O2-· 的清除能力与Vc相当。低功率微波辅助酶解能够缩短酶解时间,提高酶解效率和酶解产物的抗氧化活性。
| [1] |
POPOOLA J O, OBEMBE O O. Local knowledge, use pattern and geographical distribution of Moringa oleifera Lam. (Moringaceae) in Nigeria[J]. Journal of Ethnopharmacology, 2013, 150(2): 682-691. DOI:10.1016/j.jep.2013.09.043 |
| [2] |
SAUCEDO-POMPA S, TORRES-CASTILLO J A, CASTRO-L PEZ C, ROJAS R, S NCHEZ-ALEJO E J, NGANGYO-HEYA M, MART NEZ-ÁVILA G C G. Moringa plants: Bioactive compounds and promising applications in food products[J]. Food Research International, 2018, 111: 438-450. DOI:10.1016/j.foodres.2018.05.062 |
| [3] |
BAKY H, BAROTY G. Characterization of Egyptian Moringa peregrine seed oil and its bioactivities[J]. Social Science Electronic Publishing, 2017, 2(7): 99-108. |
| [4] |
CCHEN R, WANG X J, ZHANG Y Y, XING Y, YANG L, NI H, LI H H. Simultaneous extraction and separation of oil, proteins, and glucosinolates from Moringa oleifera seeds[J]. Food Chemistry, 2019, 300: 125162. DOI:10.1016/j.foodchem.2019.125162 |
| [5] |
HASSAN A, AL-KAHTAN I. Some antinutritional factors in Moringa peregrina (Al-Yassar or Al-Ban) and soybean products[J]. Journal of Food Science, 1995, 60(2): 395-398. DOI:10.1111/j.1365-2621.1995.tb05680 |
| [6] |
曾永明, 谷瑶, 陈松武, 曾祥艳, 栾洁, 周丽珠. 全自动凯氏定氮仪测定辣木籽蛋白质含量[J]. 轻工科技, 2020, 36(12): 10-15. ZENG Y M, GU Y, CHEN S W, ZENG X Y, LUAN J, ZHOU L Z. Determination of protein content of Moringa oleifera seeds by automatic Kjeldahl nitrogen analyzer[J]. Light Industry Science and Technology, 2020, 36(12): 10-15. |
| [7] |
SALEM H B, MAKKAR H. Defatted Moringa oleifera seed meal as a feed additive for sheep[J]. Animal Feed Science & Technology, 2009, 150(2): 27-33. DOI:10.1016/j.anifeedsci.2008.07.007 |
| [8] |
KAPSE G, SAMADDER S R. Moringa oleifera seed defatted press cake based biocoagulant for the treatment of coal beneficiation plant effluent[J]. Journal of Environmental Management, 2021, 296: 113202. DOI:10.1016/j.anifeedsci.2008.07.007 |
| [9] |
余楠楠, 陈琛. 生物活性肽功能及制备技术研究进展[J]. 中国酿造, 2018, 37(9): 17-21. YU N N, CHEN C. Research progress of bioactive peptides function and preparation technology[J]. China Brewing, 2018, 37(9): 17-21. |
| [10] |
ULUG S K, JAHANDIDEH F, WU J. Novel technologies for the production of bioactive peptides[J]. Trends in Food Science & Technology, 2021, 108(1): 27-39. DOI:10.1016/j.tifs.2020.12.002 |
| [11] |
SHARMA P, WICHAPHON J, KLANGPETCH W. Antimicrobial and antioxidant activities of defatted Moringa oleifera seed meal extract obtained by ultrasound-assisted extraction[J]. International Journal of Food Microbiology, 2020, 332(2): 1-8. DOI:10.1016/j.ijfoodmicro.2020.108770 |
| [12] |
HUANG Z, KANG D, LI J, GUO C, PENG S. Study on the optimization of the enzymatic hydrolysis of antimicrobial protein from Moringa oleifera leaves by response surface method[J]. IOP Conference Series, Earth and Environmental Science, 2020, 446(3): 032057. DOI:10.1088/1755-1315/446/3/032057 |
| [13] |
ADERINOLA T A, FAGBEMI T N, ENUJIUGHA V N, ALASHI A M, ALUKO R E. Amino acid composition and antioxidant properties of Moringa oleifera seed protein isolate and enzymatic hydrolysates[J]. Heliyon, 2018, 4(10): e00877. DOI:10.1016/j.heliyon.2018.e00877 |
| [14] |
刘华勇. 水酶法同时提取辣木籽油和抗氧化肽的研究[D]. 广州: 华南理工大学, 2016. LIU H Y. Aqueous enzymatic of Moringa oleifera seed oil and antioxidant peptides simultaneously[D]. Guangzhou: South China University of Technology, 2016. |
| [15] |
URBIZO-REYES U, MARTIN-GONZ LEZ M, GARCIA-BRAVO J, MALO A L, LICEAGA A M. Physicochemical characteristics of chia seed (Salvia hispanica) protein hydrolysates produced using ultrasonication followed by microwave-assisted hydrolysis[J]. Food Hydrocolloids, 2019, 97: 105187. DOI:10.1016/j.foodhyd.2019.105187 |
| [16] |
FRANCK M, PERREAULT V, SUWAL S, MARCINIAK A, BAZINET L, DOYEN A. High hydrostatic pressure-assisted enzymatic hydrolysis improved protein digestion of flaxseed protein isolate and generation of peptides with antioxidant activity[J]. Food Research International, 2019, 115: 467-473. DOI:10.1016/j.foodres.2018.10.034 |
| [17] |
焦洁. 考马斯亮蓝G-250染色法测定苜蓿中可溶性蛋白含量[J]. 农业工程技术, 2016, 36(17): 33-34. DOI:10.16815/j.cnki.11-5436/s.2016.17.023 JIAO J. Determination of soluble protein content in alfalfa by Coomassie brilliant blue G-250 staining method[J]. Agricultural Engineering Technology, 2016, 36(17): 33-34. DOI:10.16815/j.cnki.11-5436/s.2016.17.023 |
| [18] |
郭兴凤. 蛋白质水解度的测定[J]. 中国油脂, 2000, 25(6): 176-177. DOI:10.3321/j.issn:1003-7969.2000.06.053 GUO X F. Determination of hydrolysis degree of protein[J]. China Oil and Fats, 2000, 25(6): 176-177. DOI:10.3321/j.issn:1003-7969.2000.06.053 |
| [19] |
王宪泽. 生物化学实验技术原理和方法[M]. 北京: 中国农业出版社, 2002. WANG X Z. Principles and methods of biochemical experiment technology[M]. Beijing: China Agriculture Press, 2002. |
| [20] |
孙立. 红花籽粕抗氧化肽的制备及抗氧化活性研究[D]. 石河子: 石河子大学, 2014. SUN L. Activity of Safflower meal preparation and antioxidant peptides and antioxidant[D]. Shihezi: Shihezi University, 2014. |
| [21] |
田旭静. 藜麦糠清蛋白的提取及多肽抗氧化性研究[D]. 太原: 山西大学, 2018. TIAN X J. Study on extraction and polypeptides antioxidant of Quinoa chaff albumin[D]. Taiyuan: Shanxi University, 2018. |
| [22] |
ARNAO M B. Some methodological problems in the determination of antioxidant activity using chromogen radicals: A practical case[J]. Trends in Food Science & Technology, 2000, 11(11): 419-421. DOI:10.1016/S0924-2244(01)00027-9 |
| [23] |
MA Y, WU Y, LI L. Relationship between primary structure or spatial conformation and functional activity of antioxidant peptides from Pinctada fucata[J]. Food Chemistry, 2018, 264: 108-117. DOI:10.1016/j.foodchem.2018.05.006 |
| [24] |
徐萍. 蜂蛹多肽的制备, 初步纯化及抗氧化活性研究[D]. 镇江: 江苏大学, 2018. XU P. Preparation, preliminary purification and antioxidant activity of bee pupa polypeptides[D]. Zhenjiang: Jiangsu University, 2018. |
| [25] |
兰亚茹, 黄硕, 赵飞, 吴宏宇, 郭永学. 响应面法优化鹿茸胶原蛋白制备抗氧化肽的水解条件[J]. 过程工程学报, 2020, 20(1): 91-98. LAN Y R, HUANG S, ZHAO F, Guo Y X. Optimization of enzymatic hydrolysis conditions for antioxidant peptides preparation from velvet antler collagen by response surface methodology[J]. Chinese Journal of Process Engineering, 2020, 20(1): 91-98. |
| [26] |
COELHO M S, DE ARAUJO AQUINO S, LATORRES J M, DE LAS MERCEDES SALAS-MELLADO M. In vitro and in vivo antioxidant capacity of chia protein hydrolysates and peptides[J]. Food Hydrocolloids, 2019, 91: 19-25. DOI:10.1016/j.foodhyd.2019.01.018 |
| [27] |
TIAN S, DU K, YAN F, LI YTIAN S, DU K, YAN F, LI Y. Microwave-assisted enzymatic hydrolysis of wheat germ albumin to prepare polypeptides and influence on physical and chemical properties[J]. Food Chemistry, 2022, 374: 131707. DOI:10.1016/j.foodchem.2021.131707 |
| [28] |
陈西娟. 白果蛋白的提取分离、结构表征及酶解制备多肽的研究[D]. 北京: 中国林业科学研究院, 2010. CHEN X J. Study on separation and structural of Ginkgo protein and preparation of peptides by enzymatic hydrolysis[D]. Beijing: Chinese Academy of Forestry Sciences, 2010. |
| [29] |
陈胜军, 刘欢, 杨少玲, 杨贤庆, 戚勃, 胡晓. 舌状蜈蚣藻多糖提取工艺及抗氧化活性分析[J]. 上海海洋大学学报, 2020, 29(1): 153-160. DOI:10.12024/jsou.20181002415 CHEN S J, LIU H, YANG S L, YANG X Q, QI B, HU X. Extraction process and antioxidant activity analysis of polysaccharide from Centipede vulgaris[J]. Journal of Shanghai Ocean University, 2020, 29(1): 153-160. DOI:10.12024/jsou.20181002415 |
| [30] |
唐天悦, 周海玥, 姜婧, 宋立华. 利用油料籽粕酶法制备多肽工艺及其抗氧化活性研究进展[J]. 食品工业科技, 2016, 37(17): 390-394. DOI:10.13386/j.issn1002-0306.2016.17.069 TANG T Y, ZHOU H Y, JIANG J, SONG L H. Research progress in enzymatic preparation of oil crop meal petides and its antioxidant activity[J]. Food Industry Science and Technology, 2016, 37(17): 390-394. DOI:10.13386/j.issn1002-0306.2016.17.069 |
| [31] |
FANG H L I, ZHU G Q, GUO X X, HAN X X, TANG X J, WANG K W, WANG Y B. Optimization on the preparation of flavor precursor of Penaeus chinensis seasoning by flavour protease hydrolysis technology[J]. Science and Technology of Food Industry, 2018, 37(4): 229-236. DOI:10.1111/jfq.12091 |
| [32] |
夏吉安, 黄凯, 李森, 宋洪东, 管骁. 绿豆抗氧化肽的酶法制备及其抗氧化活性[J]. 食品与生物技术学报, 2020, 39(10): 40-47. DOI:10.3969/j.issn.1673-1689.2020.10.006 XIA J A, HUANG K, LI S, SONG H D, GUAN X. Enzymatic preparation of mung bean antioxidant peptide and antioxidant activity investigation[J]. Chinese Journal of Food and Biotechnology, 2020, 39(10): 40-47. DOI:10.3969/j.issn.1673-1689.2020.10.006 |
| [33] |
SUN W. Microwave-assisted protein preparation and enzymatic digestion in proteomics[J]. Molecular & Cellular Proteomics, 2005, 5(4): 769-776. DOI:10.1074/mcp.t500022-mcp200 |
| [34] |
陈正毅. 连续微波辅助酶解技术及其在蛋白与多肽研究中的应用[D]. 桂林: 桂林理工大学, 2014. CHEN Z Y. Continuous microwave-assisted enzymolysis technology and its application in protein and peptide research[D]. Guilin: Guilin University of Technology, 2014. |
(责任编辑 邹移光)
 2022, Vol. 49
2022, Vol. 49