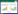文章信息
基金项目
- 广东省重点领域研发计划项目(2021B0707010009);广东省普通高校特色创新项目(2022KTSCX148);肇庆学院博士启动项目(21010117)
作者简介
- 刘郁夫(1990—),男,博士,研究方向为兽医微生物学,E-mail:363995606@qq.com.
通讯作者
- 陈瑞爱(1970—),女,博士,教授,研究方向为动物疫病防控,E-mail:chensa727@vip.126.com.
文章历史
- 收稿日期:2023-07-27
2. 岭南现代农业科学与技术广东省实验室肇庆分中心,广东 肇庆 526238;
3. 农业农村部兽用生物制品工艺技术重点实验室/广东省兽用生物制品技术研究与应用企业重点实验室/肇庆大华农生物药品有限公司,广东 肇庆 526238
2. Zhaoqing Branch Center of Guangdong Laboratory for Lingnan Modern Agricultural Science and Technology, Zhaoqing 526238, China;
3. Key Laboratory of Manufacture Technology of Veterinary Bioproducts, Ministry of Agriculture and Rural Affairs/Guangdong Enterprise Key Laboratory of Biotechnology R&D of Veterinary Biologics/Zhaoqing Dahuanong Biology Medicine Co., Ltd, Zhaoqing 526238, China
【研究意义】禽流感病毒(Avian influenza virus,AIV)是影响养禽业健康发展的重要病原之一,其中高致病性AIV(H5亚型、H7亚型)因其传播广泛、死亡率高、危害严重而备受科研人员关注[1-2],此外H5、H7亚型AIV还可感染人,威胁人类健康[3]。针对H7亚型禽流感亚单位疫苗具有广阔的应用前景,本试验为进一步制备H7亚型禽流感亚单位疫苗,评价其免疫原性提供前期基础。【前人研究进展】自2013年新型H7N9亚型AIV首次在我国发现以来,已经历5轮疫情的流行,并持续威胁家禽养殖业和公共卫生安全[1]。灭活疫苗免疫是AIV防控的主要措施[4],目前市场上使用较多的重组禽流感病毒二价(H5+H7)灭活疫苗对鸡、鸭等家禽免疫保护效果较好,但流感病毒流行变异速度较快[5],需要定期更换种毒,且灭活鸡胚病毒液中含有较多杂蛋白,不利于抗原纯化浓缩[6]。目前已报道有多种蛋白表达系统可用于制备重组蛋白,常用的有大肠杆菌原核系统、酵母真核系统、昆虫细胞表达系统和哺乳动物表达系统[7-9]。不同表达系统各有优势,其中大肠杆菌原核系统的表达成功率高、表达量高,但多以包涵体形式表达蛋白,生物活性低[10];酵母表达系统易培养无毒性,易高密度发酵,但糖基化修饰与哺乳动物之间仍有差异[11];哺乳动物表达系统表达的蛋白最贴近病毒天然状态,是制备病毒抗原蛋白的最佳途径,但哺乳动物表达系统的表达量低、成本高,且技术程度要求高[12]。杆状病毒不感染哺乳动物细胞,安全性高,可表达具有生物学活性的蛋白[13],采用无血清全悬浮细胞培养技术可批量化生产重组蛋白,是理想的蛋白表达系统。【本研究切入点】血凝素蛋白(Hemagglutinin, HA)是AIV囊膜表面的主要免疫原性蛋白,可诱导机体产生中和抗体,是新型亚单位疫苗研发的重要靶点。为H7亚型禽流感亚单位疫苗研发提供足够的蛋白原料,本试验利用昆虫细胞系统表达HA蛋白,并建立相应的荧光定量PCR试验检测方法,确定最优的感染复数和培养时间后,再进行大量表达和纯化。【拟解决的关键问题】利用杆状病毒- 昆虫细胞表达系统表达H7亚型AIV HA蛋白,建立荧光定量PCR检测方法对杆状病毒滴度进行定量,确定最佳的昆虫细胞表达条件。
1 材料与方法 1.1 试验材料供试杆状病毒穿梭质粒pFastBac1、质粒pUC19、草地贪夜蛾卵巢细胞Sf9由岭南现代农业科学与技术广东省实验室肇庆分中心保存,H7亚型AIV鸡阳性血清(Re-3株)由肇庆大华农生物药品有限公司提供,DH5α感受态细胞(C1100)、DH10Bac感受态细胞(C1480)、Anti-His鼠源单抗(K200060M)、HRP标记羊抗鼠IgG(SE131)购自北京索莱宝科技有限公司。
主要试剂:Premix Ex Taq(RR001B)、Prime STAR GXL DNA聚合酶(R050A)、BamH I限制性内切酶(1605)、Hind Ⅲ限制性内切酶(1615),宝日医生物科技(北京)有限公司产品;BAC/PAC DNA小量提取试剂盒(D2156),OMEGA公司产品;Sf-900 Ⅲ昆虫细胞培养基(12658035)、Opti-MEM减血清培养基(31985088),Gibco公司产品;ExpiFectamine Sf转染试剂(A38915),赛默飞世尔科技(中国)有限公司产品;SDS-PAGE凝胶一步法快速制备试剂盒(WB2102),北京博泰斯生物技术有限公司产品;考马斯亮蓝超快染色液(P0017F)、BeyoGold His-tag Purification Resin(P2210)、BCA蛋白浓度测定试剂盒(P0012),上海碧云天生物技术有限公司产品。
主要仪器:PCR仪C1000 Touch、蛋白垂直电泳仪,美国BIO-RAD公司产品;凝胶成像系统,上海天能科技有限公司产品;荧光倒置显微镜,Invitrogen公司产品;恒温培养箱,赛默飞世尔科技(中国)有限公司产品;全能型化学发光成像系统,美国通用电气公司产品。
1.2 试验方法1.2.1 目的基因设计与合成 从NCBI网站上下载H7亚型禽流感病毒中国流行株A/chicken/Jiangxi/JX4/2017(H7N9)的HA蛋白序列(KY751065),根据昆虫细胞的密码子偏嗜性进行密码子优化。为提高在昆虫细胞上清中表达的效果,将HA的血凝素信号肽序列替换成杆状病毒GP64蛋白信号肽序列(MVSAIVLYVLLAAAAHSAFA),在肽链C端设计6×His标签(HHHHHH)用于目的蛋白的检测和纯化,基因序列由苏州金唯智生物科技有限公司合成。本试验的质粒构建、重组病毒拯救、表达鉴定和蛋白纯化等内容均于2023年1—6月在岭南现代农业科学与技术广东省实验室肇庆分中心完成。
1.2.2 杆状病毒穿梭质粒构建 参考优化后的基因序列设计HA基因的PCR扩增引物,引物序列见表 1,在引物序列5' 端和3' 端分别添加BamH Ⅰ和Hind Ⅲ酶切位点,以酶切连接的形式克隆至pFastBac1中。然后再将连接产物转化DH5α感受态细胞,经氨苄霉素抗性筛选和菌液PCR验证,筛选出阳性克隆菌株,再送苏州金唯智生物科技有限公司进行测序验证。
1.2.3 重组HA基因杆状病毒拯救 参考DH10Bac感受态细胞说明书(C1480)构建重组杆状病毒质粒,通过化学转化法向DH10Bac感受态细胞中导入杆状病毒穿梭质粒pFastBac-HA,并置于37 ℃摇床振荡培养4 h,然后取10 μL菌液分别涂布于含卡那霉素(终浓度50 μg/mL)、四环素(终浓度10 μg/mL)和庆大霉素(终浓度7 μg/mL)3种抗生素的LB平板中,并添加IPTG和X-gal试剂进行蓝白斑筛选;37 ℃温箱培养20 h后挑取白色单菌落以H7-F/R引物对进行PCR鉴定。根据BAC/PAC DNA小量提取试剂盒(D2156)说明书抽提杆状病毒质粒,置于-20 ℃冰箱保存备用。
参考ExpiFectamine Sf转染试剂说明书(A38915)拯救重组杆状病毒,将处于对数生长期的Sf9昆虫细胞以每孔1×106个细胞的密度接种至6孔细胞培养板,待细胞贴壁后,取3 μg杆状病毒质粒和8 μL转染试剂,分别加入到Opti-MEM培养基中,室温静置5 min,将两者混匀、再静置5 min,然后逐滴加入Sf9中,置于27 ℃温箱培养96 h。盲传3代后,显微镜下观察是否出现Sf9变圆变大、漂浮、脱落等细胞病变。
1.2.4 H7亚型AIV HA重组蛋白的表达及鉴定 为鉴定Sf9是否表达HA重组蛋白,通过间接免疫荧光试验进行检测。Sf9经4% 多聚甲醛固定处理、0.1% Triton X-100细胞透化5 min,再以1∶500倍稀释的anti-His单抗为一抗,37 ℃温箱孵育1 h,以1∶500倍稀释的FITC标记的羊抗鼠IgG为二抗,37 ℃温箱孵育1 h,最后用PBS清洗3次,置于荧光显微镜下观察结果。
为鉴定Sf9表达的HA重组蛋白分子量大小是否符合预期,通过Western blots试验进行检测。Sf9细胞样品经SDS-PAGE电泳、NC膜转印、5% 脱脂牛奶封闭后,分别以1∶5 000倍稀释的anti-His鼠源单抗和1∶500倍稀释的H7亚型AIV(Re-3株)阳性血清为一抗,孵育NC膜,PBST清洗3遍,再分别以HRP标记的羊抗鼠IgG和HRP标记的兔抗鸡IgG为二抗,孵育NC膜。最后滴加显色液,通过化学发光的方法成像。
1.2.5 荧光定量PCR检测杆状病毒滴度 为建立杆状病毒荧光定量PCR检测方法,首先将杆状病毒质粒中的gp64基因克隆至pUC19质粒中,同时设计gp64基因的qPCR检测引物,gp64基因的PCR扩增引物和qPCR检测引物序列见表 1。以重组质粒pUC19-gp64为标准质粒,计算质粒拷贝数,并10倍倍比稀释至1×108~1×103 copy/μL,通过荧光定量PCR构建标准曲线。
1.2.6 H7亚型AIV HA蛋白在昆虫细胞中的表达及纯化 根据荧光定量PCR检测结果,将杆状病毒病毒液分别以20、10、2、1 MOI的剂量接种至Sf9,接种后24、48、72 h取样进行Western blots检测,以筛选最佳的蛋白表达条件。最后通过His镍株亲和层析的方式从Sf9中纯化HA重组蛋白,并以Bradford法检测纯化后蛋白浓度。
2 结果与分析 2.1 杆状病毒穿梭质粒的构建以H7-F/R引物对进行H7亚型AIV HA基因的PCR扩增,结果如图 1所示,可扩增出约1 700 bp的条带,PCR扩增结果与预期大小相符。经酶切连接克隆至杆状病毒穿梭质粒pFastBac1,将测序验证正确的阳性克隆命名为pFastBac-HA。
|
| M:DNA marker;1、2:HA基因; 3:空白对照 M: DNA marker; 1, 2: HA gene; 3: Blank control 图 1 HA基因PCR扩增结果 Fig. 1 PCR amplification results of HA gene |
2.2 重组杆状病毒的拯救
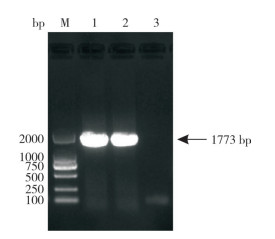
将制备的杆状病毒穿梭质粒pFastBac-HA,转化到DH10Bac感受态细胞中,经基因转座、抗生素筛选和PCR鉴定,获得重组HA基因的杆状病毒质粒bacmid-HA。将bacmid-HA以脂质体转染的形式转入Sf9昆虫细胞中,置于27 ℃温箱孵育4 d,盲传3代后,直至Sf9出现细胞肿胀、脱落、死亡等典型病变,再进行间接免疫荧光试验检测昆虫细胞中是否表达特异性目的蛋白。如图 2所示,以His标签抗体为一抗孵育,接种重组杆状病毒的Sf9细胞可在荧光显微镜下观察到绿色荧光,证明重组杆状病毒拯救成功。
|
| A:Sf9接种P3代杆状病毒(绿色荧光,100×);B:Sf9接种P3代杆状病毒(白光,100×);C:正常Sf9(绿色荧光,100×);D:正常Sf9(白光,100×) A: Inoculation of P3 generation baculovirus into Sf9 cells (green fluorescence, 100×); B: Inoculation of P3 generation baculovirus into Sf9 cells (white light, 100×); C: Normal Sf9 cells (green fluorescence, 100×); D: Normal Sf9 cells (white light, 100×) 图 2 间接免疫荧光鉴定H7亚型AIV HA重组蛋白的表达 Fig. 2 Identification of expression of H7 subtype AIV HA recombinant protein by indirect immunofluorescence |
2.3 H7亚型AIV HA蛋白的表达及鉴定
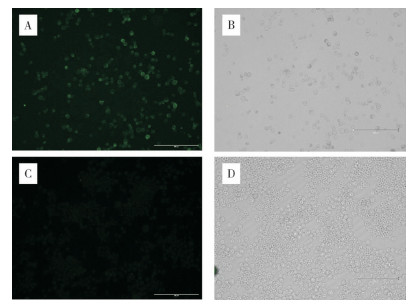
为鉴定Sf9表达的目的蛋白分子量是否符合预期,取接种重组杆状病毒的Sf9细胞样品进行Western blots检测,分别以His标签抗体和H7亚型AIV阳性血清为一抗孵育,结果如图 3所示,均可显色出一条70 kD左右的目的蛋白条带,与预期大小相符,表明H7亚型AIV HA重组蛋白表达成功,且该重组蛋白可被H7亚型AIV阳性血清识别。
|
| 1:以His标签抗体为一抗孵育;2:以H7亚型AIV阳性血清为一抗孵育 1: Incubation with His antibody as primary antibody; 2: Incubation with H7 subtype AIV positive serum as primary antibody 图 3 Western blots试验鉴定H7亚型AIV HA重组蛋白的表达 Fig. 3 Identification of expression of H7 subtype AIV HA recombinant protein by western blots assay |
2.4 gp64基因荧光定量PCR检测方法的建立
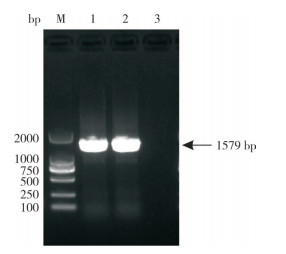
为定量检测重组杆状病毒滴度,构建基于杆状病毒gp64基因的荧光定量PCR检测方法。首先以GP64-F/R引物对为引物,从杆状病毒质粒中将gp64基因克隆至pUC19质粒中,结果如图 4所示,可PCR扩增出约1 500 bp左右的单一条带,与预期相符,将测序验证正确的重组质粒命名为pUC19-gp64。
|
| 1、2:gp64基因; 3:空白对照 1, 2: gp64 gene; 3: Blank control 图 4 gp64基因的PCR扩增结果 Fig. 4 PCR amplification results of gp64 gene |
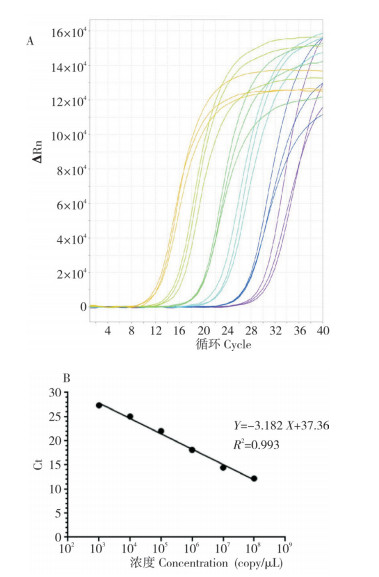
将pUC19-gp64质粒稀释至1×103~1×108 copy/μL,以qGP64-F/R引物对进行荧光定量PCR检测,扩增曲线为平滑的“S”形(图 5),且溶解曲线单一,标准曲线的相关系数R2=0.993,表明gp64基因在1×103~1×108 copy/μL间呈现良好的线性关系,具有较好的重复性。利用该方法测得P5代杆状病毒滴度为2.8×105 copy/μL。
|
| A:pUC19-gp64质粒不同稀释倍数的扩增曲线; B:gp64基因标准曲线 A: Amplification plot of pUC19-gp64 plasmid with different dilution ratios; B: Standard curve of gp64 gene 图 5 荧光定量PCR检测杆状病毒gp64基因拷贝数 Fig. 5 Fluorescence quantitative PCR detection of gp64 gene copy number in baculovirus |
2.5 HA蛋白在昆虫细胞中的表达及纯化
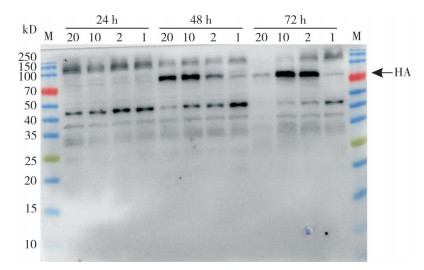
根据qPCR检测杆状病毒液效价的结果,将P5代病毒液分别以20、10、2、1 MOI的比例接种至Sf9,并取接种后24、48、72 h的细胞样品进行Western blots检测,结果如图 6所示,接种24 h细胞未表达目的蛋白;接种48 h,以20、10、2 MOI比例接种的细胞开始表达HA重组蛋白;接种72 h,以10、2 MOI比例接种的细胞可以表达目的蛋白。综合比较,以10 MOI接种72 h后,昆虫细胞中HA重组蛋白的表达量最高。
|
| 图 6 不同接种剂量和表达时间对昆虫细胞表达HA蛋白的影响 Fig. 6 Effect of different inoculation doses and expression time on the expression of HA protein in insect cells |
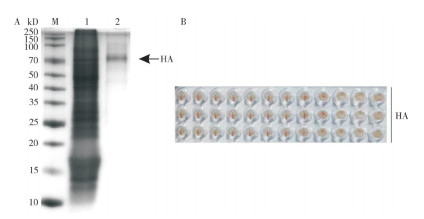
将P5代杆状病毒病毒液以10 MOI的比例接种至Sf9,置于27 ℃温箱培养72 h,收获细胞样品,并以His镍株亲和纯化的方式纯化目的蛋白,结果如图 7所示,可纯化出70 kD左右的单一目的条带,经Bradford法检测HA重组蛋白浓度为0.268 mg/mL,且表达的HA重组蛋白具有凝集鸡红细胞的活性,鸡红细胞凝集效价为4 log2,说明H7亚型AIV HA重组蛋白可在昆虫细胞中成功表达。
|
|
A:HA蛋白的纯化;B:HA蛋白的血凝活性 1:His镍株纯化前Sf9细胞样品;2:纯化后HA蛋白 A: Purification of HA protein; B: Hemagglutination activity of HA protein 1:Sf9 cell sample before purification; 2: Purified HA protein 图 7 His镍株纯化后的HA蛋白 Fig. 7 HA protein purified from His nickel strain |
3 讨论
高致病性AIV是影响养鸡业的重要病原,其中H5和H7亚型是高致病性AIV主要亚型[14]。为有效阻止新型H7N9病毒在鸡群中的传播,2017年我国采用灭活疫苗免疫的方式进行防控,取得了很好的效果[1]。但传统鸡胚灭活疫苗的使用也面临多种限制,如需要定期更换种毒以匹配流行毒株的抗原性;生产过程中需要生物安全3级车间,增加了生产成本;生产依赖鸡胚,且鸡胚病毒液含有较多杂蛋白,不利于抗原纯化浓缩等。利用现代基因工程技术,研发新型亚单位疫苗可有效避免这些不利因素,是禽流感疫苗研发的热点[15]。
目前已有较多文献报道通过多种途径制备禽流感新型亚单位或载体疫苗。在AIV侵染宿主细胞过程中,HA蛋白需要被蛋白酶水解成HA1和HA2两个亚基,再启动病毒囊膜和细胞膜的融合过程[16]。其中HA1区域含有抗原决定簇和受体结合位点,主要发挥识别和结合细胞表面受体的功能,HA2的羧基端插入病毒囊膜的脂质双层,主要由疏水氨基酸残基组成,HA亚单位疫苗的构建策略可选择HA1、HA2和HA全长3种靶点。Hsieh等[17]利用杆状病毒表达系统表达H6亚型AIV的HA1蛋白,但表达的HA1蛋白没有血凝活性;Jiang等[18]构建表面展示HA2亚基的重组乳杆菌,并利用SPF鸡动物模型证明该乳杆菌可有效降低H9N2亚型AIV感染引起的病死率、体重减轻、病理损伤等症状;Shirvani等[19]以重组新城疫病毒为载体,分别构建重组表达H5亚型AIV HA1、HA2和HA蛋白的重组病毒,结果显示单独表达HA1或HA2亚基的重组病毒免疫保护效果弱于HA蛋白,表明HA1和HA2对于诱导机体产生中和抗体、发挥生物学活性和提供完全的免疫保护力都是必需的。为表达具有完整生物学活性的HA蛋白,本试验选择表达H7亚型AIV HA蛋白的全长,但HA重组蛋白的免疫原性和免疫保护力仍需通过动物试验进一步验证。
杆状病毒表达系统由于系统成熟,便于操作和可表达具有生物活性蛋白等优点,在重组蛋白表达中应用较多。Tung等[20]利用杆状病毒表面展示系统构建HA亚单位疫苗,经佐剂配比后免疫SPF鸡,免疫2周后HI抗体可达到7 log2;孙一等[21]构建表达HA蛋白的重组杆状病毒,对高致病性H7N9 AIV可提供100% 的临床保护;Yu等[22]构建了串联表达H1、H9、H7亚型HA抗原表位的杆状病毒,并通过动物试验证明该重组蛋白可在鸡和小鼠上提供一定免疫效力。综上所述,以杆状病毒表达HA蛋白制备禽流感亚单位疫苗的技术路线可行,为提高HA蛋白在昆虫细胞中的表达量,本试验对HA基因序列进行密码子优化,并将HA血凝素信号肽替换成杆状病毒GP64蛋白信号肽。
终点稀释和空斑法是测定杆状病毒滴度常用方法,但该方法耗时长,往往需要4~7 d才能读数,且操作复杂,对技术要求高,不利于杆状病毒滴度的快速测定[23]。gp64基因是杆状病毒的必需基因,其编码的GP64蛋白分布在杆状病毒囊膜表面,是测定杆状病毒滴度的靶标蛋白[24]。本试验将杆状病毒的gp64基因克隆至pUC19质粒中,并建立基于gp64基因的荧光绝对定量PCR检测方法,该方法可在4 h内对杆状病毒的滴度进行快速检测,有助于后续筛选合适的感染复数和培养时间。此外,王妍等[25]研发出针对杆状病毒GP64蛋白的免疫染色检测方法,利用该方法与商品化试剂盒进行比较,灵敏度差异不显著,表明该方法可用于杆状病毒滴度的检测。qPCR检测方法的优势在于简便快速,虽然免疫化学检测方法需要进行细胞培养过程,但对病毒滴度测定的结果更准确可靠,两种方法之间的相关性需要进一步验证。
4 结论本试验利用杆状病毒- 昆虫细胞表达系统表达H7亚型AIV HA蛋白。首先密码子优化并合成H7亚型AIVHA基因序列,拯救重组HA基因的杆状病毒,并在草地贪夜蛾卵巢细胞Sf9中成功表达HA蛋白,经Western blots鉴定,HA重组蛋白大小约70 kD左右,且可与H7亚型AIV阳性血清反应。接着利用SYBR green染料法荧光定量PCR试验,建立基于gp64基因的杆状病毒qPCR检测方法,该方法在1×103~1×108 copy/μL间呈现良好的线性关系,标准曲线的相关系数R2=0.993。然后利用qPCR检测方法对杆状病毒液进行定量,并通过Western blots试验筛选HA蛋白表达的最佳感染复数和孵育时间,结果显示以10 MOI的比例接种Sf9,孵育72 h,蛋白表达效果最好。最后通过His镍株亲和纯化的HA重组蛋白,蛋白浓度为0.268 mg/mL,鸡红细胞凝集效价为4 log2。本试验可为H7亚型禽流感亚单位疫苗的研发提供前期基础。
| [1] |
LI C J, CHEN H L. H7N9 influenza virus in China[J]. Cold Spring Harbor Perspectives in Medicine, 2021, 11(8): a038349. DOI:10.1101/cshperspect.a038349 |
| [2] |
HU Z L, JIAO X N, LIU X F. Antibody immunity induced by H7N9 avian influenza vaccines: evaluation criteria, affecting factors, and implications for rational vaccine design[J]. Frontiers in Microbiology, 2017, 8: 1898. DOI:10.3389/fmicb.2017.01898 |
| [3] |
YANG H, DONG Y R, BIAN Y, HUO C Z, ZHU C C, QIN T, CHEN S J, PENG D X, LIU X F. The synergistic effect of residues 32 T and 550 L in the PA protein of H5 subtype avian influenza virus contributes to viral pathogenicity in mice[J]. PLoS Pathogens, 2023, 19(7): e1011489. DOI:10.1371/journal.ppat.1011489 |
| [4] |
CRIADO MF, SÁ E SILVA M, LEE DH, SALGE CAL, SPACKMAN E, DONIS R, WAN XF, SWAYNE DE. Cross-protection by inactivated H5 prepandemic vaccine seed strains against diverse goose/Guangdong lineage H5N1 highly pathogenic avian influenza viruses[J]. Journal of Virology, 2020, 94(24): e00720. DOI:10.1128/JVI.00720-20 |
| [5] |
ZHANG Q, MEI X D, ZHANG C, LI J, CHANG N N, AJI D, SHI W F, BI Y H, MA Z H. Novel reassortant 2.3.4.4B H5N6 highly pathogenic avian influenza viruses circulating among wild, domestic birds in Xinjiang, northwest China[J]. Journal of Veterinary Science, 2021, 22(4): e43. DOI:10.4142/jvs.2021.22.e43 |
| [6] |
SULTAN HA, ARAFA AE, TALAAT S, GABALLA A A, KILANY WH, ELFEIL WK, SHEHATA AA, AMARIN N. Efficacy of clade 2.3.2 H5-recombinant baculovirus vaccine in protecting muscovy and Peking ducks from clade 2.3.4.4 H5N8 highly pathogenic avian influenza infection[J]. Avian Diseases, 2019, 63(sp1): 219. DOI:10.1637/0005-2086-63.1.219 |
| [7] |
JIANG D W, LIU Y C, WANG A P, ZHANG G P, YANG G Y, CHEN Y M, JI P C, LIU C, SONG Y P, SU Y Y, WANG G Q, WANG J C, ZHAO B L, DENG R G. High level soluble expression and one-step purification of IBDV VP2 protein in Escherichia coli[J]. Biotechnology Letters, 2016, 38(6): 901-908. DOI:10.1007/s10529-016-2073-8 |
| [8] |
WU P P, LU J H, ZHANG X H, MEI M, FENG L, PENG D X, HOU J B, KANG SM, LIU X F, TANG Y H. Single dose of consensus hemagglutinin-based virus-like particles vaccine protects chickens against divergent H5 subtype influenza viruses[J]. Frontiers in Immunology, 2017, 8: 1649. DOI:10.3389/fimmu.2017.01649 |
| [9] |
LAZUTKA J, SIMUTIS K, MATULIS P, PETRAITYTE-BURNEIKIENE R, KUCINSKAITE-KODZE I, SIMANAVICIUS M, TAMOSIUNAS PL. Antigenicity study of the yeast-generated human parvovirus 4 (PARV4) virus-like particles[J]. Virus Research, 2021, 292: 198236. DOI:10.1016/j.virusres.2020.198236 |
| [10] |
莫超迪, 覃呈欢, 戴龙喜, 韩鹏夫, 纪月鑫, 韦友传. 黄喉拟水龟肺炎克雷伯菌外膜蛋白A的原核表达与纯化[J]. 广东农业科学, 2023, 50(3): 137-143. DOI:10.16768/j.issn.1004-874X.2023.03.016 MO C D, QIN C H, DAI L X, HAN P F, JI Y X, WEI Y C. Prokaryotic expression and purification of OmpA of Klebsiella pneumoniae isolated from Mauremys mutica[J]. Guangdong Agricultural Sciences, 2023, 50(3): 137-143. DOI:10.16768/j.issn.1004-874X.2023.03.016 |
| [11] |
郭建军, 范汉东, 杨一兵, 罗成. 新城疫病毒F48E9株F-HN蛋白融合基因在毕赤酵母中的表达[J]. 广东农业科学, 2011, 38(20): 130-133. DOI:10.16768/j.issn.1004-874X.2011.20.075 GUO J J, FAN H D, YANG Y B, LUO C. F gene and HN gene co-express of Newcastle disease virus strain F48E9 in Pichia pastoris[J]. Guangdong Agricultural Sciences, 2011, 38(20): 130-133. DOI:10.16768/j.issn.1004-874X.2011.20.075 |
| [12] |
武旺盛, 颜仁和, 仇珍珍, 梁文翰, 刘军, 高永宏, 许明宇, 胡桂学, 钱爱东, 李红卫. 猪流行性腹泻病毒重组S1蛋白的免疫原性评价[J]. 中国兽医科学, 2021, 51(3): 305-313. DOI:10.16656/j.issn.1673-4696.2021.0050 WU W S, YAN R H, QIU Z Z, LIANG W H, LIU J, GAO Y H, XU M Y, HU G X, QIAN A D, LI H W. Immunogenicity of recombinant S1 of porcine epidemic diarrhea virus[J]. Chinese Veterinary Science, 2021, 51(3): 305-313. DOI:10.16656/j.issn.1673-4696.2021.0050 |
| [13] |
HSIEH MS, HE JL, WU TY, JUANG RH. A secretary bi-cistronic baculovirus expression system with improved production of the HA1 protein of H6 influenza virus in insect cells and spodoptera litura larvae[J]. Journal of Immunological Methods, 2018, 459: 81-89. DOI:10.1016/j.jim.2018.06.001 |
| [14] |
LIU S, ZHUANG Q Y, WANG S C, JIANG W M, JIN J H, PENG C, HOU G Y, LI J P, YU J M, YU X H, LIU H L, SUN S F, YUAN L P, CHEN J M. Control of avian influenza in China: Strategies and lessons[J]. Transboundary and Emerging Diseases, 2020, 67(4): 1463-1471. DOI:10.1111/tbed.13515 |
| [15] |
LIU H Y, CHEN Y K, LI H Y, YANG L G, YANG S L, LUO X Y, WANG S, CHEN J L, YAN S H. Pathogenicity, transmissibility, and immunogenicity of recombinant H9N2 avian influenza viruses based on representative viruses of Southeast China[J]. Poultry Science, 2023, 102(6): 102625. DOI:10.1016/j.psj.2023.102625 |
| [16] |
曾庆航, 刘杨, 孙敏华, 胡鑫宇, 谢梓民, 张敏霞, 袁朝霞, 廖明. 广东地区H9N2亚型禽流感病毒HA和NA基因生物学特征分析[J]. 广东农业科学, 2023, 50(5): 103-111. DOI:10.16768/j.issn.1004-874X.2023.05.012 ZENG Q H, LIU Y, SUN M H, HU X Y, XIE Z M, ZHANG M X, YUAN C X, LIAO M. Biological characteristic of HA and NA genes of H9N2 avian influenza virus in Guangdong Province[J]. Guangdong Agricultural Sciences, 2023, 50(5): 103-111. DOI:10.16768/j.issn.1004-874X.2023.05.012 |
| [17] |
HSIEH M S, HE J L, WU TY, JUANG R H. A secretary bi-cistronic baculovirus expression system with improved production of the HA1 protein of H6 influenza virus in insect cells and Spodoptera litura larvae[J]. Journal of Immunological Methods, 2018, 459(8): 81-89. DOI:10.1016/j.jim.2018.06.001 |
| [18] |
JIANG Y L, YANG G L, WANG Q, WANG Z N, YANG W T, GU W, SHI C W, WANG J Z, HUANG H B, WANG C F. Molecular mechanisms underlying protection against H9N2 influenza virus challenge in mice by recombinant Lactobacillus plantarum with surface displayed HA2-LTB[J]. Journal of Biotechnology, 2017, 259: 6-14. DOI:10.1016/j.jbiotec.2017.08.011 |
| [19] |
SHIRVANI E, PALDURAI A, VARGHESE B P, SAMAL S K. Contributions of HA1 and HA2 subunits of highly pathogenic avian influenza virus in induction of neutralizing antibodies and protection in chickens[J]. Frontiers in Microbiology, 2020, 11: 1085. DOI:10.3389/fmicb.2020.01085 |
| [20] |
TUNG MC, LU HY, CHANG YK, HUANG WR, LIAO TL, WU HY, CHANG CD, FAN HC, NIELSEN BL, LIU HJ. Baculovirus surface display of the HA protein of H5N2 avian influenza virus and its immunogenicity against a lethal challenge with H5N1 virus in chickens[J]. Veterinary Microbiology, 2020, 243: 108640. DOI:10.1016/j.vetmic.2020.108640 |
| [21] |
孙一, 李如梦, 李军, 马春喜, 赵以恒, 范雪莲, 何丽红, 刘东, 胡娇, 刘秀梵. 表达高致病性H7N9亚型禽流感病毒血凝素蛋白的重组杆状病毒疫苗候选株的构建与免疫效果评估[J]. 中国家禽, 2019, 41(18): 18-23. DOI:10.16372/j.issn.1004-6364.2019.18.004 SUN Y, LI R M, LI J, MA C X, ZHAO Y H, FAN X L, HE L H, LIU D, HU J, LIU X F. Generation and immune efficacy evaluation of the vaccine candidate of a recombinant baculovirus expressing hemagglutinin of the highly pathogenic H7N9 avian influenza virus[J]. China Poultry, 2019, 41(18): 18-23. DOI:10.16372/j.issn.1004-6364.2019.18.004 |
| [22] |
YU L, PAN J, CAO G, JIANG M, ZHANG Y, ZHU M, LIANG Z, ZHANG X, HU X, XUE R, GONG C. AIV polyantigen epitope expressed by recombinant baculovirus induces a systemic immune response in chicken and mouse models[J]. Virology Journal, 2020, 17(1): 121. DOI:10.1186/s12985-020-01388-w |
| [23] |
KIELKOPF C L, BAUER W, URBATSCH I L. Expression of cloned genes bsing the baculovirus expression system[J]. Cold Spring Harbor Protocols, 2020(6): 102152. DOI:10.1101/pdb.prot102152 |
| [24] |
熊宇, 左勇, 郭靖, 孟胜利, 申硕, 陈晓琦. 重组杆状病毒滴度免疫荧光法的建立及验证[J]. 微生物学免疫学进展, 2023, 51(3): 14-20. DOI:10.13309/j.cnki.pmi.2023.03.003 XIONG Y, ZUO Y, GUO J, MENG S L, SHEN S, CHEN X Q. An immunofluorescence method for determination the titer of recombinant baculovirus[J]. Progress in Microbiology and Immunology, 2023, 51(3): 14-20. DOI:10.13309/j.cnki.pmi.2023.03.003 |
| [25] |
王妍, 邓跃, 宋欢欢, 贺笋, 张超林, 李俊辉, 颜世君, 王尊宝, 王同燕, 谭菲菲, 田克恭. 基于GP64单抗的重组杆状病毒滴度测定方法的建立及应用[J]. 中国兽医学报, 2020, 40(11): 2090-2096. DOI:10.16303/j.cnki.1005-4545.2020.11.02 WANG Y, DENG Y, SONG H H, HE S, ZHANG C L, LI J H, YAN S J, WANG Z B, WANG T Y, TAN F F, TIAN K G. Establishment and application of titer determination method based on GP64 monoclonal antibody for recombinant baculovirus[J]. Chinese Journal of Veterinary Science, 2020, 40(11): 2090-2096. DOI:10.16303/j.cnki.1005-4545.2020.11.02 |
(责任编辑 邹移光)
 2023, Vol. 50
2023, Vol. 50