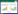文章信息
基金项目
- 广东省重点领域研发计划(2020B0202080004);广东省现代农业产业技术体系生猪创新团队项目;广东省动物疫病野外科学观测研究站项目(2021B1212050021);广东省农业科学院协同创新中心项目(XTXM202202)
作者简介
- 陈锦良(1989—),男,硕士,研究方向为动物流行病防控,E-mail:1556453464@qq.com.
通讯作者
- 黄元(1980—),男,硕士,副研究员,研究方向为动物传染病学及相关生物制品研发,E-mail:huangyuan62@126.com.
文章历史
- 收稿日期:2023-04-25
2. 东莞市动物疫病预防控制中心,广东 东莞 523128;
3. 广州市农业农村局,广东 广州 510405
2. Dongguan Animal Disease Prevention and Control Center, Dongguan 523128, China;
3. Guangzhou Agricultural and Rural Bureau, Guangzhou 510405, China
【研究意义】停乳链球菌(Streptococcus dysgalactiae)是一种革兰氏阳性菌,呈链状或双球状,属于链球菌科(Streptococcaceae)链球菌属(Streptococcus)。停乳链球菌有两个亚种,即停乳链球菌类马亚种(Streptococcus dysgalactiae subsp. equisimilis,SDSE)和停乳链球菌停乳亚种(Streptococcus dysgalactiae subsp. dysgalactiae)[1]。自2005年我国四川省暴发人感染猪链球菌病疫情以来,猪链球菌作为人兽共患病病原,引起公共卫生和科学研究领域的极大关注[2-5]。而停乳链球菌被认为致病力不强,报道较少。但近年来越来越多的研究表明,猪的SDSE感染可引致仔猪关节炎、心内膜炎或脑膜炎,从而导致养猪业生产力下降[6-10]。因此,对SDSE临床菌株进行研究,将有助于解决养猪生产实践中相似病例。【前人研究进展】猪、奶牛和山羊等动物感染停乳链球菌能引起菌血症、心内膜炎、关节炎,以及呼吸道和皮肤疾病等[11-12],大熊猫[13]和狐狸[14]等野生动物也有相关报道。Kasuya等[6]报道,SDSE感染引起18周龄约克夏种母猪发生严重的散播性化脓性脑膜炎。Oh等[8]报道,SDSE引起仔猪化脓性关节炎、脑炎、肾和心脏多灶脓肿。幸文定等[7]报道,SDSE引起江西某猪场仔猪被毛粗乱、跛行和关节肿大。陈楠楠等[9]报道,停乳链球菌停乳亚种引起东北民猪仔猪关节肿大、跛行,后期无法站立。【本研究切入点】目前对猪源停乳链球菌的相关报道仍然较少,在华南地区尚未有关于SDSE导致猪群患病的报道。2022年3月广东省肇庆市某规模化猪场的哺乳仔猪出现精神萎靡、关节肿大和跛行等症状,经剖检发现关节滑膜肿胀、充血和关节液浑浊,有必要对该病例进行深入分析。【拟解决的关键问题】本研究通过病原菌分离培养、形态和培养特性观察、16S rDNA扩增和测序、生化试验等鉴定方法,确定分离菌株为停乳链球菌类马亚种,并对分离菌株进行药敏试验、致病性试验及毒力基因鉴定,为临床猪源停乳链球菌病的防治提供参考。
1 材料与方法 1.1 试验材料1.1.1 病料 2022年3月广东省肇庆市某规模化猪场有10余头哺乳仔猪出现精神萎靡、关节肿大和跛行现象。对病死仔猪进行剖检,并无菌采取2头发病仔猪的关节液。本研究相关试验在广东省农业科学院动物卫生研究所进行。
1.1.2 培养基及主要试剂 血琼脂平板、革兰氏染色试剂盒、生化鉴定管和其他培养基均购自广东环凯微生物科技有限公司,抗菌药物药敏纸片和营养肉汤培养基购自杭州微生物试剂有限公司;基因组DNA提取试剂盒GeneJet Genomic DNA Purification Kit和DNA凝胶回收试剂盒购自赛默飞世尔科技(中国)有限公司,PreMix ExTaq DNA聚合酶和DNA分子量标准为TaKaRa产品,PCR扩增引物由广州擎科生物有限公司合成。
1.1.3 试验动物 20只SPF级小鼠(体重约20 g)购于珠海百事通生物科技有限公司。
1.2 试验方法1.2.1 细菌分离及革兰氏染色镜检 无菌挑取病猪的关节液,接种于血琼脂平板上,37 ℃恒温培养24 h,次日观察菌落大小和形态。对分离到的细菌进行纯化培养,挑单个菌落接种到血琼脂平板上,并进行革兰氏染色镜检。
1.2.2 16S rDNA鉴定 在血琼脂平板上无菌挑取单个菌落接种于营养肉汤培养基中,37 ℃培养24 h后取2 mL菌液,用试剂盒提取细菌基因组DNA,采用扩增细菌16S rDNA的通用引物[15]进行PCR反应(表 1)。PCR反应体系:2.5 μL 10×Buffer缓冲液,1 μL dNTP,上、下引物各0.25 μL,ExTaq DNA聚合酶0.3 μL,无菌去离子水24 μL,裂解产物1 μL。PCR反应程序:95 ℃ 5 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,30个循环;72 ℃延伸10 min。用DNA凝胶回收试剂盒将PCR产物回收后,送广州擎科生物技术有限公司进行测序,所得序列在NCBI上利用BLAST在线工具进行分析。
1.2.3 细菌生化鉴定 挑取待检菌落接种于营养肉汤培养基中,37 ℃培养24 h,取50 μL培养后的菌液接种于生化鉴定管中,分别进行过氧化氢酶(CAT)、VP、马尿酸盐水解酶、乳糖、甘露醇、蔗糖、水杨素、D-核糖、精氨酸双水解酶等系统的生化特性测定,生化鉴定管置于37 ℃培养24 h后观察结果。
1.2.4 毒力基因鉴定 以分离菌株的基因组DNA为模板,分别进行针对16SrDNA和毒力基因的PCR鉴定(表 1)。PCR反应程序:95 ℃ 5 min;94 ℃ 30 s、退火30 s(具体退火温度见表 1)、72 ℃ 60~90 s,30个循环;72 ℃延伸10 min。PCR产物用1.5% 琼脂糖凝胶进行电泳,用DNA凝胶回收试剂盒将PCR产物回收后,送广州擎科生物技术有限公司进行测序,所得序列在NCBI上利用BLAST在线工具分析比对。
1.2.5 药敏试验 按标准纸片琼脂扩散法进行操作,挑取分离菌株接入营养肉汤培养基中,37 ℃摇床培养24 h后,吸取100 μL菌液均匀涂布到血琼脂平板上,待平板上的液体完全吸收后,用无菌镊子将药敏纸片平贴于平板表面,在37 ℃培养箱中倒置培养24 h,用游标卡尺测量抑菌圈直径。以变异链球菌(Streptococcus mutans,ATCC25175)作为质控菌株。
1.2.6 动物致病性试验 在正式试验前将小鼠饲养观察5 d,确定其健康状况良好。将20只健康小鼠随机分成对照组与攻毒组,每组10只。攻毒组小鼠经腹腔注射分离菌菌液,每只剂量为0.2 mL(3.0×109 CFU/mL),对照组小鼠经腹腔注射等体积的TSB培养液(含10% 新生牛血清)。每天观察小鼠发病情况,对死亡小鼠立即剖检,无菌取心、肝和脾等脏器进行涂片和革兰氏染色,在显微镜下观察结果。未死亡的小鼠于第7天进行剖检。
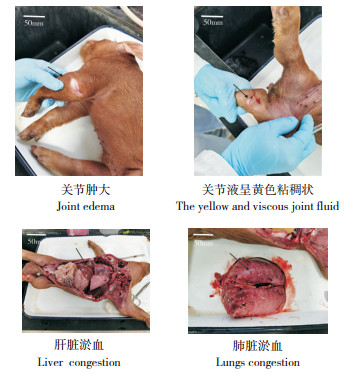
2 结果与分析 2.1 临床剖检结果病猪临床症状表现为倦怠无力、关节肿大及跛行,出现明显的运动障碍。剖检发现,其关节滑膜肿胀、充血,关节腔内关节液呈黄色粘稠状,肝脏、肾脏、肺脏均有淤血(图 1)。
|
| 图 1 发病仔猪的剖检结果 Fig. 1 Autopsy results of diseased piglets |
2.2 分离菌株形态与培养特性
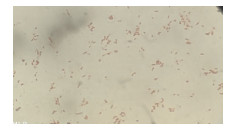
分离菌株在血琼脂平板上37 ℃恒温倒置培养24 h后,生长菌落呈灰白色,针尖大小,表面光滑,边缘整齐,菌落周围形成2~4 mm宽的透明溶血环(图 2),表现为β型溶血特征,与α型溶血的绿色溶血环有显著区别。对菌落进行革兰氏染色镜检,细菌为革兰氏阳性球菌,呈链状或双个形式存在[1](图 3)。

|
| 图 2 分离菌株在血琼脂平板划线培养24 h的结果 Fig. 2 Results of isolated bacteria after 24 h culture on blood agar medium |
|
| 图 3 分离菌株经革兰氏染色后镜检结果 Fig. 3 Microscopic examination results of isolated bacteria after gram staining |
2.3 16S rDNA序列比对分析
将分离菌株的16S rDNA基因序列与GenBank中的已知核酸序列进行在线BLAST比对,结果表明,分离菌株的16S rDNA基因序列与分离自日本熊本市的SDSE序列AB537922相似性达到100%,与源自日本的AB104840和CP053074的相似性分别为99.29%[18]和99.21%[19]。
2.4 细菌生化特性鉴定结果分离菌株在10 ℃和45 ℃下均不生长;VP试验、过氧化氢酶(CAT)检测均为阴性;不能利用乳糖、甘露醇,可利用蔗糖、水杨素、D-核糖、马尿酸盐,不能水解精氨酸。以上结果与停乳链球菌的生化特性相符。
综上,结合16S rDNA序列比对分析、溶血类型和生化特性鉴定结果,将该分离菌株鉴定为SDSE。
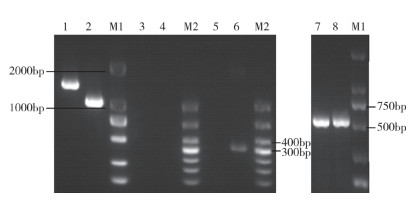
2.5 毒力基因鉴定结果针对SDSE的8种常见毒力基因进行PCR鉴定,结果(图 4)表明,分离菌株 eno、napr、lmb、scpB和 cyl基因的PCR检测均获得单一的特异性条带;BLAST分析表明,测序序列与NCBI报道的停乳链球菌相应基因序列完全一致;cfb、bca和 bac基因的PCR检测结果为阴性。
|
| 1:eno;2:napr;3:bac;4:bca;5:cfb;6:cyl;7:lmb;8:sccpB;M1:DL2000;M2:DL1000 图 4 分离菌株毒力基因PCR鉴定结果 Fig. 4 PCR identification results of virulence genes of isolated bacteria |
2.6 药敏试验结果
对分离菌株进行药敏试验,结果表明,该菌株对头孢曲松、头孢克洛、青霉素G、头孢氨苄、头孢吡肟、环丙沙星、磺胺异恶唑、大观霉素、恩诺沙星较敏感,对丁胺卡那、多西环素、多粘菌素B、诺氟沙星、氨苄西林次敏感,而对卡那霉素、庆大霉素、链霉素、林可霉素、阿莫西林表现出耐药性(表 2)。
选用分离菌株的敏感药物头孢氨苄和环丙沙星对发病仔猪进行治疗,仔猪关节肿大、跛行等运动障碍得到有效控制。
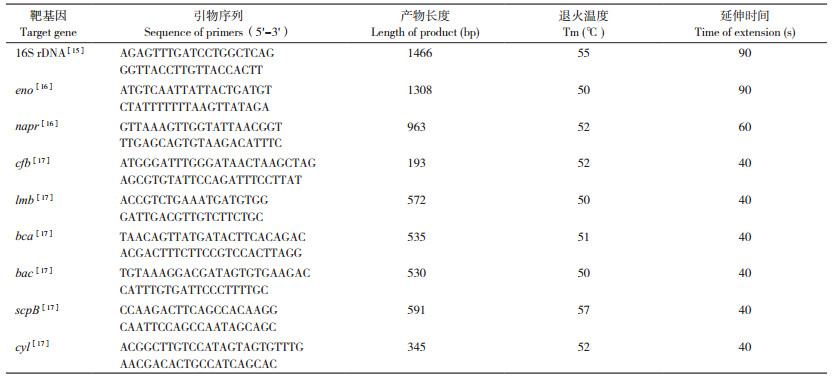
2.7 动物致病性试验结果10只攻毒组小鼠接种后4 h,均出现精神萎靡、被毛粗乱、蜷缩扎堆等现象;24 h内3只小鼠死亡(表 3),经剖检发现,死亡小鼠肺脏明显出血并伴有坏死点,肝脾肿大且颜色变暗;其余7只小鼠均出现一定程度的肝脏肿大和肺部病变。对照组小鼠无死亡,剖检未见明显异常。
用死亡小鼠病变组织涂片后进行革兰氏染色镜检,发现存在大量革兰氏阳性球菌。对死亡小鼠病变组织进行优势菌分离和16S rDNA扩增测序,得到的序列与原分离菌株完全一致。
3 讨论1984年,Farrow等[20]证实停乳链球菌,类马链球菌和兰氏C群、G群和L群链球菌为同一种属。1998年,Vieira等[21]利用多位点酶切电泳分型技术,将兰氏C群的α型溶血和不溶血的停乳链球菌命名为停乳链球菌停乳亚种,将兰氏C群、G群和L群的β型溶血链球菌命名为停乳链球菌类马亚种(SDSE)。由于停乳链球菌在猪病临床上未受重视,因此我国对猪源停乳链球菌的报道较少,已有的研究也常混淆停乳链球菌的分类,如把停乳链球菌全部归为兰氏C群[7, 10]。实际上,1985—1994年分离到的猪停乳链球菌中,45.8% 属于兰氏C群,25.3% 属于兰氏L群,6.5% 属于兰氏G群[22]。本研究从发病猪关节中分离优势菌,结合16S rDNA序列比对分析、溶血类型观察和生化特性鉴定结果,将该分离菌株确定为SDSE,是华南地区首次关于致病性猪源停乳链球菌的报道。
人类源性SDSE经常引起咽喉、皮肤和软组织的感染,甚至可能侵入血液系统并广泛传播到心内膜等深层组织部位,引起危及生命的侵袭性感染[23-25]。人类源性SDSE感染以上呼吸道症状为主,主要通过空气飞沫和食物传播,且有SDSE引起群体性发热的报道[26]。尽管许多研究报道动物源性SDSE与人类源性SDSE不同,但多项研究表明,SDSE相关的人类链球菌病可能是一种人畜共患病[27-29]。因此,SDSE在兽医临床上不可忽视,而且其还具有公共卫生意义。
napr和 eno基因编码的结合宿主纤溶酶原蛋白,有助于感染和定殖宿主[12],纤溶酶原向细菌表面汇聚是促进细菌粘附细胞表面的关键致病机制。lmb基因编码的层胶结合蛋白在促进与宿主层胶粘连中起关键作用,已在人分离的停乳链球菌中检测到[30]。cyl基因编码的β-溶血素主要增强细菌对宿主的侵袭[31]。scpB基因可以编码表面酶scpB,这是一种C5a肽酶,可以阻碍中性粒细胞聚集,并与纤维连接蛋白结合,促进细菌对上皮细胞的侵袭。scpB基因的表达是B型链球菌引起新生儿严重感染的主要决定因素之一[12]。本研究对分离的SDSE进行毒力基因鉴定,确定分离菌株的基因型为 eno + napr + cfb - lmb + bca - bac - scpB + cyl+。小鼠致病性试验结果表明,分离菌株可引起小鼠内脏病变和死亡,表现显著的致病性。本研究通过药敏试验选用分离菌株的敏感药物可有效控制临床症状,为猪停乳链球菌病的临床治疗提供参考。
4 结论本研究从规模化猪场发病仔猪的关节液中分离到优势菌株,根据分离菌株的形态特征、生化特性,结合16S rDNA序列测定及在线BLAST分析结果,确定为链球菌属的SDSE。毒力基因PCR鉴定结果表明,该菌株的基因型为 eno+ napr+cfb-lmb+bca-bac-scpB+cyl+。小鼠致病性试验结果表明,分离菌株导致小鼠内脏病变和死亡,表现出显著的致病性。抗生素敏感性试验结果表明,分离菌株对头孢曲松、头孢克洛、青霉素G、头孢氨苄、头孢吡肟、环丙沙星、磺胺异恶唑、大观霉素、恩诺沙星敏感,对丁胺卡那、多西环素、多粘菌素B、诺氟沙星、氨苄西林次敏感,而对卡那霉素、庆大霉素、链霉素、林可霉素、阿莫西林表现出耐药性。
| [1] |
ZIMMERMAN J, KARRIKER L A, RAMIREZ A, SCHWARTZ K, STEVENSON G. Diseases of swine (10th Edition)[M]. Beijing: China Agricultural University Press, 2014.
|
| [2] |
OBRADOVIC M R, SEGURA M, SEGALES J, GOTTSCHALK M. Review of the speculative role of co-infections in Streptococcus suis-associated diseases in pigs[J]. Veterinary Research, 2021, 52(1): 49. DOI:10.1186/s13567-021-00918-w |
| [3] |
黄元, 陈锦良, 黄育浩, 张端秀, 王晓虎, 杨德胜, 王刚, 向华. 东莞某屠宰场猪链球菌检测及分离鉴定[J]. 广东农业科学, 2022, 49(10): 118-126. DOI:10.16768/j.issn.1004-874X.2022.10.014 HUANG Y, CHEN J L, HUANG Y H, ZHANG D X, WANG X H, YANG D S, WANG G, XIANG H. Detection, isolation and identification of streptococcus suis in a slaughterhouse in Dongguan[J]. Guangdong Agricultural Sciences, 2022, 49(10): 118-126. DOI:10.16768/j.issn.1004-874X.2022.10.014 |
| [4] |
刘召颖, 朱夏雨, 牛洪颖, 万欣, 吴宗福. 浙江某市屠宰场猪链球菌血清型、耐药及致病特征[J]. 微生物学报, 2022(8): 1-14. DOI:10.13343/j.cnki.wsxb.20210788 LIU Z Y, ZHU X Y, NIU H Y, WAN X, WU Z F. Serotypes, antimicrobial resistance, and pathogenic characteristics of Streptococcus suis isolated from a slaughterhouse in an area of Zhejiang Province[J]. Acta Microbiologica Sinica, 2022(8): 1-14. DOI:10.13343/j.cnki.wsxb.20210788 |
| [5] |
李小军, 李旭金, 郭丽芬, 周柱辉, 陈贵珍, 吴寿军, 钟文超. 猪链球菌分子生物学检测研究进展[J]. 广东农业科学, 2009(7): 208-211. DOI:10.3969/j.issn.1004-874X.2009.07.070 LI X J, LI X J, GUO L F, ZHOU Z H, CHEN G Z, WU S J, ZHONG W T. Research advances in molecular biology detection of Streptococcus suis[J]. Guangdong Agricultural Sciences, 2009(7): 208-211. DOI:10.3969/j.issn.1004-874X.2009.07.070 |
| [6] |
KASUYA K, YOSHIDA E, HARADA R, HASEGAWA M, OSAKA H, KATO M, SHIBAHARA T. Systemic Streptococcus dysgalactiae subspecies equisimilis infection in a Yorkshire pig with severe disseminated suppurative meningoencephalomyelitis[J]. Journal of Veterinary Medical Science, 2014, 76(5): 715-8. DOI:10.1292/jvms.13-0526 |
| [7] |
幸文定, 曾文斌, 刘悦欣, 左明开, 白帅州, 陶政, 王萍. 猪源停乳链球菌类马亚种的分离与鉴定[J]. 畜牧与兽医, 2016, 48(2): 106-109. XING W D, ZENG W B, LIU Y X, ZUO M K, BAI S Z, TAO Z, WANG P. Isolation and identification of pig derived Streptococcus dysgalactiae subsp. equisimilis[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(2): 106-109. |
| [8] |
OH S I, KIM J W, JUNG J Y, CHAE M, LEE Y R, KIM J H, SO B, KIM H Y. Pathologic and molecular characterization of Streptococcus dysgalactiae subsp. equisimilis infection in neonatal piglets[J]. Journal of Veterinary Science, 2018, 19(2): 313-317. DOI:10.4142/jvs.2018.19.2.313 |
| [9] |
陈楠楠, 秦平伟, 尹珺伊, 王岩, 史同瑞, 刘宇. 东北民猪停乳链球菌停乳亚种的分离鉴定[J]. 动物医学进展, 2019, 40(12): 121-125. DOI:10.3969/j.issn.1007-5038.2019.12.026 CHEN N N, QIN P W, YIN J Y, WANG Y, SHI T R, LIU Y. Isolation and identification of the Streptococcus dysgalactiae subsp. dysgalactiae in Northeast Min Pigs[J]. Progress in Veterinary Medicine, 2019, 40(12): 121-125. DOI:10.3969/j.issn.1007-5038.2019.12.026 |
| [10] |
龙剑, 罗灵芝, 张古月, 尹德明, 李润成. 猪源停乳链球菌的分离鉴定、药敏检测及致病性试验[J]. 养猪, 2020(4): 97-100. DOI:10.3969/j.issn.1002-1957.2020.04.052 LONG J, LUO L Z, ZHANG G Y, YIN D M, LI R C. Identification, antibiotic susceptibility and pathogenicity of isolates from pigs[J]. Swine Production, 2020(4): 97-100. DOI:10.3969/j.issn.1002-1957.2020.04.052 |
| [11] |
SHI H, ZHOU M, ZHANG Z, HU Y, SONG S, HUI R, WANG L, LI G, YAO L. Molecular epidemiology, drug resistance, and virulence gene analysis of Streptococcus agalactiae isolates from dairy goats in backyard farms in China[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12: 1049167. DOI:10.3389/fcimb.2022.1049167 |
| [12] |
SHEN J, WU X, YANG Y, LV Y, LI X, DING X, WANG S, YAN Z, YAN Y, YANG F, LI H. Antimicrobial resistance and virulence factor of Streptococcus dysgalactiae isolated from clinical bovine mastitis cases in Northwest China[J]. Infection and Drug Resistance, 2021, 14: 3519-3530. DOI:10.2147/IDR.S327924 |
| [13] |
王旭, 颜其贵, 陈世界, 张和民, 李德生, 王承东, 杨晓龙, 雷燕, 左兰. 大熊猫源停乳链球菌类马亚种的分离与鉴定[J]. 中国兽医科学, 2011, 41(5): 464-469. DOI:10.16656/j.issn.1673-4696.2011.05.011 WANG X, YAN Q G, CHEN S J, ZHANG H M, LI D S, WANG C D, YANG X D, LEI Y, ZUO L. Isolation and identification of a strain of Streptococcus dysgalactiae subsp. equisimilis from giant panda (Ailuropoda melanoleuca)[J]. Chinese Veterinary Science, 2011, 41(5): 464-469. DOI:10.16656/j.issn.1673-4696.2011.05.011 |
| [14] |
张瑞华, 高善颂, 庞天津, 张丹萍, 窦心怡, 李焕发, 丛杨, 韩先杰. 狐狸源停乳链球菌类马亚种的分离鉴定和耐药性分析[J]. 中国兽医杂志, 2022, 58(12): 31-35. ZHANG R H, GAO S S, PANG T J, ZHANG D P, DOU X Y, LI H F, CONG Y, HAN X J. Isolation, identification and drug resistane analysis of Streptococcus dysgalactiae subsp.equisimilis from fox[J]. Chinese Journal of Veterinary Medicine, 2022, 58(12): 31-35. |
| [15] |
张芬芬, 周晓伦, 贺洋洋. 一株溶磷促生菌的分离、鉴定及其对玉米幼苗生长的影响[J]. 广东农业科学, 2021, 48(5): 76-82. DOI:10.16768/j.issn.1004-874X.2021.05.010 ZHANG F F, ZHOU X L, HE Y Y. Isolation and identification of a phosphorus-solubilizing growth-promoting bacterium and its effect on the growth of Zea mays L. seedlings[J]. Guangdong Agricultural Sciences, 2021, 48(5): 76-82. DOI:10.16768/j.issn.1004-874X.2021.05.010 |
| [16] |
KACZOREK E, MALACZEWSKA J, WOJCIK R, SIWICKI A K. Biofilm production and other virulence factors in Streptococcus spp. isolated from clinical cases of bovine mastitis in Poland[J]. BMC Veterinary Research, 2017, 13(1): 398. DOI:10.1186/s12917-017-1322-y |
| [17] |
TIAN X Y, ZHENG N, HAN R W, HO H, WANG J, WANG Y T, WANG S Q, LI H G, LIU H W, YU Z N. Antimicrobial resistance and virulence genes of Streptococcus isolated from dairy cows with mastitis in China[J]. Microbial Pathogenesis, 2019, 131: 33-39. DOI:10.1016/j.micpath.2019.03.035 |
| [18] |
HASHIKAWA S, ⅡNUMA Y, FURUSHITA M, OHKURA T, NADA T, TORⅡ K, HASEGAWA T, OHTA M. Characterization of group C and G streptococcal strains that cause streptococcal toxic shock syndrome[J]. Journal of Clinical Microbiology, 2004, 42(1): 186-192. DOI:10.1128/JCM.42.1.186-192.2004 |
| [19] |
TANAKA D, ISOBE J, WATAHIKI M, NAGAI Y, KATSUKAWA C, KAWAHARA R, ENDOH M, OKUNO R, KUMAGAI N, MATSUMOTO M, MORIKAWA Y, IKEBE T, WATANABE H. Genetic features of clinical isolates of Streptococcus dysgalactiae subsp. equisimilis possessing Lancefield's group A antigen[J]. Journal of Clinical Microbiology, 2008, 46(4): 1526-1529. DOI:10.1128/JCM.02188-07 |
| [20] |
FARROW J A, COLLINS M D. DNA base composition, DNA-DNA homology and long-chain fatty acid studies on Streptococcus thermophilus and Streptococcus salivarius[J]. Journal of General Microbiology, 1984, 130(2): 357-62. DOI:10.1099/00221287-130-2-357 |
| [21] |
VIEIRA V V, TEIXEIRA L M, ZAHNER V, MOMEN H, FACKLAM R R, STEIGERWALT A G, BRENNER D J, CASTRO A C. Genetic relationships among the different phenotypes of Streptococcus dysgalactiae strains[J]. International Journal of Systematic Bacteriology, 1998, 48(4): 1231-1243. DOI:10.1099/00207713-48-4-1231 |
| [22] |
KATSUMI M, KATAOKA Y, TAKAHASHI T, KIKUCHI N, HIRAMUNE T. Bacterial isolation from slaughtered pigs associated with endocarditis, especially the isolation of Streptococcus suis[J]. Journal of Veterinary Medical Science, 1997, 59(1): 75-78. DOI:10.1128/JCM.02188-07 |
| [23] |
BARACCO G J. Infections caused by Group C and G Streptococcus (Streptococcus dysgalactiae subsp. equisimilis and others): Epidemiological and clinical aspects[J]. Microbiology Spectrum, 2019, 7(2): 1-11. DOI:10.1128/microbiolspec.GPP3-0016-2018 |
| [24] |
RANTALA S. Streptococcus dysgalactiae subsp. equisimilis bacteremia: An emerging infection[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2014, 33(8): 1303-1310. DOI:10.1007/s10096-014-2092-0 |
| [25] |
ISHIHARA H, OGURA K, NGUYEN V A, MIYOSHI-AKIYAMA T, OKAMOTO S, TAKEMOTO N. Comparative genome analysis of three Group A Streptococcus dysgalactiae subsp. equisimilis strains isolated in Japan[J]. Journal of Medical Microbiology, 2021, 70(3): 1390. DOI:10.1099/jmm.0.001322 |
| [26] |
李闻, 郑宝璐, 于爱萍, 高鑫, 李晓燕. 天津市一起停乳链球菌似马亚种感染引起的聚集性发热事件的调查分析[J]. 中国热带医学, 2021, 21(5): 403-407, 450. DOI:10.13604/j.cnki.46-1064/r.2021.05.02 LI W, ZHENG B L, YU A P, GAO X, LI X Y. Investigation and analysis of a cluster fever event caused by Streptococcus dysgalactiae subsp. equisimilis infection in Tianjin[J]. China Tropical Med icine, 2021, 21(5): 403-407, 450. DOI:10.13604/j.cnki.46-1064/r.2021.05.02 |
| [27] |
PINHO M D, EROL E, RIBEIRO-GONCALVES B, MENDES C I, CARRICO J A, MATOS S C, PREZIUSO S, LUEBKE-BECKER A, WIELER L H, MELO-CRISTINO J, RAMIREZ M. Beta-hemolytic Streptococcus dysgalactiae strains isolated from horses are a genetically distinct population within the Streptococcus dysgalactiae taxon[J]. Scientifi c Reports, 2016, 6: 31736. DOI:10.1038/srep31736 |
| [28] |
SILVA L G, GENTELUCI G L, CORREA D M M, GLATTHARDT T, SA F A, FERREIRA-CARVALHO B T. Group C Streptococcus dysgalactiae subsp. equisimilis in south-east Brazil: Genetic diversity, resistance profile and the first report of human and equine isolates belonging to the same multilocus sequence typing lineage[J]. Journal of Medical Microbiology, 2015, 64(5): 551-558. DOI:10.1099/jmm.0.000052 |
| [29] |
SCHRIEBER L, TOWERS R, MUSCATELLO G, SPEARE R. Transmission of Streptococcus dysgalactiae subsp. equisimilis between child and dog in an aboriginal Australian community[J]. Zoonoses and Public Health, 2014, 61(2): 145-148. DOI:10.1111/zph.12057 |
| [30] |
CISZEWSKI M, SZEWCZYK E M. Potential factors enabling human body colonization by animal Streptococcus dysgalactiae subsp. equisimilis strains[J]. Current Microbiology, 2017, 74(5): 650-654. DOI:10.1007/s00284-017-1232-z |
| [31] |
ARMISTEAD B, WHIDBEY C, IYERL M, HERRERO-FONCUBIERTA P, QUACH P, HAIDOUR A, ARAVIND L, CUERVA J M, JASPAN H B, RAJAGOPAL L. The cyl genes reveal the biosynthetic and evolutionary origins of the Group B Streptococcus hemolytic lipid, Granadaene[J]. Frontiers in Microbiology, 2019, 10: 3123. DOI:10.3389/fmicb.2019.03123 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50