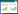文章信息
基金项目
- 国家自然科学基金(32272920); 广东省自然科学基金(2023A1515012491); 国家生猪产业技术体系专项(CAR-35); 广州市科技计划项目(202201011372); 岭南现代农业科学与技术广东省实验室茂名分中心基金项目(2022ZD003)
作者简介
- 易宏波,博士,副研究员,硕士生导师,广东省农业科学院蒋宗勇研究员团队核心成员。2011年本科毕业于吉林大学,2016年博士毕业于浙江大学,主要从事仔猪营养、肠道免疫和功能微生物开发等研究工作。主持国家自然科学基金(青年、面上)、国家重点研发计划项目子课题、广东省自然科学基金等项目15项,以第一或通信作者在《 Journal of Immunology》《 Food & Function》《 Journal of Animal Science》《动物营养学报》等国内外权威期刊发表论文35篇,申请发明专利10件(获授权6件),获2016年度中国动物营养学会青年科学奖特等奖。受聘华南农业大学、广西大学、广东海洋大学、西南民族大学等院校硕士指导老师。易宏波(1989—),男,博士,副研究员,研究方向为动物营养与饲料科学,E-mail: yihongbo@gdaas.cn.
通讯作者
- 蒋宗勇(1963—),男,博士,研究员,研究方向为动物营养与饲料科学,E-mail: jiangz28@qq.com.
文章历史
- 收稿日期:2023-09-13
2. 广西大学动物科学技术学院,广西 南宁 530004
2. College of Animal Science and Technology, Guangxi University, Nanning 530004, China
【研究意义】仔猪早期断奶易引起肠道功能受损、生长缓慢等应激反应,致使断奶后仔猪死亡率升高,导致养殖收益降低。在仔猪日粮中添加抗生素可以有效改善其断奶后的应激反应,但药物残留问题会严重影响食品安全及人体健康。罗伊氏乳杆菌(Lactobacillus reuteri,LR1)作为一种益生菌,具有促进肠道免疫细胞发育、加强肠道屏障等作用[1]。推动罗伊氏乳杆菌在畜禽生产中广泛使用,对于响应国家“减抗、限抗、禁抗”要求,开发绿色高效饲料添加剂具有重要的促进作用。
【前人研究进展】细胞外基质(Extracellular matrix,ECM)在体内分布广泛,是由肠道上皮细胞与基质细胞相互作用组成的一个复杂的蛋白质合成网络,在维持肠道正常结构、肠道屏障正常功能,以及介导关键细胞保护信号等方面具有重要作用[2-3]。ECM主要由糖蛋白和蛋白聚糖组成,其中糖蛋白的主要成分为胶原蛋白(Collagen,COL)、纤维黏连蛋白(Fibronectin,FN)、肌腱蛋白(Tenascin,TN),其中胶原蛋白为ECM网络提供了基础结构,也是ECM网络的主要成分,FN可在一定程度上促进胶原纤维生成,TN则可以与胶原蛋白相互作用,实现对组织结构的调整[4-6]。围绕微血管与基底层,肠黏膜也含有丰富的ECM,并且不同类型的肠细胞所分泌的ECM有所不同,主要以Collagen Ⅰ、Ⅲ、Ⅳ、Ⅵ为主,这些物质可以为肠上皮细胞提供保护和机械支撑,形成抵御外部病原体入侵的重要屏障[7-8]。研究表明,当肠道屏障受损或发生炎症时,肠上皮细胞的受损会导致ECM重塑受到阻碍,从而阻碍肠道愈合[9],肠道愈合失调致使肠道纤维化增加,ECM在纤维化部位过度积累。此外,肠道发生炎症时,ECM在肠道黏膜组织中高度表达,会降低肠道对葡聚糖硫酸钠的敏感性,从而使肠道炎症进一步加重[10]。ECM蛋白过度沉积进一步促使肠道纤维化,因此减弱ECM的功能或降低ECM的沉积是治疗肠道炎症的潜在策略。
ECM中的COL、FN等成分可以成为细菌和病原菌的黏附靶点[11],乳杆菌可通过黏液与ECM相互作用,达到增强肠道屏障、保护肠道菌群的作用。Kashima等[12]研究发现,乳杆菌所分泌的生物活性分子聚磷酸盐,在不影响正常成纤维细胞中胶原蛋白表达的同时,可降低小鼠结肠炎模型中结肠上皮细胞炎症因子的表达,并能改善结肠炎症及其纤维化。对小鼠结肠炎模型使用12种益生菌联合给药,可以改善与肠炎相关的纤维化状况,并且可在结肠切片中观察到Collagen Ⅰ阳性细胞减少,显著抑制了肠道炎症[13],表明乳杆菌可通过调节ECM改善肠道纤维化。
【本研究切入点】前期研究显示,日粮中添加5×1010 CFU/kg猪源罗伊氏乳杆菌LR1可以改善断奶后42 d仔猪的生长性能、小肠绒毛形态及肠上皮屏障功能[14],但LR1对肠道ECM的影响还不清楚。【拟解决的关键问题】本研究在断奶仔猪饲粮中添加猪源罗伊氏乳杆菌LR1,初步分析断奶仔猪肠道胶原蛋白含量、胶原蛋白分子表达的变化,探讨猪源罗伊氏乳杆菌LR1对肠道ECM的影响,以期为断奶仔猪肠道ECM的调控研究提供参考。
1 材料与方法 1.1 试验材料供试的猪源罗伊氏乳杆菌LR1由广东省农业科学院动物科学研究所从35日龄健康断奶仔猪的粪便中筛选得到,其16S rRNA序列已提交至GenBank数据库(No. KT205306)。罗伊氏乳杆菌LR1在MRS肉汤中37 ℃下生长18 h,之后经喷雾干燥处理制成冻干粉制剂。试验动物为21日龄杜长大杂交断奶仔猪,平均体重为6.49(±0.02)kg。
1.2 仪器设备与试剂1.2.1 仪器设备 石蜡切片机(KD-5500)、石蜡包埋机(KD-BM)、摊烤片机(KD-P)、生物组织脱水染色机(KD-TR),均购自浙江金华市科迪仪器设备有限公司;荧光正置显微镜(Axio ScopeA1,德国Zeiss公司),高速冷冻离心机(Universal 32R,德国Het tich公司),精密电子天平(BSA2254-CW,德国Sartorius公司),全自动样品冷冻研磨仪(JXFSTPRP-CL,上海净信实业发展有限公司),微量紫外分光光度计(ND-1000,美国Nanodrop公司),实时荧光定量PCR仪(CFX96 Connect Detection,美国BioRad公司),梯度PCR仪(T100,美国Bio-Rad公司),气相色谱仪(7890B,美国Aglient公司)。
1.2.2 试剂 (1)Masson染色试剂盒:二甲苯、无水乙醇、中性树胶(国药集团化学试剂有限公司),Masson染液套装、防脱载玻片(中国Servicebio公司)。
(2)蛋白质组学分析:蛋白酶抑制剂、BCA试剂盒(上海碧云天生物技术有限公司)、尿素、四乙基溴化铵(美国Sigma公司)、胰酶(美国Promega公司)、乙腈(美国Fisher Chemical公司)、TMT试剂盒(美国Thermo Fisher Science公司)。
(3)ELISA试剂盒:猪源肠道胶原蛋白Ⅰ~Ⅵ(Collagen Ⅰ~Ⅵ)ELISA试剂盒(南京建成生物工程研究所)。
(4)实时荧光定量PCR:TRIzol裂解液(北京艾德莱生物科技有限公司)、三氯甲烷和异丙醇(南京化学试剂有限公司)、Trizol Reagent(美国Invitrogen公司)、PrimeScript RT Reagent Kit(日本TaKaRa公司)、iTaqTM Universal SYBR® Green Supermix定量试剂盒、96孔定量板和封板膜(美国Bio-Rad公司)、无RNAse离心管(美国Corning公司)、DEPC水(中国Biosharp公司)等。
(5)免疫荧光:牛血清蛋白(BSA,瑞典Ubio Biotechnology公司)、Collagen Ⅵ一抗(美国Abcam公司)、DAPI、抗荧光淬灭剂(中国Biosharp公司)。
1.3 试验设计及分组选取21日龄杜长大杂交断奶仔猪144头,平均体重为6.49(±0.02)kg,随机分为3组,每组8栏,每栏6头仔猪,公母各半。对照组(CON)饲喂基础饲粮〔参照NRC(2012)营养需要配制,表 1〕;试验组分为抗生素组(AO)和罗伊氏乳杆菌组(LR1),分别在基础饲粮中添加75 mg/kg金霉素和100 mg/kg喹乙醇、5×1010 CFU/kg猪源罗伊氏乳杆菌LR1(参照文献[15]确定添加量,益生菌制剂逐级稀释后与粉状配合饲料混合均匀)。试验期为42 d。
1.4 测定项目及方法
1.4.1 肠道胶原纤维测定 试验结束时,从每栏随机挑选1头仔猪进行屠宰,环切约1 cm十二指肠(近端)、空肠(中段)、回肠(远端),用注射器吸取磷酸盐缓冲液(PBS)轻轻冲洗后分别置于4% 多聚甲醛样品瓶中固定保存,经过冲水、脱水、透明、石蜡包埋等处理后,采用Masson染液套装进行染色,利用Axio Scope A1显微镜观察切片图像、Image-Pro软件进行图片拍摄。
1.4.2 蛋白质组学分析 提取回肠组织样本中的蛋白,按照TMT试剂盒操作说明书标记肽段,然后利用高pH反向高效液相色谱法将肽段分级,色谱柱为Agilent 300Extend C18(粒径5 μm、内径4.6 mm、长250 mm),分级后的肽段用液相色谱流动相A相溶解后使用EASY-nLC 1000超高效液相系统进行分离,分离后注入NSI离子源中进行电离,然后通过Orbitrap FusionTM LumosTM质谱进行分析。使用Maxquant(V1.5.2.8)检索二级质谱数据,经KEGG通路数据库对蛋白通路进行注释,并通过双尾Fisher’snexact测试检验差异表达的富集程度。
1.4.3 肠道胶原蛋白含量测定 肠道胶原蛋白Collagen Ⅰ~Ⅵ的含量采用ELISA试剂盒进行检测,按照说明书操作,每个样品进行2次重复检测。
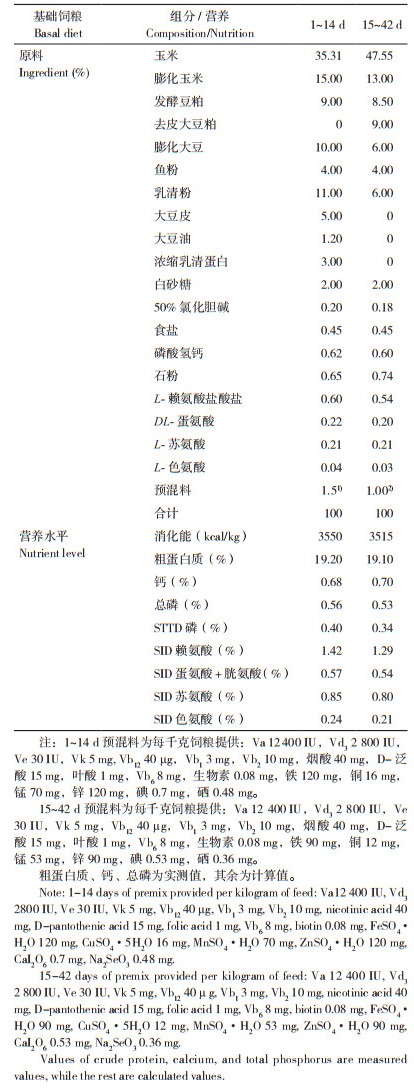
1.4.4 实时荧光定量PCR测定 采用实时荧光定量PCR方法测定肠道ECM相关基因的相对表达量:利用Trizol Reagent提取肠黏膜中的总RNA,经反转录合成cDNA。后续PCR扩增反应体系为10 μL:Premix Taq 5 μL,上、下游引物各0.5 μL,cDNA模板2 μL,超纯水2 μL。试验所需引物(表 2)均由Primer Premier 5.0软件设计,引物合成由上海生工生物工程有限公司完成。内参基因为β-actin,目的基因相对表达量用2-ΔΔct法计算。
1.4.5 免疫荧光分析 将保存在4% 多聚甲醛固定液中的肠段进行脱水、石蜡包埋、切片和脱蜡复水后,避光滴加DAPI染液,避光孵育,然后滴加抗荧光淬灭封片剂进行封片固定,最后在荧光学显微镜下观察蛋白质在细胞中表达的位置并拍照记录。
1.5 数据处理数据经Excel 2019初步整理后用SPSS 25.0进行单因素方差分析(One-way ANOVA)、邓肯(Duncan’s)多重比较。采用GraphPad Prism 8.0.2软件绘制图片。
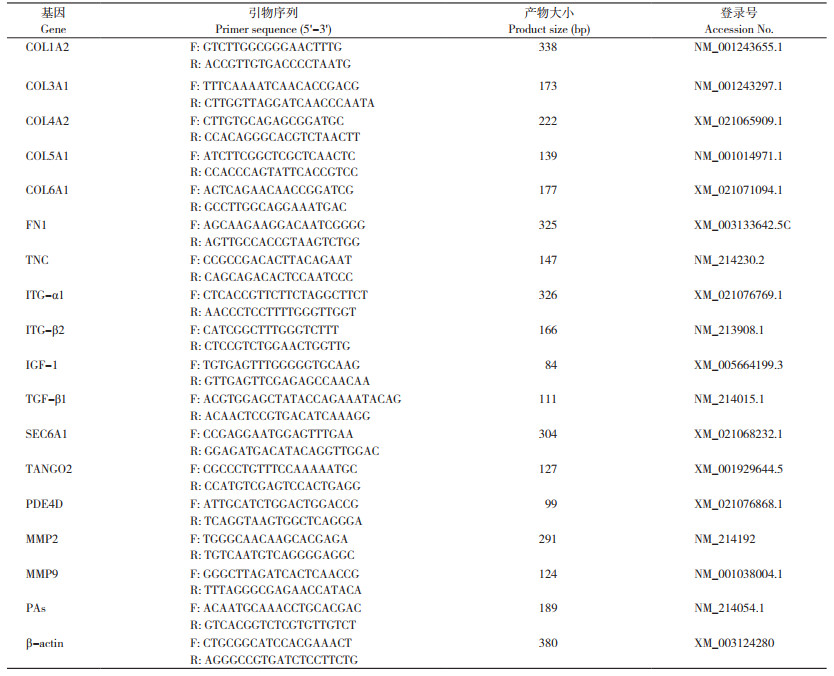
2 结果与分析 2.1 猪源罗伊氏乳杆菌LR1对断奶仔猪肠道胶原纤维的影响本试验利用Masson染色观察断奶仔猪十二指肠、空肠和回肠中的胶原纤维,结果(图 1A)显示,断奶仔猪十二指肠、空肠和回肠中的胶原纤维均由肠黏膜下层向上层延伸。通过Image J软件将Masson染色结果进行量化处理,计算胶原纤维(蓝色)面积与组织总面积之比,得到各组间的肠道胶原容积分数,结果(图 1B)发现,与CON组相比,LR1组和AO组断奶仔猪的十二指肠胶原容积分数均显著降低(P < 0.05),LR1组的回肠胶原容积分数也显著降低(P < 0.05)。可见,猪源罗伊氏乳杆菌LR1能够减少肠道胶原纤维的沉积。
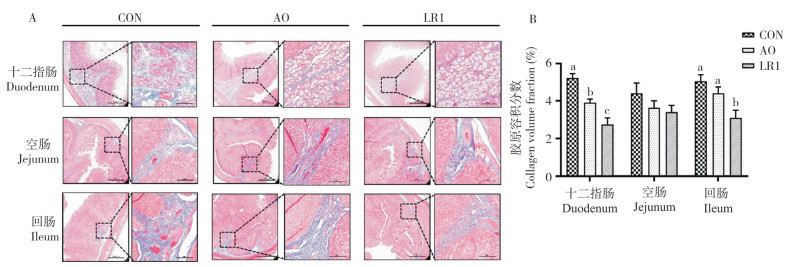
|
| A:肠道胶原纤维Masson染色,蓝色为胶原纤维(左图比例尺=1 000 μm,右图比例尺=200 μm);B:肠道胶原容积分数(n=8) A: Masson staining of intestinal collagen fibers. Blue in the figure represents collagen fiber (scale in the left figure is 1 000 μm, and scale bar in the right image is 200 μm); B: Intestinal collagen volume fraction (n=8) 图 1 猪源罗伊氏乳杆菌对断奶仔猪肠道胶原纤维的影响 Fig. 1 Effects of porcine Lactobacillus reuteri on the intestinal collagen fiber in weaned piglets |
2.2 猪源罗伊氏乳杆菌LR1对断奶仔猪肠道ECM基因的影响
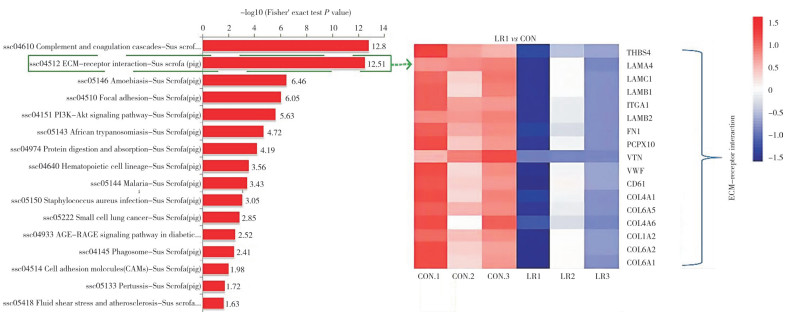
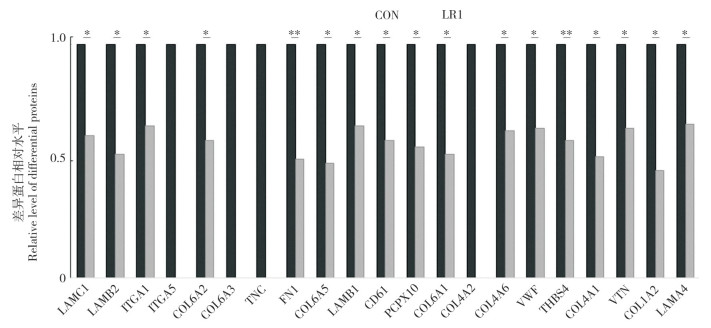
2.2.1 仔猪肠道ECM基因筛选 利用TMT高通量蛋白质组学分析猪源罗伊氏乳杆菌LR1组断奶仔猪回肠差异蛋白(图 2)。KEGG富集分析结果(图 3)显示,ECM- 受体互作通路(ECM-receptor interaction,SSC 04512)是差异蛋白主要富集通路之一,差异蛋白主要包括COL1A2、COL4A2、COL6A1、ITGA1和TNC等ECM分子。与CON组相比,LR1组的差异蛋白均显著降低。
|
| 图 2 断奶仔猪回肠蛋白质组学分析 Fig. 2 Proteomic analysis of ileum in weaned piglets |
|
| **:P < 0.01,*:P < 0.05,n=8 图 3 LR1组与CON组在ECM-受体互作通路中的差异蛋白 Fig. 3 Differential proteins of LR1 and CON in the ECM-receptor interaction pathway |
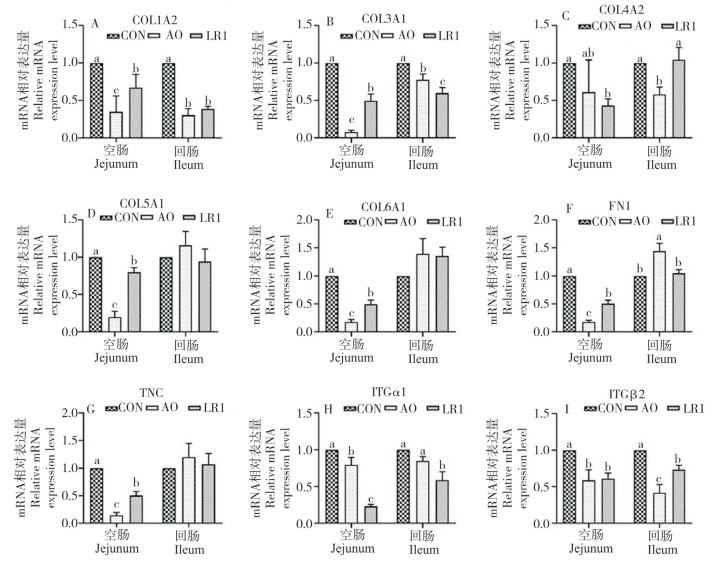
2.2.2 ECM基因表达 检测上述部分下调ECM及其他ECM相关基因的表达,验证蛋白质组学分析结果并进一步探讨猪源罗伊氏乳杆菌对断奶仔猪肠道ECM的影响。结果(图 4)显示,与CON组相比,LR1组和AO组的空肠和回肠COL1A2、COL3A1、ITGβ2的基因表达均显著降低(P < 0.05)。此外,LR1还显著降低了空肠COL4A2、COL5A1、COL6A1、FN1、TNC、ITGα1及回肠ITGα1的基因表达(P < 0.05),但对回肠COL4A2、COL5A1、COL6A1、FN1、TNC无显著影响。
|
| 柱上小写英文字母不同者表示差异显著(P < 0.05) Different lowercase letters above the column represent significant differences 图 4 猪源罗伊氏乳杆菌对断奶仔猪肠道ECM基因表达的影响 Fig. 4 Effects of porcine Lactobacillus reuteri on the intestinal ECM gene expression in weaned piglets |
2.3 猪源罗伊氏乳杆菌LR1对断奶仔猪肠道胶原蛋白分子的影响
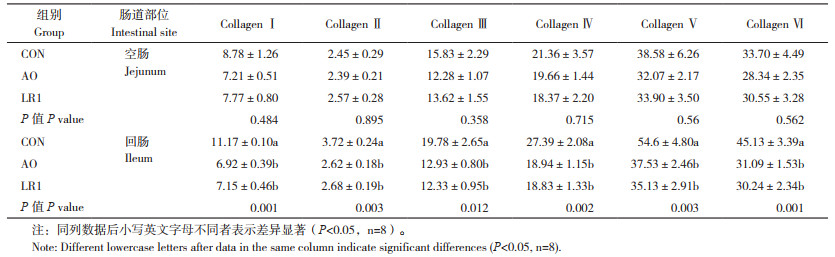
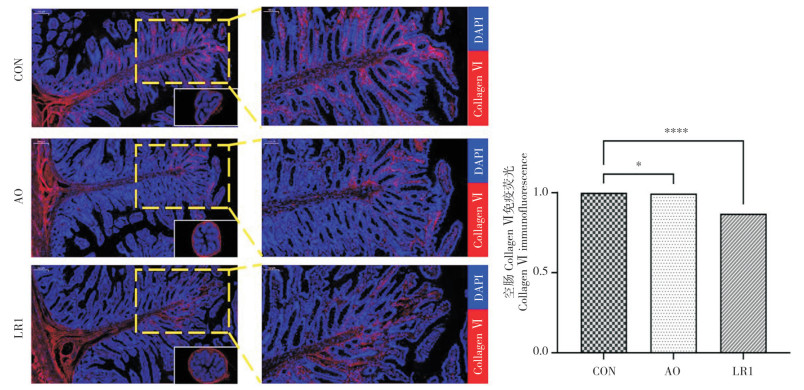
利用ELISA试剂盒评估断奶仔猪肠道胶原蛋白分子含量,结果(表 3)显示,在空肠中,各组间胶原蛋白分子含量无显著差异;在回肠中,与CON组相比,LR1组和AO组回肠Collagen Ⅰ ~ Ⅵ的含量均显著降低(P < 0.05)。基于ELISA结果,利用免疫荧光进一步验证空肠中Collagen Ⅵ的蛋白表达,图中红色荧光标记为Collagen Ⅵ(图 5),LR1组的红色荧光标记在各组中均最少,Collagen Ⅵ的蛋白表达趋势整体上与基因表达趋势一致。
|
|
| 图中蓝色标记为DAPI,红色标记为Collagen Ⅵ;左图比例尺=200 μm,右图比例尺=100 μm ****:P < 0.0001,**:P < 0.01,*:P < 0.05,n=8 The blue mark in the figure is DA PI, and the red mark is Collagen Ⅵ. Scale of the left image is 200 μm. Scale bar of the right image is 100 μm. ****: P < 0.0001, **: P < 0.01, *: P < 0.05, n=8 图 5 断奶仔猪空肠Collagen Ⅵ免疫荧光分析 Fig. 5 Collagen Ⅵ immunofluorescence analysis of ileum in weaned piglets |
2.4 猪源罗伊氏乳杆菌LR1对断奶仔猪肠道ECM动态调控因子表达的影响
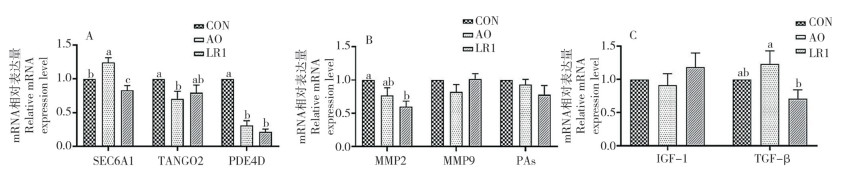
ECM存在一种动态变化机制,其受多种因子调控,本试验进一步探究猪源罗伊氏乳杆菌对断奶仔猪肠道ECM动态调控因子SEC6A1、PDE4D、MMP等的影响。结果(图 6)显示,与CON组相比,LR1组断奶仔猪的回肠胞内调控因子内质网通道蛋白(Secretory protein,SEC6A1)、磷酸二酯酶4D(Recombinant phosphodiesterase 4D,PDE4D)及胞外调控因子基质金属蛋白酶2(Matrix metalloproteinase, MMP2)的基因表达显著降低(P < 0.05);但胞内调控因子运输和高尔基体组织2(The transport and golgi organization 2,TANGO2)、胞外调控因子MMP9和纤溶酶原激活物(Plasminogen activator,Pas),以及细胞因子胰岛素样生长因子-1(Insulin-like growth factor-1,IGF-1)和转化生长因子-β(Transforming growth factor-β,TGF-β)的基因无显著变化。与AO组相比,LR1组断奶仔猪的回肠胞内调控因子SEC6A1、细胞因子TGF-β的基因表达显著降低(P < 0.05)。
|
| 实时荧光定量PCR检测回肠胞内调控因子(A)、胞外调控因子(B)和细胞因子(C)的基因表达(n=8) Real-time fluorescence quantitative PCR is used to detect gene expression of intracellular regulatory factors (A), extracellular regulatory factors (B), and cytokines (C) in ileum (n=8) 图 6 猪源罗伊氏乳杆菌对断奶仔猪肠道ECM动态调控因子表达的影响 Fig. 6 Effects of porcine Lactobacillus reuteri on the intestinal ECM dynamic regulators in weaned piglets |
3 讨论 3.1 猪源罗伊氏乳杆菌LR1对断奶仔猪肠道胶原纤维的影响
胶原蛋白是ECM的主要组成成分,对维持肠道形态和肠道正常免疫环境方面发挥重要作用,但当胶原蛋白过度沉积则会导致ECM重塑失调,进而引起肠道纤维化和肠道炎症等疾病,因此ECM重塑已成为肠道炎症的重要特征之一[16-17]。胶原纤维是胶原蛋白分布在组织中的形式,本研究利用Masson染色观察小肠组织中的胶原纤维,结果显示胶原纤维均由肠黏膜下层向上层延伸,并且乳杆菌LR1组断奶仔猪的肠道胶原纤维含量显著减少。
3.2 猪源罗伊氏乳杆菌LR1对断奶仔猪ECM及其调控因子的影响本研究利用TMT高通量蛋白质组学高重现性、高灵敏度等优点,分析了CON组与乳杆菌LR1组中的差异蛋白,并筛选出两组肠道ECM,结果显示,ECM-受体互作通路是差异蛋白主要富集通路之一,乳杆菌LR1的添加使通路中的蛋白呈现下调状态。在小鼠回肠炎模型中,ECM-受体互作通路中的蛋白表达呈上调[18]。结合本研究结果,表明ECM- 受体互作通路的富集状态与肠道炎症程度呈正相关。本试验中ECM-受体互作通路下调的蛋白均是ECM及其相关分子,如COL1A2、COL4A2等,其含量与肠道纤维化密切相关。因此,本研究检测了上述下调胶原蛋白分子的基因表达,结果显示,猪源罗伊氏乳杆菌LR1可显著降低回肠和空肠中COL1A2、COL3A1等胶原蛋白分子的基因表达,并且经过ELISA进一步验证发现,LR1降低了回肠中胶原蛋白的表达量,免疫荧光的结果与基因表达结果的趋势一致,即LR1组中Collagen Ⅵ的蛋白表达是各组中最少的。胶原沉积可导致肠壁结构改变,并导致肠道因肠炎性疾病而变得狭窄[19]。果蝇COL4A1产生突变,可致使其肠道上皮细胞发生变性、肠道缩短,进而导致肠道功能障碍,寿命缩短[20]。可见,由肠道胶原蛋白沉积过多而引起的肠道纤维化会导致一系列肠道疾病。短双歧杆菌可以通过调节胶原蛋白来缓解肠道屏障功能[21],本试验结果与之一致,表明猪源罗伊氏乳杆菌LR1的使用能够减少肠道炎症的发生,从而缓解肠道屏障功能。
前期研究工作中,我们发现猪源罗伊氏乳杆菌LR1可降低空肠中抗菌肽相关基因的表达,但能够显著提高回肠中抗菌肽基因的表达[14]。研究显示,胶原蛋白降解后产生的多肽片段可能是合成抗菌肽的原料[22],因此推测本研究断奶仔猪回肠中胶原蛋白的减少是由于抗菌肽的合成增加。纤维黏连蛋白(FN)存在于肠道基底膜、固有层和结缔组织基质中,是一种多功能细胞外基质蛋白[23]。在伤口愈合过程中,FN对于肌成纤维细胞和上皮细胞迁移和增殖起重要作用[24],且研究发现,FN基因表达在溃疡性结肠炎患者和克罗恩病纤维化患者肠道中显著增加[25]。肌腱蛋白(TNC)是母细胞蛋白家族的原始成员,也是一种大分子ECM糖蛋白,在正常机体中表达较弱,但在各种组织病理条件下其表达强烈上调[26]。整合素(Integrin,ITG)是由α和β亚基组成的异二聚体跨膜受体,充当ECM和细胞骨架之间的桥梁,可感知基质刚度的改变,导致细胞生物学功能异常激活,最终造成组织功能障碍(如肠道纤维化)[27]。多项试验证实,ITG会促进肠道纤维化的发展,导致肠道损伤、影响肠道屏障功能[28-29]。本研究结果表明,猪源罗伊氏乳杆菌LR1显著降低了空肠中FN1、TNC及空肠和回肠中ITGα1、ITGβ2的基因表达。以上结果揭示LR1可通过减少肠道ECM中胶原蛋白、TNC和ITG的沉积来防止肠道纤维化发生,以此维持肠道功能的完整性。
基质金属蛋白酶(MMP)/ 基质金属蛋白酶抑制物(TIMP)、纤溶酶原激活物(PA)/ 纤溶酶原激活物抑制物(PAIs)是调控ECM网络动态变化的主要酶系。MMP-2和MMP-9在胶原原纤维上可随机横向扩散,并在3/4-1/4位点内展开和裂解胶原蛋白[30]。实验性葡聚糖硫酸钠(DSS)结肠炎的研究表明,MMP9在肠道组织中具有破坏作用,并在肠损伤期间高度表达[31]。研究表明,MMP2和MMP9在炎症性肠病患者的发炎结肠黏膜中高度表达,并且与疾病严重程度呈正相关[32-34]。本研究结果表明,猪源罗伊氏乳杆菌LR1减少了回肠中MMP2的基因表达,但对回肠MMP9的影响不大,说明对仔猪饲喂LR1并不会造成肠道炎症性疾病。在胞内,ECM的重塑受内质网通道蛋白SEC6A1、运输和高尔基体组织TANGO2和磷酸二酯酶4DPDE4D的调节[35],本试验结果表明,LR1降低了回肠SEC6A1和PDE4D的基因表达,从而影响了肠道ECM的基因表达及运输。转化生长因子βTGF-β是参与ECM蛋白合成生物调控的关键生长因子,也是参与纤维化发展的主要分子因素。IGF-1则是许多不同组织中纤维化的主要媒介之一。TGF-β激活后,进一步导致胶原蛋白的生成和黏膜肌纤维化,IGF-1在发炎肠道中的表达与TGF-β相似,高度表达的IGF-1可刺激胶原蛋白的产生并增加各种成纤维细胞的增殖[36]。本研究结果表明,与抗生素相比,猪源罗伊氏乳杆菌LR1降低了回肠中TGF-β的基因表达。
4 结论饲粮中添加猪源罗伊氏乳杆菌LR1可降低断奶后0~42 d仔猪的肠道胶原容积分数、减少胶原纤维的沉积,使回肠中ECM- 受体互作通路差异蛋白显著富集,显著降低COL1A2、COL4A2、COL6A1、ITGA1和TNC等ECM分子及其在肠道中的基因表达水平,回肠中胶原蛋白分子Collagen Ⅰ、Collagen Ⅱ、Collagen Ⅲ、Collagen Ⅳ、Collagen Ⅴ和Collagen Ⅵ的含量显著降低;并且通过减少肠道细胞外基质调控因子SEC6A1、PDE4D、MMP-2的基因表达来影响细胞外基质主要组成部分Collagen、FN、TNC和ITG的基因表达,进而调节肠道细胞外基质的动态变化。日粮添加猪源罗伊氏乳杆菌LR1可通过降低肠道细胞外基质相关分子的表达来减少断奶仔猪肠道中的纤维沉积,维护仔猪肠道健康。
| [1] |
MU Q, TAVELLA V J, LUO X M. Role of Lactobacillus reuteri in human health and diseases[J]. Frontiers in Microbiology, 2018, 19(9): 757. DOI:10.3389/fmicb.2018.00757 |
| [2] |
TOMLIN H, PICCININI A M. A complex interplay between the extracellular matrix and the innate immune response to microbial pathogens[J]. Immunology, 2018, 155(2): 186-201. DOI:10.1111/imm.12972 |
| [3] |
NIEDERLECHNER S, KLAWITTER J, BAIRD C, KALLWEIT A R, CHRISTIANS U, WISCHMEYER P E. Fibronectin-integrin signaling is required for L-glutamine's protection against gut injury[J]. PLoS One, 2012, 7(11): e50185. DOI:10.1371/journal.pone.0050185 |
| [4] |
KOMOSINSKA-VASSEV K, KAŁUŻNA A, JURA-PÓŁTORAK A, DERKACZ A, OLCZYK K. Circulating profile of ECM-related proteins as diagnostic markers in inflammatory bowel diseases[J]. Journal of Clinical Medicine, 2022, 11(19): 5618. DOI:10.3390/jcm11195618 |
| [5] |
KARAMANOS N K, THEOCHARIS A D, PIPERIGKOU Z, MANOU D, PASSI A, SKANDALIS S S, VYNIOS D H, ORIAN-ROUSSEAU V, RICARD-BLUM S, SCHMELZER C E H, DUCA L, DURBEEJ M, AFRATIS N A, TROEBERG L, FRANCHI M, MASOLA V, ONISTO M. A guide to the composition and functions of the extracellular matrix[J]. Febs Journal, 2021, 288(24): 6850-6912. DOI:10.1111/febs.15776 |
| [6] |
AKTAR R, PEIRIS M, FIKREE A, EATON S, KRITAS S, KENTISH S J, ARAUJO E J A, BACARIN C, PAGE A J, VOERMANS N C, AZIZ Q, BLACKSHAW L A. A novel role for the extracellular matrix glycoprotein-Tenascin-X in gastric function[J]. Journal of Physiology-London, 2019, 597(6): 1503-1515. DOI:10.1113/JP277195 |
| [7] |
JI Y, ZHOU J, SUN T, TANG K, XIONG Z, REN Z, YAO S, CHEN K, YANG F, ZHU F, GUO X. Diverse preparation methods for small intestinal submucosa (SIS): Decellularization, components, and structure[J]. Journal of Biomedical Materials Research Part A, 2019, 107(3): 689-697. DOI:10.1002/jbm.a.36582 |
| [8] |
POMPILI S, LATELLA G, GAUDIO E, SFERRA R, VETUSCHI A. The charming world of the extracellular matrix: A dynamic and protective network of the intestinal wall[J]. Frontiers in Medicine, 2021(8): 610189. DOI:10.3389/fmed.2021.610189 |
| [9] |
MORTENSEN J H, LINDHOLM M, LANGHOLM L L, KJELDSEN J, BAY-JENSEN A C, KARSDAL M A, MANON-JENSEN T. The intestinal tissue homeostasis-the role of extracellular matrix remodeling in inflammatory bowel disease[J]. Expert Review of Gastroenterology & Hepatology, 2019, 13(10): 977-993. DOI:10.1080/17474124.2019.1673729 |
| [10] |
ZHANG Y, LI X, LUO Z, MA L, ZHU S, WANG Z, WEN J, CHENG S, GU W, LIAN Q, ZHAO X, FAN W, LING Z, YE J, ZHENG S, LI D, WANG H, LIU J, SUN B. ECM1 is an essential factor for the determination of M1 macrophage polarization in IBD in response to LPS stimulation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(6): 3083-3092. DOI:10.1073/pnas.1912774117 |
| [11] |
VACA D J, THIBAU A, SCHÜTZ M, KRAICZY P, HAPPONEN L, MALMSTRÖM J, KEMPF V A J. Interaction with the host: the role of fibronectin and extracellular matrix proteins in the adhesion of Gramnegative bacteria[J]. Med Microbiol Immunology, 2020, 209(3): 277-299. DOI:10.1007/s00430-019-00644-3 |
| [12] |
KASHIMA S, FUJIYA M, KONISHI H, UENO N, INABA Y, MORIICHI K, TANABE H, IKUTA K, OHTAKE T, KOHGO Y. Polyphosphate, an active molecule derived from probiotic Lactobacillus brevis, improves the fibrosis in murine colitis[J]. Translational Research, 2015, 166(2): 163-175. DOI:10.1016/j.trsl.2015.02.002 |
| [13] |
PARK J S, CHOI J W, KWON J Y, JUNG K A, YANG C W, PARK S H, CHO M L. A probiotic complex, rosavin, zinc, and prebiotics ameliorate intestinal inflammation in an acute colitis mouse model[J]. Journal of Translational Medicine, 2018, 16(1): 37. DOI:10.1186/s12967-018-1410-1 |
| [14] |
刘春艳, 孙焱杰, 王倩, 熊云霞, 吴绮雯, 杨雪芬, 王丽, 蒋宗勇, 易宏波, 黄艳娜. 猪源罗伊氏乳杆菌LR1对断奶后42 d仔猪生长性能和肠道上皮屏障功能的影响[J]. 动物营养学报, 2023, 35(6): 3583-3593. LIU C Y, SUN Y J, WANG Q, XIONG Y X, WU Q W, YANG X F, WANG L, JIANG Z Y, YI H B, HUANG Y N. Effects of porcine Lactobacillus reuteri LR1 on growth performance and intestinal epithelial barrier function of piglets at 42 days after weaning[J]. Chinese Journal of Animal Nutrition, 2023, 35(6): 3583-3593. |
| [15] |
YANG K M, JIANG Z Y, ZHENG C T, WANG L, YANG X F. Effect of Lactobacillus plantarum on diarrhea and intestinal barrier function of young piglets challenged with enterotoxigenic Escherichia coli K88[J]. Journal of Animal Science, 2014, 92(4): 1496. DOI:10.2527/jas.2013-6619 |
| [16] |
唐青松, 王丽, 徐娥, 刘春艳, 肖明飞, 肖昊, 吴绮雯, 蒋宗勇, 易宏波. 21日龄仔猪断奶过程不同肠段细胞外基质重要蛋白表达规律的研究[J]. 动物营养学报, 2022, 34(7): 4704-4715. DOI:10.3969/j.issn.1006-267x.2022.07.057 TANG Q S, WANG L, XU E, LIU C Y, XIAO M F, XIAO H, WU Q W, JIANG Z Y, YI H B. Study on expression regularity of important proteins in extracellular matrix of different intestinal segments during weaning of 21-day-old piglets[J]. Chinese Journal of Animal Nutrition, 2022, 34(7): 4704-4715. DOI:10.3969/j.issn.1006-267x.2022.07.057 |
| [17] |
PORRAS A M, ZHOU H, SHI Q, XIAO X, JRI LIVE CELL BANK, LONGMAN R, BRITO I L. Inflammatory bowel disease-associated gut commensals degrade components of the extracellular matrix[J]. mBio, 2022, 13(6): e0220122. DOI:10.1128/mbio.02201-22 |
| [18] |
AVULA L R, KNAPEN D, BUCKINX R, VERGAUWEN L, ADRIAENSEN D, VAN NASSAUW L, TIMMERMANS J P. Wholegenome microarray analysis and functional characterization reveal distinct gene expression profiles and patterns in two mouse models of ileal inflammation[J]. BMC Genomics, 2012, 13: 377. DOI:10.1186/1471-2164-13-377 |
| [19] |
LIN S N, MUSSO A, WANG J, MUKHERJEE P K, WEST G A, MAO R, LYU R, LI J, ZHAO S, ELIAS M, HABERMAN Y, DENSON L A, KUGATHASAN S, CHEN M H, CZARNECKI D, DEJANOVIC D, LE H T, CHANDRA J, LIPMAN J, STEELE S R, NGUYEN Q T, FIOCCHI C, RIEDER F. Human intestinal myofibroblasts deposited collagen VI enhances adhesiveness for T cells - A novel mechanism for maintenance of intestinal inflammation[J]. Matrix Biology, 2022, 113: 1-21. DOI:10.1016/j.matbio.2022.09.001 |
| [20] |
KISS M, KISS AA, RADICS M, POPOVICS N, HERMESZ E, CSISZÁR K, MINK M. Drosophila type IV collagen mutation associates with immune system activation and intestinal dysfunction[J]. Matrix Biology, 2016, 49: 120-131. DOI:10.1016/j.matbio.2015.09.002 |
| [21] |
LI B, DING M, LIU X, ZHAO J, ROSS R P, STANTON C, YANG B, CHEN W. Bifidobacterium breve CCFM1078 alleviates collagen-induced arthritis in rats via modulating the gut microbiota and repairing the intestinal barrier damage[J]. Journal of Agricultural and Food Chemistry, 2022, 70(46): 14665-14678. DOI:10.1021/acs.jafc.2c04602 |
| [22] |
唐青松, 徐娥, 王丽, 易宏波. 胶原蛋白动态平衡及其对动物肠道健康的作用[J]. 动物营养学报, 2020, 32(12): 5578-5586. DOI:10.3969/j.issn.1006-267x.2020.12.011 TANG Q S, XU E, WANG L, YI H B. Collagen homeostasis and lts effects on lntestinal health of animal[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5578-5586. DOI:10.3969/j.issn.1006-267x.2020.12.011 |
| [23] |
KOLACHALA V L, BAJAJ R, WANG L, YAN Y, RITZENTHALER J D, GEWIRTZ A T, ROMAN J, MERLIN D, SITARAMAN S V. Epithelial-derived fibronectin expression, signaling, and function in intestinal inflammation[J]. Journal of Biological Chemistry, 2007, 282(45): 32965-32973. DOI:10.1074/jbc.M704388200 |
| [24] |
BASSON C T, KNOWLES W J, BELL L, ALBELDA S M, CASTRONOVO V, LIOTTA L A, MADRI J A. Spatiotemporal segregation of endothelial cell integrin and nonintegrin extracellular matrix-binding proteins during adhesion events[J]. Journal of Cell Biology, 1990, 110(3): 789-801. DOI:10.1083/jcb.110.3.789 |
| [25] |
BRENMOEHL J, LANG M, HAUSMANN M, LEEB SN, FALK W, SCHÖLMERICH J, GÖKE M, ROGLER G. Evidence for a differential expression of fibronectin splice forms ED-A and ED-B in Crohn's disease (CD) mucosa[J]. International Journal of Colorectal Disease, 2007, 22(6): 611-623. DOI:10.1007/s00384-006-0188-4 |
| [26] |
IMANAKA-YOSHIDA K. Tenascin-C in heart diseases-The role of inflammation[J]. International Journal of Molecular Sciences, 2021, 22(11): 5828. DOI:10.3390/ijms22115828 |
| [27] |
GARLATTI V, LOVISA S, DANESE S, VETRANO S. The multiple faces of integrin-ECM interactions in inflammatory bowel disease[J]. International Journal of Molecular Sciences, 2021, 22(19): 10439. DOI:10.3390/ijms221910439 |
| [28] |
XIE H, JIAO Y, ZHOU X, LIAO X, CHEN J, CHEN H, CHEN L, YU S, DENG Q, SUN L, XU X, WANG J. Integrin αvβ6 contributes to the development of intestinal fibrosis via the FAK/AKT signaling pathway[J]. Experimental Cell Research, 2022, 411(2): 113003. DOI:10.1016/j.yexcr.2021.113003 |
| [29] |
SUN J K, ZHANG Q, SHEN X, ZHOU J, WANG X, ZHOU S M, MU X W. Integrin αEβ7 is involved in the intestinal barrier injury of sepsis[J]. Aging (Albany NY), 2022, 14(2): 780-788. DOI:10.18632/aging.203839 |
| [30] |
VAN DOREN S R. Matrix metalloproteinase interactions with collagen and elastin[J]. Matrix Biology, 2015(44/46): 224-231. DOI:10.1016/j.matbio.2015.01.005 |
| [31] |
GARG P, VIJAY-KUMAR M, WANG L, GEWIRTZ A T, MERLIN D, SITARAMAN S V. Matrix metalloproteinase-9-mediated tissue injury overrides the protective effect of matrix metalloproteinase-2 during colitis[J]. American Journal of Physiology-Gastrointestinal and Liver Physiolog y, 2009, 296(2): G175-184. DOI:10.1152/ajpgi.90454.2008 |
| [32] |
BAILEY C J, HEMBRY R M, ALEXANDER A, IRVING M H, GRANT M E, SHUTTLEWORTH C A. Distribution of the matrix metalloproteinases stromelysin, gelatinases A and B, and collagenase in Crohn's disease and normal intestine[J]. Journal of Clinical Pathology, 1994, 47(2): 113-116. DOI:10.1136/jcp.47.2.113 |
| [33] |
STALLMACH A, CHAN C C, ECKER K W, FEIFEL G, HERBST H, SCHUPPAN D, ZEITZ M. Comparable expression of matrix metalloproteinases 1 and 2 in pouchitis and ulcerative colitis[J]. Gut, 2000, 47(3): 415-422. DOI:10.1136/gut.47.3.415 |
| [34] |
VON LAMPE B, BARTHEL B, COUPLAND SE, RIECKEN EO, ROSEWICZ S. Differential expression of matrix metalloproteinases and their tissue inhibitors in colon mucosa of patients with inflammatory bowel disease[J]. Gut, 2000, 47(1): 63-73. DOI:10.1136/gut.47.1.63 |
| [35] |
CHANG J, GARVA R, PICKARD A, YEUNG C C, MALLIKARJUN V, SWIFT J, HOLMES D F, CALVERLEY B, LU Y, ADAMSON A, RAYMOND-HAYLING H, JENSEN O, SHEARER T, MENG Q J, KADLER K E. Circadian control of the secretory pathway maintains collagen homeostasis[J]. Nature Cell Biology, 2020, 22(1): 74-86. DOI:10.1038/s41556-019-0441-z |
| [36] |
LI C, FLYNN R S, GRIDER J R, MURTHY K S, KELLUM J M, AKBARI H, KUEMMERLE J F. Increased activation of latent TGF-β1 by αVβ3 in human Crohn's disease and fibrosis in TNBS colitis can be prevented by cilengitide[J]. Inflammatory Bowel Diseases, 2013, 19(13): 2829-2839. DOI:10.1097/MIB.0b013e3182a8452e |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50