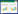文章信息
基金项目
- 广东省级乡村振兴战略专项资金种业振兴项目(2022-NJS-00-005, 2022-NPY-00-024); 广东省农业科学院蔬菜研究所专项课题(2023ZZ10); 广州市科技计划项目(2023B03J1082)
作者简介
- 衡周(1988—),男,博士,助理研究员,研究方向为辣椒品质育种及品质性状形成机理,E-mail:hengzhou@gdaas.cn.
通讯作者
- 王恒明(1964—),男,研究员,研究方向为辣椒育种及抗逆分子机理,E-mail:whming@21cn.com.
文章历史
- 收稿日期:2023-09-28
2. 广东药科大学,广东 广州 510006
2. Guangdong Pharmaceutical University, Guangzhou 510006, China
【研究意义】辣椒是世界上栽培最广泛的蔬菜作物之一,广泛应用于蔬菜、香料、食品添加剂和化工提取等行业[1]。中国辣椒(Capsicum chinense)是辣椒的5个主要栽培种之一,种内大部分品种具浓郁果香。果香能使人精神愉悦,是很有价值的商品性状[2]。中国辣椒果实中呈现果香的物质主要为支链酯类物质[3]。醇酰基转移酶(Alcohol acyl-CoA transferase,AAT)催化支链酯类合成的最后一步反应,是影响支链酯类含量的重要因素[4]。开展AAT基因家族的鉴定及表达分析,能为进一步研究其功能、探究中国辣椒果实香气合成机理提供理论基础。【前人研究进展】 AAT属于酰基转移酶(BAHD)家族,催化酰基基团从酰基CoA供体转移至醇类受体分子,形成酯类物质[5],含有2个保守基序,分别是HxxxD基序和DFGWG基序,其中HxxxD基序与催化作用相关,相关研究推测DFGWG基序仅起结构作用[6]。AAT基因家族的鉴定、表达分析及功能验证工作已在多种植物中展开。温思为等[7]从蔷薇科植物中鉴定出多个AAT基因(苹果7个、梨4个、杜梨6个、桃8个、凤梨草莓7个)。曹香梅[8]在桃子中筛选出28个AAT基因,其中PpAAT1转录本数量最多,进一步研究发现,PpAAT1可催化挥发物质γ-癸内酯的合成,通过与PpCXE1协同作用,共同调控酯类物质代谢。在茄科作物中,番茄的SlAAT1能直接影响番茄果实的酯类物质含量变化[9],通过底物测试发现SlAAT1对1-戊醇底物有极强的特异性偏好。Souleyre等[10]从苹果中鉴定到MdAAT1并证明其为酯类物质合成的关键基因。在成熟前期,苹果果肉组织中的AAT基因表达量和相关酶活性显著提高,同时酯类物质合成增加。Li等[11]发现苹果中转录因子MdMYB1和MdMYB6结合后激活MdAAT2启动子,调控苹果酯类物质的合成。PpNAC1或PpNAC2转录因子与桃PpAAT1基因的启动子结合后可激活其表达[12]。猕猴桃转录因子AcNAC4可直接调节AcAAT10的表达,参与丁酸乙酯和丁酸甲酯的合成积累[13]。草莓SAAT基因编码的蛋白具有催化支链酯类形成的能力[14]。原核表达功能验证发现哈密瓜CM-AAT1编码的蛋白质具有合成酯类物质的功能[15]。Shalit等[16]在月季花EST数据库中发现3个与BAHD醇酰基转移酶相似的基因。【本研究切入点】AAT是影响呈果香的支链酯类物质含量的重要酶,但目前辣椒中还未有对其相关基因家族的系统研究。【拟解决的关键问题】本研究拟通过对中国辣椒AAT基因家族的生物信息学鉴定和表达模式分析,明确中国辣椒基因组中AAT基因的数目及分布并获得其时空表达特征,为辣椒支链酯类物质代谢机理研究提供理论支持。
1 材料与方法 1.1 试验材料供试材料为中国辣椒品种‘金田1号’,2022年7月播种,8月定植于广东省农业科学院白云基地。在植株出现首花后第5周,分别取植株距离地面5 cm处的地下侧根、嫩茎、顶端幼叶、花和花后第1~5周的果实,采集后放入液氮速冻,转入-80 ℃超低温冰箱待用,设3个生物学重复。
1.2 试验方法1.2.1 中国辣椒AAT家族基因的鉴定 基于下载自NCBI的中国辣椒基因组数据[17]和已报道的其他物种AAT蛋白序列,在Pfam网站(http://www.expasy.org/tools/protparam.html)下载AAT(PF07247)的hmm文件,使用HMMER(V3.3.1)软件和TBtools(V1.09876)软件对蛋白质的氨基酸序列进行比对(E-value < 1×10-5,其余参数默认)。通过在线BLAST、hmmsearch及hmmbuild和hmmsearch联用的方法对辣椒AAT基因家族成员进行鉴定后,使用MEGA与植物中已鉴定的AAT基因相应的蛋白序列共同绘制进化树。已报道的其他物种AAT基因信息见表 1。
1.2.2 中国辣椒AAT蛋白的理化性质、亚细胞定位、结构预测和系统进化分析 使用在线工具ExPASy(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)对中国辣椒AAT蛋白序列进行理化性质分析,包括分子质量、氨基酸数、等电点、不稳定指数、平均亲水系数、脂肪族指数等。利用Plant-mPLoc网站(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)进行亚细胞定位预测。使用在线工具SOPMA (https://swissmodel.expasy.org) 对蛋白的二级结构进行预测, 使用SWISS-MODEL(http://alternate.meme-suite.org/tools/meme)构建中国辣椒AAT蛋白的三维结构模型。使用邻接法对中国辣椒与其他已鉴定物种的AAT蛋白序列进行比对分析,利用MAGA软件构建进化树。
1.2.3 中国辣椒AAT基因家族的染色体定位、保守基序和基因结构分析 从中国辣椒基因组注释文件中筛选出AAT基因的染色体定位数据,利用MapChart软件制作AAT基因的染色体定位图,分析各AAT基因在染色体上的分布情况。通过MEME数据库(http://gsds.cbi.pku.edu.cn/)分析蛋白基序,Motif搜索数为20;利用基因结构GSDS 2.0(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析软件,对AAT基因序列进行内含子和外显子结构分析。利用PlantCARE(10.7666/d.d143420)分析网站,对AAT基因家族成员启动子区的顺式作用元件进行预测分析,结合TBtools进行可视化分析。
1.2.4 中国辣椒AAT家族基因时空表达分析 使用RNA提取试剂盒(全式金,北京)提取辣椒根、茎、叶、花和各个时期果实的总RNA;使用反转录试剂盒(TaKaRa,大连)进行反转录,操作方法参照说明书进行。使用荧光定量试剂盒SYBR Premix Ex TaqTM(TaKaRa,大连)进行基因表达量分析,荧光定量PCR采用25 μL体系,扩增程序为95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,40个循环;溶解曲线绘制程序为:65~95 ℃之间每0.5 ℃依次读板,每个样品设3个生物学重复,每组生物学重复设3个技术重复。目标基因相对表达量计算使用2-ΔΔCT法。荧光定量PCR引物信息见表 2。
2 结果与分析 2.1 中国辣椒AAT基因鉴定及理化性质分析
通过隐马尔可夫模型、AAT保守结构域和BLAST 3种方法筛选获得中国辣椒10个AAT基因,分别命名为CcAAT1-10。
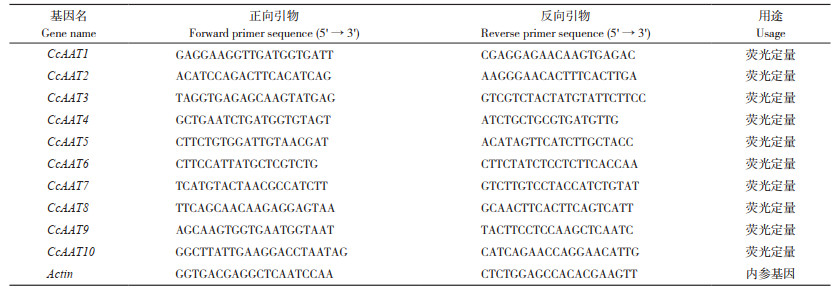
生物信息学分析结果(表 3)显示,中国辣椒AAT蛋白编码的氨基酸平均数为386.4 aa,最大值为683 aa,最小值为256 aa。筛选出的分子质量范围为29~77 kDa,等电点范围为5.34~8.79。平均亲水系数均小于0,说明该类基因所表达的蛋白质为亲水性蛋白。不稳定指数在23.76~51.02之间,CcAAT6、CcAAT9、CcAAT10蛋白性质稳定性较好,CcAAT5和CcAAT7的蛋白质稳定性较差,其余蛋白不稳定指数在40左右、相对稳定。根据亚细胞定位预测可了解到,所筛选出中国辣椒AAT均定位于细胞质中。
2.2 中国辣椒AAT蛋白结构预测
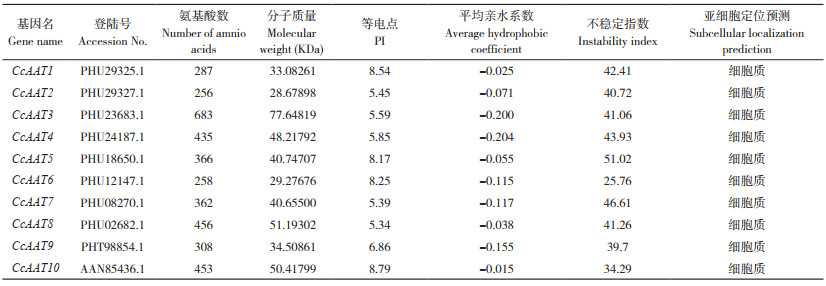
对AAT基因家族编码的蛋白结构预测结果显示,其编码的蛋白由α螺旋、延伸链、β-转角和无规卷曲4种元件组成。其中,α-螺旋和无规则卷曲的含量相对较高(表 4)。在CcAAT2、CcAAT6和CcAAT9中,α- 螺旋所占比例最高,为41.23%~47.27%;而在CcAAT4、CcAAT5和CcAAT7中,无规则卷曲所占比例最高,为45.86%~46.90%。利用SWISS-MODEL构建蛋白的三维结构模型,发现10种AAT蛋白三维结构差异明显(图 1)。所有的蛋白结构中均有不少于4个的β- 转角结构,说明中国辣椒AAT在功能上可能存在分化,又具有一定的保守性。
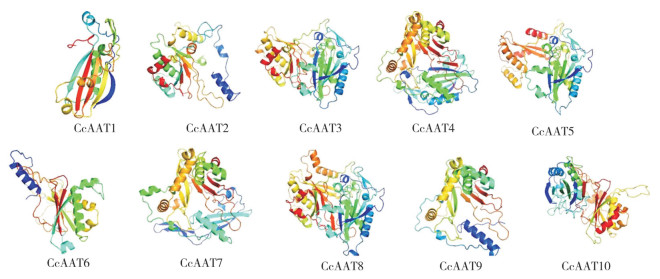
|
| 图 1 CcAAT蛋白三级结构预测 Fig. 1 Prediction of the tertiary structure of CcAAT proteins |
2.3 中国辣椒AAT蛋白系统进化树分析
将筛选获得的中国辣椒AAT蛋白序列与其他物种AAT蛋白进行序列比对分析,并构建进化树。结果(图 2)显示,CcAAT2、CcAAT3、CcAAT5、CcAAT8位于同一分支,与草莓的SAAT、甜瓜的CmAAT4、月季的RhAAT1亲缘关系较近,CcAAT7与CcAAT4位于同一分支,与康乃馨中的DcAAT亲缘关系较接近,CcAAT9与猕猴桃中的AdAAT1亲缘关系较近,CcAAT6、CcAAT10与番茄中的SIAAT1关系比较接近。
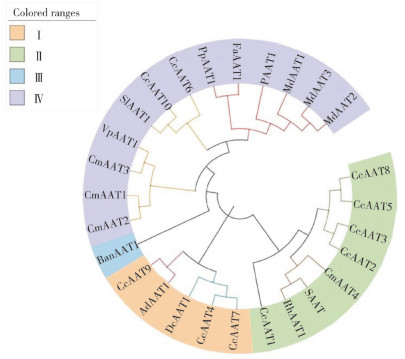
|
| 图 2 不同物种AAT蛋白的系统进化关系 Fig. 2 Phylogenetic relationships of AAT proteins in different species |
2.4 AAT家族基因的染色体定位、保守基序和基因结构分析
通过MapChart制作的染色体定位图(图 3)可见,CcAAT1、CcAAT2位于1号染色体,CcAAT3、CcAAT4位于3号染色体,CcAAT5位于5号染色体,CcAAT6位于7号染色体,CcAAT7位于9号染色体,CcAAT8位于11号染色体。CcAAT9和CcAAT10则暂无明确的染色体定位信息。
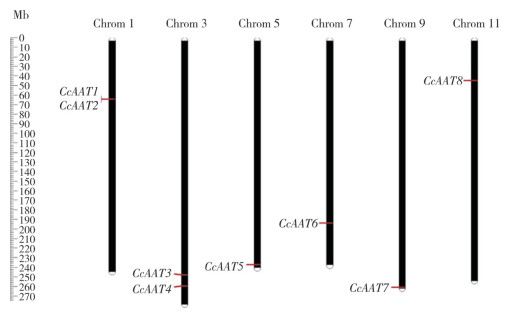
|
| 图 3 CcAAT基因染色体定位图 Fig. 3 Chromosome mapping map of CcAAT genes |
将中国辣椒AAT蛋白序列提交到MEME网站进行保守基序分析,结果(图 4)显示,CcAAT成员共包含12个保守基序,CcAAT1、CcAAT3~5、CcAAT8、CcAAT10具有相对保守的基序8、4和基序1、5共同组成的结构。聚类结果显示其亲缘关系较接近,位于同一分支的序列之间有较强保守性。
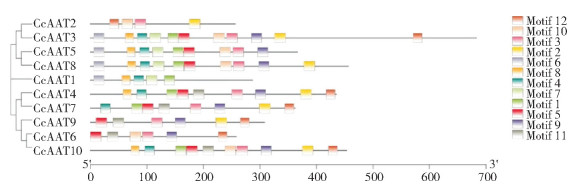
|
| 图 4 CcAAT蛋白保守基序分析 Fig. 4 Analysis of conserved motifs of CcAAT proteins |
基因结构对基因的表达有重要影响[18]。为探索AAT家族基因的结构多样性,本研究对其外显子、内含子和非编码区进行分析。结果(图 5)显示,CcAAT6、CcAAT8和CcAAT9基因为连续基因,无内含子;CcAAT1、CcAAT2含2个内含子,CcAAT4、CcAAT5、CcAAT7含有1个内含子,CcAAT3含有6个内含子。在进化树上处于同一个分支的成员具有相似的基因结构。由于CcAAT10来自直接提交的序列,因此无法进行基因结构和启动子区域顺式作用元件的分析。
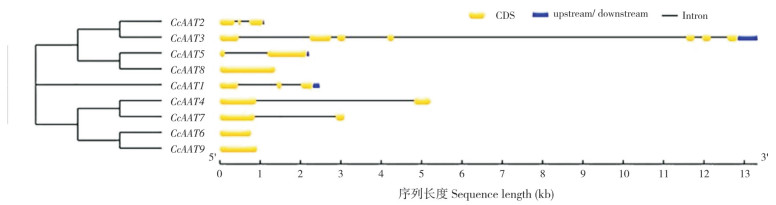
|
| 图 5 CcAAT基因外显子和内含子分析 Fig. 5 Exon and intron analysis of CcAAT genes |
使用Plant CARE数据库对CcAAT1-9的5’端上游2 000 bp进行了顺式作用元件分析(图 6)。共发现16种顺式作用元件,其中激素响应相关原件最多,主要包括脱落酸响应元件、赤霉素响应元件、生长素响应元件、茉莉酸响应元件和水杨酸响应元件。其次是光响应相关元件,它们在所有基因的启动子区域都存在。低温响应元件和厌氧诱导相关元件存在于部分家族基因的启动子中。以上结果表明,中国辣椒AAT家族成员可能具有差异化的生物学功能,主要受到植物激素和光照调控。
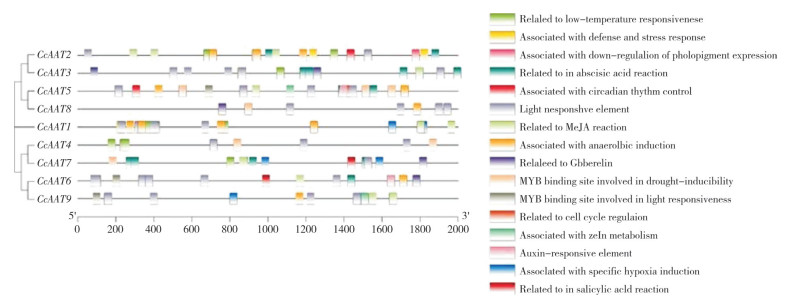
|
| 图 6 CcAAT基因的顺式作用元件分析 Fig. 6 Cis-acting elements analysis for the promoter of CcAAT genes |
2.5 AAT基因家族成员时空表达分析
使用实时荧光定量PCR分析CcAAT1-10的时空表达情况,结果(图 7)显示,CcAAT5和CcAAT6未检测到表达,CcAAT1、2、8在根中不表达,CcAAT8在茎中不表达,CcAAT8、9在叶片中不表达,CcAAT9在果实中未检测到表达,剩余基因在植株各部分均检测到表达。CcAAT10和CcAAT8分别在花和果实中具有较高的相对表达量。CcAAT1在叶片中检测到较高的表达。CcAAT2在果实发育的第一个时期表达量较高。CcAAT3和CcAAT4在果实中表达量较低。CcAAT1、3、4、10在果实中检测到持续的表达,其中CcAAT1在果实发育过程中表达呈上升趋势,CcAAT10呈先升后降趋势,CcAAT3和CcAAT4呈先降后升趋势。
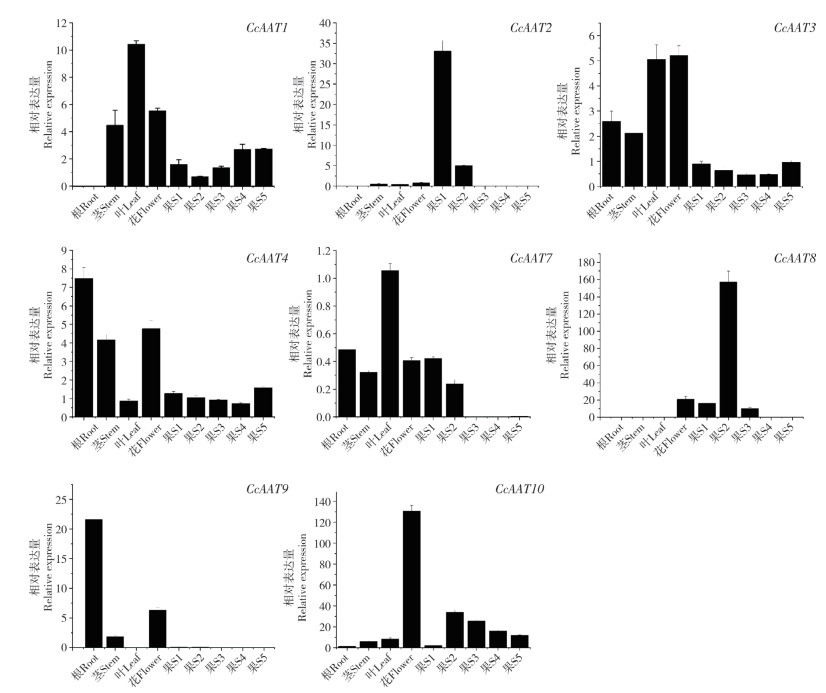
|
| S1~5分别代表花后第1~5周的果实 S1~5: Fruits at the first to fifth week after flowering 图 7 CcAAT基因时空表达 Fig. 7 Spatiotemporal expression of CcAAT genes |
3 讨论
支链酯类是中国辣椒果实中的重要香气成分,AAT是催化支链酯类合成中最后一步反应的关键酶。对AAT基因家族的鉴定和分析可为AAT功能研究打下理论基础,助力辣椒果实香气形成机理研究及品质育种。本研究通过生物信息学分析在中国辣椒基因组中鉴定到10个AAT基因。已报道的AAT基因还有10种蔷薇科果树中64个[7]、甜瓜中3个[15]、番茄中5个[19]、月季中3个[16]等。与已报道的物种相比,中国辣椒中的AAT基因相对校多,这也暗示其果香物质的合成调控机理可能更加复杂。在甜瓜[20]、苹果[21]、草莓[22]中均已对AAT功能展开研究,其在辣椒中的功能有待进一步验证。
顺式作用调节元件可以通过与特定转录因子结合,在生物或非生物胁迫、植物激素响应和生长进程等多种过程中参与转录调控[23]。在AAT基因家族顺式元件分析中,除了核心启动子元件外,共发现16种顺式调控元件,与生长发育调节相关的元件有9个,分别与脱落酸响应、茉莉酸响应、赤霉素响应、低温响应、生长素响应、水杨酸响应、玉米醇溶蛋白代谢调节、昼夜规律调节、细胞周期调节相关。5个防御相关的元件,包括光响应、防御和应激、缺氧诱导、厌氧调控,以及干旱诱导调控相关的元件。光响应元件和脱落酸响应元件出现在所有基因中,其余大部分元件分布在不同基因上,由此可推测出,AAT基因家族多数基因参与中国辣椒生长发育调控和胁迫响应,并有可能参与中国辣椒的各个不同生理调节,说明AAT基因广泛参与调节中国辣椒的各项生命活动。这与当前的苹果[24]、梨[25]、番茄[26]等研究结果相似。
基因时空表达在一定程度上能够反映出该基因的功能特性[27]。本研究的表达分析结果显示,在不同的组织部位和果实不同生长发育时期,AAT的表达量存在差异。本次测定的10个AAT基因有8个在中国辣椒植株中表达,2个不表达。根据其在不同时期的表达量可以推测出AAT基因家族成员基本参与了辣椒生长发育、开花结果等多项生理过程。不同的AAT基因家族成员参与调节着植物体多个不同生理活动,如King[28]等研究发现矮牵牛中AAT与其花瓣表皮覆盖的阻断水分流失的蜡酯合成有关。本研究发现,CcAAT8基因在花和果实中特异性表达,其表达量随着果实成熟先增加后下降。这种表达模式与‘金田1号’辣椒果实中的支链酯类物质变化趋势相似[2]。此结果说明该基因有可能参与辣椒酯类香气的合成。CcAAT8在‘金田1号’中的时空表达结果与梨[29]、葡萄[30]和草莓[31]中的AAT基因表达模式相似。这一现象暗示CcAAT8可能是影响辣椒果实支链酯类物质合成的重要基因。要明确其具体功能及调控模式,后续还需开展功能验证及调控机理研究。
4 结论通过生物信息学的方法鉴定出中国辣椒基因组中10个AAT基因,分析了其蛋白质理化性质、二级结构、三级结构、活性位点和作用位置。预测到10个基因分布于6条染色体上,其启动子区域包含16种顺式调控元件,主要为激素响应元件。时空表达分析显示,鉴定到的10个基因家族成员中,除CcAAT5和CcAAT6以外,都能在中国辣椒植株中检测到表达。CcAAT8在花和果实中特异表达,且表达量变化趋势与果实支链酯类物质含量变化趋势一致,可能是影响辣椒果实支链酯类物质合成的重要基因。本研究结果为辣椒AAT基因家族功能和辣椒香气物质合成机理提供了理论基础。
| [1] |
邹学校, 朱凡. 辣椒的起源、进化与栽培历史[J]. 园艺学报, 2022, 49(6): 1371-1381. DOI:10.16420/j.issn.0513-353x.2021-0853 ZOU X X, ZHU F. Origin, evolution and cultivation history of the pepper[J]. Acta Horticulturae Sinica, 2022, 49(6): 1371-1381. DOI:10.16420/j.issn.0513-353x.2021-0853 |
| [2] |
RODRÍGUEZ-BURRUEZO A, KOLLMANNSBERGER H, GONZÁLEZ-MAS M C, NITZ S, FERNANDO N. HS-SPME comparative analysis of genotypic diversity in the volatile fraction and aroma-contributing compounds of Capsicum fruits from the annuum-chinense-frutescens complex[J]. Developmental Science, 2010, 7(7): 4388-4400. DOI:10.1021/jf903931t |
| [3] |
HENG Z, XU X, XU X M, WANG H M, LIU L, LI Z X, LI Z L, YOU Q, SUN B J, GONG C, YIN Y, LI Y, LI T. Characterization of odorcontributing volatile in Capsicum chinense 'JT-1' fruits during development and transcriptome analysis of key fruit-aroma formation periods[J]. Scientia Horticulturae, 2023, 309: 111691. DOI:10.1016/j.scienta.2022.111691 |
| [4] |
KOEDA S, NODA T, HACHISU S, KUBO A, TANAKA Y, YAMAMOTO H, OZAKI S, KINOSHITA M, OHNO K, TANAKA Y, TOMI K, KAMIYOSHIHARA Y. Expression of alcohol acyltransferase is a potential determinant of fruit volatile ester variations in Capsicum[J]. Plant Cell Report, 2023, 42(11): 1745-1756. DOI:10.1007/s00299-023-03064-z |
| [5] |
BEEKWILDER J, ALVAREZ-HUERTA M, NEEF E, VERSTAPPEN F W, BOUWMEESTER H J, AHARONI A. Functional characterization of enzymes forming volatile esters from strawberry and banana[J]. Plant Physiology, 2004, 135(4): 1865-78. DOI:10.1104/pp.104.042580 |
| [6] |
SONG Z Z, PENG B, GU Z X, TANG M L, LI B, LIANG M X, WANG L M, GUO X T, WANG J P, SHA Y F, ZHANG H X. Sitedirected mutagenesis identified the key active site residues of alcohol acyltransferase PpAAT1 responsible for aroma biosynthesis in peach fruits[J]. Horticulture Research, 2021, 8(1): 32. DOI:10.1038/s41438-021-00461-x |
| [7] |
温思为, 张黄伟, 岳超, 李梦. 10种蔷薇科果树AAT基因家族鉴定、特性与表达分析[J]. 果树学报, 2021, 38(7): 1029-1043. DOI:10.13925/j.cnki.gsxb.20200523 WEN S W, ZHANG H W, YUE C, LI M. Identification, characterization, and expression analysis of AAT gene families in 10 Rosaceae fruit trees[J]. Journal of Fruit Trees, 2021, 38(7): 1029-1043. DOI:10.13925/j.cnki.gsxb.20200523 |
| [8] |
曹香梅. 桃果实酯类芳香物质的代谢与调控研究[D]. 杭州: 浙江大学, 2020. DOI: 10.27461/d.cnki.gzjdx.2019.001945. CAO X M. Metabolism and regulation of peach fruit esters[D]. Hangzhou: Zhejiang University, 2020. DOI: 10.27461/d.cnki.gzjdx.2019.001945. |
| [9] |
MA Q, XU Y Q, HANG X, MARIGA A M, CHEN Y P, ZHANG X C, WANG L, LI D, LI L, LUO Z S. Rethinking of botanical volatile organic compounds applied in food preservation: Challenges in acquisition, application, microbial inhibition and stimulation[J]. Trends in Food Science & Technology, 2022, 125: 166-184. DOI:10.1016/j.tifs.2022.05.007 |
| [10] |
SOULEYRE E, CHAGNÉ D, CHEN X. The AAT1 locus is critical for the biosynthesis of esters contributing to 'ripe apple' flavor in 'Royal Gala' and 'Granny Smith' apples[J]. The Plant Journal, 2014, 78(6): 903-915. DOI:10.1111/tpj.12518 |
| [11] |
LI P C, YU S W, SHEN J, LI Q Q, LI D P, LI D Q, ZHENG C C, SHU H R. The transcriptional response of apple alcohol acyltransferase (MdAAT2) to salicylic acid and ethylene is mediated through two apple MYB TFs in transgenic tobacco[J]. Plant Molecular Biology, 2014, 85(6): 627-638. DOI:10.1007/s11103-014-0207-8 |
| [12] |
CAO X, WEI C, DUAN W, GAO Y, KUANG J F, LIU M C, CHEN K S, KLEE H, ZHANG B. Transcriptional and epigenetic analysis reveals that NAC transcription factors regulate fruit flavor ester biosynthesis[J]. The Plant Journal, 2021, 106(3): 785-800. DOI:10.1111/tpj.15200 |
| [13] |
WANG R C, SHU P, ZHANG C, ZHANG J L, CHEN Y, ZHANG Y X, DU K, XIE Y, LI M Z, MA T, ZHANG Y, LI Z G, GRIERSON D, PIRRELLO J L, CHEN K S, BOUZAYEN M, ZHANG B, LIU M C. Integrative analyses of metabolome and genome‐wide transcriptome reveal the regulatory network governing flavor formation in kiwifruit (Actinidia chinensis)[J]. New Phytologist, 2022, 233(1): 373-389. DOI:10.1111/nph.17618 |
| [14] |
董静, 张运涛, 王桂霞, 钟传飞, 王丽娜, 常琳琳. 草莓果实酯类合成关键酶基因SAATB2和VAATW2表达特性分析[J]. 西北农业学报, 2014, 23(12): 149-153. DOI:10.7606/j.issn.1004-1389.2014.12.023 DONG J, ZHANG Y T, WANG G X, ZHONG C F, WANG L N, CHANG L L. Analysis of the expression characteristics of SAATB2 and VAATW2, key enzyme genes for ester synthesis in strawberry fruits[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2014, 23(12): 149-153. DOI:10.7606/j.issn.1004-1389.2014.12.023 |
| [15] |
EL-SHARKAWY I, DANIEL MANRÍQUEZ, FLORES F B. Functional characterization of a melon alcohol acyl-transferase gene family involved in the biosynthesis of ester volatiles. Identification of the crucial role of a threonine residue for enzyme activity[J]. Plant Molecular Biology, 2005, 59(2): 345-362. DOI:10.1007/s11103-005-8884-y |
| [16] |
SHALIT M. Volatile ester formation in roses. Identification of an acetyl-coenzyme a. Geraniol/citronellol acetyltransferase in developing rose petals[J]. Plant Physiology, 2003, 131(4): 1868-1876. |
| [17] |
KIM S, PARK M, YEOM S I, KIM Y M, LEE J M, LEE H A, SEO E, CHOI J, CHEONG K, KIM K T, JUNG K, LEE G W, OH S K, BAE C, KIM S B, LEE H Y, KIM S Y, KIM M S, KANG B C, JO YD, YANG H B, JEONG H J, KANG W H, KWON J K, SHIN C, LIM J Y, PARK J H, HUH J H, KIM J S, KIM B D, COHEN O, PARAN I, SUH M C, LEE S B, KIM Y K, SHIN Y, NOH S J, PARK J, SEO Y S, KWON S Y, KIM H A, PARK J M, KIM H J, CHOI S B, BOSLAND P W, REEVES G, JO S H, LEE B W, CHO H T, CHOI H S, LEE M S, YU Y, DO CHOI Y, PARK B S, VAN DEYNZE A, ASHRAFI H, HILL T, KIM W T, PAI H S, AHN H K, YEAM I, GIOVANNONI J J, ROSE J K, SØRENSEN I, LEE S J, KIM R W, CHOI I Y, CHOI B S, LIM J S, LEE Y H, CHOI D. Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species[J]. Nature Genetics, 2014, 46(3): 270-278. DOI:10.1038/ng.2877 |
| [18] |
时小东, 吴琪, 向达兵, 万燕, 赵钢. 苦荞GIS基因家族生物信息学分析[J]. 西南农业学报, 2019, 32(8): 1717-1722. DOI:10.16213/j.cnki.scjas.2019.8.005 SHI X D, WU Q, XIANG D B, WAN Y, ZHAO G. Bioinformatics analysis of GIS gene family in Fagopyrum tataricum[J]. Southwest China Journal of Agricultural Sciences, 2019, 32(8): 1717-1722. DOI:10.16213/j.cnki.scjas.2019.8.005 |
| [19] |
GOULET C, KAMIYOSHIHARA Y, LAM N B, RICHARD T, TAYLOR M G, TIEMAN D M, KLEE H J. Divergence in the enzymatic activities of a tomato and Solanum pennellii alcohol acyltransferase impacts fruit volatile ester composition[J]. Molecular Plant, 2015, 8(1): 153-162. DOI:10.1093/mp/ssu124 |
| [20] |
赵聪. 甜瓜果实醇酰基转移酶基因表达分析与功能鉴定[D]. 泰安: 山东农业大学, 2011. DOI: 10.7666/d.d143420. ZHAO C. Gene expression analysis and functional characterization of alcohol acyl transferase in melon fruit[D]. Taian: Shandong Agricultural University, 2011. DOI: _ext_link_paichu__. |
| [21] |
ZHOU W, KONG W, YANG C, FENG R, XI W. Alcohol acyltransferase is involved in the biosynthesis of c6 esters in Apricot (Prunus armeniaca L.) fruit[J]. Frontiers in Plant Science, 2021, 12: 763139. DOI:10.3389/fpls.2021.763139 |
| [22] |
LI Z, WANG Z, WANG K, LIU Y, HONG Y, CHEN C, GUAN X, CHEN Q. Co-expression network analysis uncovers key candidate genes related to the regulation of volatile esters accumulation in woodland strawberry[J]. Planta, 2020, 252: 1-15. DOI:10.1007/s00425-020-03462-7 |
| [23] |
曹颖, 胡尚连, 张慧莹, 唐晓凤, 刘永胜. 番茄醇酰基转移酶基因SlAAT1克隆、序列分析和原核表达[J]. 植物研究, 2012, 32(6): 731-736. CAO Y, HU S L, ZHANG H Y, TANG X F, LIU Y S. Cloning, sequence analysis and prokaryotic expression of an alcohol acyltransferase (AAT) gene in tomato (Solanum lycopersicum)[J]. Bulletin of Botanical Research, 2012, 32(6): 731-736. |
| [24] |
SUGIMOTO N, ENGELGAU P, JONES A D, SONG J, BEAUDRY R. Citramalate synthase yields a biosynthetic pathway for isoleucine and straight- and branched-chain ester formation in ripening apple fruit[J]. Proceedings of the National Academy of Sciences, 2021, 118(3): e2009988118. DOI:10.1073/pnas.2009988118 |
| [25] |
ZHOU X, DONG L, LI R, ZHOU Q, WANG J W, JI S J. Low temperature conditioning prevents loss of aroma-related esters from 'Nanguo' pears during ripening at room temperature[J]. Postharvest Biology and Technology, 2015, 100: 23-32. DOI:10.1016/j.scienta.2015.01.021 |
| [26] |
ZOU J, CHEN J, TANG N, GAO Y Q, HONG M S, WEI W, CHAO H H, JIAN W, LI N, DENG W, LI Z G. Transcriptome analysis of aroma volatile metabolism change in tomato (Solanum lycopersicum) fruit under different storage temperatures and 1-MCP treatment[J]. Postharvest Biology and Technology, 2018, 135: 57-67. DOI:10.1016/j.postharvbio.2017.08.017 |
| [27] |
杜姗姗, 周绍礼, 赵宝林, 赵维月, 陈江华. 豌豆TCP基因家族的鉴定与分析[J]. 植物生理学报, 2022, 58(8): 1575-1586. DOI:10.13592/j.cnki.ppj.100015 DU S S, ZHOU S L, ZHAO B L, ZHAO W Y, CHEN J H. Identification and analysis of the TCP gene family in Pisum sativum[J]. Plant Physiology Journal, 2022, 58(8): 1575-1586. DOI:10.13592/j.cnki.ppj.100015 |
| [28] |
KING A, NAM J W, HAN J, HILLIARD J, JAWORSKI J G. Cuticular wax biosynthesis in petunia petals: Cloning and characterization of an alcohol-acyltransferase that synthesizes wax-esters[J]. Planta, 2007, 226: 381-394. DOI:10.1007/s00425-007-0489-z |
| [29] |
ZHOU X, DONG L, ZHOU Q, WANG J W, CHANG N, LIU Z Y, JI S J. Effects of intermittent warming on aroma-related esters of 1-methylcyclopropene-treated 'Nanguo' pears during ripening at room temperature[J]. Scientia Horticulturae, 2015, 185: 82-89. DOI:10.1016/j.scienta.2015.01.021 |
| [30] |
QIAN X, LIU Y, ZHANG G, YAN A L, WANG H L, WANG X Y, PAN Q H, XU H Y, SUN L, ZHU B Q. Alcohol acyltransferase gene and ester precursors differentiate composition of volatile esters in three interspecific hybrids of Vitis labrusca × V. Vinifera during berry development period[J]. Food Chemistry, 2019, 295: 234-246. DOI:10.1016/j.foodchem.2019.05.104 |
| [31] |
CUMPLIDO-LASO G, MEDINA-PUCHE L, MOYANO E, HOFFMANN T, SINZ Q, RING L, STUDART-WITTKOWSKI C, CABALLERO J L, SCHWAB W, MUÑOZ-BLANCO J, BLANCOPORTALES R. The fruit ripening-related gene FaAAT2 encodes an acyl transferase involved in strawberry aroma biogenesis[J]. Journal of Experimental Botany, 2012, 63(11): 4275-4290. DOI:10.1093/jxb/ers120 |
(责任编辑 马春敏)
 2023, Vol. 50
2023, Vol. 50