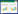文章信息
基金项目
- 国家自然科学基金(32072598);广东省教育厅重点学科建设-基础研究重大项目(2021ZDJS004);贵州省毕节市科学技术揭榜挂帅项目(毕科合重大专项〔2022〕3号);广州市科技计划项目(2023B03J1082);广东省农业厅种业振兴与科技兴农项目(2022-NPY-00-024)
作者简介
- 赵威(1999—),男,在读硕士生,研究方向为蔬菜生物技术及分子育种,E-mail:1519312088@qq.com.
通讯作者
- 吴智明(1981—),男,博士,教授,研究方向为蔬菜生物技术与遗传育种,E-mail:wuzm2012@zhku.edu.cn.
文章历史
- 收稿日期:2023-10-03
2. 广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室,广东 广州 510640
2. Vegetable Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Key Laboratory for New Technology Research of Vegetables, Guangzhou 510640, China
【研究意义】辣椒(Capsicum annuum L.)是茄科一年生或多年生草本作物,原产于南美洲亚热带地区,在全世界范围都有栽培,是重要经济作物[1]。辣椒在我国各地均有广泛的种植,近年来栽培面积稳定在210万hm2以上,已经成为我国种植面积最广、经济效益最好的蔬菜之一[2]。辣椒是自花授粉作物,常发生自交现象,偶尔发生天然杂交。在F1代杂交种制种过程中,由于生物学混杂和人工操作混杂等原因造成杂交种纯度降低的现象时有发生,给种子生产者、经营者和农户造成巨大经济损失。因此,在制种后和销售前对辣椒F1代杂交种子进行纯度鉴定必不可少。传统的辣椒种子纯度鉴定通常采用田间小区种植、形态观察的办法[3],但由于辣椒生育期长,形态学鉴定通常需要60~120 d,受环境影响大,准确性较低且耗费人力、财力,所以其应用受到限制。随着分子生物技术的迅猛发展,从DNA水平准确、可靠地对种子纯度进行鉴定成为现实。基于F1代杂交种具有父母本共同遗传特点,且亲本在特异性位点具有多态性,利用分子标记技术对杂种一代及其亲本进行PCR扩增,通过凝胶电泳观察扩增结果,根据F1代具有父母本互补带型,可以区分杂交种、其亲本和其他杂种[4]。【前人研究进展】DNA分子标记技术是根据个体之间或群体内核苷酸序列中碱基的差异性作为遗传标记,直观地反映生物的多态性[5]。在种子纯度鉴定中可以应用的分子标记技术包括:限制性内切酶片段长度多态性(Restriction fragment length polymorphism,RFLP)、随机扩增多态性DNA(Randomly amplified polymorphic DNA,RAPD)、扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)、简单序列重复(Simple sequence repeat,SSR)、单核苷酸多态性(Single nucleotide polymorphism,SNP)等[6]。SSR是一类广泛分布于基因组上的DNA序列,根据其在不同材料间产生不同的重复次数从而产生多态SSR标记[7],是一种共显性标记,具有多态性好、重复性高、操作简便等优点,被认为是一种发展前景良好的DNA指纹技术,目前已广泛应用于小麦[8]、水稻[9-10]、玉米[11]、大豆[12]等作物种子纯度鉴定。随着其他作物基因组学的迅速发展,利用SSR分子标记检测种子纯度的方法也在黄瓜[13]、茄子[14]、节瓜[15]、萝卜[16]、冬瓜[17]、辣椒[18]等蔬菜作物中得以应用。Guan等[19]利用公布的17对SSR引物对100份辣椒杂交种进行DNA指纹分析,根据多态性和杂合性筛选出了Hpms1-214、Es395和Hpms1-5 3对可以鉴定杂种纯度的首选核心引物。陈琛等[20]在辣椒杂种甘科4号和甘科10号中各自筛选出了一对共显性引物Es330和Epms923,2对引物在杂种中表现均为共显性,分别利用其进行纯度鉴定时,在甘科4号中的纯度为96.4%、与田间纯度鉴定结果相差1.8%;在甘科10号中的纯度为91.8%、与田间鉴定结果相差0.9%,引物鉴定结果与田间鉴定结果误差均在2% 以内,说明筛选出的2对引物是可靠的,能够快速准确地鉴定杂交种纯度。综上所述,利用SSR分子标记可以建立一套快速准确鉴定种子纯度的实验技术。【本研究切入点】‘汇丰2号’辣椒是广东省农业科学院蔬菜研究所选育的抗疫病和病毒病、早熟绿皮辣椒品种。由于该品种田间高抗疫病、耐雨水、早熟、优质等特点,深受广大种植户和收购商的好评,取得良好的社会效益。自2009年通过广东省农作物品种审定以来,累计推广14年,现已在广东省大面积种植,成为广东省的主栽品种。在种植前对品种进行纯度鉴定,采用传统的田间鉴定方法,时间长、见效慢,而利用SSR分子标记建立一套快速、准确鉴定‘汇丰2号’种子纯度的技术,可有效降低鉴定成本。【拟解决的关键问题】本研究基于公开的辣椒全基因组SSR标记引物资源,筛选出合适的SSR分子标记引物,可有效且准确地鉴定‘汇丰2号’辣椒杂交种的种子纯度;建立一套标准化的流程,确保不同的操作环境下得到的试验结果一致;验证在不同批次和环境下该方法的适用性和稳定性,保证在实际操作中其具有可行性。
1 材料与方法 1.1 试验材料本试验所用材料为广东省农业科学院蔬菜研究所培育的辣椒品种‘汇丰2号’,其母本是W2280,父本是W2102;‘粤红1号’、‘汇丰1号’和‘汇丰5号’3个辣椒品种均购于广东科农蔬菜种业有限公司。田间试验材料均种植于广东省农业科学院蔬菜研究所大丰试验基地。
1.2 试验方法1.2.1 基因组DNA的提取 将‘汇丰2号’、‘粤红1号’、‘汇丰1号’和‘汇丰5号’杂交种子及‘汇丰2号’的父母本分别播种于50孔穴盘中,在实验室植物培养室进行育苗,于4片真叶期取其中嫩叶1片提取DNA用于分子标记检测,待已取样幼苗出苗后约25 d移栽至试验大田。辣椒幼苗基因组DNA提取采用TPS法,步骤如下:将约200 mg辣椒幼苗叶片放入2.0 mL离心管中,每管插一根塑料研磨棒,用长柄镊子夹住在液氮中速冻约30 s后快速研磨成粉末,后加入TPS抽提液800 μL,72 ℃水浴30 min;常温下12 000 r/min离心10~15 min;取上清,转入1.5 mL离心管中,加入等体积异丙醇,12 000 r/min离心5 min;弃上清,晾干后加入100 μL双蒸水溶解,于4 ℃冰箱保存待用。
TPS抽提液配制:Tris-HCl(pH 8.0)终浓度0.1 mol/L,EDTA(pH 8.0)为0.01 mol/L,KCl为0.5 mol/L。
1.2.2 SSR分子标记筛选 在茄果类基因组数据库网站(https://solgenomics.net/cview/map.pl?map_id=10)下载辣椒SSR分子标记引物序列,每条染色体随机选取2对,共选取24对引物送生工生物工程股份有限公司合成。以‘汇丰2号’母本W2280和父本W2102对24个标记进行筛选,选出父、母本特征条带差异明显、清晰且扩增稳定的SSR标记用于后续试验。
1.2.3 PCR扩增及聚丙烯胺电泳 PCR扩增反应体系:10×PCR buffer 2 μL,2.5 mmol/L dNTPs 1.5 μL,10 μmol/L正向引物1 μL,10 μmol/L反向引物1 μL,模板DNA 1 μL,Taq酶1 U,加双蒸水补足至20 μL。PCR扩增反应程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃保持7 min。
PCR扩增产物经过8% 非变性聚丙烯酰胺凝胶进行电泳。电泳条件:120 V稳压电泳2 h。电泳结束后进行0.1% AgNO3银染10 min,然后在NaOH溶液(2% NaOH、0.4% 甲醛和0.04% Na2CO3)中显色10 min,最后在灯箱上辨识条带(读带)并分析。
1.2.4 种子纯度计算 根据聚丙烯酰胺电泳条带读取结果分别记录每个单株的带型,只有母本特征带型的记录为F,只有父本特征带型的记录为M,杂合带型(兼有母本和父本特征带型)的记录为H,杂交种子纯度计算公式为:
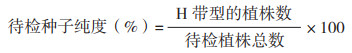
|
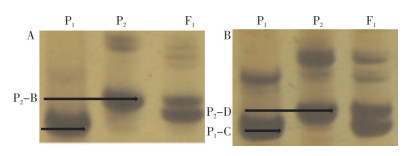
以‘汇丰2号’父、母本材料对24个SSR标记引物进行筛选,结果(表 1、图 1)表明,位于辣椒第1号染色体上的标记L0143和位于第6号染色体上的标记L0622在2个亲本材料中的特征条带差异明显,且条带清晰,扩增稳定。引物L0143在父本W2102(P1)中扩增出特异性条带P1-A,在母本W2280(P2)中扩增出特异性条带P2-B(图 1A),其特征带型分别长141 bp和149 bp;引物L0622在父本W2102(P1)中扩增出特异性条带P1-C,在母本W2280(P2)中扩增出特异性条带P2-D(图 1B),其特征带型分别长196 bp和208 bp。
|
| A: L0143引物多态性检测;B: L0622引物多态性检测;P1: 父本W2102;P2: 母本W2280;F1: ‘汇丰2号’ A: Polymorphism detection with primer L0413; B Polymorphism detection with primer L0622; P1: Male parent W2102; P2: Female parent W2280; F1: Huifeng 2 图 1 引物L0143和L0622对‘汇丰2号’及其亲本的PCR扩增结果 Fig. 1 PCR amplification results of hybrid 'Huifeng 2' and its parents with primers L0143 and L0622 |
2.2 ‘汇丰2号’杂交种子纯度鉴定
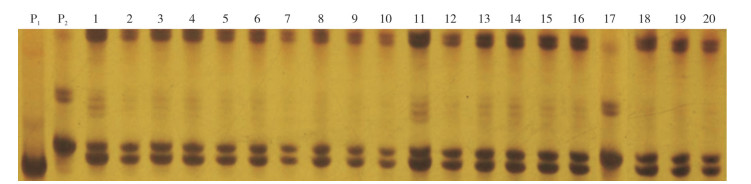
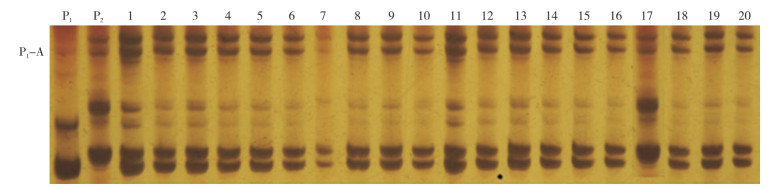
以筛选出的2个SSR分子标记L0143和L0622对96株‘汇丰2号’F1单株进行分子标记检测,结果(图 2、图 3)表明,引物L0143在95个单株中均能扩增出父、母本的特异性条带P1-A和P2-B,只有1个单株(编号17)只能扩增出母本的特异性条带,编号17的单株即鉴定为非‘汇丰2号’F1代杂交种;引物L0622在96个单株中的检测结果和标记L0143完全一致,即95个单株能扩增出父、母本的特异性条带P1-C和P2-D,只有1个单株只能扩增出母本的特异性条带,同样是编号17的单株,鉴定为非‘汇丰2号’F1代杂交种。依据种子纯度计算公式可知,这批检测的种子纯度为:95/96×100% ≈99.0%。
|
| P1:父本W2102;P2:母本W2280;1~20:‘汇丰2号’F1代单株 P1: Male parent W2102; P2: Female parent W2280; 1~20: F1 hybrid plants of 'Huifeng 2' 图 2 引物L0143对‘汇丰2号’F1代杂交种子纯度的验证结果 Fig. 2 Purity verification result of F1 hybrid seeds of 'Huifeng 2' with primer L0143 |
|
| P1:父本W2102;P2:母本W2280;1~20:‘汇丰2号’F1代待检测单株 P1: Male parent W2102; P2: Female parent W2280; 1-20: F1 hybrid plants of 'Huifeng 2' 图 3 引物L0622对‘汇丰2号’F1代杂交种子纯度的验证结果 Fig. 3 Purity verification result of F1 hybrid seeds of 'Huifeng 2' with primer L0622 |
为验证分子标记鉴定杂交种子纯度的可靠性,96个待检单株也在大田进行了种植,田间形态观察显示,编号17的单株果实明显比其他植株更“短胖”,平均果长17.95 cm、果宽3.04 cm,其他植株果型较为一致,平均果长18.26 cm、果宽2.56 cm,因此判断编号17单株为杂株,与2个SSR分子标记检测的结果完全一致,表明利用L0143和L0622标记鉴定‘汇丰2号’F1代杂交种子纯度是可靠的。
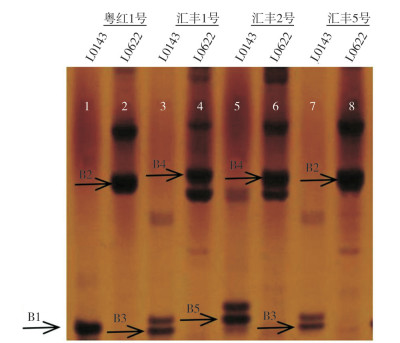
2.3 ‘汇丰2号’杂交种子真实性鉴定‘汇丰1号’、‘汇丰2号’和‘汇丰5号’3个品种性状具有一定的相似性,均为大果青皮椒类型品种,‘粤红1号’为红椒类型品种。利用筛选出的2个SSR分子标记L0143和L0622对这4个品种进行检测,结果(图 4)显示,2个标记在4个品种中共扩增出5种特异性条带,分别用B1、B2、B3、B4和B5表示,其中,‘粤红1号’同时扩增出B1和B2带型,‘汇丰1号’同时扩增出B3和B4带型,‘汇丰2号’同时扩增出B5和B4带型,‘汇丰5号’同时扩增出B3和B2带型。这表明L0143和L0622标记同时对4个品种进行检测时,每个品种都能扩增出特异的条带组合,因此可以成功将4个品种区分开来,可以用来检测这4个品种的真实性。
|
| 图 4 引物L0143及L0622对‘汇丰2号’的特异性验证结果 Fig. 4 Verification result of the specificity of primers L0143 and L0622 for 'Huifeng 2' |
3 讨论
我国辣椒产业发达,在全球辣椒产业中居第一位,是世界上主要的辣椒生产国和消费国,并且辣椒育种水平在国际上处于领先地位[21]。种子在农业生产活动中是重要的基本生产资料,种子纯度是衡量种子质量的重要指标,因此在种子生产销售环节中鉴定种子纯度是不可或缺的[22]。通过鉴定杂交种子的纯度可以降低假杂交种和低纯度种子流入市场的可能性,减少农业生产中的经济损失[23]。与传统方法相比,利用分子标记技术在鉴定作物种子纯度的应用越来越广泛[24]。Juhasz等[25]利用114个微卫星标记在9个杂交稻组合中筛选得到11个标记,可以区分杂交组合的多态性,其中GPMS15和GPMS112能够区分4种不同杂交组合的亲本,GPMS8、GPMS37和GPMS113能够区分3种不同的杂交组合。张爽爽等[26]以‘吉椒15号’、‘吉椒16号’及其亲本为材料,在72对候选SSR引物中筛选出6对具有亲本间多态性的共显性标记,在‘吉椒15号’和‘吉椒16号’”中均可以鉴定出杂种一代与亲本间有多态性存在带型互补,但该研究未进行田间鉴定试验,无法保证其分子标记结果的准确性。上述2个研究筛选出的标记仅能鉴定杂交种的纯度,不能鉴定其是否具有特异性,未能将其他品种与研究材料进行区分,而本研究筛选出的两对SSR标记不仅可以对杂种纯度进行鉴定,还可以将‘汇丰2号’与其他辣椒品种进行区分,鉴定了杂种的真实性,因此具有广泛的商业应用价值。
杨双娟等[27]利用辣椒品种“豫椒101”及其亲本材料在64对SSR引物中筛选出2对在亲本间有明显多态、杂交种呈现带型互补的特异性引物CA08g16130和CA02g22780,利用筛选出的引物对188株“豫椒101”杂种材料进行分析,第一对引物测得的纯度为93.6%,第二对引物测得的纯度为94.1%,2个标记检测结果的一致性为95.2%,一致性较差,其原因可能和分子标记的偏态分离有关。分子标记偏态分离是一种较为常见的现象,表现为标记的分离比例偏离了正常的分离比例,有更多个体偏向父本或母本基因型,这种现象在与育性相关基因连锁的标记上较常见[28]。本研究中,2个标记分别检测种子纯度的结果完全一致,也和田间表型鉴定结果一致,说明标记的选择效果最佳。
4 结论本研究通过对辣椒已公开基因组的SSR标记进行筛选,获得2个特征条带差异明显且带清晰、扩增稳定的SSR分子标记L0143和L0622。标记L0143在‘汇丰2号’母本W2280中PCR扩增条带为149 bp,在父本W2102中的扩增条带为141 bp;标记L0622在‘汇丰2号’母本和父本中的扩增条带分别为208 bp和196 bp,表明利用L0143和L0622任意一个标记即可鉴定‘汇丰2号’辣椒杂交种种子纯度。此外,2个标记同时使用可用于辣椒品种‘粤红1号’‘汇丰1号’‘汇丰2号’和‘汇丰5号’杂交种种子的真实性鉴定。本研究开发的引物组L0143和L0622能够快速、准确、低成本、有效地对‘汇丰2号’辣椒种子纯度进行鉴定,替代传统杂交种子纯度鉴定的方法,具有较高的商业应用价值。
| [1] |
魏家香, 俞佳虹, 程远, 叶青静, 王荣青, 阮美颖, 李志邈, 姚祝平, 周国治, 杨悦俭, 万红建. 辣椒种间杂交的现状及其研究进展[J]. 分子植物育种, 2018, 16(16): 5474-5482. DOI:10.13271/j.mpb.016.005474 WEI J X, YU J H, CHENG Y, YE Q J, WANG R Q, RUAN M Y, LI Z M, YAO Z P, ZHOU G Z, YANG Y J, WAN H J. Current situation and research progress of interspecific hybridization in pepper[J]. Molecular Plant Breeding, 2018, 16(16): 5474-548. DOI:10.13271/j.mpb.016.005474 |
| [2] |
邹学校, 马艳青, 戴雄泽, 李雪峰, 杨莎. 辣椒在中国的传播与产业发展[J]. 园艺学报, 2020, 47(9): 1715-1726. DOI:10.16420/j.issn.0513-353x.2020-0103 ZOU X X, MA Y Q, DAI X Z, LI X F, YANG S. Spread and industry development of pepper in China[J]. Acta Horticulturae Sinica, 2020, 47(9): 1715-1726. DOI:10.16420/j.issn.0513-353x.2020-0103 |
| [3] |
李春, 梁根云, 蔡鹏, 李跃建, 房超, 刘独臣, 刘小俊. 利用SSR分子标记鉴定华南型黄瓜'川绿15号'杂交种子纯度[J]. 西昌学院学报(自然科学版), 2022, 36(3): 13-17. DOI:10.16104/j.issn.1673-1891.2022.03.003 LI C, LIANG G Y, CAI P, LI Y J, FANG C, LIU D C, LIU X J. Identification of hybrid seed purity on south China type cucumber 'Chuanlv15' using SSR molecular markers[J]. Journal of Xichang University (Natural Science Edition), 2022, 36(3): 13-17. DOI:10.16104/j.issn.1673-1891.2022.03.003 |
| [4] |
李肯, 武云鹏, 彭冬秀, 张若纬. 利用SSR标记快速检测甜瓜'天美55'种子纯度与真实性[J]. 分子植物育种, 2022, 20(8): 2674-2681. DOI:10.13271/j.mpb.020.002674 LI K, WU Y P, PENG D X, ZHANG R W. Rapid identification of seed purity and facticity of Cucumis melo variety 'Tianmei 55' by SSR markers[J]. Molecular Plant Breeding, 2022, 20(8): 2674-2681. DOI:10.13271/j.mpb.020.002674 |
| [5] |
REDDY A, SHASHIBHUSHAN D, PRADEEP T. Molecular finger printing and genetic purity assessment of a rice hybrid using microsatellite markers[J]. The Pharma Innovation, 2021, 10(6): 926-929. |
| [6] |
SHARMA M, SINGH A. DNA Based molecular markers in plant varietal identification: A review[J]. Plant Archives, 2021, 21(S1): 1973-1980. DOI:10.51470/PLANTARCHIVES.2021.v21.S1.321 |
| [7] |
廖秋石, 雷刚, 陈学军, 袁欣捷, 黄月琴, 周坤华, 方荣. 分子标记技术在茄子种质资源评价中的应用研究进展[J]. 江西农业学报, 2020, 32(8): 44-51. DOI:10.19386/j.cnki.jxnyxb.2020.08.08 LIAO Q S, LEI G, CHEN X J, YUAN X J, HUANG Y Q, ZHOU K H, FANG R. Research progress in application of molecular marker techniques in germplasm resources evaluation of eggplant[J]. Acta Agriculturae Jiangxi, 2020, 32(8): 44-51. DOI:10.19386/j.cnki.jxnyxb.2020.08.08 |
| [8] |
NIE Y, KONG D, CUI F, SANG W, MU P Y, XU H J, TIAN X M. Blend wheat AL-type hybrid and using SSRs to determine the purity of hybrid seeds[J]. Seed Science and Technology, 2021, 49(3): 275-285. DOI:10.15258/sst.2021.49.3.08 |
| [9] |
YAO D Q, XIA J M, LOU J F, GU Q Q, LIU J, ZHANG Y, ZHANG Q L, ZHANG W W. Identification of seed purity on hybrid Japonica rice using SSR markers[J]. Molecular Plant Breeding, 2021, 12(25): 1-7. DOI:10.5376/mpb.2021.12.0025 |
| [10] |
NAGENDRA M S, SELVARAJU P, JERLIN R, GANESAMURTHY K, SENTHIL N. Application of SSR marker in genetic purity analysis of CORH 4 rice hybrid and its parental lines[J]. Electronic Journal of Plant Breeding, 2020, 11(4): 1181-1186. DOI:10.37992/2020.1104.190 |
| [11] |
SHINDE N, BHAROSE A, SARODE D K, PIMNALE P. Assessment of hybrid purity in maize (Zea mays L.) using RAPD and SSR markers[J]. The Pharma Innovation, 2021, 10(4): 870-874. |
| [12] |
KUMAR S P J, SUSMITA C, SRIPATHY K V, AGARWAL D K, PAL G, SINGH A N, KUMAR S, RAI A K, SIMAL-GANDARA J. Molecular characterization and genetic diversity studies of Indian soybean (Glycine max (L.) Merr.) cultivars using SSR markers[J]. Molecular Biology Reports, 2022, 49: 2129-2140. DOI:10.1007/s11033-021-07030-4 |
| [13] |
MANISHA T, RAMESH K, PARUL S, RAJNISH S. Assessment of genetic purity and earliness in F1 and F2 Population of cucumber (Cucumis sativus L.) using SSR markers[J]. Genetika, 2023, 55(1): 33-44. DOI:10.2298/GENSR2301033T |
| [14] |
蔚亚楠, 龚亚菊, 汪骞, 黎志彬, 鲍锐, 李石开, 吴丽艳. 基于SSR分子标记'云茄3号'的种子纯度鉴定[J]. 云南大学学报(自然科学版), 2020, 42(4): 804-810. DOI:10.7540/j.ynu.20190737 WEI Y N, GONG Y J, WANG Q, LI Z B, BAO Y, LI S K, WU L Y. Seed purity identification of eggplant cultivar 'Yunqie No.3' based on SSR molecular marker[J]. Journal of Yunnan University: Natural Sciences Edition, 2020, 42(4): 804-810. DOI:10.7540/j.ynu.20190737 |
| [15] |
CHEN J Y, CHEN Q M, LIU Z G, WANG C L, MA L L, GUO J Q, CHENG Z K. Seed genetic purity testing of F1 Benincasa hispida var. Chieh-Qua hybrids using SSR molecular marker analysis[J]. Seed Science and Technology, 2020, 48(3): 345-353. DOI:10.15258/sst.2020.48.3.03 |
| [16] |
WANG P G, YAO J L, ZENGCHEN Q Y, WANG L L, LI J C, FANG Y P, LI S S. Development of specific SSR molecular marker of "Huangzhou radish aased on purity identification[J]. Agricultural Biotechnology, 2019, 8(5): 9-11, 18. |
| [17] |
CHEN J Y, LIU Z G, WANG C L, CHEN Q M, CHENG Z K, MA L L, GOU J Q. Genetics of SSR polymorphism marker and purity identification of hybrid seeds in wax gourd (Benincasa hispida)[J]. Molecular Plant Breeding, 2022, 13(1): 1-6. DOI:10.5376/mpb.2022.13.0001 |
| [18] |
杨中周. 分子标记技术在辣椒种子纯度检测中的应用[J]. 中国瓜菜, 2015, 28(3): 1-4. DOI:10.16861/j.cnki.zggc.2015.03.001 YANG Z Z. Application of molecular marker technologies in testing varietal purity of pepper[J]. China Cucurbits and Vegetables, 2015, 28(3): 1-4. DOI:10.16861/j.cnki.zggc.2015.03.001 |
| [19] |
GUAN J J, HAUNG Q M, ZHANG P, MA F R, ZHANG H, ZHANG J H. Screening of SSR core primers for purity identification of pepper (Capsicum) hybrids[J]. Agricultural Science and Technology, 2015, 16(10): 2155-2158, 2230. |
| [20] |
陈琛, 罗俊杰, 陈卫国. 利用SSR技术快速鉴定两个辣椒杂交品种纯度[J]. 甘肃农业科技, 2020(4): 53-58. CHEN C, LUO J J, CHEN W G. Rapid identification of two pepper hybrid cultivars purity by SSR markers[J]. Gansu Agricultural Science and Technology, 2020(4): 53-58. |
| [21] |
张子峰. 我国辣椒产业发展现状、主要挑战与应对之策[J]. 北方园艺, 2023(14): 153-158. ZHANG Z F. Current development situation, main challenges and its countermeasures of the pepper industry in China[J]. Northern Horticulture, 2023(14): 153-158. |
| [22] |
凌志阳. 节瓜杂种种子纯度鉴定的SSR分析[D]. 南宁: 广西大学, 2019. LING Z Y. SSR molecular markers analysis for the purity identification of Chien-Qua hybrid seeds[D]. Nanning: Guangxi University, 2019. |
| [23] |
朱海生, 李祖亮, 李永平, 刘建汀, 王彬, 陈敏氡, 温庆放. 基于SSR分子标记的普通丝瓜杂交种子纯度鉴定[J]. 江苏农业科学, 2020, 48(8): 53-56. DOI:10.15889/j.issn.1002-1302.2020.08.009 ZHU H S, LI Z L, LI Y P, LIU J T, WANG B, CHEN M D, WEN Q F. Purity identification of common luffa hybrid seeds based on SSR molecular markers[J]. Jiangsu Agricultural Sciences, 2020, 48(8): 53-56. DOI:10.15889/j.issn.1002-1302.2020.08.009 |
| [24] |
蒋钰东, 何茹薇, 罗俊涛, 杨扬, 郑军, 付均, 曾正明. 8个杂交水稻新组合种子纯度的分子标记鉴定[J]. 中国种业, 2022(1): 71-74. DOI:10.19462/j.cnki.1671-895x.2022.01.021 JIANG Y D, HE R W, LUO J T, YANG Y, ZHENG J, FU J, ZENG Z M. Identification of seed purity of 8 new hybrid rice combinations by molecular markers[J]. China Seed Industry, 2022(1): 71-74. DOI:10.19462/j.cnki.1671-895x.2022.01.021 |
| [25] |
JUHASZ A G, STAGEL A, ACS S, ZATYKO L, NAGY I. Microsatellite markers and automated fragment analysis techniques for efficient and precise hybrid identification and genetic purity testing in pepper (Capsicum annuum L.)[J]. Acta Agronomica Hungarica, 2006, 54(2): 141-146. DOI:10.1556/AAgr.54.2006.2.3 |
| [26] |
张爽爽, 张悦, 王健鹂, 聂楚楚, 滕巍, 王学国, 王秀峰. '吉椒15号'和'吉椒16号'辣椒种子纯度SSR分子标记鉴定体系的初步建立[J]. 辣椒杂志, 2020, 18(2): 18-21. DOI:10.16847/j.cnki.issn.1672-4542.2020.02.004 ZHANG S S, ZHANG Y, WANG J L, NIE C C, TENG W, WANG X G, WANG X F. Preliminary Establishment of seed purity identification system for pepper varieties 'Jilin pepper 15' and 'Jilin pepper 16' using SSR markers[J]. Journal of China Capsicum, 2020, 18(2): 18-21. DOI:10.16847/j.cnki.issn.1672-4542.2020.02.004 |
| [27] |
杨双娟, 于文涛, 原玉香, 魏小春, 王志勇, 赵艳艳, 姚秋菊, 张晓伟. 辣椒品种'豫椒101'纯度鉴定的SSR标记筛选[J]. 分子植物育种, 2019, 17(22): 7433-7437. DOI:10.13271/j.mpb.017.007433 YANG S J, YU W T, YUAN Y X, WEI X C, WANG Z Y, ZHAO Y Y, YAO Q J, ZHANG X W. Screening of SSR markers for purity identification of pepper variety 'Yujiao No.101'[J]. Molecular Plant Breeding, 2019, 17(22): 7433-7437. DOI:10.13271/j.mpb.017.007433 |
| [28] |
GARCIA A A F, BENCHIMOL L L, BARBOSA A M M, GERALDI I O, SOUZA JR C L, SOUZA A P. Comparison of RAPD, RFLP, AFLP and SSR markers for diversity studies in tropical maize inbred lines[J]. Genetics and Molecular Biology, 2005, 27(4): 579-588. DOI:10.1590/S1415-47572004000400019 |
(责任编辑 邹移光)
 2023, Vol. 50
2023, Vol. 50