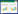文章信息
基金项目
- 江西省教育厅科学技术研究项目(GJJ2202001);新疆维吾尔自治区区域协同创新专项(2021E02030);江西省良种联合攻关项目(2022JXCQZY03,2022JXCQZY04)
作者简介
- 柴学文(1985—),男,实验师,研究方向为家禽育种,E-mail:279391585@qq.com.
通讯作者
- 许继国(1982—),男,博士,副教授,研究方向为家禽育种,E-mail:3425614@qq.com.
文章历史
- 收稿日期:2023-03-14
2. 江西省地方鸡种遗传改良重点实验室/中国科学院家禽分子育种技术联合实验室,江西 南昌 330032;
3. 江西省农业科学院畜牧兽医研究所,江西 南昌 330299;
4. 阜康市泰昆养殖有限公司,新疆 昌吉 831599
2. Jiangxi Key Laboratory of Genetic Improvement of Indigenous Chicken Breeds/Poultry Molecular Breeding Technology Joint Laboratory, Chinese Academy of Sciences, Nanchang 330032, China;
3. Institute of Animal Husbandry and Veterinary Sciences, Jiangxi Academy of Agricultural Sciences, Nanchang 330299, China;
4. Fukang Taikun Breeding Co., Ltd., Changji 831599, China
【研究意义】色素表型历来是生物学家研究基因型和表型之间关系的重要性状。本研究以鸡的青黄脚性状和白色羽性状作为研究对象,探究性状形成的分子基础,以期为上述性状的精准选择提供参考,对于缩短育种进程具有重要意义。【前人研究进展】研究显示,鸡的肤色由两个主要的基因座控制,其中控制白色肤色的基因座W对控制鸡的黄色肤色的等位基因y为显性[1-4]。由于胫部鳞片是皮肤的衍生物,因此,上述两个等位基因会影响胫色[5-6]。等位基因ID位于Z染色体上,影响胫部真皮下层的颜色,携带该等位基因的个体胫部真皮无色素沉着,其对控制真皮沉积黑色素的等位基因id为显性[7-8]。活体鸡的胫色是表皮色素沉着和真皮色素沉着共同作用的结果。Eriksson等[3]证实了BCO2基因控制肤色的W基因座,并鉴定了3个与脚色完全连锁的SNP位点。国内的诸多研究也确认了BCO2基因与黄色肤色的关系,并鉴定出可用于肤色选择的基因位点[9-11]。
隐性白基因座C和显性白基因座I均可以导致鸡羽色变为白色[12-13]。隐性白等位基因c呈现常染色体隐性遗传,隐性白杂合子Cc允许正常羽色的表现,隐性白纯合子cc显示为纯白色。在一些情况下,野生型等位基因C对隐性白c是不完全显性。Chang等[12]研究发现,隐性白羽表型是由TYR基因外显子4内一段7.7 kb的片段插入造成。显性白基因座I上包含3个等位基因,显性白基因座标记为I*I,其对应的野生型基因型I*i为不完全显性。显性白基因座突变会选择性抑制黑色色素,导致羽毛中的黑色色素被稀释,因此被称为黑色抑制因子[12]。Kerje等[13]研究发现,显性白基因座对应编码前黑素体蛋白PMEL17,序列分析显示,显性白等位基因与PMEL17基因外显子10上的9 bp插入片段完全连锁,该突变导致在PMEL17跨膜域上插入了3个氨基酸。此外,编码e基因座上的等位基因与显性白羽的形成相关,只有当携带显性白的个体同时携带E等位基因时才能表现为白色羽。研究发现,e基因座对应的编码蛋白为MC1R[14-15]。该基因座上已经确认了8个等位基因,其中E和ER等位基因与黑色羽的形成相关。隐性白羽和显性白羽的典型代表分别为隐性白羽洛克鸡和快大型白羽肉鸡。
【本研究切入点】青脚麻鸡配套系商品代出现青黄脚(行业内称之为蛇皮脚、柳色脚或者阴阳脚等),不符合品种青脚性状特征;利用隐性白羽洛克鸡和快大型白羽肉鸡合成隐性白羽新品系(隐性白位点为纯合子cc),而利用该品系与有色羽杂交的后代出现大量白色羽个体和黑色羽个体,不符合生产预期。根据前人研究结果,青黄脚性状可能是由于青脚纯系携带了控制表皮呈黄色的y基因座,从而导致后代性状分离而出现青黄脚个体。对合成隐性白纯系与有色羽个体杂交出现白色羽个体的现象,推测由于新合成隐性白纯系携带显性白突变所致。【拟解决的关键问题】本研究采用候选基因的思路对上述性状进行研究。针对鸡的青黄脚性状,以青脚、黄脚和青黄脚个体为材料,鉴定BCO2基因变异与不同表型之间的关系,以期探寻与性状完全连锁的SNP位点。针对鸡的白色羽性状,以新合成的隐性白羽品系、快大型白羽肉鸡、隐性白羽洛克鸡和商品代白羽个体为材料,分析不同群体中隐性白基因座、显性白基因座和e基因座对应的TYR、PMEL17、MC1R基因突变情况,以期阐明白色羽产生的原因。本研究探究导致肉鸡青黄脚性状和白色羽性状的分子遗传学基础,为建立相关性状的分子标记辅助选择提供参考。
1 材料与方法 1.1 试验材料供试的肉鸡材料均来自新疆泰昆集团有限责任公司。青脚A系,纯繁会出现青黄脚后代;青脚麻纯系(B系)、黄脚纯系(C系),胫色均稳定遗传,不会出现分离。2021年11—12月采集血液样本,翅下静脉采血0.5 mL并抽提DNA。其中采集(A系♂×C系♀)黄脚公鸡100羽、A系纯繁分离出的青黄脚公鸡100羽、C系公鸡100羽、B系公鸡100羽,用于验证BCO2候选基因位点与青黄脚性状之间的关系;采集隐性白羽洛克鸡、快大型白羽肉鸡以及黄色羽B♂×合成隐性白A系♀的白羽后代各100羽,用于验证MC1R、TYR和PMEL17候选基因位点与白色羽性状之间的关系;采集A系585羽,用于青黄脚性状的分子标记辅助选择。
1.2 试验方法1.2.1 BCO2、MC1R、TYR、PMEL17基因扩增与测序分析 采用购自广州飞扬生物工程有限公司的禽血抽提试剂盒(NRBC Blood DNA Kit),按照说明书抽提DNA。
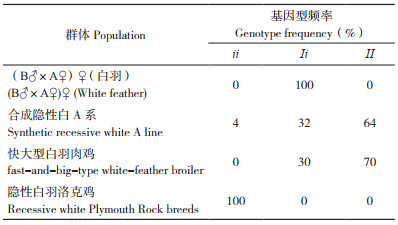
BCO2、MC1R、TYR、PMEL17基因分别参考GenBank数据库中的序列NC006111.3、D78272.1、DQ118701、AY636124.1为模板,利用在线引物设计软件Primer-Blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)设计相应引物(表 1)。
PCR扩增体系为20 μL,其中2× PCR Mix10 μL,20 μmol/L上下游引物各0.2 μL,DNA模板1 μL,ddH2O 8.6 μL。扩增程序为95 ℃预变性30 s;95 ℃变性30 s、适宜温度(表 1)下退火30 s、72 ℃延伸30 s,40个循环;72 ℃延伸5min,12 ℃保存。将扩增产物交由上海捷瑞生物科技有限公司进行测序。
1.2.2 基因型和单倍型分析 将BCO2、MC1R和PMEL17的测序结果利用DNAStar中的SeqMan模块进行读取。TYR基因采用琼脂糖凝胶电泳进行分型。
MC1R基因上的等位基因是由6个突变位点组成的单倍型构成,本研究使用DNAsp对MC1R基因上的等位基因进行分析。将所有被扩增个体的序列编辑在同一个.txt文本,目的位点的杂合子位点用简并碱基代码代替,采用DNAsp中的Haplotype analysis模块对文本进行分析。
如果不同性状的被检个体100% 与目的位点连锁,则将该位点确定为分子标记,针对该性状进行分子标记辅助选择。
2 结果与分析 2.1 鸡青黄脚性状相关位点分析选取青脚公鸡和黄脚母鸡(A系♂× C系♀)杂交后代中的黄脚公鸡、青脚A系纯繁分离出的青黄脚公鸡、黄脚纯系(C系)公鸡、青脚麻纯系(B系)公鸡各100羽,对BCO2基因扩增片段342 bp处的位点进行基因分型。结果(表 2)显示,除青脚麻纯系公鸡为CC基因型外,黄脚和青黄脚个体均为TT基因型,表明青黄脚表型与342 bp位点完全连锁,利用该位点可以对纯系开展青黄脚性状分子标记辅助选择,淘汰青脚A系中携带C等位基因的个体(CT)则可以解决纯繁时出现青黄脚表型的问题。
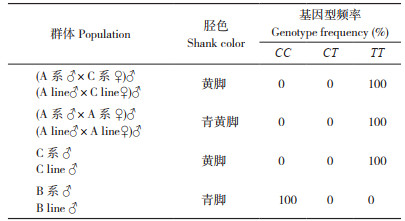
|
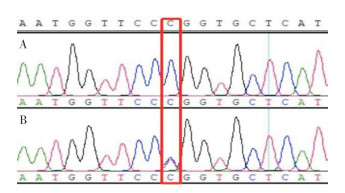
根据上述结果,育种生产中对A系585羽个体进行检测,结果(图 1)显示,有200羽个体为CT基因型、占比34.2%,其余全部为CC基因型、占比65.8%。按照杂合子比例推算该纯系纯繁时出现青黄脚的比例为2.9%,与实际统计的3% 相近。经分子标记辅助选择后,该纯系纯繁后代未出现青黄脚个体。
|
| A:CC基因型,B:CT基因型 A: CC genotype, B: CT genotype 图 1 BCO2基因扩增片段342 bp位点测序分型结果 Fig. 1 Sequencing and typing results of 342 bp locus in BCO2 gene amplified fragment |
2.2 鸡白色羽性状相关位点分析
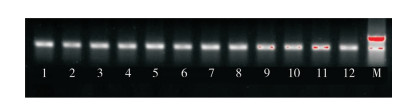
2.2.1 隐性白位点(TYR)突变检测结果 隐性白羽洛克鸡和快大型白羽肉鸡的合成隐性白A系,培育过程中采用分子标记辅助选择的方法选留了隐性白位点为纯合子的个体。本研究结果显示,被检的100羽个体均为隐性白纯合子cc(图 2,表 3)。此外,对黄色羽B♂×合成隐性白A系♀产生的白羽后代进行检测,结果发现被检个体全部为隐性白杂合子Cc(表 3)。这表明造成黄色羽B♂×合成隐性白A系♀出现白羽的原因为非隐性白纯合子突变。
|
| 1~12:被检个体,均为隐性白纯合子cc;M:已知基因型的隐性白杂合子Cc(对照) 1-12: the tested individual, which is the recessive white homozygote cc; M: the recessive white heterozygote Cc (control) with known genotype 图 2 隐性白突变琼脂糖凝胶电泳检测结果 Fig. 2 Agarose gel electrophoresis results of recessive white mutation |

|
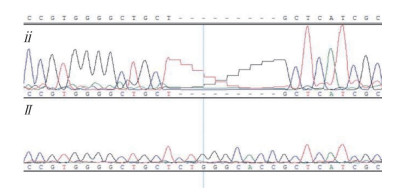
2.2.2 显性白位点(PMEL17)突变检测结果 对黄色羽B♂×合成隐性白A系♀白色羽杂交后代开展显性白位点检测,结果显示,被检的100羽个体全部为显性白杂合子Ii(表 4)。为验证显性白突变的来源,对合成隐性白亲本隐性白羽洛克鸡和快大型白羽肉鸡进行显性白位点检测,结果显示,隐性白羽洛克鸡不携带I等位基因,快大型白羽肉鸡均携带显性白突变(图 3,表 4),表明合成隐性白A系中的I等位基因来自快大型白羽肉鸡。
|
| 上图为显性白野生型纯合子ii,下图为显性白突变纯合子II The above individual genotype is a homozygote of dominant white field type ii, the following individual genotype is homozygous II with dominant white mutation 图 3 显性白突变测序结果 Fig. 3 Dominant white mutation detection by sequencing |
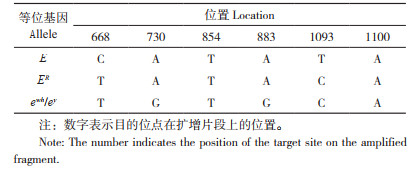
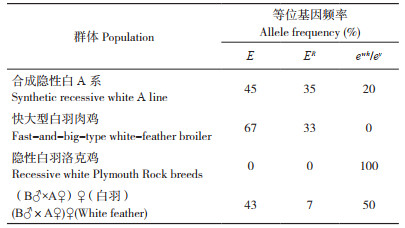
2.2.3 e基因座(MC1R)等位基因分布情况 e基因座是控制羽色的主要基因座之一,其上共有8个等位基因,每个等位基因由6个SNP组成的单倍型决定[15]。控制黑色羽的等位基因E和ER位于该基因座上,是携带显性白突变个体呈现白色羽的前提条件。前期研究发现,快大型白羽肉鸡也携带黑色羽等位基因,因此本研究同时检测了合成隐性白A系及其亲本快大型白羽肉鸡、隐性白羽洛克鸡、黄色羽B♂×合成隐性白A系♀杂交白色羽后代e基因座上的等位基因情况,结果显示,被检群体中共有3种等位基因E、ER和ewh/ey(表 5)。其中合成隐性白A系的主要等位基因E、ER占比达80%,仅有20% 的ewh/ey;快大型白羽肉鸡的等位基因全部为控制黑色羽表型的E和ER,但主要是以E等位基因为主,占比67%;隐性白羽洛克鸡的等位基因全部为ewh/ey;杂交的白羽后代中,E和ER等位基因共占50%,ewh/ey等位基因占50%;被检个体有E/ewh/ey和ER/ewh/ey两种基因型,被检个体均携带1个E或者ER等位基因,另外一个等位基因为ewh/ey(表 6)。以上结果说明黄色羽B♂×合成隐性白A系♀杂交白羽后代是由显性白导致,且显性白突变等位基因来自快大型白羽肉鸡。
3 讨论
肤色、羽色等着色性状是品种的特征性状,是品种选育的重要性状之一。大部分着色性状受单基因控制,或者受两个独立的基因互作控制[16-19]。单基因控制的性状可通过肉眼观察表型进行个体淘汰,或者通过测交手段淘汰。根据表型淘汰个体的方法,理论上3个世代就可以将性状基本固定;通过测交手段则可以快速淘汰杂合个体,使相关性状通过1个世代的选育快速达到纯合。对于有遗传异质性的性状或多个基因座互作形成的性状(胫色、黑白芦花、白色羽等)[20-21],通过上述两种方法选育的进展会慢很多,而且实际操作过程繁琐且容易出错。针对上述情况,若能够解析相关性状的分子遗传学基础,建立相应的分子标记辅助选择方法,则能加速相关性状的选育进展,从而加速新品种的培育进程。
2008年瑞典乌普萨拉大学Eriksson等[3]证实了控制黄色、白色胫色的基因座对应编码的基因为BCO2基因,并发现了3个与胫色完全连锁的SNP位点。在该研究基础上,张细权等[10]以中国地方鸡品种为素材,分析了BCO2基因多态性与黄白胫色的关系,发现测序片段上的342位点与黄白胫色完全连锁。本研究检测了342位点与不同胫色群体的关系,结果显示,342位点在被检测群体中与青黄脚性状完全连锁。由于目前未鉴定到导致黄色、白色胫色的致因突变,因此在不同群体中利用分子选择方法对青黄脚进行选择时,建议首先在群体中检验Eriksson等[3]和张细权等[10]研究的相关位点,找到完全连锁的位点后再实施分子选择。
对利用快大型白羽肉鸡合成的隐性白品系,除检测隐性白等位基因外,还应检测显性白等位基因I和e基因座。本研究证实了黄色羽B♂×合成隐性白A系♀产生白色羽个体是由于合成隐性白携带了显性白突变。当合成的隐性品系为隐性白杂合子,其掩盖了显性白突变的效应;而利用有色羽与其杂交时,显性白的效应就在后代中显现。因此,对合成品系进行分子选择时,除检测选留隐性白纯合子(cc)外,还应检测选留基因型为ccii的个体,淘汰携带显性白突变的个体(ccIi和ccII)。E和ER等位基因控制黑色羽性状,其对于ewh/ey等位基因呈现显性遗传。研究结果显示,合成隐性白纯系中,E和ER等位基因频率达80%。当合成的纯系为隐性白等位基因纯合子(cc)时,E和ER等位基因的遗传效应被掩盖。但用有色羽和上述合成隐性白纯系杂交时,由于后代为隐性白杂合子(Cc)而不能掩盖E和ER等位基因效应,因此后代会出现大量黑色羽个体。
研究表明,银色羽等位基因也是影响羽色的重要基因座,在快大型白羽肉鸡和隐性白羽洛克鸡中均可能存在[4]。因银色羽是伴性遗传,而合成隐性白羽品系用于与第一父系杂交生产父母代母鸡,故银色羽不能遗传到商品代。因此本研究并未针对银色羽等位基因进行分析。
4 结论本研究利用候选基因的方法确认了导致鸡青黄脚和白色羽的遗传基础。BCO2基因是青黄脚性状形成的关键,扩增片段上342 bp处的SNP位点与青黄脚性状完全连锁,该位点可用于青黄脚性状的分子标记辅助选择。合成隐性白品系的隐性白突变位点纯合子cc与杂交后代出现白色羽无关。显性白等位基因I是合成隐性白品系与有色羽个体杂交产生白色羽的主要原因,该等位基因来自快大型白羽肉鸡,因此在利用快大型白羽肉鸡合成隐性白羽品系时应注意针对该等位基因开展分子选择。
| [1] |
KNOX C W. The inheritance of shank color in chickens[J]. Genetics, 1935, 20: 529-544. DOI:10.1093/genetics/20.6.529 |
| [2] |
MCGIBBON W H. Green shanks and adult mortality in chickens[J]. Journal of Heredity, 1979, 70(1): 44-46. DOI:10.1093/oxfordjournals.jhered.a109186 |
| [3] |
ERIKSSON J, LARSON G, GUNNARSSON U, BED'HOM B, TIXIER-BOICHARD M, STROMSTEDT L, WRIGHT D, JUNGERIUS A, VEREIJKEN A, rANDI E, JENSEN P, ANDERSSON L. Identification of the yellow skin gene reveals a hybrid origin of the domestic chicken[J]. PLoS Genetics, 2008, 4(2): e1000010. DOI:10.1371/journal.pgen.1000010 |
| [4] |
ANDERSSON L, BED'HOM B, CHUONG CM, INABA M, OKIMOTO R, TIXIER-BOICHARD M. The genetic basis for pigmentation phenotypes in poultry//AGGREY S E, ZHOU H, TIXIER-BOICHARD M, RHOADS D D. Advances in poultry genetics and genomics[M]. Cambridge, UK: Burleigh Dodds Science Publishing, 2020.
|
| [5] |
WU J, LIN Z, ChEN G, LUO Q, NIE Q, ZHANG X, LUO W. Characterization of chicken skin yellowness and exploration of genes involved in skin yellowness deposition in chicken[J]. Frontiers in Physiology, 2021, 12: 585089. DOI:10.3389/fphys.2021.585089 |
| [6] |
HE S, REN T, LIN W, YANG X, HAO T, ZHAO G, LUO W, NIE Q, ZHANG X. Identification of candidate genes associated with skin yellowness in yellow chickens[J]. Poultry Science, 2023, 102(4): 102469. DOI:10.1016/j.psj.2022.102469 |
| [7] |
BATESON W. The inheritance of the peculiar pigmentation of the silky fowl[J]. Journal of Genetics, 1911(1): 185-203. |
| [8] |
XU J, LIN S, GAO X, NIE Q, LUO Q, ZhANG X. Mapping of Id locus for dermal shank melanin in a Chinese indigenous chicken breed[J]. Journal of Genetics, 2017, 96: 977-983. DOI:10.1007/s12041-017-0862-z |
| [9] |
吴静文, 陈庚华, 林泽桐, 殷允谦, 陈泓庆, 陈杰, 罗庆斌, 聂庆华, 张细权, 罗文. BCO2基因多态性与麻黄鸡皮肤黄度的相关性研究[J]. 中国家禽, 2020, 42(5): 7-13. DOI:10.16372/j.issn.1004-6364.2020.05.002 WU J W, CHEN G H, LIN Z T, YIN Y Q, CHEN H Q, CHEN J, LUO Q B, NIE Q H, ZHANG X Q, LUO W. Polymorphism of BCO2 gene and its correlation with skin yellowness in partridge chickens[J]. China Poultry, 2020, 42(5): 7-13. DOI:10.16372/j.issn.1004-6364.2020.05.002 |
| [10] |
张细权, 许继国, 聂庆华, 詹惠娜. 一种鸡皮肤颜色相关的分子标记及其应用[P]. 中国: ZL 2014 10050812.7, 2014-06-04. ZHANG X Q, XU J G, NIE Q H, ZHAN H N. A molecular marker related to chicken skin color and its application[P]. China: ZL 2014 10050812.7, 2014-06-04. |
| [11] |
王艳, 罗成龙, 李春雨, 邓科源, 马杰, 瞿浩, 舒鼎铭. 一种鸡皮肤颜色相关的分子标记及其鉴别方法和应用[P]. 中国: ZL201010531819.2, 2010-11-04. WANG Y, LUO C L, LI C Y, DENG K Y, MA J, QU H, SHU D M. A molecular marker related to chicken skin color and its identification method and application[P]. China: ZL201010531819.2, 2010-11-04. |
| [12] |
CHANG CM, COVILLE JL, COQUERELLE G, GOURICHON D, OULMOUDEN A, TIXIER-BOICHARD M. Complete association between a retroviral insertion in the tyrosinase gene and the recessive white mutation in chickens[J]. BMC Genomics, 2006, 7: 19. DOI:10.1186/1471-2164-7-19 |
| [13] |
KERJE S, SHARMA P, GUNNARSSON U, KIM H, BAGCHI S, FREDRIKSSON R, SCHÜTZ K, JENSEN P, VON HEIJNE G, OKIMOTO R, ANDERSSON L. The Dominant white, Dun and Smoky color variants in chicken are associated with insertion/deletion polymorphisms in the PMEL17 gene[J]. Genetics, 2004, 168: 1507-1518. DOI:10.1534/genetics.104.027995 |
| [14] |
LING M K, LAGERSTROM M C, FREDRIKSSON R, OKIMOTO R, MUNDY N I, TAKEUCHI S, SCHIOTH H B. Association of feather colour with constitutively active melanocortin 1 receptors in chicken[J]. European Journal of Biochemistry, 2003, 270(7): 1441-1449. DOI:10.1046/j.1432-1033.2003.03506.x |
| [15] |
KERJE S, LIND J, SCHUTZ K, JENSEN P, ANDERSSON L. Melanocortin 1-receptor (MC1R) mutations are associated with plumage colour in chicken[J]. Animal Genetics, 2003, 34: 241-248. DOI:10.1046/j.1365-2052.2003.00991.x |
| [16] |
ANDERSSON L. Melanocortin receptor variants with phenotypic effects in horse, pig, and chicken[J]. Annals of the New York Academy of Sciences, 2003, 994: 313-318. DOI:10.1111/j.1749-6632.2003.tb03195.x |
| [17] |
何艺平, 陈杰, 高鑫凤, 许继国. 文昌鸡白麻羽性状与SLC45A2多态性关系[J]. 广东农业科学, 2019, 46(10): 99-103. DOI:10.16768/j.issn.1004-874X.2019.10.016 HE Y P, CHEN J, GAO X F, XU J G. Relationship between the trait of white-partridge feathers and SLC45A2 polymorphism in Wenchang chicken[J]. Guangdong Agricultural Sciences, 2019, 46(10): 99-103. DOI:10.16768/j.issn.1004-874X.2019.10.016 |
| [18] |
SCHWOCHOW THALMANN D, RING H, SUNDSTRÖM E, CAO X, LARSSON M, KERJE S, HÖGLUND A, FOGELHOLM J, WRIGHT D, JEMTH P, HALLBÖÖK F, BED'HOM B, DORSHORST B, TIXIER-BOICHARD M, ANDERSSON L. The evolution of sex-linked barring alleles in chickens involves both regulatory and coding changes in CDKN2A[J]. PLoS Genetics, 2017, 13: e1006665. DOI:10.1371/journal.pgen.1006665 |
| [19] |
何艺平, 许继国, 谢袖娟, 詹惠娜. 鸡羽色性状基因座研究进展[J]. 广东农业科学, 2014, 40(9): 129-134. DOI:10.16768/j.issn.1004-874X.2014.09.046 HE Y P, XU J G, XIE X J, ZHAN H N. Research progress of feather color loci in Gallus gallus domestica[J]. Guangdong Agricultural Sciences, 2014, 40(9): 129-134. DOI:10.16768/j.issn.1004-874X.2014.09.046 |
| [20] |
HUA G, CHEN J, WANG J, LI J, DENG X. Genetic basis of chicken plumage color in artificial population of complex epistasis[J]. Animal Genetics, 2021, 52: 656-666. DOI:10.1111/age.13094 |
| [21] |
SCHWOCHOW D, BORNELÖV S, JIANG T, LI J, GOURICHON D, BED'hOM B, DORSHORST B J, CHUONG C M, TIXIER-BOICHARD M, ANDERSSON L. The feather pattern autosomal barring in chicken is strongly associated with segregation at the MC1R locus[J]. Pigment Cell Melanoma Research, 2021, 34: 1015-1028. DOI:10.1111/pcmr.12975 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50