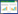文章信息
基金项目
- 国家重点研发计划项目(2022YFB3604603-01); 广东省农业科学院农业优势产业学科团队建设项目(202101TD); 广东省乡村振兴战略专项资金种业振兴项目(2022NPY00005); 国家水稻产业技术体系专项(CARS-01)
作者简介
-
刘迪林,博士,研究员,广东省农业科学院水稻研究所杂交水稻研究开发中心副主任,主要从事水稻遗传育种研究。近5年主持和参与国家自然科学基金、国家重点研发计划、省部级项目等10余项,在国内外期刊发表学术论文40余篇,参编著作1部;荣获广东省、江西省科技进步一等奖3项,广东省农业技术推广奖一等奖1项,获授权国家发明专利6件、软件著作权4项;作为主要完成人育成水稻新品种30个,获植物新品种权20余件。担任广东省遗传学会理事、国家水稻产业技术体系岗位科学家团队核心成员、广东海洋大学硕士生导师。
刘迪林(1981—),男,博士,研究员,研究方向为水稻分子育种,E-mail:dilin_liu@163.com.
通讯作者
- 柳武革(1974—),男,硕士,研究员,研究方向为水稻遗传育种,E-mail:liuwuge1974@163.com.
文章历史
- 收稿日期:2023-10-20
2. 华南农业大学农学院,广东 广州 510642
2. College of Agriculture, South China Agricultural University, Guangzhou 510642, China
据估计,未来30年全球人口将增长25%,达到100亿[1]。然而,水稻、小麦和玉米等主要农作物目前的增产速度无法满足未来的需求。在培育高产、营养、多抗、广适的作物新品种方面,植物育种家和作物科学家面临着巨大压力。以水稻为例,水稻是我国第一大口粮作物,是全国约60% 人口的主食,播种面积常年稳定在3 000万hm2左右,我国水稻播种面积和总产量分别居全球第2位和第1位。然而,近年来我国的粮食供需一直处于“紧平衡”状态,随着社会经济发展和人民生活水平的提高,对水稻的多元化需求也不断增加,亟需全面提高水稻产量和品质,提供功能多样化的品种,以满足“吃饱、吃好、吃得营养健康”的时代新需求。长期的生产和研究实践证明,品种改良是提高水稻产量、品质和抗性等特性最经济有效的手段。得益于遗传改良的进步,我国水稻产量曾发生两次质的飞跃[2],20世纪50年代末,黄耀祥等利用矮仔占这一矮秆资源,育成第一个大面积推广应用的半矮秆水稻品种广场矮,成功地开创了水稻矮化育种的先河,使水稻单产大幅度提升,引领了农业发展史上的“第一次绿色革命”;20世纪70年代,袁隆平等利用在海南崖县发现的野生稻花粉败育资源(简称“野败”),成功研发“三系法”杂交稻技术,实现杂交水稻的大面积应用,使水稻单产在矮化育种的基础上再增加10%~20%,被誉为农业发展史上的“第二次绿色革命”。水稻是典型的自花授粉作物,品种间杂交后需经多代自交、基因纯合和性状稳定后进行选择。依靠传统育种方法,审定一个水稻新品种可能需要7~8年,培育三系不育系一般需要10年以上。如此漫长的水稻育种过程,面对不断加剧的人口、耕地和水资源压力,越来越难以满足水稻生产对高产优质新品种和多元化品种的需要。如何有效加速水稻育种进程、缩短水稻的育种周期,一直是世界各国水稻遗传育种家们普遍关注的焦点问题,其中以缩短水稻繁育周期为核心的“快速育种”(Speed breeding)技术,是当前的研究重点之一,可能给水稻育种方式带来巨大变革。近些年来,全球水稻遗传育种家们在水稻快速育种研究方面取得了较多进展,然而国内外尚无该领域的研究综述报道。为促进水稻同行对水稻快速育种技术的了解、加快水稻快速育种技术的研究和应用,本文从作物快速育种技术的兴起、水稻快速育种的研究概况、水稻快速育种中的关键基因、影响水稻繁育周期的环境因素、快速育种与现代育种技术的融合等方面,系统梳理水稻快速育种的研究现状和进展,并对该领域面临的挑战及今后的重点方向进行讨论和展望。
1 作物快速育种技术的兴起2003年,“快速育种”这一概念由澳大利亚昆士兰大学的科学家们首先提出[1]。他们受到美国航天局(NASA)的太空生命支持系统的启发,将这一系统引入作物育种中,并建立了一套缩短小麦繁育周期、加快小麦育种进程的方法[1],后来又用于花生育种[3],在24 h连续光照、温度28~32 ℃的人工光温环境下,将花生的生育期从145 d缩短到89 d,1年繁殖4代。同时,昆士兰大学的科学家们与英国约翰·英纳斯中心(John Innes Centre,JIC)的同行开展合作研究,通过延长光照、调控温度、提前采收种子等综合技术措施,加快小麦、大麦等长日照作物的发育速度,大幅度缩短从播种到种子成熟的繁育周期,实现小麦、大麦、鹰嘴豆、豌豆等多种作物的一年6代种植和油菜的一年4代种植[4-5],引发强烈反响。
尽管2018年以来“快速育种”技术在全球范围得到广泛快速的传播,但是“快速育种”的理念和实践却远早于此。大约150年前,植物学家发现,植物可以在碳弧灯人工光下生长[6]。1930年,Arthur等[7]发现在持续光照下,蔬菜、谷物、杂草、草本和观赏植物等近百种植物的开花速度大部分得到加快。1939年,Coulden[8]就提出对水稻杂种世代进行加速世代进程的建议。目前,“快速育种”技术已被广泛应用于十字花科[9]、豆科[10-14]、禾本科[15-18]等多种作物的遗传育种研究,通过利用适宜的自然环境或人工创造作物快速发育所需的光温环境,叠加其他调控措施,在作物的加代纯合过程中发挥了重要作用。对水稻而言,由于其模式植物和重要粮食作物的重要地位,相关快速育种技术的研究也较多。
2 水稻快速育种的研究概况 2.1 水稻快速育种的早期探索我国海南、菲律宾、墨西哥、哥斯达黎加等多地具有真正意义的热带气候,光热资源丰富,可满足水稻等作物的周年生长。因此,利用自然条件进行水稻的异地快繁加代、加速水稻的世代进程,在国际上具有广泛的应用。例如,上世纪50年代后期,我国开始在海南岛利用冬季进行南繁加代。1961年,玉米育种家吴绍骙[19]提出利用南方天然光温条件加快作物种子繁殖的方法。到上世纪60年代末,除新疆、西藏外,大陆各省纷纷去海南岛南繁,其中水稻面积占南繁总面积的70% 以上[20]。南繁的应用使水稻育种周期缩短一半,极大地促进了杂交水稻的普及和应用。目前,全国有500多家单位在海南三亚等地建设了长期的南繁基地,常态化开展异地加代工作[21]。从全球来看,美国把低代材料送到中美洲的哥斯达黎加去加代。韩国在国际水稻研究所进行水稻加代研究,取得一年4代的显著成效[22]。1976年日本学者池桥宏[8]在国际水稻所对光周期敏感的水稻品种进行加代,一年可完成2~3个世代。1979年,广东省农业科学院水稻研究所柯苇等[23]提出水稻的“快速育种法”,采用广州晚造种植、海南冬育结合广州早造遮光的办法,在大田环境下实现了晚稻一年连续3代的种植。同年,日本农林水产省也与国际水稻研究所协作,在菲律宾对粳稻材料进行一年4代的加代,其中最短的世代仅用时67 d[22]。1982年,日本水稻育种家采用温室和大田试验相结合,1年完成2~3个世代,1985年育成著名的水稻品种日本晴[8],也是水稻基因组研究应用最广泛的参考基因组品种,此后相继通过温室或暖地加代育成丰锦雪光等多个知名水稻品种[24]。可见,水稻的快速育种方法在国内外均有一定的探索和应用。这些早期的水稻加代研究,以“暖地”的利用为显著特征,通过异地加代的方式充分利用了光温资源条件。
2.2 水稻快速育种技术的新进展随着现代设施农业技术的快速发展,以及水稻生物学机制研究的不断深入,人类控制环境和遗传改造的能力越来越强,水稻快速育种进入全新阶段。根据水稻生长发育的需要,可以通过全密闭植物工厂等现代设施进行环境因子的动态精准调控,加快营养生长向生殖生长的转变,显著缩短水稻的繁育周期,从而加速水稻育种进程。水稻快速育种的实质是将水稻材料置于特定的生态环境之中,诱导其早花、早熟,促进世代的快速完成,大幅度缩短生育期,实现一年多代繁育的目标[22]。表 1列举了国内外水稻加速育种的一些典型案例。总体上,高温、短日照、LED光配方、密植、少肥、干湿交替灌溉等成为加快水稻营养生长向生殖生长转换的主要措施[22, 25]。以Ohnishi等[26]创立的“人工气候箱育种体系(Biotron breeding system, BBS)”为例,该体系利用装备良好的人工气候箱,整合了密植、CO2调控、去除多余分蘖和胚挽救等调节措施。气候箱内大幅提高水稻种植密度,每个塑料盆规格为直径6 cm、高7 cm,盆内装150 mL水稻育苗营养土,单个气候箱内可种植70株水稻;气候箱内增施CO2,显著提高种子产量;为控制水稻植株生物量,在有限的空间、光照和养分供应条件下维持植株生长,仅保留主蘖,其余分蘖一律去除,成熟时仅收获1个稻穗;其余环境参数(如日照长度、温度和湿度)也作出相应调整。BBS法在较小的空间内实现了水稻的快速繁殖,取得良好结果,所有测试品种中以日本晴抽穗最早,播后50 d即实现抽穗开花。由于去除分蘖、胚挽救等环节工作量太大,不适合育种中大规模采用,Tanaka等[27]从更实用化的角度对BBS法进行简化,命名为sBBS(simplified BBS),在评估各单项调控措施抽穗效应的基础上,取消了去除分蘖和胚挽救步骤;应用sBBS法,日本晴在3个月内完成一个世代。
2023年,国际水稻研究所在水稻快速育种方法研发上取得重要突破,研发出水稻快速育种体系“SpeedFlower” [34],该体系基于在印度建立的快速育种设施平台SpeedBreed完成研发,对水稻生长的光谱、光强、光周期、温度、湿度、营养水平以及激素调控进行全面试验和优化,加速水稻的生长、开花和种子成熟,一年可实现籼稻和粳稻4~5代繁殖。研究表明,较高的红光/ 蓝光配比(R∶B > 2∶1)下,水稻营养生长阶段前15 d采用24 h长日照,可促进水稻提早开花;水稻生长后期,采用10 h短日照、昼夜温度32/30 ℃、相对湿度65% 和高光强(800 mol/m2·s),同样可以促进水稻早花,且开花期在52~60 d。此外,提早收获未成熟种子后进行赤霉素处理,种子灌浆成熟的天数可缩短一半。Kabade等[34]进一步采用198份水稻种质进行验证,结果表明水稻在58~71 d可完成一个生育周期,平均一年可繁育5.1~6.3代。按照以上繁育速度,“SpeedFlower”体系不但可以在水稻遗传研究中用于遗传分离群体的快速创制,加速水稻重要性状的基因定位和功能研究,还可以在水稻育种研究中为水稻性状改良和多基因聚合带来革命性变化,理论上最快在1年半左右完成一个完整的育种周期,从而显著提升水稻遗传改良效率,帮助水稻育种更好地应对气候变化和资源压力带来的挑战。
3 水稻快速育种中的关键基因 3.1 水稻抽穗期与光周期水稻的抽穗期长短既影响籽粒产量和品质,又影响其地域适应性,具有复杂的基因调控网络,受多种遗传因素和光温条件的共同影响。水稻在光温反应方面存在极其丰富的遗传变异,导致不同水稻品种之间在生育期性状方面产生丰富的遗传多样性,从而适应不同的光温环境[35]。目前,在水稻中定位了超过600个与生育期相关的QTL位点,已经克隆的重要生育期基因有几十个[36],这些是水稻快速育种中的重要靶基因。双子叶模式植物拟南芥主要有光周期途径、春化途径、赤霉素途径、自主开花途径、温度途径和年龄途径等6种开花调控途径[37],而在水稻中研究比较深入的是光周期途径。
通常认为,水稻抽穗期调控途径主要有OsGI-Hd1-Hd3a和Ghd7-Ehd1-Hd3a/RFT1两条,前者以Hd1为核心,是一条保守的信号通路,与拟南芥的GI-CO-FT途径具有高度同源性[38],而后者以Ehd1为核心,是水稻特有的抽穗期调控途径[39]。以上两条调控途径并非完全独立,而是通过蛋白复合物的形式协同互作,在水稻抽穗期调控途径网络中共同发挥作用。
3.2 水稻快速育种的关键基因及调控一般来说,光温介导的植物开花途径调控机制可以分为4步:光温信号的接收、生物节律钟的信号加工、特定输出基因的信号传递、以及花分生组织特征基因对信号的整合。每一步都由一组基因负责特定的信号传输。相应地,光温感受器也可以通过非生物钟依赖途径,将信号直接传递给下游的花时基因[40]。
水稻的OsGI-Hd1-Hd3a途径同时受到光感知和生物钟的调控,OsGI促进Hd1的表达,Hd1结合Hd3a的启动子并激活Hd3a表达[41]。Hd1是拟南芥CO基因在水稻中的同源基因,在水稻抽穗中具有双重作用,在短日照下促进水稻抽穗、长日照下抑制水稻抽穗,Hd1在长日照和短日照条件下的活性转变通过光敏色素介导的信号转导途径来实现[42]。水稻中的光敏色素由OsPHYA、OsPHYB和OsPHYC等3个基因编码[43], 均可与下游信号中间体直接互作,调节下游基因表达和生理反应,影响成花诱导。
在水稻的Ghd7-Ehd1-Hd3a/RFT1途径中,Ghd7和Ehd1均为水稻特有,在拟南芥基因组中未发现同源基因。其中Ghd7编码一个CCT蛋白,在长日照条件下表达增强,是水稻在长日照条件下的核心开花抑制子[39],长日照条件下,Ghd7抑制Ehd1、Hd3a和RFT1等下游基因的表达,进而推迟抽穗期[44];Ehd1编码一个B型反应调节蛋白,通过激活Hd3a和RFT1的转录,诱导开花[45]。Ehd1和Ghd7的表达均受光敏色素和隐花色素响应生物节律的影响,二者在叶片中感知光周期信号,并通过Hd3a和RFT1蛋白组成的成花素长距离传递到茎尖分生组织,进而刺激水稻花器官生殖发育[45]。光敏色素蛋白OsPHYA和OsPHYB可直接与Ghd7相互作用,而OsPHYC不能与Ghd7互作。在osphyb突变体中,Ghd7的蛋白丰度显著降低[44],表明Ghd7蛋白的稳定性部分依赖于光敏色素。
水稻快速育种涉及的抽穗期调控基因还包括DTH8、OsPRR37等。DTH8和Ghd7均可与Hd1蛋白互作形成复合物,在长日照条件下,通过下调Ehd1和Hd3a/RFT1,共同抑制水稻抽穗[46]。Ghd8/DTH8/LHD1编码一个CCAAT盒结合因子,又被称为OsNF-YB11,长日照条件下通过抑制Ehd1和Hd3a的表达阻止水稻开花。Hd1、DTH8和OsNFYC7可以形成三聚体,Ghd7或OsPRR37也可以与DTH8、OsNFYC1形成三聚体复合物[47]。Ghd7、Hd1和DTH8的不同等位基因组合在调控水稻的日长感应中发挥重要作用,同时控制水稻在不同纬度的分布[48]。OsPRR37属于PRRs家族,是水稻中主要的长日照开花抑制子,通过抑制Ehd1的表达进而抑制水稻成花素Hd3a和RFT1的表达,或者直接下调Hd3a的表达,从而影响水稻抽穗[49]。OsPRR37受光敏色素B(PhyB)的调控,osphyb突变体中OsPRR37的表达水平大幅下降,这种下调和日照长短无关[50]。值得注意的是,OsPRR37和Ghd7在长日照条件下的开花抑制效应是加性的,二者可以协同作用共同抑制Ehd1的表达从而延迟抽穗[51]。
尽管水稻中的抽穗期调控网络复杂,但是,这些信号通路最终都通过Hd3a和Ehd1的表达进行汇合,受DTH8-Hd1和Ghd7-Hd1蛋白复合体的调控[52]。RFT1和Hd3a是同源蛋白,相似度高达90% 以上,分别是水稻在短日照和长日照行使主要功能的成花素[53],在叶片感知光周期等信号后,二者通过与14-3-3蛋白、OsFD1蛋白逐步形成异源六聚体,产生长距离信号(成花素)通过韧皮部传递到茎尖分生组织,刺激水稻花器官生殖发育,诱导成花[46, 54]。通过对上述重要基因的调控,是实现水稻生育期调控和快速育种的遗传基础,部分核心基因见表 2。
4 影响水稻生长周期的环境因素 4.1 光照
影响水稻生长周期的环境因素包括光周期、光质、温度、养分、水分等。光周期是影响水稻生长、发育、开花和结实的重要因素[35]。作为短日照植物,水稻通过对光周期长度的感应,实现从营养生长向生殖生长的转变,完成开花结实。可能诱导开花的最大限度的日长称为临界日长。通常,要求光周期低于临界日长水稻才能开花。由于遗传组成的不同,不同水稻品种对光周期变化的生理反应存在差异。例如,早稻品种、中稻品种和晚稻品种对光周期的敏感性存在差异[59]。通常早稻和中稻的感光性弱,晚稻感光性强,尤其是晚稻中的迟熟品种感光性最强。
光质在水稻的生长发育过程中也发挥重要作用。水稻体内存在的光感受器受到光质的调节,进而影响水稻开花。研究表明,红光(R)和蓝光(B)的比例、以及红光和远红光(FR)的比例对作物开花至关重要,600~700 nm的红光波长包含了叶绿素的吸收峰660 nm,可以有效促进光合作用,400~500 nm的蓝光波长则影响植物向光性、气孔开放和幼苗生长。光敏色素存在远红光吸收型(Pfr)和红光吸收型(Pr)两种形式,当R/FR比例较低时,光敏色素从Pfr形式转化为Pr形式,相反地,当R/FR比例升高时,光敏色素从Pr形式转化为Pfr形式,这一可逆转换参与对水稻开花的调控。研究发现,适当提高远红光比例可使某些水稻品种的花期提早20 d[32]。
4.2 温度水稻品种抽穗期由感光性、感温性和基本营养生长性共同决定[59]。因此,温度也是影响水稻发育进程的核心因素之一。水稻品种对温度的响应模式大致相同,生长速率随着温度的升高而增加,营养生长阶段比生殖生长阶段需要更高的温度。水稻萌发所需的温度在12~30 ℃,而水稻生长、开花和灌浆的最佳温度在25~30 ℃。水稻生殖生长阶段对高温敏感,花粉活力显著下降,造成结实率下降。因此在水稻抽穗前,可以使用较高温度加速水稻的营养生长,在生殖生长阶段保持较低的温度,维持花粉活力。研究发现,水稻在低温和高温下,生育进程存在显著差异。就感温性而言,早稻一般比较弱,晚稻在自然条件和短日照下的感温性强。
4.3 逆境及其他因素逆境诱导开花(Stress-induced flowering)是植物中一种新的开花反应类型,和已经发现的6种开花途径不同[60],因此逆境胁迫也是影响水稻抽穗开花的重要因素。现有研究表明,多种胁迫因子均能诱导植物开花,包括高/低光强、紫外线、高/低温、营养不良、缺氮、干旱、低氧、拥挤、修剪根系和机械刺激等[60]。通常,氮肥增加会延缓水稻从营养生长向生殖生长的转变,使得营养生长过于旺盛、分蘖增多,造成水稻贪青晚熟现象。但实际上氮素对水稻抽穗开花的影响十分复杂,氮素过少和过多均会抑制开花[61]。CO2是水稻光合作用的主要碳源,高浓度CO2可以促进水稻生长和生殖,而低浓度CO2可能由于碳源不足而降低生长和繁殖产量[4]。例如,水稻光合效率随着CO2浓度的增加而增加,生物量增加、花期提前。高浓度CO2可加快水稻的开花进程,3个月内完成水稻的生育期,实现一年4代的繁育[26-27]。此外,旱直播、密植、控水、控蘖、矮化处理等多种栽培措施,也会通过影响光温环境和养分供应分配,间接影响水稻的生育进程,缩短水稻生育周期[30]。
5 水稻快速育种技术与现代育种技术的融合 5.1 现代育种技术的融合快速育种作为一个有效的育种工具,对缩短作物繁育周期、加快世代更替具有显著作用。就作物高效育种技术体系而言,快速育种技术如果能与其他现代作物育种技术紧密融合可能发挥更大的作用,如基因编辑、基因组选择、高通量表型技术及高通量基因分型技术等可与快速育种技术协同发力。这种协同和融合不仅能充分利用各种技术的优势,还有助于建立一个多功能的育种技术体系,推动现代植物育种和作物改良创新发展,广泛用于作图群体构建、多性状聚合、基因鉴定、突变体分析、遗传转化等方面,最终在全球气候变化背景下有效提升作物改良的速度和规模,满足全球人口不断增长带来的粮食需求[16]。以生育期改良为例,由于目前已经克隆出大量水稻生育期相关基因,可以对生育期基因进行不同形式的编辑,创制超短生育期(50~60 d)的水稻品种,再叠加快速育种技术从而实现加速育种,最后通过基因编辑将超短生育期品种恢复到正常生育期。
5.2 快速育种技术的应用低成本高通量基因分型技术的发展为基因组辅助育种的普及打开了大门。目前,高通量基因分型技术在作物遗传改良中得到广泛应用。育种家可以通过精准的基因功能标记对重要目标性状或关键基因进行有效的前景选择,利用高通量分子标记对背景进行筛选或者开展全基因组选择育种。虽然这些方法已经逐渐获得应用,但是时间仍然是获得大量基因重组和优异等位变异组合的主要限制因素。作物完成“从种子到种子”的完整生育世代和进行杂交所需的时间成为刚性约束。在现代育种中,低世代选择在某种程度上依靠基因型即可完成,对表型的田间选择可以在高世代进行,因此快速育种技术的创新尤为重要,可以有效缩短育种材料早期纯合的过程。国内科学家已将植物工厂用于多倍体水稻的改良,融合水稻高密度全基因组SNP芯片技术、组织培养等技术,实现一年3~4代的加代快繁[31]。当前,快速育种技术已广泛用于长日照、日中性和短日照等各类作物的育种加速[16]。得益于现代设施农业尤其是植物工厂产业的高速发展,育种家对作物生长环境的调控日益简单、精准和智能。通过优化日照长度、光强、光质、温度等,结合种子提前采收和CO2施肥等措施,从而促进作物生物量的快速积累,实现提早开花和种子繁殖[16]。为提高节水抗旱稻的育种效率,上海农业生物基因研究中心罗利军团队[62]研发了工厂化育种体系,通过优化育种工厂中的环境因子确保水稻材料加代不受自然条件的限制,在短日照等方法的处理下,实现育种材料3~4代/年的加代频率,并结合快速育种技术和功能标记技术,培育了早熟、抗稻瘟病、高产优质的节水抗旱稻品种沪旱106,该品种于2020年通过上海市农作物品种审定委员会审定(沪审稻2020011)。在该体系中,育种材料F3~F6代的快速加代以及功能基因选择在育种工厂体系中进行,而稻瘟病抗性、产量和品质等表型鉴定均通过大田种植完成。类似地,快速育种技术也与SNP标记选择、基因组测序相结合,被用于耐盐水稻新品系的培育,在17个月的时间里完成6个世代的繁育,实现耐盐基因hst1向高产品种Yukinko-mai的精准导入,获得的BC3F3代材料YNU31-2-4与野生型的遗传相似度达93.5%,田间表征表明该品种CO2同化速率提高、生殖生长期盐分胁迫导致的产量损失有所降低[63]。
传统的水稻大田繁殖受季节性光温变化的限制,一年只能繁育1~2代。相较而言,利用植物工厂环境进行水稻育种材料的繁殖加代可以显著缩短育种周期、提高选择效率,不依赖日长、温度、降雨等环境和气候的季节变化,可在任一季节开展,一年多代周年繁殖,优势十分明显,是提升传统育种体系的有效工具。粗略估计,快速育种的效率可比传统育种方法提升1~3倍,而且由于快速育种可全部在室内进行,经济、省力,有望在欠发达地区也广泛采用。部分种质可在小空间内高度密植,对大规模的群体筛选尤其有效。
6 发展快速育种技术面临的主要挑战 6.1 设施与配套支持快速育种技术需要适当的基础设施、专业知识、有效的植物表型组学设施和持续的研发经费支持。用于快速育种的植物工厂造价相对高昂,而普通温室大棚在环境调控能力方面有所欠缺,很多农业科研单位尤其是欠发达地区的单位普遍缺乏用于快速育种的现代设施,这些是快速育种技术面临的现实问题。要实现上述配套资源的保障到位,需要对快速育种技术进行更有效的研发和应用,利用成功案例进行广泛、令人信服的宣传示范,使各级政府、行业专家、相关企业及社会公众对该技术的认识不断加深,充分了解快速育种技术在促进传统育种、分子标记辅助选择、智能育种和生物工程育种等方面的潜力和作用。
6.2 跨学科人才支撑快速育种需要跨学科的知识和人才支撑。相关专家和技术人员的缺乏,是快速育种技术发展的另一挑战。由于学科的条块分割,设施环境管理人才一般通过设施农业专业培养,他们熟悉设施构造、性能和环境智能调控,但未必熟悉作物生理;作物栽培人才一般通过农学专业培养,他们熟悉作物栽培,但未必熟悉育种;作物育种人才一般通过作物遗传育种专业培养,他们熟悉作物育种流程和育种方法,但对设施环境管理和农艺栽培不够了解。能整合设施环境、农艺和作物育种的人才仍然十分稀少。
6.3 潜在的负面效应由于光周期敏感性不同,快速育种技术在短日照作物上的应用成效不如长日照作物或日中性作物显著。目前,仅大豆、水稻、苋菜等少数几种短日照作物在快速育种上取得进展[32]。光照时间延长后,可能导致作物萎蔫、坏死、生物量下降等生长发育的负面效应。在全封闭的植物工厂环境内,尤其是水培条件下的高温高湿环境,往往也存在诱发病虫害爆发的风险。在快速发育过程中,作物难以像大田环境下一样充分表现其农艺特性和生产潜力,因此快速育种的选择效果受到影响,难以根据育种目标对产量、品质、适应性等复杂性状进行全面有效的筛选[63-64]。由于作物在育种工厂内难以充分展现其全部特性,快速育种技术的成功应用仍然高度依赖田间的生产试验评价。作物快速育种技术需要与大田生产评价紧密结合,其中快速育种技术主要是通过加速世代进程实现水稻材料快速纯合、获得遗传稳定的新品系,大田生产评价则确保水稻农艺性状的真实表达和表型准确选择。
7 结语与展望水稻作为人类最重要的粮食作物之一,其高产稳产与粮食安全和经济发展密切相关,关乎社会稳定和国家长治久安。为满足未来对水稻优质高效生产和多元化水稻产品的需求,需要不断研发新技术,并将新技术融入水稻新品种培育实践中,为水稻产业的高质量发展提供强大的科技支撑。快速育种技术具有多学科交叉的特点,需要多学科领域的通力合作。无论是短日照作物还是长日照作物,快速育种技术的研究和应用都在如火如荼地开展,并取得十分显著的效果。以国际水稻研究所SpeedFlower为代表的水稻快速育种技术方案,理论上能实现一年5~6代的繁育速度,展现了惊人的育种加速能力,具有巨大应用潜力。在国内,中国农业科学院都市农业研究所利用植物工厂,也在部分水稻品种上实现60 d收获的快繁加代。纵观国内水稻育种单位,大多处于快速育种的探索阶段,陆续在搭建快速育种所需的人工气候室或智能植物工厂等平台设施,逐步建立快速育种技术体系,离规模化、常规化和高效化应用于水稻育种尚有一定的差距。
我们相信,水稻快速育种技术将在国内外育种界获得广泛应用。从技术研发和推广应用角度,今后的重点为一方面要积极研发适合不同光温反应类型水稻的快速育种技术,建立与不同熟期水稻品种匹配的环境干预方案和育种筛选程序;另一方面要广泛争取支持,完成相关基础设施的布局和普及,并将快速育种技术方案与分子标记辅助选择、基因编辑、基因组辅助育种、基因组选择等现代育种技术进行有机融合,形成系统解决方案,真正提高水稻育种效率,为突破性品种培育和多元化水稻产品开发提供技术支撑,促进粮食安全和营养安全,保障农业生产的可持续发展。
| [1] |
HICKEY L T, HAFEEZ A N, ROBINSON H, JACKSON S A, LEALBERTIOLI S C M, TESTER M, GAO C, GODWIN I D, HAYES B J, WULFF B B H. Breeding crops to feed 10 billion[J]. Nature Biotechnology, 2019, 37(7): 744-754. DOI:10.1038/s41587-019-0152-9 |
| [2] |
郭韬, 余泓, 邱杰, 李家洋, 韩斌, 林鸿宣. 中国水稻遗传学研究进展与分子设计育种[J]. 中国科学: 生命科学, 2019, 49(10): 1185-1212. DOI:10.1360/SSV-2019-0209 GUO T, YU H, QIU J, LI J Y, HAN B, LIN H X. Advances in rice genetics and breeding by molecular design in China[J]. Scientia Sinica (Vitae), 2019, 49: 1185-1212. DOI:10.1360/SSV-2019-0209 |
| [3] |
O'CONNOR D J, WRIGHT G C, DIETERS M J. Development and application of speed breeding technologies in a commercial peanut breeding program[J]. Peanut Science, 2013, 40: 107-114. DOI:10.3146/PS12-12.1 |
| [4] |
GHOSH S, WATSON A, GONZALEZ-NAVARRO O E, RAMIREZ-GONZALEZ R H, YANES L, MENDOZA-SUÁREZ M, SIMMONDS J, WELLS R, RAYNER T, GREEN P, HAFEEZ A, HAYTA S, MELTON R E, STEED A, SARKAR A, CARTER J, PERKINS L, LORD J, TESTER M, OSBOURN A, MOSCOU M J, NICHOLSON P, HARWOOD W, MARTIN C, DOMONEY C, UAUY C, HAZARD B, WULFF B B H, HICKEY L T. Speed breeding in growth chambers and glasshouses for crop breeding and model plant research[J]. Nature Protocols, 2018, 13(12): 2944-2963. DOI:10.1038/s41596-018-0072-z |
| [5] |
WATSON A, GHOSH S, WILLIAMS M J, CUDDY W S, SIMMONDS J, REY M D, HATTA M S M, HINCHLIFFE A, STEED A, REYNOLDS D, ADAMSKI N M, BREAKSPEAR A, KOROLEV A, RAYNER T, DIXON L E, RIAZ A, MARTIN W, RYAN M, EDWARDS D, BATLEY J, RAMAN H, CARTER J, ROGERS C, DOMONEY C, MOORE G, HARWOOD W, NICHOLSON P, DIETERS M J, DELACY I H, ZHOU J, UAUY C, BODEN S A, PARK R F, WULFF B B H, HICKEY L T. Speed breeding is a powerful tool to accelerate crop research and breeding[J]. Nature Plants, 2018, 4(1): 23-29. DOI:10.1038/s41477-017-0083-8 |
| [6] |
PFEIFFER N E. Microchemical and morphological studies of effect of light on plants[J]. Botanical Gazette, 1926, 81: 173-195. DOI:10.1086/333584 |
| [7] |
ARTHUR J M, GUTHRIE J D, NEWELL J M. Some effects of artificial climates on the growth and chemical composition of plants[J]. American Journal of Botany, 1930, 17: 416-482. DOI:10.1002/J.1537-2197.1930.TB09557.X |
| [8] |
朴京姬. 寒地水稻利用日光温室加代技术及应用前景[J]. 黑龙江农业科学, 1994(1): 42-43. PU J J. The generation advancement technology in cold land rice utilizing solar greenhouse and its application prospects[J]. Heilongjiang Agricultural Sciences, 1994(1): 42-43. |
| [9] |
YAO Y, ZHANG P, WANG H B, LU Z Y, LIU C J, LIU H, YAN G J. How to advance up to seven generations of canola (Brassica napus L.) per annum for the production of pure line populations?[J]. Euphytica, 2016, 209(1): 113-119. DOI:10.1007/s10681-016-1643-0 |
| [10] |
EDET O U, ISHII T. Cowpea speed breeding using regulated growth chamber conditions and seeds of oven-dried immature pods potentially accommodates eight generations per year[J]. Plant Methods, 2022, 18(1). DOI:10.1186/s13007-022-00938-3 |
| [11] |
SAMINENI S, SEN M, SAJJA S B, GAUR P M. Rapid generation advance (RGA) in chickpea to produce up to seven generations per year and enable speed breeding[J]. Crop Journal, 2020, 8(1): 164-169. DOI:10.1016/j.cj.2019.08.003 |
| [12] |
MOBINI S, KHAZAEI H, WARKENTIN T D, VANDENBERG A. Shortening the generation cycle in faba bean (Vicia faba) by application of cytokinin and cold stress to assist speed breeding[J]. Plant Breeding, 2020, 139(6): 1181-1189. DOI:10.1111/pbr.12868 |
| [13] |
SAXENA K B, SAXENA R K, HICKEY L T, VARSHNEY R K. Can a speed breeding approach accelerate genetic gain in pigeonpea?[J]. Euphytica, 2019, 215(12): 202. DOI:10.1007/s10681-019-2520-4 |
| [14] |
OCHAT T S J, SANGWAN R S, MARGET P, NDONG Y A, RANCILLAC M, PERNEY P, RöBBELEN G. New approaches towards the shortening of generation cycles for faster breeding of protein legumeshh[J]. Plant Breeding, 2002, 121(5): 436-440. DOI:10.1046/j.1439-0523.2002.746803.x |
| [15] |
CHA J K, PARK H, CHOI C, KWON Y, LEE S M, OH K W, KO J M, KWON S W, LEE J H. Acceleration of wheat breeding: enhancing efficiency and practical application of the speed breeding system[J]. Plant Methods, 2023, 19(1). DOI:10.1186/s13007-023-01083-1 |
| [16] |
SONG Y, DUAN X, WANG P, LI X, YUAN X, WANG Z, WAN L, YANG G, HONG D. Comprehensive speed breeding: a high-throughput and rapid generation system for long-day crops[J]. Plant Biotechnology Journal, 2022, 20(1): 13-15. DOI:10.1111/pbi.13726 |
| [17] |
WATSON A, HICKEY L T, CHRISTOPHER J, RUTKOSKI J, POLAND J, HAYES B J. Multivariate genomic selection and potential of rapid indirect selection with speed breeding in spring wheat[J]. Crop Science, 2019, 59(5): 1945-1959. DOI:10.2135/cropsci2018.12.0757 |
| [18] |
ALAHMAD S, DINGLASAN E, LEUNG KM, RIAZ A, DERBAL N, VOSS-FELS K P, ABLE J A, BASSI F M, CHRISTOPHER J, HICKEY L T. Speed breeding for multiple quantitative traits in durum wheat[J]. Plant Methods, 2018, 14. DOI:10.1186/s13007-018-0302-y |
| [19] |
吴绍骙. 异地培育玉米自交系在生产上利用可能性的研究[J]. 河南农学院学报, 1961(1): 16-40. DOI:10.16445/j.cnki.1000-2340.1961.01.002 WU S K. Studies on the possibility of utilizing maize inbred lines in production by ex situ breeding[J]. Journal of Henan Agricultural College, 1961(1): 16-40. DOI:10.16445/j.cnki.1000-2340.1961.01.002 |
| [20] |
李心岩. 关于水稻南繁问题的讨探[J]. 种子世界, 1989(4): 24-26. LI X Y. Discussion on the southern propagation of rice[J]. Seed World, 1989(4): 24-26. |
| [21] |
吕青, 柯用春, 何志军. 南繁制种水稻基地现状以及问题分析[J]. 农村经济与科技, 2017, 2018(20): 24-25. LYU Q, KE Y C, HE Z J. Analysis of the current situation and problems of rice bases for southern propagation and seed production[J]. Rural Economy and Technology, 2017, 2018(20): 24-25. |
| [22] |
阙更生. 水稻育种的世代促进法[J]. 作物杂志, 1986(3): 29-31. QUE G S. The method of generation advancement in rice breeding[J]. Crops, 1986(3): 29-31. |
| [23] |
柯苇, 徐炎康, 罗仲强, 赵丽霞, 李永兴. 晚稻一年三代快速育种法[J]. 广东农业科学, 1982(5): 12-15. DOI:10.16768/j.issn.1004-874X.1982.05.004 KE W, XU Y K, LUO Z Q, ZHAO L X, LI Y X. Speed breeding of late-season rice for three generation in one year[J]. Guangdong Agricultural Sciences, 1982(5): 12-15. DOI:10.16768/j.issn.1004-874X.1982.05.004 |
| [24] |
[日]石坂助. 世代促进による育种年限の短缩[J]. 农业技术, 1990, 45(2): 88-93. ISHIZAKA S. Shortening the breeding cycles by generation advancement[J]. Agricultural Technology, 1990, 45(2): 88-93. |
| [25] |
张启星, 刘国庆, 王秀萍, 王永新, 刘善资, 刘亚琴, 孙宇. 温室加速水稻世代进程研究[J]. 河北农业技术师范学院学报, 1997(3): 20-25. ZHANG Q X, LIU G Q, WANG X P, WANG Y S, LIU S Z, LIU Y Q, SUN Y. Study on shortening rice breeding cycle by using greenhouse[J]. Journal of Hebei Normal University of Science & Technology, 1997(3): 20-25. |
| [26] |
OHNISHI T, YOSHINO M, YAMAKAWA H, KINOSHITA T. The biotron breeding system: a rapid and reliable procedure for genetic studies and breeding in rice[J]. Plant and Cell Physiology, 2011, 52(7): 1249-1257. DOI:10.1093/pcp/pcr066 |
| [27] |
TANAKA J, HAYASHI T, IWATA H. A practical, rapid generation-advancement system for rice breeding using simplified biotron breeding system[J]. Breeding Science, 2016, 66(4): 542-551. DOI:10.1270/jsbbs.15038 |
| [28] |
王秀萍, 张启星, 刘国庆, 王永新, 刘善资, 刘亚琴, 张军远. 温室加速水稻世代进程栽培技术研究[J]. 河北农业科学, 1995(3): 17-19. DOI:10.16318/j.cnki.hbnykx.1995.03.006 WANG X P, ZHANG Q X, LIU G Q, WANG Y X, LIU S Z, LIU Y Q, ZHANG J Y. Study on greenhouse cultivation technology for rice generation advancement[J]. Journal of Hebei Agricultural Sciences, 1995(3): 17-19. DOI:10.16318/j.cnki.hbnykx.1995.03.006 |
| [29] |
COLLARD B C Y, BEREDO J C, LENAERTS B, MENDOZA R, SANTELICES R, LOPENA V, VERDEPRADO H, RAGHAVAN C, GREGORIO G B, VIAL L, DEMON T M, BISWAS P S, IFTEKHARUDDAULA K M, RAHMAN M A, COBB J N, ISLAM M R. Revisiting rice breeding methods-evaluating the use of rapid generation advance (RGA) for routine rice breeding[J]. Plant Production Science, 2017, 20(4): 337-352. DOI:10.1080/1343943X.2017.1391705 |
| [30] |
唐力琼, 王新华, 熊怀阳, 韩义胜, 王效宁. 水稻育种材料一年四代快速加代繁殖技术[J]. 农业与技术, 2018, 38(1): 1-2. TANG L Q, WANG X H, XIONG H Y, HAN Y S, WANG X N. Rapid generation advancement propogation technology of four generation in one year for rice breeding materials[J]. Agriculture and Technology, 2018, 38(1): 1-2. |
| [31] |
隗志松, 舒园园, 蔡得田, 刘育华, 王庆飞, 王群, 马雪寒. 智能育种工厂在多倍体水稻育种中的应用[J]. 湖北农业科学, 2021, 60(18): 21-25. DOI:10.14088/j.cnki.issn0439-8114.2021.18.005 WEI Z S, SHU Y Y, CAI D T, LIU Y H, WANG Q F, WANG Q, MA X H. Application of intelligent breeding plant in polyploid rice breeding[J]. Hubei Agricultural Sciences, 2021, 60(18): 21-25. DOI:10.14088/j.cnki.issn0439-8114.2021.18.005 |
| [32] |
JÄHNE F, HAHN V, WÜRSCHUM T, LEISER WL. Speed breeding short-day crops by LED-controlled light schemes[J]. Theoretical and Applied Genetics, 2020, 133(8): 2335-2342. DOI:10.1007/s00122-020-03601-4 |
| [33] |
仇泽宇, 唐兆成, 凌溪铁, 张保龙. 一种促进水稻快速加代的方法[P]. 202310335170.4, 2023. CHOU Z Y, TANG Z C, LING X T, ZHANG B L. A method for rapid generation advancement of rice[P]. 202310335170.4, 2023. |
| [34] |
KABADE P G, DIXIT S, SINGH U M, ALAM S, BHOSALE S, KUMAR S, SINGH S K, BADRI J, VARMA N R G, CHETIA S, SINGH R, PRADHAN S K, BANERJEE S, DESHMUKH R, SINGH S P, KALIA S, SHARMA T R, SINGH S, BHARDWAJ H, KOHLI A, KUMAR A, SINHA P, SINGH V K. SpeedFlower: A comprehensive speed breeding protocol for indica and japonica rice[J]. Plant Biotechnology Journal, 2023. DOI:10.1111/pbi.14245 |
| [35] |
丁颖. 水稻品种与日长等环境条件的生态关系[J]. 作物学报, 1962(4): 1-6. DING Y. Ecological relationships between rice varieties and environmental conditions such as day length[J]. Acta Agronomica Sinica, 1962(4): 1-6. |
| [36] |
王婧莹, 赵广欣, 邱冠凯, 方军. 水稻抽穗期途径基因的磷酸化、泛素化研究进展[J]. 中国水稻科学, 2022, 36(3): 215-226. DOI:10.16819/j.1001-7216.2022.210707 WANG J Y, ZHAO G X, QIU G K, FANG J. Advances in research on the modification of the heading date genes in rice by phosphorylation and ubiquitination pathways[J]. Chinese Journal of Rice Science, 2022, 36(3): 215-226. DOI:10.16819/j.1001-7216.2022.210707 |
| [37] |
FORNARA F A, DE MONTAIGU A G C. SnapShot: Control of flowering in Arabidopsis[J]. Cell, 2010, 141: 550. DOI:10.1016/j.cell.2010.04.024 |
| [38] |
HAYAMA R, YOKOI S, TAMAKI S, MASAHIRO Y S K. Adaptation of photoperiodic control pathways produces short-day flowering in rice[J]. Nature, 2003, 422: 719-722. DOI:10.1038/nature01549 |
| [39] |
XUE W Y, XING Y Z, WENG X Y, ZHAO Y, TANG W J, WANG L, ZHOU H J, YU S B, XU C G, LI X H, ZHANG Q F. Natural variation in Ghd7 is an important regulator of heading date and yield potential in rice[J]. Nature Genetics, 2008, 40(6): 761-767. DOI:10.1038/ng.143 |
| [40] |
CAO S, LUO X, XU D, TIAN X, SONG J, XIA X, CHU C, HE Z. Genetic architecture underlying light and temperature mediated flowering in Arabidopsis, rice, and temperate cereals[J]. New Phytologist, 2021, 230(5): 1731-1745. DOI:10.1111/nph.17276 |
| [41] |
HAYAMA R, IZAWA T. Isolation of rice genes possibly involved in the photoperiodic control of flowering by a fluorescent differential display method[J]. Plant Cell Physiology, 2002(43): 494-504. DOI:10.1093/pcp/pcf059 |
| [42] |
YANO M, KATAYOSE Y, ASHIKARI M, YAMANOUCHI U, MONNA L, FUSE T, BABA T, YAMAMOTO K, UMEHARA Y, NAGAMURA Y. Hd1, a major photoperiod sensitivity quantitative trait locus in rice, is closely related to the Arabidopsis flowering time gene CONSTANS[J]. Plant Cell, 2001, 12: 2473-2484. DOI:10.1105/tpc.12.12.2473 |
| [43] |
KAY S A, KEITH B, SHINOZAKI K. The sequence of the rice phytochrome gene[J]. Nucleic Acids Research, 1989, 17(7): 2865-2866. DOI:10.1093/nar/17.7.2865 |
| [44] |
WENG X Y, WANG L, WANG J, HU Y, DU H, XU C G, XING Y Z, LI X H, XIAO J H, ZHANG Q F. Grain number, plant height, and heading date7 is a central regulator of growth, development, and stress response[J]. Plant Physiology, 2014, 164(2): 735-747. DOI:10.1104/pp.113.231308 |
| [45] |
DOI K, IZAWA T, FUSE T, YAMANOUCHI U, KUBO T, SHIMATANI Z, YANO M, YOSHIMURA A. Ehd1, a B-type response regulator in rice, confers short-day promotion of flowering and controls FT-Iike gene expression independently of Hd1[J]. Genes & Development, 2004, 18(8): 926-936. DOI:10.1101/gad.1189604 |
| [46] |
DU A P, TIAN W, WEI M H, YAN W, HE H, ZHOU D, HUANG X, LI S G, OUYANG X H. The DTH8-Hd1 module mediates day-length-dependent regulation of rice flowering[J]. Molecular Plant, 2017, 10(7): 948-961. DOI:10.1016/j.molp.2017.05.006 |
| [47] |
SHEN C C, LIU H Y, GUAN Z Y, YAN J J, ZHENG T, YAN W H, WU C Y, ZHANG Q F, YIN P, XING Y Z. Structural insight into DNA recognition by CCT/NF-YB/YC complexes in plant photoperiodic flowering[J]. Plant Cell, 2020, 32(11): 3469-3484. DOI:10.1105/tpc.20.00067 |
| [48] |
QIU L L, WU Q Q, WANG X Y, HAN J P, ZHUANG G, WANG H, SHANG Z Y, TIAN W, CHEN Z, LIN Z C, HE H, HU J, LYU Q M, REN J S, XU J, LI C, WANG X F, LI Y, LI S H, HUANG R Y, CHEN X, ZHANG C, LU M, LIANG C Z, QIN P, HUANG X, LI S G, OUYANG X H. Forecasting rice latitude adaptation through a daylength-sensing-based environment adaptation simulator[J]. Nature Food, 2021, 2(5): 348-362. DOI:10.1038/s43016-021-00280-2 |
| [49] |
KOO B H, YOO S C, PARK J W, KWON C T, LEE B D, AN G, ZHANG Z Y, LI J J, LI Z C, PAEK N C. Natural variation in OsPRR37 regulates heading date and contributes to rice cultivation at a wide range of latitudes[J]. Molecular Plant, 2013, 6(6): 1877-1888. DOI:10.1093/mp/sst088 |
| [50] |
GAO H, JIN M N, ZHENG X M, CHEN J, YUAN D Y, XIN Y Y, WANG M Q, HUANG D Y, ZHANG Z, ZHOU K N, SHENG P K, MA J, MA W W, DENG H F, JIANG L, LIU S J, WANG H Y, WU CY, YUAN L P, WAN J M. Days to heading 7, a major quantitative locus determining photoperiod sensitivity and regional adaptation in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(46): 16337-16342. DOI:10.1073/pnas.1418204111 |
| [51] |
LI X F, LIU H Z, WANG M Q, LIU H L, TIAN X J, ZHOU W J, LÜ T X, WANG Z Y, CHU C C, FANG J, BU Q Y. Combinations of Hd2 and Hd4 genes determine rice adaptability to Heilongjiang Province, northern limit of China[J]. Journal of Integrative Plant Biology, 2015, 57: 698-707. DOI:10.1111/jipb.12326 |
| [52] |
ZHANG Z Y, HU W, SHEN G J, LIU HY, HU Y, ZHOU X C, LIU T M, XING Y Z. Alternative functions of Hd1 in repressing or promoting heading are determined by Ghd7 status under long-day conditions[J]. Scientifi c Reports, 2017, 7: 5388. DOI:10.1038/s41598-017-05873-1 |
| [53] |
KOMIYA R, IKEGAMI A, TAMAKI S, YOKOI S. Hd3a and RFT1 are essential for flowering in rice[J]. Development, 2008, 135: 767-774. DOI:10.1242/dev.008631 |
| [54] |
TAOKA K, OHKI I, TSUJI H, FURUITA K, HAYASHI K, YANASE T, YAMAGUCHI M, NAKASHIMA C, PURWESTRI Y A, TAMAKI S, OGAKI Y, SHIMADA C, NAKAGAWA A, KOJIMA C. 14-3-3 proteins act as intracellular receptors for rice Hd3a florigen[J]. Nature, 2011, 476: 332-335. DOI:10.1038/nature10272 |
| [55] |
ISHIKAWA R, AOKI M, KUROTANI K, YOKOI S, SHINOMURA T, TAKANO M, SHIMAMOTO K. Phytochrome B regulates Heading date 1 (Hd1)-mediated expression of rice florigen Hd3a and critical day length in rice[J]. Molecular Genetics and Genomics, 2011, 285(6): 461-470. DOI:10.1007/s00438-011-0621-4 |
| [56] |
MONNA L, KITAZAWA N, YOSHINO R, SUZUKI J, MASUDA H, MAEHARA Y, TANJI M, SATO M, NASU S, MINOBE Y. Positional cloning of rice semidwarfing gene, sd-1: Rice "Green revolution gene" encodes a mutant enzyme involved in gibberellin synthesis[J]. DNA Research, 2002, 9(1): 11-17. DOI:10.1093/dnares/9.1.11 |
| [57] |
IZAWA T, MIHARA M, SUZUKI Y, GUPTA M, ITOH H, NAGANO A J, MOTOYAMA R, SAWADA Y, YANO M, HIRAI M Y, MAKINO A. Os-GIGANTEA confers robust diurnal rhythms on the global transcriptome of rice in the field[J]. Plant Cell, 2011, 23: 1741-1755. DOI:10.1105/tpc.111.083238 |
| [58] |
WEI X J, XU J F, GUO H N, JIANG L, CHEN S H, YU C Y, ZHOU Z L, HU P S, ZHAI H Q, WAN J M. DTH8 suppresses flowering in rice, influencing plant height and yield potential simultaneously[J]. Plant Physiology, 2010, 153(4): 1747-1758. DOI:10.1104/pp.110.156943 |
| [59] |
梁光商, 蔡善信. 水稻品种出穗临界日长的研究[J]. 华南农学院学报, 1980(3): 54-66. LIANG G S, CAI S X. Studies on the critical photoperiod for panicle initiation of different rice cultivars[J]. Journal of South China Agricultural College, 1980(3): 54-66. |
| [60] |
TAKENO K. Stress-induced flowering: the third category of flowering response[J]. Journal of Experimental Botany, 2016, 67(17): 4925-4934. DOI:10.1093/jxb/erw272 |
| [61] |
ZHANG S, LIU Y, DU M, SHOU G, WANG Z, XU G. Nitrogen as a regulator for flowering time in plant[J]. Plant and Soil, 2022, 480(1-2): 1-29. DOI:10.1007/s11104-022-05608-w |
| [62] |
WANG F, LIU Y, ZHANG A, KONG D, BI J, LIU G, YU X, LUO L. Breeding an early maturing, blast resistance water-saving and drought-resistance rice (WDR) cultivar using marker-assisted selection coupled with rapid generation advance[J]. Molecular Breeding, 2022, 42(8): 46. DOI:10.1007/s11032-022-01319-3 |
| [63] |
RANA M M, TAKAMATSU T, BASLAM M, KANEKO K, ITOH K, HARADA N, SUGIYAMA T, OHNISHI T, KONOSHITA T, TAKAGI H, MITSUI T. Salt tolerance improvement in rice through efficient SNP marker-assisted selection coupled with speed-breeding[J]. International Journal of Molecular Sciences, 2019, 20: 2585. DOI:10.3390/ijms20102585 |
| [64] |
房裕东, 韩天富. 作物快速育种技术研究进展[J]. 作物杂志, 2019(2): 1-7. DOI:10.16035/j.issn.1001-7283.2019.02.001 FANG Y D, HAN T F. Research progress in speed breeding of crops[J]. Crops, 2019(2): 1-7. DOI:10.16035/j.issn.1001-7283.2019.02.001 |
(责任编辑 张辉玲)
 2023, Vol. 50
2023, Vol. 50