文章信息
基金项目
- 广东省重点领域研发计划(2021B0707010006,2022B0202110003);广东省现代农业产业技术体系专项(2023KJ105);广东省乡村振兴战略专项(2022-NPY-00-001);广东省水稻育种新技术重点实验室项目(2020B1212060047);广东省农业科学院中青年学科带头人(金颖之星)培养项目(R2023PY-JX003)
作者简介
- 巫浩翔(1994—),男,硕士,研究实习员,研究方向水稻病理及抗病育种,E-mail:wuhx@gdaas.cn.
通讯作者
- 何秀英(1974—),女,博士,研究员,研究方向为水稻遗传育种,E-mail:hexiuying@gdaas.cn.
文章历史
- 收稿日期:2023-10-26
水稻是世界上最重要的粮食作物之一,是全球一半以上人口的主食,我国水稻产量占我国粮食总产量的40% 以上,其高产、稳产是保证我国粮食安全的重要指标。由稻瘟病菌(Magnaporthe oryzae)引起的稻瘟病是最能影响水稻产量的病害之一,它在水稻各个时期、不同器官均可发生,病害类型可分为苗瘟、叶瘟、穗颈瘟和谷粒瘟,其中危害最大的为穗颈瘟,发病时造成穗部干枯而死,谷粒无法充实,产量降低[1]。全球每年因稻瘟病造成水稻减产10%~30%[2],我国稻瘟病的年发生面积超380万hm2[3],造成的稻谷损失达数亿公斤,严重危害粮食生产和食品安全。目前,对稻瘟病的防治手段仍为化学防治和种植抗病品种,但施用大量药剂不但会造成农药残留、食品安全问题,还会增加生产成本。培育和种植抗病品种被认为是防治稻瘟菌最为经济、安全、绿色的防治手段,但由于稻瘟病菌变异速度快、生理小种复杂,单一抗病品种种植数年后抗性容易丧失。
稻瘟病菌的高度变异性与效应蛋白不断变异有关,病原菌通过无毒基因的变异来逃逸或抑制寄主植物介导的抗性反应,因此,研究效应蛋白的致病机理至关重要。随着基因组学、转录组学、蛋白质组学和功能分析技术的不断发展,稻瘟病菌效应蛋白的功能也不断被揭示,包括抑制宿主免疫反应、影响植物代谢和促进自身营养获取。进一步研究效应蛋白的序列结构差异、分泌方式、作用方式,有利于更深入了解真菌病原物的致病机理;另一方面,随着水稻抗性基因不断被发掘和鉴定,抗性蛋白与效应蛋白互作激活免疫反应的机制也逐渐被解析,深入研究它们之间的互作方式有助于制定更有效的稻瘟病防治策略。稻瘟病菌与水稻互作模式研究也为植物病原真菌与寄主互作研究提供了理想模型。本文综述了近年来稻瘟病菌效应蛋白的分泌、功能、与水稻互作模式以及效应蛋白的区域性分布,以期为研究致病机理提供理论支撑和为水稻抗稻瘟育种提供借鉴。
1 病原分子模式介导的免疫反应植物在生长过程中会遭受自然界的病毒、细菌、真菌等致病因子的侵害,植物为了抵御病原微生物的侵害,进化出一套免疫系统来对外界环境进行正确响应,以维持自身发展和生存。而病原微生物需要从宿主获取营养才能存活繁殖,只能不断进化出多种侵染方式和复杂的致病机制来抑制和克服宿主的免疫系统,从而完成侵染和繁殖,因此,植物和病原微生物形成了长期协同进化的过程[4-5]。在此过程中,植物形成了2层免疫反应机制,一是病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)诱导的免疫反应(PAMP-triggered immunity,PTI),二是病原菌效应蛋白(Effector)诱导的免疫反应(Effector-triggered immunity,ETI)[6-7]。PTI是由病原微生物的PAMPs被植物细胞膜表面的模式识别受体(Pattern recognition receptors,PRRs)识别,进而激活丝列原激活蛋白激酶(Mitogen-activated protein kinases,MAPKs)级联信号通路、钙离子蛋白激酶通路(Calcium dependent protein kinases,CDPKs)和活性氧(Reactive oxygen species,ROS)的爆发,实现免疫系统的激活,如气孔的开闭、防卫细胞的加厚和诱导病程相关(Pathogenesis-Related,PR)基因的表达等[8],限制病原菌的入侵和增值。PAMPs是一类保守的结构分子,如真菌的细胞壁多糖、几丁质、脂多糖等[9]。模式识别受体PRRs可分为受体类蛋白激酶(Receptorlike-kinases,RLKs)和受体蛋白(Receptor-likeproteins,RLPs)[10],有研究表明敲除水稻受体激酶OsCERK1会明显降低甲壳素低聚糖诱导的防御反应,说明OsCERK1在水稻的甲壳素信号转导和抗性反应中起着重要的作用[11]。
由于PTI和ETI在识别机制和早期信号转导上存在较大的差异,过去研究认为PTI和ETI是相互独立的防御反应,但近期研究表明PTI与ETI具有相互加强的作用。ETI可通过促进PTI免疫信号传递途径中关键蛋白的表达来提高PTI,例如,拟南芥中,ETI能够显著上调RBOHD的mRNA和蛋白水平,但该蛋白的磷酸化和激活又依赖于PTI信号[12]。由flg22或nlp20所诱导的PTI也可以显著提高TIR类抗病蛋白的表达[13]。水稻中也存在协同作用的植物PTI和ETI,使免疫代谢通路免受病原菌攻击,PICI1通过增强蛋氨酸合酶的稳定性,促进抗病激素乙烯的生物合成,从而调控水稻的抗病性[14]。该免疫代谢调控网络(PICI1- 蛋氨酸- 乙烯)既参与水稻的基础抗病性(PTI)又调控NLR介导的专化型抗病性(ETI)。说明PTI和ETI的免疫系统存在着协同互作模式,也解释了为何独立的PTI和ETI免疫系统存在共同的下游免疫反应,从而诱导更为持久的免疫反应。
2 效应蛋白引发的免疫反应稻瘟病菌在侵染过程中,可在水稻叶片表面扩散分生孢子,直接穿透角质层或气孔等自然孔口进入植物细胞,萌发形成附着胞,附着胞在细胞内聚集高浓度的甘油从而产生巨大的膨胀压力以穿透水稻细胞。为克服水稻的PTI防御反应,稻瘟菌分泌大量蛋白,在病菌入侵、繁殖、抵御寄主防卫反应中发挥着重要关键作用,这类分泌蛋白被称为效应蛋白。为抵御寄主产生的PTI,稻瘟病菌分泌各类效应蛋白来抵抗水稻的免疫反应,例如,效应蛋白MoHTR1和MoHTR2靶向细胞核,分别调节OsMYB4和OsWRKY45的表达,从而调控水稻的感病性[15]。效应蛋白AvrPiz-t通过靶向水稻的泛素化途径、钾离子通道等多种途径抑制水稻的防御反应[16],说明效应蛋白通过多种互作靶标来干扰寄主的防御反应。同时,水稻会分泌NLRs直接或间接识别稻瘟菌的效应蛋白,启动ETI,通常在病原菌的侵入部位发生超敏反应(Hypersensitive Response,HR),将病原物杀死在侵染细胞中,并将信号传导至其他组织,产生系统获得性抗性(Systemic Acquired Resistance,SAR)。ETI同样可以引起MAPKs信号通路的激活和ROS的爆发[17]。
2.1 稻瘟病菌效应蛋白的分泌与转运效应蛋白根据其在植物细胞的定位被分为胞质效应蛋白和质外体效应蛋白,胞质效应蛋白如Avr-Pita、AvrPiz-t、Pwl2、Bas1等在进入植物细胞前先积累在活体营养表面复合体(Biotrophic interfacial complex,BIC)中,其中BIC是由稻瘟病菌诱导水稻细胞产生的富含膜的结构,与稻瘟病菌的初级菌丝相连,当初级菌丝分化为次级菌丝时,BIC结构则会转移至次级菌丝的顶端。效应蛋白在BIC积累后,转运到交界面菌丝膜(Extrainvasivehyphal membrane,EIHM)中,而后再进入水稻细胞的细胞质[18]。胞质型效应蛋白进入水稻细胞这一过程还需要泡外复合体和囊泡运输系统的t-SNARE蛋白参与,靶向缺失泡外复合体和囊泡运输系统的SEC5和Exo70会导致胞质效应蛋白的分泌受到影响和致病性丧失,但对质外体效应蛋白的分泌无影响。胞质效应蛋白进入细胞后与靶标蛋白结合抑制寄主的免疫反应,同时通过胞间连丝先于菌丝转移到邻近的细胞,促进菌丝在邻近细胞的侵染,完成定植,稻瘟菌效应蛋白Pwl2:mRFP荧光能够在无侵染菌丝的临近细胞中观察到,表明效应蛋白是通过胞间连丝进入相邻的宿主细胞[19]。
质外体效应蛋白(如Avr-CO39、Bas4等)不经过BIC进入水稻细胞,而是通过传统的内质网- 高尔基体的分泌途径,停留或分散在真菌细胞壁和水稻细胞质外体EIHM之间。EIHM是一种植物细胞的膜结构,EIHM包围着稻瘟病菌的侵染菌丝,形成的质外体间隔是质外体效应蛋白分泌的必经之路。利用荧光标记Bas4结合NLS时,荧光只在侵染菌丝的外围观察到[20]。许多参与内质网- 高尔基体分泌途径的基因也在质外体效应蛋白的分泌过程中发挥作用,如Lhs1内质网伴侣蛋白是质外体效应蛋白Slp1分泌所必需的[21]。
稻瘟病菌的效应蛋白通过胞间连丝在水稻细胞间转运。将胞质效应蛋白PWL2与红色荧光蛋白融合,发现在侵染细胞相邻的细胞中也观察到荧光标记的PWL2,表明效应蛋白PWL2可能是通过胞间连丝进行细胞间的移动[19]。效应蛋白进入邻近细胞的运动性与效应蛋白的分子量、以及宿主细胞的类型有关,Khang等[18]研究发现,分子量越大的效应蛋白,其运动的水平就越低;同时,宿主细胞的类型与运动性也相关,PWL2蛋白的荧光在叶脉细胞比表皮细胞中更加明亮,说明其在叶脉细胞的运动性比表皮细胞中更高。
2.2 稻瘟病菌效应蛋白的功能稻瘟菌的无毒基因与植物的抗病基因相互作用符合经典的“基因对基因”理论[22],病原菌侵入植物体内释放效应蛋白,植物的抗性蛋白通过特异性识别病原菌分泌的效应蛋白,激活下游的免疫反应。在稻瘟菌中,有26个无毒基因已被鉴定,其中14个已被克隆(表 1)[23],如Avr1-CO39、Avr-Pita、AvrPiz-t等,7对无毒基因与抗病基因的相互作用已经被详细解析,其中Pi-ta/Avr-Pita、Pi54/Avr-Pi54、Pik/Avr-Pik、Pia/Avr-Pia、Pi-CO39/Avr1-CO39是Avr基因与R基因直接互作,而Piz-t/AvrPiz-t和Pii/Avr-Pii则是二者间接互作来影响植物免疫[22]。此外,还有2种类型的互作方式也被报道,一种是2个抗性蛋白与1个效应蛋白相互作用,例如,效应蛋白Avr-Pik与Pik-1和Pik-2相互作用[24-25],在MoHTR1和MoHTR2中也有类似的机制[26];另一种是2种不同的Avr蛋白可以被单个R蛋白复合物识别,例如RGA5和RGA4蛋白形成复合物能与Avr-Pia或者Avr1-CO39直接相互作用[27-28]。
2.2.1 效应蛋白直接作用寄主靶标 Avr-Pita与Pita是最早被发现的1对Avr基因和R基因直接相互作用的蛋白。Avr-Pita编码1个含有典型金属蛋白酶功能域的分泌蛋白[29],它的等位基因具有高度多态性,该特性是稻瘟菌适应寄主抗性而进化出的一种机制[30-31],Avr-Pita1和Avr-Pita2是同个家族的成员,都具有效应蛋白功能并触发Pita介导的抗性反应,而Avr-Pita3不具有效应蛋白的功能[32]。Jia等[29]通过Far-Western免疫印迹分析证实了Pita可与Avr-Pita直接互作,Pita的LRR结构域对识别Avr-Pita至关重要,LRR结构域突变会导致Pita与Avr-Pita的互作识别丧失。
Avr-Pia/Pia和Avr1-CO39/Pi-CO39相互作用是2个抗性蛋白识别1个效应蛋白的典型例子,Avr-Pia编码1个由85个氨基酸组成的小分子分泌蛋白,在具有同源R基因的水稻中,缺乏信号肽的Avr-Pia表达会导致细胞死亡,表明Avr-Pia是在水稻细胞中被识别的[36]。Avr1-CO39是一种可转运到植物细胞内的胞外效应蛋白,在不同寄主中分离出的稻瘟病菌中通常缺乏Avr1-CO39,而Pi-CO39在水稻品种中也较为少见[39, 45-46]。Pia/Pi-CO39是由RGA4和RGA5组成的,只有RGA5参与Avr-Pia或Avr1-CO39的互作,RGA4是1种细胞死亡诱导蛋白,被RGA5所抑制,RGA5作为Avr蛋白受体,不具有细胞死亡诱导活性。Avr-Pia/ Avr1-CO39与RGA5的识别主要由RATX1结构域起作用,其相互作用解除了RGA4介导的细胞死亡抑制从而激发免疫反应[47]。
2.2.2 效应蛋白间接作用寄主靶标 Avr-Pii与Pii的互作是间接互作的模式,Avr-Pii在水稻中以2种形式存在,其中一种形式由Avr-Pii蛋白组成,以二聚体或者三聚体存在于水稻中,另一种形式则是以Avr-Pii与水稻的胞吐相关蛋白OsExo70-F2和OsExo70-F3形成可溶性复合体。Pii介导的水稻抗性依赖于OsExo70-F2和OsExo70-F3,在Pii介导的水稻中,对OsExo70-F3基因进行沉默,导致水稻丧失了对Avr-Pii菌株的抗性[48]。此外,苹果酸酶(NADP-ME 2-3)也参与Pii介导的识别Avr-Pii的防御反应,在抗性水稻品种中,Os-NADP-ME2-3基因的敲除破坏了水稻对稻瘟病菌的免疫,Os-NADP-ME2-3缺失突变体中的ROS爆发显著减少。Avr-Pii通过直接作用抑制Os-NADP-ME2-3的活性,从而减少PAMP触发的ROS爆发[49]。
2.2.3 效应蛋白多种途径作用广谱抗病基因 水稻NLR蛋白Pi9和Piz-t等对多个稻瘟菌小种具有抗性,表现出广谱抗性特征,近年来对于它们的研究越来越深入。AvrPi9和Pi9的互作是病原物和植物在有、无效应蛋白或抗病蛋白的情形下精细调控植物免疫反应的识别模型。AvrPi9编码的分泌蛋白定殖在病原菌的BIC中,在病原物侵染期间被转移至宿主细胞[41]。研究发现,AvrPi9在感病野生型TP309中的异位表达降低了其对稻瘟菌的基础抗性,AvrPi9在NIL-Pigm背景中的异位表达导致易感性增加,病原体相关基因表达减少,宿主的基础抵抗受到抑制[50-51]。ANIP1是AvrPi9的互作蛋白,其含有类泛素结构域的蛋白,敲除和过表达实验证明ANIP1是基础防御的负调控因子,同时,ANIP1还能与OsWRKY62互作,并负调控它的蛋白稳定性,在无Pi9介导的水稻中,AvrPi9通过维持ANIP1的稳定性促进其对OsWRKY62的降解,达到减弱寄主免疫的目的;而在Pi9介导的水稻中,Pi9与ANIP1和OsWRKY62结合以维持其在无病原菌侵染的非激活状态,而AvrPi9可以促进ANIP1和Pi9的解离并释放Pi9,从而增强水稻的抗瘟性[52],表明AvrPi9能够通过多种机制调节宿主的免疫反应以促进病原菌感染。
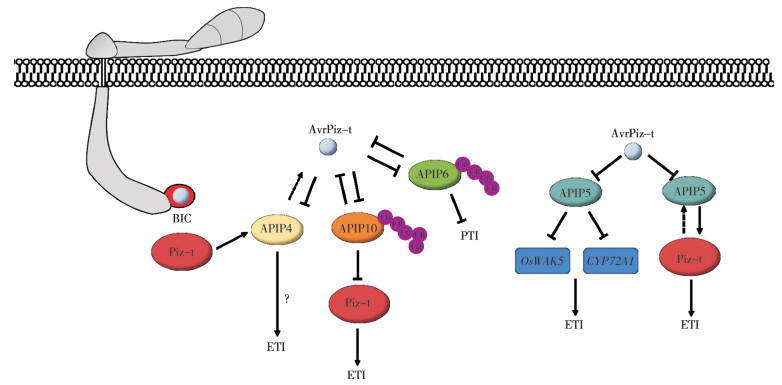
AvrPiz-t与Piz-t相互作用是通过多种信号通路激发水稻的免疫反应。AvrPiz-t编码一个长度为108个氨基酸的分泌蛋白,在转移到水稻细胞之前被分泌到BIC中,AvrPiz-t能够模拟水稻抗病相关蛋白ROD1的结构,从而清除寄主体内的活性氧,抑制寄主免疫[53]。AvrPiz-t与酵母双杂交筛选到的12个APIP相互作用,其部分作用模式见图 1。在12个APIP中,APIP6和APIP10是环型E3泛素连接酶,在不含有Piz-t的水稻中,AvrPiz-t与APIP6/APIP10相互作用,并通过促进它们的降解来抑制E3泛素连接酶活性从而抑制水稻PTI;在含有Piz-t的水稻中,APIP10通过泛素化促进Piz-t的降解,而当AvrPiz-t进入后,通过与APIP10互作消除APIP10对Piz-t的负调控,Piz-t的快速积累可触发细胞死亡并产生抗病性[54-55]。APIP5是bZip转录因子,负调控水稻的程序性死亡和稻瘟病抗性,APIP5通过结合细胞壁相关的激酶基因OsWAK5抑制其表达,从而限制木质素的积累;同时,APIP5通过抑制细胞色素基因CYP72A1表达,从而限制活性氧的产生和防御化合物的积累[56],当稻瘟病菌侵入后,效应蛋白AvrPiz-t与APIP5结合并抑制APIP5水平,导致防御相关基因激活的增加,防御相关转录物的积累,最终抑制了真菌感染,而在含有Piz-t的水稻中,Piz-t与APIP5相互作用并稳定APIP5,以抑制稻瘟病菌侵染后期坏死斑的形成[57]。APIP12编码着一个核孔蛋白Nup98的同源物,敲除和沉默APIP12会导致水稻稻瘟病抗性下降,同时,APIP12的敲除并未影响Piz-t介导的AvrPiz-t的抗性,但病程相关基因的表达受到了抑制,表明APIP12主要参与水稻基础免疫反应[58]。APIP4是一种真菌效应蛋白和NLR受体的共同靶点,在水稻体内表现出胰蛋白酶抑制活性,AvrPiz-t与APIP4互作,抑制胰蛋白酶抑制活性,从而抑制水稻抗性。而水稻NLR蛋白Piz-t与APIP4互作,提高了胰蛋白酶抑制活性,从而提高的水稻的抗性[59]。以上互作的案例表明AvrPiz-t在影响植物免疫的过程中,具有多功能性,存在多种与之互作的靶标。
|
| 效应蛋白AvrPiz-t与APIP4互作,抑制胰蛋白酶抑制活性,从而抑制水稻的抗性,Piz-t提高了APIP4的抑制活性从而提高抗病性[57];AvrPiz-t靶向水稻E3泛素连接酶APIP10以抑制其活性,APIP10泛素化AvrPiz-t从而导致Piz-t的积累以增强ETI[54];AvrPiz-t与APIP6相互作用以抑制其活性,APIP6泛素化AvrPiz-t并促进其降解以抑制稻瘟菌侵染[53];AvrPiz-t与水稻bZIP家族转录因子APIP5结合并抑制APIP5水平,导致防御化合物的积累,抑制稻瘟菌感染[55] Effector protein AvrPiz-t interacts with APIP4 to inhibit inhibitory activity of trypsin, thus inhibit rice resistance, Piz-t increases the inhibitory activity of APIP4 to improve disease resistance [57]; AvrPiz-t targets rice E3 ligase APIP10 to inhibit its activity, APIP10 ubiquitinates AvrPiz-t, which promotes Piz-t accumulation to enhance ETI [54]; AvrPiz-t interacts with APIP6 to inhibit its activity, APIP6 ubiquitinates AvrPiz-t and promotes AvrPiz-t degradation to inhibit Magnaporthe oryzae infection [53]; AvrPiz-t binds to rice bZIP family transcription factor APIP5 and inhibits APIP5 level, accumulating defense compounds and inhibiting Magnaporthe oryzae infection[55] 图 1 稻瘟病菌AvrPiz-t与水稻Piz-t互作介导的抗性反应 Fig. 1 Interaction mediated resistance response between Magnaporthe oryzae AvrPiz-t and rice Piz-t |
2.3 稻瘟病菌效应蛋白的区域性分布
在生产上连续种植同一抗病品种,其抗病性随着稻瘟病菌生理小种的变化可能逐渐降低甚至丧失,且稻瘟菌群体存在优势无毒基因。因此,研究稻瘟病菌群体的无毒基因组成和分布对于水稻抗瘟品种的培育和部署十分重要,监测各年度、各地区无毒基因的组成、变异和群体分布情况,将为有针对性地进行水稻抗瘟育种和品种的合理布局提供理论指导。
我国对于各个水稻种植区的稻瘟病菌无毒基因型的研究已经十分深入,许多地区都有报道相关无毒基因的发生频率。例如,兰波等[60]对2020年江西省采集分离的189个稻瘟病菌菌株进行8个无毒基因的基因型鉴定,发现Avr-pik和Avr-pizt检出频率最高;王群等[61]对云南省6个水稻产区采集的348份稻瘟病菌检测AvrPiz-t、AvrPib和Avr-Pii,发现分别有51.7%、46.8% 和15.8% 的菌株含有无毒基因AvrPiz-t、AvrPib和Avr-Pii,不同产区无毒基因的分布及组成差异较大,群体多样性水平较高;汪文娟等[62]对2013—2017年广东省13个市区县的70个稻瘟病菌进行无毒基因型分析,发现AvrPi9、AvrPiz-t、AvrPi50和AvrPik-h的出现频率较高,可重点引入含Pi9、Piz-t、Pi50、Pikh基因的抗病品种;刘伟等[63]对2017—2018年辽宁省7个水稻产区的151份稻瘟病菌进行10个无毒基因检测,发现AvrPiz-t、Avr-Pik和ACE1的携带频率最高,应推广含有Pita、Pi9、Pizt和Pik抗性基因的水稻品种。针对各地区不同的优势无毒基因,建立以此为基础的抗瘟基因布局和减少施用杀菌剂的稻瘟病绿色防控技术,有利于更科学、高效地防控稻瘟病。
3 结语与展望稻瘟病发病范围广泛,对水稻生产造成巨大危害,因此,在水稻新品种审定标准中,稻瘟病抗性的有无决定着品种审定能否通过。稻瘟病菌作为其病原物,由于外界环境的持续变化及稻瘟病菌的生理小种变化迅速,长期使用单一类型的稻瘟病抗性基因,使得水稻抗性逐渐降低。因此,需要深入研究病原菌的致病机制和寄主的抗病机制,水稻与稻瘟病菌之间的相互作用为深入研究植物与病原菌之间的竞争作用提供了良好模型。近年来,随着分子生物学技术和测序技术的发展,稻瘟病菌的无毒基因不断被鉴定和克隆,在分泌、转运机制、功能鉴定、靶基因筛选方面取得了一系列的进展,至少有超851个具有效应蛋白功能的小分泌蛋白已在稻瘟菌中被鉴定,尽管只有一部分被证实可影响致病力[64]。但由于真菌的效应蛋白在序列上缺乏保守的结构域,鉴定和研究效应蛋白仍是一项艰巨的任务,且效应蛋白进入宿主体内是通过哪些通路发挥作用仍不清楚,进一步研究效应蛋白能够更好地理解病原物抵抗宿主免疫的调控机制。稻瘟病抗性基因的新位点也不断被发现和研究,这些基因被用于抗性机理研究和抗稻瘟病遗传育种。已克隆的稻瘟病广谱抗性基因比如Pi2、Pigm、Pi9在生产中均有广阔的应用前景[65]。但与这些基因互作的无毒基因仍较难鉴定,并且互作机理尚不清楚。针对当前研究存在的问题,可从以下几方面深入研究:(1)利用第三代测序技术、基因组学、转录组学、蛋白质组学等新型技术鉴定和克隆水稻与稻瘟病互作网络中更多的抗性基因和无毒基因,尤其是广谱抗性基因,通过聚合广谱抗性基因扩大品种抗谱,以对抗田间不断发生变化的稻瘟菌生理小种;(2)水稻与稻瘟病菌的互作中是否存在其他PTI和ETI相互协同作用的机制,病原物入侵并分泌效应蛋白攻击寄主的基础免疫代谢调控网络中的关键作用因子,以利于病原菌的定殖,NLR受体通过保护PTI和ETI过程中的关键作用因子,进而加强免疫途径的相关化学物质的合成,获得广谱持久的抗性。是否还有其他防卫激素通过影响植物下游的基础免疫反应,调控水稻对稻瘟病的防御;(3)利用已经克隆的无毒基因设计特异性引物对Avr-Pita、AvrPiz-t、Avr1-co39、Avr-pita、ACE1、Avr-pik、Avr-piz-t、Avr-pia、Avr-pit等进行扩增,分析该地区稻瘟病菌无毒基因组成及分布特点,通过检测不同水稻种植区稻瘟病菌群体中无毒基因的动态组成有利于明确当地无毒基因的变异规律,指导当地育种者找到最合适的R基因组合来控制当地稻瘟病的流行与发生;(4)利用分子标记辅助选择技术、转基因技术、分子设计育种技术、基因编辑技术等不同水稻育种技术的优点,优化现有的育种策略,培育出抗瘟、优质的水稻新品种,例如,将抗病基因PigmR精准插入到水稻基因组上实现快速抗病育种[66],这些新技术的升级改造将为水稻分子抗病育种提供有力的技术支撑。
| [1] |
谢留杰, 潘晓飚, 黄善军. 水稻稻瘟病抗性基因研究及应用进展[J]. 广东农业科学, 2012, 39(24): 3-6. DOI:10.16768/j.issn.1004-874X.2012.24.041 XIE L J, PAN X B, HUANG S J. Research and application of blast resistance genes in rice[J]. Guangdong Agricultural Sciences, 2012, 39(24): 3-6. DOI:10.16768/j.issn.1004-874X.2012.24.041 |
| [2] |
何秀英, 廖耀平, 陈钊明, 程永盛, 陈粤汉. 水稻稻瘟病抗病育种研究进展与展望[J]. 广东农业科学, 2011, 38(1): 30-33. DOI:10.16768/j.issn.1004-874X.2011.01.020 HE X Y, LIAO Y P, CHEN Z M, CHEN Y S, CHEN Y H. Progress and prospect of rice blast disease resistance breeding[J]. Guangdong Agricultural Sciences, 2011, 38(1): 30-33. DOI:10.16768/j.issn.1004-874X.2011.01.020 |
| [3] |
姜玉英, 刘万才, 黄冲, 陆明红, 刘杰, 次仁卓嘎. 2020年全国农作物重大病虫害发生趋势预报[J]. 中国植保导刊, 2020, 40(2): 37-39, 53. DOI:10.3969/j.issn.1672-6820.2020.02.007 JIANG Y Y, LIU W C, HUANG C, LU M H, LIU J, CI R Z G. Forecast of the occurrence trend of major crop diseases and insect pests in 2020[J]. China Plant Protection, 2020, 40(2): 37-39, 53. DOI:10.3969/j.issn.1672-6820.2020.02.007 |
| [4] |
ANTOLIN-LLOVERA M, RIED M K, BINDER A, PARNISKE M. Receptor kinase signaling pathways in plant-microbe interactions[J]. Annual Review of Phytopathology, 2012, 50: 451-473. DOI:10.1146/annurev-phyto-081211-173002 |
| [5] |
MENGISTE T. Plant immunity to necrotrophs[J]. Annual Review of Phytopathology, 2012, 50: 267-294. DOI:10.1146/annurevphyto-081211-172955 |
| [6] |
DODDS P N, RATHJEN J P. Plant immunity: Towards an integrated view of plant-pathogen interactions[J]. Nature Reviews Genetics, 2010, 11(8): 539-548. DOI:10.1038/nrg2812 |
| [7] |
JONES J D, DANGL J L. The plant immune system[J]. Nature, 2006, 444(7117): 323-329. DOI:10.1038/nature05286 |
| [8] |
王伟, 唐定中. 两类免疫受体强强联手筑牢植物免疫防线[J]. 植物学报, 2021, 56(2): 142-146. DOI:10.11983/CBB21042 WANG W, TANG D Z. Synergistic cooperation between cell surface and intracellular immune receptors potentiates to activate robust plant defense[J]. Chinese Bulletin of Botany, 2021, 56(2): 142. DOI:10.11983/CBB21042 |
| [9] |
LIU B, LI J F, AO Y, QU J, LI Z, SU J, ZHANG Y, LIU J, FENG D, QI K, HE Y, WANG J, WANG H B. Lysin motif-containing proteins LYP4 and LYP6 play dual roles in peptidoglycan and chitin perception in rice innate immunity[J]. Plant Cell, 2012, 24(8): 3406-3419. DOI:10.1105/tpc.112.102475 |
| [10] |
ZIPFEL C. Pattern-recognition receptors in plant innate immunity[J]. Current Opinion in Immunology, 2008, 20(1): 10-16. DOI:10.1016/j.coi.2007.11.003 |
| [11] |
KAKU H, NISHIZAWA Y, ISHII-MINAMI N, AKIMOTO-TOMIYAMA C, DOHMAE N, TAKIO K, MINAMI E, SHIBUYA N. Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(29): 11086-11091. DOI:10.1073/pnas.0508882103 |
| [12] |
YUAN M, JIANG Z, BI G, NOMURA K, LIU M, WANG Y, CAI B, ZHOU J, HE S, XIN X. Pattern-recognition receptors are required for NLR-mediated plant immunity[J]. Nature, 2021, 592: 105-109. DOI:10.1038/s41586-021-03316-6 |
| [13] |
TIAN H, WU Z, CHEN S, AO K, HUANG W, YAGHMAIEAN H, SUN T, XU F, ZHANG Y, WANG S, LI X, ZHANG Y. Activation of TIR signalling boosts pattern-triggered immunity[J]. Nature, 2021, 598(7881): 500-503. DOI:10.1038/s41586-021-03987-1 |
| [14] |
ZHAI K, LIANG D, LI H, JIAO F, YAN B, LIU J, LEI Z, HUANG L, GONG X, WANG X, MIAO J, WANG Y, LIU J Y, ZHANG L, WANG E, DENG Y, WEN C K, GUO H, HAN B, HE Z. NLRs guard metabolism to coordinate pattern-and effector-triggered immunity[J]. Nature, 2022, 601(7892): 245-251. DOI:10.1038/s41586-021-04219-2 |
| [15] |
KIM S, KIM C Y, PARK S Y, KIM K T, JEON J, CHUNG H, CHOI G, KWON S, CHOI J, JEON J, JEON J S, KHANG C H, KANG S, LEE Y H. Two nuclear effectors of the rice blast fungus modulate host immunity via transcriptional reprogramming[J]. Nature Communication, 2020, 11(1): 5845. DOI:10.1038/s41467-020-19624-w |
| [16] |
NING Y, SHI X, WANG R, FAN J, PARK C H, ZHANG C, ZHANG T, OUYANG X, LI S, WANG G L. OsELF3-2, an ortholog of Arabidopsis ELF3, interacts with the E3 ligase APIP6 and negatively regulates immunity against Magnaporthe oryzae in rice[J]. Molecular Plant, 2015, 28(11): 1679-1682. DOI:10.1016/j.molp.2015.08.004 |
| [17] |
QI J S, WANG J L, GONG Z Z, ZHOU J M. Apoplastic ROS signaling in plant immunity[J]. Current Opinion Plant Biology, 2017, 38: 92-100. DOI:10.1016/j.pbi.2017.04.022 |
| [18] |
KHANG C H, BERRUYER R, GIRALDO M C, KANKANALA P, PARK S Y, CZYMMEK K, KANG S, VALENT B. Translocation of Magnaporthe oryzae effectors into rice cells and their subsequent cell-to-cell movement[J]. Plant Cell, 2010, 22(4): 1388-1403. DOI:10.1105/tpc.109.069666 |
| [19] |
GIRALDO M C, DAGDAS Y F, GUPTA Y K, MENTLAK T A, YI M, MARTINEZ-ROCHA A L, SAITOH H, TERAUCHI R, TALBOT N J, VALENT B. Two distinct secretion systems facilitate tissue invasion by the rice blast fungus Magnaporthe oryzae[J]. Nature Communication, 2013, 4: 1996. DOI:10.1038/ncomms2996 |
| [20] |
MOSQUERA G, GIRALDO M C, KHANG C H, COUGHLAN S, VALENT B. Interaction transcriptome analysis identifies Magnaporthe oryzae BAS1-4 as biotrophy-associated secreted proteins in rice blast disease[J]. Plant Cell, 2009, 21(4): 1273-1290. DOI:10.1105/tpc.107.055228 |
| [21] |
MENTLAK T A, TALBOT N J, KROJ T. Effector translocation and delivery by the rice blast fungus Magnaporthe oryzae[J]. Effectors in Plant–Microbe Interactions, 2011, 219-241. |
| [22] |
FLOR H H. The complementary genic systems in flax and flax rust[J]. Advances in Genetics, 1956, 8: 29-54. DOI:10.1016/s0065-2660(08)60498-8 |
| [23] |
DEVANNA B N, JAIN P, SOLANKE AU, DAS A, THAKUR S, SINGH P K, KUMARI M, DUBEY H, JASWAL R, PAWAR D, KAPOOR R, SINGH J, ARORA K, SAKLANI B K, ANILKUMAR C, MAGANTI S M, SONAH H, DESHMUKH R, RATHOUR R, SHARMA T R. Understanding the dynamics of blast resistance in rice-Magnaporthe oryzae interactions[J]. Journal of Fungi (Basel), 2022, 8(6): 584. DOI:10.3390/jof8060584 |
| [24] |
李珊, 杜春梅. 稻瘟病菌与水稻互作研究进展[J]. 中国农学通报, 2020, 36(24): 125-131. DOI:10.11924/j.issn.1000-6850.casb20190800517 LI S, DU C M. The interaction between Magnaporthe oryzae and rice: research progress[J]. Chinese Agricultural Science Bulletin, 2020, 36(24): 125-131. DOI:10.11924/j.issn.1000-6850.casb20190800517 |
| [25] |
KANZAKI H, YOSHIDA K, SAITOH H, FUJISAKI K, HIRABUCHI A, ALAUX L, FOURNIER E, THARREAU D, TERAUCHI R. Arms race co-evolution of Magnaporthe oryzae AVR-Pik and rice Pik genes driven by their physical interactions[J]. The Plant Journal: for Cell and Molecular Biology, 2012, 72(6): 894-907. DOI:10.1111/j.1365-313X.2012.05110.x |
| [26] |
ZHAI C, ZHANG Y, YAO N, LIN F, LIU Z, DONG Z, WANG L, PAN Q. Function and interaction of the coupled genes responsible for Pik-h encoded rice blast resistance[J]. PloS One, 2014, 9(6): e98067. DOI:10.1371/journal.pone.0098067 |
| [27] |
CÉSARI S, KANZAKI H, FUJIWARA T, BERNOUX M, CHALVON V, KAWANO Y, SHIMAMOTO K, DODDS P, TERAUCHI R, KROJ T. The NB-LRR proteins RGA4 and RGA5 interact functionally and physically to confer disease resistance[J]. The EMBO Journal, 2014, 33(17): 1941-1959. DOI:10.15252/embj.201487923 |
| [28] |
OKUYAMA Y, KANZAKI H, ABE A, YOSHIDA K, TAMIRU M, SAITOH H, FUJIBE T, MATSUMURA H, SHENTON M, GALAM D C, UNDAN J, ITO A, SONE T, TERAUCHI R. A multifaceted genomics approach allows the isolation of the rice Pia-blast resistance gene consisting of two adjacent NBS-LRR protein genes[J]. The Plant Journal : for Cell and Molecular Biology, 2011, 66(3): 467-479. DOI:10.1111/j.1365-313X.2011.04502.x |
| [29] |
JIA Y, MCADAMS S A, BRYAN G T, HERSHEY H P, VALENT B. Direct interaction of resistance gene and avirulence gene products confers rice blast resistance[J]. The EMBO Journal, 2000, 19(15): 4004-4014. DOI:10.1093/emboj/19.15.4004 |
| [30] |
DAI M D, LI Y, SUN L X, LIN F C, LIU X H. Isolation and functional analysis of effector proteins of Magnaporthe oryzae[J]. Methods Molecular Biology, 2021, 2356: 199-209. DOI:10.1007/978-1-0716-1613-016 |
| [31] |
ZHOU E, JIA Y, SINGH P, CORRELL J C, LEE F N. Instability of the Magnaporthe oryzae avirulence gene AVR-Pita alters virulence[J]. Fungal Genetics and Biology, 2007, 44(10): 1024-1034. DOI:10.1016/j.fgb.2007.02.003 |
| [32] |
KHANG C H, PARK S Y, LEE Y H, VALENT B, KANG S. Genome organization and evolution of the AVR-Pita avirulence gene family in the Magnaporthe grisea species complex[J]. Molecular Plant Microbe Interaction, 2008, 21(5): 658-670. DOI:10.1094/mpmi-21-5-0658 |
| [33] |
KANG S, SWEIGARD J A, VALENT B. The PWL host specificity gene family in the blast fungus Magnaporthe grisea[J]. Molecular Plant Microbe Interaction, 1995, 8(6): 939-948. DOI:10.1094/mpmi-8-0939 |
| [34] |
SWEIGARD J A, CARROLL A M, KANG S, FARRALL L, CHUMLEY F G, VALENT B. Identification, cloning, and characterization of PWL2, a gene for host species specificity in the rice blast fungus[J]. Plant Cell, 1995, 7(8): 1221-1233. DOI:10.1105/tpc.7.8.1221 |
| [35] |
ORBACH M J, FARRALL L, SWEIGARD J A, CHUMLEY F G, VALENT B. A telomeric avirulence gene determines efficacy for the rice blast resistance gene Pi-ta[J]. Plant Cell, 2000, 12(11): 2019-2032. DOI:10.1105/tpc.12.11.2019 |
| [36] |
MIKI S, MATSUI K, KITO H, OTSUKA K, ASHIZAWA T, YASUDA N, FUKIYA S, SATO J, HIRAYAE K, FUJITA Y, NAKAJIMA T, TOMITA F, SONE T. Molecular cloning and characterization of the AVR-Pia locus from a Japanese field isolate of Magnaporthe oryzae[J]. Molecular Plant Pathology, 2009, 10(3): 361-374. DOI:10.1111/j.1364-3703.2009.00534.x |
| [37] |
YOSHIDA K, SAITOH H, FUJISAWA S, KANZAKI H, MATSUMURA H, YOSHIDA K, TOSA Y, CHUMA I, TAKANO Y, WIN J, KAMOUN S, TERAUCHI R. Association genetics reveals three novel avirulence genes from the rice blast fungal pathogen Magnaporthe oryzae[J]. Plant Cell, 2009, 21(5): 1573-1591. DOI:10.1105/tpc.109.066324 |
| [38] |
WU W, WANG L, ZHANG S, LI Z, ZHANG Y, LIN F, PAN Q. Stepwise arms race between AvrPik and Pik alleles in the rice blast pathosystem[J]. Molecular Plant Microbe Interaction, 2014, 27(8): 759-769. DOI:10.1094/mpmi-02-14-0046-r |
| [39] |
FARMAN M L, LEONG S A. Chromosome walking to the AVR1-CO39 avirulence gene of Magnaporthe grisea: Discrepancy between the physical and genetic maps[J]. Genetics, 1998, 150(3): 1049-1058. DOI:10.1093/genetics/150.3.1049 |
| [40] |
LI W, WANG B, WU J, LU G, HU Y, ZHANG X, ZHANG Z, ZHAO Q, FENG Q, ZHANG H, WANG Z, WANG G, HAN B, WANG Z, ZHOU B. The Magnaporthe oryzae avirulence gene AvrPiz-t encodes a predicted secreted protein that triggers the immunity in rice mediated by the blast resistance gene Piz-t[J]. Molecular Plant Microbe Interaction, 2009, 22(4): 411-420. DOI:10.1094/mpmi-22-4-0411 |
| [41] |
WU J, KOU Y, BAO J, LI Y, TANG M, ZHU X, PONAYA A, XIAO G, LI J, LI C, SONG M Y, CUMAGUN C J, DENG Q, LU G, JEON J S, NAQVI N I, ZHOU B. Comparative genomics identifies the Magnaporthe oryzae avirulence effector AvrPi9 that triggers Pi9-mediated blast resistance in rice[J]. The New Phytologist, 2015, 206(4): 1463-1475. DOI:10.1111/nph.13310 |
| [42] |
ZHANG S, WANG L, WU W, HE L, YANG X, PAN Q. Function and evolution of Magnaporthe oryzae avirulence gene AvrPib responding to the rice blast resistance gene Pib[J]. Scientifi c Reports, 2015, 5: 11642. DOI:10.1038/srep11642 |
| [43] |
RAY S, SINGH P K, GUPTA D K, MAHATO A K, SARKAR C, RATHOUR R, SINGH N K, SHARMA T R. Analysis of Magnaporthe oryzae genome reveals a fungal effector, which is able to induce resistance response in transgenic rice line containing resistance gene, Pi54[J]. Frontiers in Plant Science, 2016, 7: 1140. DOI:10.3389/fpls.2016.01140 |
| [44] |
BÖHNERT H U, FUDAL I, DIOH W, THARREAU D, NOTTEGHEM J L, LEBRUN M H. A putative polyketide synthase/peptide synthetase from Magnaporthe grisea signals pathogen attack to resistant rice[J]. Plant Cell, 2004, 16(9): 2499-2513. DOI:10.1105/tpc.104.022715 |
| [45] |
RIBOT C, CESARI S, ABIDI I, CHALVON V, BOURNAUD C, VALLET J, LEBRUN M H, MOREL J B, KROJ T. The Magnaporthe oryzae effector AVR1-CO39 is translocated into rice cells independently of a fungal-derived machinery[J]. The Plant Journal: for Cell and Molecular Biology, 2013, 74(1): 1-12. DOI:10.1111/tpj.12099 |
| [46] |
TOSA Y, OSUE J, ETO Y, OH H S, NAKAYASHIKI H, MAYAMA S, LEONG S A. Evolution of an avirulence gene, AVR1-CO39, concomitant with the evolution and differentiation of Magnaporthe oryzae[J]. Molecular Plant Microbe Interaction, 2005, 18(11): 1148-1160. DOI:10.1094/mpmi-18-1148 |
| [47] |
CESARI S, THILLIEZ G, RIBOT C, CHALVON V, MICHEL C, JAUNEAU A, RIVAS S, ALAUX L, KANZAKI H, OKUYAMA Y, MOREL J B, FOURNIER E, THARREAU D, TERAUCHI R, KROJ T. The rice resistance protein pair RGA4/RGA5 recognizes the Magnaporthe oryzae effectors AVR-Pia and AVR1-CO39 by direct binding[J]. Plant Cell, 2013, 25(4): 1463-1481. DOI:10.1105/tpc.112.107201 |
| [48] |
FUJISAKI K, ABE Y, ITO A, SAITOH H, YOSHIDA K, KANZAKI H, KANZAKI E, UTSUSHI H, YAMASHITA T, KAMOUN S, TERAUCHI R. rice Exo70 interacts with a fungal effector, AVR-Pii, and is required for AVR-Pii-triggered immunity[J]. The Plant Journal : for Cell and Molecular Biology, 2015, 83(5): 875-887. DOI:10.1111/tpj.12934 |
| [49] |
SINGH R, DANGOL S, CHEN Y, CHOI J, CHO Y S, LEE J E, CHOI M O, JWA N S. Magnaporthe oryzae effector AVR-Pii helps to establish compatibility by inhibition of the rice NADP-Malic enzyme resulting in disruption of oxidative burst and host innate immunity[J]. Molecules and Cells, 2016, 39(5): 426-438. DOI:10.14348/molcells.2016.0094 |
| [50] |
LIU Z, QIU J, SHEN Z, WANG C, JIANG N, SHI H, KOU Y. The E3 ubiquitin ligase OsRGLG5 targeted by the Magnaporthe oryzae effector AvrPi9 confers basal resistance against rice blast[J]. Plant Communication, 2023, 4(5): 100626. DOI:10.1016/j.xplc.2023.100626 |
| [51] |
ZHAI K, LIANG D, LI H, JIAO F, YAN B, LIU J, LEI Z, HUANG L, GONG X, WANG X, MIAO J, WANG Y, LIU J Y, ZHANG L, WANG E, DENG Y, WEN C K, GUO H, HAN B, HE Z. NLRs guard metabolism to coordinate pattern-and effector-triggered immunity[J]. Nature, 2022, 601(7892): 245-251. DOI:10.1038/s41586-021-04219-2 |
| [52] |
SHI X, XIONG Y, ZHANG K, ZHANG Y, ZHANG J, ZHANG L, XIAO Y, WANG G L, LIU W. The ANIP1-OsWRKY62 module regulates both basal defense and Pi9-mediated immunity against Magnaporthe oryzae in rice[J]. Molecular Plant, 2023, 16(4): 739-755. DOI:10.1016/j.molp.2023.03.001 |
| [53] |
GAO M, HE Y, YIN X, ZHONG X, YAN B, WU Y, CHEN J, LI X, ZHAI K, HUANG Y, GONG X, CHANG H, XIE S, LIU J, YUE J, XU J, ZHANG G, DENG Y, WANG E, THARREAU D, WANG G L, YANG W, HE Z. Ca(2+) sensor-mediated ROS scavenging suppresses rice immunity and is exploited by a fungal effector[J]. Cell, 2021, 184(21): 5391-5404.e17. DOI:10.1016/j.cell.2021.09.009 |
| [54] |
PARK C H, CHEN S, SHIRSEKAR G, ZHOU B, KHANG C H, SONGKUMARN P, AFZAL A J, NING Y, WANG R, BELLIZZI M, VALENT B, WANG G L. The Magnaporthe oryzae effector AvrPiz-t targets the RING E3 ubiquitin ligase APIP6 to suppress pathogenassociated molecular pattern-triggered immunity in rice[J]. Plant Cell, 2012, 24(11): 4748-4762. DOI:10.1105/tpc.112.105429 |
| [55] |
PARK C H, SHIRSEKAR G, BELLIZZI M, CHEN S, SONGKUMARN P, XIE X, SHI X, NING Y, ZHOU B, SUTTIVIRIYA P, WANG M, UMEMURA K, WANG G L. The E3 ligase APIP10 connects the effector AvrPiz-t to the NLR receptor Piz-t in Rice[J]. PLoS Pathogens, 2016, 12(3): e1005529. DOI:10.1371/journal.ppat.1005529 |
| [56] |
ZHANG F, FANG H, WANG M, HE F, TAO H, WANG R, LONG J, WANG J, WANG G L, NING Y. APIP5 functions as a transcription factor and an RNA-binding protein to modulate cell death and immunity in rice[J]. Nucleic Acids Research, 2022, 50(9): 5064-5079. DOI:10.1093/nar/gkac316 |
| [57] |
WANG R, NING Y, SHI X, HE F, ZHANG C, FAN J, JIANG N, ZHANG Y, ZHANG T, HU Y, BELLIZZI M, WANG G L. Immunity to rice blast disease by suppression of effector-triggered necrosis[J]. Current Biology, 2016, 26(18): 2399-2411. DOI:10.1016/j.cub.2016.06.072 |
| [58] |
TANG M, NING Y, SHU X, DONG B, ZHANG H, WU D, WANG H, WANG G L, ZHOU B. The Nup98 homolog APIP12 targeted by the effector AvrPiz-t is involved in rice basal resistance against Magnaporthe oryzae[J]. Rice, 2017, 10(1): 5. DOI:10.1186/s12284-017-0144-7 |
| [59] |
ZHANG C, FANG H, SHI X, HE F, WANG R, FAN J, BAI P, WANG J, PARK C H, BELLIZZI M, ZHOU X, WANG G L, NING Y. A fungal effector and a rice NLR protein have antagonistic effects on a BowmanBirk trypsin inhibitor[J]. Plant Biotechnology Journal, 2020, 18(11): 2354-2363. DOI:10.1111/pbi.13400 |
| [60] |
兰波, 余建, 霍光华, 李湘民, 杨迎青. 江西稻瘟病自然病圃菌群毒性相关基因的鉴定与分析[J]. 江西农业大学学报, 2022, 44(2): 377-385. DOI:10.13836/j.jjau.2022039 LAN B, YU J, HUO G H, LI X M, YANG Y Q. Identification and analysis of virulence-related genes in Magnaporthe oryzae from rice blast nursery of Jiangxi Province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2022, 44(2): 377-385. DOI:10.13836/j.jjau.2022039 |
| [61] |
王群, 毕云青, 孔垂思, 金桂梅, 杨明英, 李进斌. 云南省六个水稻产区稻瘟病菌三个无毒基因的组成及其致病型[J]. 植物保护学报, 2021, 48(4): 723-731. DOI:10.13802/j.cnki.zwbhxb.2021.2020131 WANG Q, BI Y Q, KONG C S, JIN G M, YANG M Y, LI J B. Three avirulance genes composition and pathotype structure among Magnaporthe oryzae isolates from six rice growing areas of Yunnan Province[J]. Journal of Plant Protection, 2021, 48(4): 723-731. DOI:10.13802/j.cnki.zwbhxb.2021.2020131 |
| [62] |
汪文娟, 苏菁, 陈深, 杨健源, 陈凯玲, 冯爱卿, 汪聪颖, 封金奇, 陈炳, 朱小源. 广东省侵染美香占2号的稻瘟病菌致病性及无毒基因变异分析[J]. 中国农业科学, 2022, 55(7): 1346-1358. DOI:10.3864/j.issn.0578-1752.2022.07.007 WANG W J, SU J, CHEN S, YANG J Y, CHEN K L, FENG A Q, WANG C Y, FENG J Q, CHEN B, ZHU X Y. Identification of physiological race and analysis avirulent genes for isolates of rice blast infecting from rice variety of Meixiangzhan 2[J]. Scientia Agricultura Sinica, 2022, 55(7): 1346-1358. DOI:10.3864/j.issn.0578-1752.2022.07.007 |
| [63] |
刘伟, 魏松红, 朱丽珺, 王海宁, 张照茹, 李昕洋. 辽宁省稻瘟病菌生理小种及无毒基因鉴定[J]. 西南农业学报, 2020, 33(9): 1969-1976. DOI:10.16213/j.cnki.scjas.2020.9.014 LIU W, WEI S H, ZHU L J, WANG H N, ZHANG Z R, LI X Y. Identification of physiological races and avirulence genes of pyricularia oryzae in Liaoning Province[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(9): 1969-1976. DOI:10.16213/j.cnki.scjas.2020.9.014 |
| [64] |
ZHU Y, LIU L, ZHANG C, ZHANG C, HAN T, DUAN R, JIN Y, GUO H, SHE K, XIAO Y, GOTO A, CAI Q, JI S. Endoplasmic reticulumassociated protein degradation contributes to toll innate immune defense in Drosophila melanogaster[J]. Front Immunol, 2022, 13: 1099637. DOI:10.3389/fimmu.2022.1099637 |
| [65] |
苏菁, 陈深, 朱小源. 水稻广谱抗病分子机理研究进展[J]. 广东农业科学, 2020, 47(11): 84-92. DOI:10.16768/j.issn.1004-874X.2020.11.010 SU J, CHEN S, ZHU X Y. Research progress in molecular mechanism of broad-spectrum disease resistance in rice[J]. Guangdong Agricultural Sciences, 2020, 47(11): 84-92. DOI:10.16768/j.issn.1004-874X.2020.11.010 |
| [66] |
SUN C, LEI Y, LI B, GAO Q, LI Y, CAO W, YANG C, LI H, WANG Z, LI Y, WANG Y, LIU J, ZHAO K T, GAO C. Precise integration of large DNA sequences in plant genomes using PrimeRoot editors[J]. Nature Biotechnology, 2023, 3: 24. DOI:10.1038/s41587-023-01769-w |
(责任编辑 陈丽娥)
 2023, Vol. 50
2023, Vol. 50