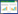文章信息
基金项目
- 广东省自然科学基金(2021A1515010517,2022A1515010798);广东省大学生创新创业训练计划项目(S202311347004);仲恺农业工程学院仲华基因产业学院项目(KA2103139)
作者简介
- 缪乐怡(1999—),女,在读硕士生,研究方向为水稻重要农艺性状分子机理,E-mail:miaole01@163.com.
通讯作者
- 唐辉武(1981—),男,博士,副研究员,研究方向为水稻重要农艺性状分子机理,E-mail:huiwutang@zhku.edu.cn.
文章历史
- 收稿日期:2023-07-23
【研究意义】水稻是世界上最重要的粮食作物之一,全球超过50% 的人口以大米为主食。近年来,随着全球气候变化加剧,高温胁迫频繁发生,严重制约着水稻的生产。因此,亟需开展水稻耐热基因的挖掘与功能分析,确保水稻生产的可持续发展。【前人研究进展】作为固着生物,植物已逐渐形成复杂且高效的调控网络,以快速响应各种生物和非生物胁迫[1-2]。例如,在逆境胁迫尤其是高温胁迫下,热激蛋白(Heat shock proteins,HSPs)在植物体内快速积累,并参与新生肽的折叠、组装、易位和降解,以阻止受损蛋白的累积,维护细胞内环境的稳定[3-6]。HSPs最早是在果蝇(Drosophila melanogaster)中被发现[7]。随后,研究人员在动物、植物和微生物中也鉴定到相应的HSPs基因[8]。根据分子量的大小,植物HSPs可以分为HSP100、HSP90、HSP70、HSP60和小分子HSPs(Small heat shock proteins,sHSPs)等家族[9-11]。sHSPs是植物中含量最丰富、分布最广泛的一类HSPs,其分子量一般在16~40 kD之间,不同sHSPs亚家族之间的N端结构域变化较大,而C端结构域相对保守,大部分sHSPs的C端含有1个大约由90个氨基酸组成的α- 晶体蛋白域(Alpha crystallin domain,ACD)[12-14]。ACD是sHSPs的进化保守区域,对sHSPs的寡聚化过程和生物活性具有重要作用[15]。在正常生长条件下,大多数sHSPs在植物组织中不表达,而在高温等逆境胁迫的诱导下,其表达量快速增加;但也有少数sHSPs在植物生长发育的特定时期表达,说明sHSPs除参与植物各种逆境胁迫响应外,还参与植物的生长发育调控[16-18]。玉米(Zea mays)钙依赖性蛋白激酶ZmCDPK7可以促使sHSP17.4和呼吸爆发氧化酶同源物RBOHB的磷酸位点磷酸化,通过介导sHSP17.4的磷酸化参与玉米的耐热性调控[19]。在拟南芥(Arabidopsis thaliana)中,sHSP22受IAA诱导表达,且该诱导过程依赖于ABA信号传导通路的主要负调控因子ABI1。sHSP22通过影响生长素极性运输调控生长素分布,同时负调控ABA信号途径,进而参与生长素介导的侧根发育调控。此外,在高温条件下,sHSP22还参与生长素介导的下胚轴伸长调控[20]。大豆(Glycine max)GmHSP17.9编码一个小分子热激蛋白,通过调节乙酰辅酶A的含量和琥珀酸脱氢酶(SDH)的活性,进而影响植物碳源和供能,参与调控根瘤发育和生物固氮[21]。【本研究切入点】水稻中关于sHSPs基因的功能研究较少,大部分sHSPs基因的功能及调控机理尚不清楚。【拟解决的关键问题】本研究通过生物信息学技术分析水稻小分子热激蛋白基因Os02g0782500的基因结构并构建系统进化树,利用qRT-PCR技术分析Os02g0782500在非生物胁迫和植物激素处理下的响应模式,以期为进一步研究Os02g0782500的生物学功能提供理论基础。
1 材料与方法 1.1 试验材料本研究以常规粳稻‘中花11’(Zhonghua 11,ZH11)为试验材料。2023年3月将水稻幼苗在光照培养箱中(28 ℃光照培养13 h、25 ℃黑暗培养11 h,相对湿度为60%)使用木村B营养液培养[22],每隔2 d更换1次营养液,培养至3~4叶期时进行各种处理。同时,2023年3月将萌发后的ZH11播种于广东省广州市试验田中,在3~4叶期时,提取ZH11幼根的总RNA;在孕穗期时,提取ZH11茎、叶和幼穗(2~3 cm)的总RNA,用于组织特异性表达分析。以上每个实验均设置3个生物学重复。
1.2 试验方法1.2.1 生物信息学分析 利用NCBI数据库获取Os02g0782500的CDS序列、启动子序列和氨基酸序列,借助SMART(http://smart.embl-heidelberg.de/)在线软件预测Os02g0782500结构域,使用MEGA 11进行氨基酸序列多重比对和系统进化树构建,并利用New Place(https://www. dna.affrc.go.jp/PLACE/?action=newplace)在线软件分析启动子顺式作用元件。
1.2.2 材料处理 将在光照培养箱中培养至3~4叶期的ZH11幼苗进行各种植物激素和逆境胁迫处理。植物激素处理为:将ZH11幼苗分别移至含有各种植物激素的木村B营养液中进行处理。各激素处理浓度为:10-5 mol/L生长素(IAA)、10-5 mol/L细胞分裂素(6-BA)和10-5 mol/L赤霉素(GA3)[23],处理0、1、2、8、24 h后收取水稻叶片并提取总RNA,用于Os02g0782500的表达分析。
非生物胁迫处理为:高温处理,将ZH11幼苗放置于42 ℃培养箱中;低温处理,将ZH11幼苗放置于4 ℃培养箱中;干旱处理,将ZH11幼苗置于含20% PEG 6000的营养液中;盐处理,将ZH11幼苗置于含200 mmol/L NaCl的营养液中。以上分别处理0、1、2、8、24 h后收取水稻叶片并提取总RNA,用于Os02g0782500的表达分析。
1.2.3 RNA提取和qRT-PCR分析 采用TRIzol法提取水稻样本总RNA。参照南京诺唯赞生物科技公司的逆转录试剂盒(Vazyme,R312-01)说明书进行反转录,合成cDNA第一链。在ABI PRISM 7500HT上进行实时荧光定量PCR(qRT-PCR),使用的荧光染料为2× SYBR(Vazyme,Q711-02)。qRT-PCR反应体系为20 µL,反应程序为95 ℃预变性1 min,1个循环;95 ℃变性5 s,60 ℃延伸30 s,40个循环,然后从65 ℃到95 ℃构建溶解曲线。以水稻基因Actin1作为内参,每个样品均设置3个技术重复,采用2-ΔΔCT计算Os02g0782500的表达水平。通过t检验进行差异显著性分析,P值小于0.05视为基因表达量发生显著变化。根据Os02g0782500基因序列,使用NCBI数据库中Primer-Blast(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)在线软件,设计特异引物,并于广州艾基生物技术有限公司合成。引物序列见表 1。
2 结果与分析 2.1 Os02g0782500的克隆和序列分析
本研究以ZH11叶片cDNA为模板,利用Os02g0782500的特异引物进行PCR扩增获得Os02g0782500的全长编码序列(Coding sequence,CDS),并对PCR产物进行测序分析。结果表明,ZH11中Os02g0782500的CDS为519 bp,且与NCBI数据库中‘日本晴’的序列完全一致。结构域预测结果显示,Os02g0782500在58~170 aa区域存在一个HSP20保守结构域(图 1),属于小分子热激蛋白HSP20基因家族。

|
| 黑色框为编码区,灰色框为UTR区,直线为内含子及上下游调控区 The black box represents coding regions; The gray box represents UTR regions; The think lines represent the intron, the upstream and downstream regions 图 1 Os02g0782500基因结构 Fig. 1 Gene structure of Os02g0782500 |
2.2 Os02g0782500同源蛋白序列比对及系统进化分析
将水稻Os02g0782500与其他植物的同源蛋白进行氨基酸序列比对,结果(图 2)显示,Os02g0782500与其同源蛋白在56~172 aa区域高度相似。为进一步了解Os02g0782500与其他植物同源蛋白之间的演化关系,本研究构建了Os02g0782500与其他植物同源蛋白的系统进化树,结果(图 3)表明,Os02g0782500与玉米(Zea mays)、高粱(Sorghum bicolor)、二穗短柄草(Brachypodium distachyon)、小麦(Triticum aestivum)和大麦(Hordeum vulgare)的同源蛋白亲缘关系较近,与番茄(Solanum lycopersicum)、菠菜(Spinacia oleracea)、拟南芥(Arabidopsis thaliana)、萝卜(Raphanus sativus)、马铃薯(Solanum tuberosum)等的亲缘关系相对较远。

|
| Oryza sativa:水稻(NP_001403908.1);Zea mays:玉米(PWZ20531.1);Sorghum bicolor:高粱(XP_002452929.1);Brachypodium distachyon:二穗短柄草(XP_003570701.1);Triticum aestivum:小麦(XP_044416930.1);Hordeum vulgare:大麦(KAI4982465.1);Solanum lycopersicum:番茄(NP_001234130.2);Spinacia oleracea:菠菜(XP_021847503.1);Arabidopsis thaliana:拟南芥(NP_001323264.1);Raphanus sativus:萝卜(XP_018450667.1);Solanum tuberosum:马铃薯(KAI4982465.1) 图 2 Os02g0782500及其同源蛋白的序列比对 Fig. 2 Sequence alignment of Os02g0782500 and its homologous proteins |

|
| Oryza sativa:水稻(NP_001403908.1);Zea mays:玉米(PWZ20531.1);Sorghum bicolor:高粱(XP_002452929.1);Brachypodium distachyon:二穗短柄草(XP_003570701.1);Triticum aestivum:小麦(XP_044416930.1);Hordeum vulgare:大麦(KAI4982465.1);Solanum lycopersicum:番茄(NP_001234130.2);Spinacia oleracea:菠菜(XP_021847503.1);Arabidopsis thaliana:拟南芥(NP_001323264.1);Raphanus sativus:萝卜(XP_018450667.1);Solanum tuberosum:马铃薯(KAI4982465.1) 图 3 Os02g0782500及其同源蛋白的系统进化分析 Fig. 3 Phylogenetic analysis of Os02g0782500 and its homologous proteins |
2.3 Os02g0782500启动子顺式作用元件分析
利用New Place(https://www.dna.affrc.go.jp/PLACE/?action=newplace)在线软件对Os02g0782500 ATG上游3 000 bp的启动子区序列进行分析,结果表明,Os02g0782500的启动子区除存在常见的顺式作用元件外,还存在35个环境胁迫(热激、冷害、干旱等)响应元件、28个植物激素响应元件(GA3、IAA、6-BA)和20个叶肉细胞分化相关顺式作用元件(表 2),表明Os02g0782500可能参与水稻叶肉细胞的发育调控,且在非生物胁迫和激素响应过程中发挥重要作用。
2.4 Os02g0782500的表达模式分析
利用qRT-PCR技术检测Os02g0782500在ZH11不同组织的表达模式,结果(图 4)显示,在正常生长条件下,Os02g0782500在ZH11各个组织中均有表达,且在叶片中的表达水平最高,表达量约为根部的70倍;其次为茎和穗,在根中的表达量最低。该结果表明Os02g0782500的表达具有明显的时空特异性,其可能在水稻不同组织部位发挥不同的生物学功能。
|
| Actin1:内参基因,**:与根部差异显著(P<0.01) Actin1 : An internal reference, **: Significant difference compared with root (P < 0.01) 图 4 Os02g0782500在水稻不同组织中的表达模式分析 Fig. 4 Expression analysis of Os02g0782500 in different tissues |
2.5 外源激素处理对Os02g0782500的表达影响分析
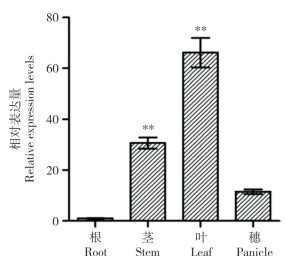
生物信息学分析表明,在Os02g0782500的启动子区域含有多个与激素响应相关的顺式元件,因此本研究利用qRT-PCR技术检测不同激素处理后Os02g0782500的表达变化。结果表明,IAA处理1 h后,Os02g0782500的表达水平显著上调,并在处理2 h后表达量达到最高,随后表达量降低。6-BA处理后,Os02g0782500的表达趋势与IAA处理相似。GA3处理2 h后,Os02g0782500的表达量达到最高,随后逐渐下降(图 5)。
|
| 10-5 mol/L生长素(A)、10-5 mol/L细胞分裂素(B)和10-5 mol/L赤霉素(C)处理下Os02g0782500的表达分析;Actin1为内参基因;*,P<0.05;**,P<0.01 Expression analysis of Os02g0782500 under10-5 mol/L IAA (A), 10-5 mol/L 6-BA (B) and 10-5 mol/L GA3 (C) treatments; Actin1 as an internal reference; *, P < 0.05; **, P < 0.01 图 5 不同激素处理下Os02g0782500的表达分析 Fig. 5 Expression analysis of Os02g0782500 under different hormone treatments |
2.6 非生物胁迫处理对Os02g0782500的表达影响分析
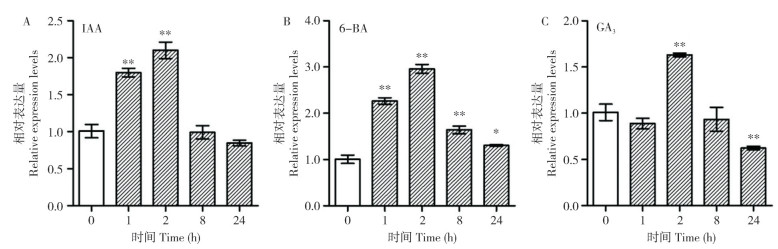
为研究Os02g0782500如何响应非生物胁迫,本研究利用qRT-PCR技术检测Os02g0782500在高温、低温、PEG和NaCl处理后的表达量变化。结果显示,高温处理后,Os02g0782500的表达量显著上调,高温处理1 h后表达量达到最高,随着处理时间的延长,表达量有所下降。低温处理后,Os02g0782500的表达水平呈先上调后下降趋势。PEG处理后,Os02g0782500的表达水平呈现逐渐上调的趋势,处理24 h时其表达水平到达峰值。NaCl处理后,Os02g0782500的表达量呈先上升再下降再上升的趋势,处理8 h后表达量最低,处理24 h后表达量最高(图 6)。
|
| 42 ℃(A)、4 ℃(B)、20% PEG 6000(C)和200 mmol/L NaCl(D)处理下Os02g0782500的表达分析;Actin1为内参基因;*,P<0.05;**,P<0.01 Expression analysis of Os02g0782500 under 42 ℃ (A), 4 ℃ (B), 20% PEG 6000 (C) and 200 mmol/L NaCl (D) treatments; Actin1 as an internal reference; *, P < 0.05; **, P < 0.01 图 6 非生物胁迫处理对Os02g0782500的表达影响 Fig. 6 Effects of abiotic stress treatments on the expression of Os02g0782500 |
3 讨论
水稻在生长发育过程中可能会受到各种逆境胁迫的影响,其中高温胁迫所产生的危害严重制约着水稻的生产[24]。研究表明,适温以上,夜间平均气温每升高1 ℃,水稻的平均产量将下降10%[25]。因此,深入研究水稻耐热相关基因的表达调控,阐明其响应高温胁迫的分子机制,对促进水稻安全生产具有重要意义。
小分子热激蛋白(sHSP)作为一种重要的分子伴侣,主要在胁迫条件下协助受损蛋白的正确折叠和降解,防止变性蛋白的非特异性聚集,维护细胞稳态。大多数sHSPs基因在高温等逆境胁迫的诱导下表达量快速增加,进而参与各种逆境胁迫响应。例如,在正常生长条件下,水稻sHSP17.7不表达,而在高温和干旱等胁迫条件下,sHSP17.7表达量显著增加。过量表达sHSP17.7可明显增强水稻幼苗对高温、UV-B和干旱胁迫的耐受性[12, 26]。在水稻中,OsHSP17.0和OsHSP23.7可受高温等胁迫快速诱导表达。过量表达OsHSP17.0和OsHSP23.7可提高转基因植株的耐旱性和耐盐性[27]。本研究在水稻中克隆了一个小分子热激蛋白HSP20基因家族成员Os02g0782500,系统进化分析表明,Os02g0782500与玉米、高粱、大麦和小麦的同源蛋白亲缘关系较近,而与双子叶植物的同源蛋白具有相对较远的亲缘关系,推测Os02g0782500在物种演化过程中受到了选择。启动子顺式作用元件分析表明,Os02g0782500的启动子中存在35个环境胁迫响应元件,推测Os02g0782500的转录表达可能受到逆境胁迫的调节,并参与各种逆境胁迫响应。qRT-PCR分析表明,高温、低温、PEG6000和NaCl等胁迫均能显著诱导Os02g0782500的表达,因此推测Os02g0782500可能参与水稻的逆境胁迫响应。在高温、低温和NaCl胁迫下,Os02g0782500的表达量均表现为先急剧升高、随后逐渐下降的趋势,推测Os02g0782500在高温等胁迫下的表达可能存在一个反馈调节机制。当水稻遇到高温等胁迫时,体内受损蛋白增加,从而使Os02g0782500的表达水平上调,防止受损蛋白的积累;当受损蛋白减少后,Os02g0782500的表达受到负反馈调节,以防止恢复期间Os02g0782500的进一步增加。在PEG6000处理下,Os02g0782500的表达量表现为逐渐上调的趋势,表明Os02g0782500可能在水稻抵御干旱胁迫后期发挥作用。此外,Os02g0782500的启动子中存在多个叶肉细胞分化相关的顺式作用元件,且在叶片中的表达量最高,推测Os02g0782500可能主要在叶片中发挥作用。
植物激素不仅能够参与植物的生长发育调控,还能感知各种非生物胁迫,在植物非生物胁迫响应过程中具有重要作用。在水稻中,AET1能够直接结合生长素响应因子OsARF的转录本,通过调控OsARF19和OsARF23的蛋白翻译效率参与水稻高温胁迫响应[28]。Li等[29]研究表明,在高温条件下,外施SA或6-BA可使玉米叶片中赤霉素和玉米素的含量增加、脱落酸和茉莉酸的含量降低,从而有利于蒸腾散热和CO2同化,减少高温胁迫对玉米光合作用的影响。本研究结果表明,Os02g0782500的启动子区域存在28个与植物激素响应相关的顺式作用元件,且Os02g0782500受IAA、6-BA和GA3的诱导表达,推测Os02g0782500参与了不同的激素信号通路。在IAA和6-BA的处理下,Os02g0782500的表达量均表现为先快速上升、随后下降的趋势,推测Os02g0782500可能在响应IAA和6-BA信号的初期发挥作用。此外,在IAA和6-BA的处理下,Os02g0782500的表达趋势与高温胁迫下的变化趋势一致,推测在高温胁迫下,Os02g0782500可能通过影响IAA和6-BA的运输过程改变其在植物体内的分布,通过IAA和6-BA的信号转导途径参与高温胁迫响应。本研究为后续深入研究Os02g0782500的生物学功能奠定了基础。
4 结论本研究在水稻中克隆了一个小分子热激蛋白HSP20家族成员Os02g0782500。Os02g0782500的启动子区存在多个激素及逆境胁迫响应相关的顺式作用元件,且高温、低温、PEG、NaCl、6-BA、GA3和IAA均可诱导Os02g0782500的表达,推测Os02g0782500可能通过IAA等激素信号转导途径参与水稻的非生物胁迫响应。
| [1] |
YAMANOUCHI U, YANO M, LIN H, ASHIKARI M, YAMADA K. A rice spotted leaf gene, spl7, encodes a heat stress transcription factor protein[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(11): 7530-7535. DOI:10.1073/pnas.112209199 |
| [2] |
OHAMA N, SATO H, SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. Transcriptional regulatory network of plant heat stress response[J]. Trends in Plant Science, 2017, 22(1): 53-65. DOI:10.1016/j.tplants.2016.08.015 |
| [3] |
TIMPERIO A M, EGIDI M G, ZOLLA L. Proteomics applied on plant abiotic stresses: role of heat shock proteins (HSP)[J]. Journal of Proteomics, 2008, 71(4): 391-411. DOI:10.1016/j.jprot.2008.07.005 |
| [4] |
AHUJA I, DE VOS R C, BONES A M, HALL R D. Plant molecular stress responses face climate change[J]. Trends in Plant Science, 2010, 15(12): 664-674. DOI:10.1016/j.tplants.2010.08.002 |
| [5] |
EHÜTTNER S, STRASSER R. Endoplasmic reticulum-associated degradation of glycoproteins in plants[J]. Frontiers in Plant Science, 2012, 3: 67. DOI:10.3389/fpls.2012.00067 |
| [6] |
PARK C J, SEO Y S. Heat shock proteins: A review of the molecular chaperones for plant immunity[J]. Plant Pathology Journal, 2015, 31(4): 323-333. DOI:10.5423/PPJ.RW.08.2015.0150 |
| [7] |
RITOSSA F. A new puffing pattern induced by temperature shock and DNP in Drosophila[J]. Experientia, 1962, 18(12): 571-573. DOI:10.1007/BF02172188 |
| [8] |
BARNETT T, ALTSCHULER M, MCDANIEL N C, MASCARENHAS P J. Heat shock induced proteins in plant cells[J]. Developmental Genetics, 1979, 1(4): 331-340. DOI:10.1002/dvg.1020010406 |
| [9] |
栗振义, 龙瑞才, 张铁军, 杨青川, 康俊梅. 植物热激蛋白研究进展[J]. 生物技术通报, 2016, 32(2): 7-13. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.003 LI Z Y, LONG R C, ZHANG T J, YANG Q C, KANG J M. Research progress on plant heat shock protein[J]. Journal of Biotechnology Bulletin, 2016, 32(2): 7-13. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.003 |
| [10] |
李广隆, 刘思言, 鲁中爽, 么梦凡, 李远强, 关淑艳, 姚丹, 曲静. 植物热激蛋白响应非生物胁迫研究进展[J]. 广东农业科学, 2019, 46(3): 24-30. DOI:10.16768/j.issn.1004-874X.2019.03.004 LI G L, LIU S Y, LU Z S, MO M F, LI Y Q, GUAN S Y, YAO D, QU J. Research advances in plant heat shock protein response to abiotic stress[J]. Guangdong Agricultural Sciences, 2019, 46(3): 24-30. DOI:10.16768/j.issn.1004-874X.2019.03.004 |
| [11] |
CSERMELY P, SCHNAIDER T, SOTI C, PROHÁSZKA Z, NARDAI G. The 90-kDa molecular chaperone family: structure, function, and clinical applications: A comprehensive review[J]. Pharmacology and Therapeutics, 1998, 79(2): 68-129. DOI:10.1016/s0163-7258(98)00013-8 |
| [12] |
SATO Y, YOKOYA S. Enhanced tolerance to drought stress in transgenic rice plants overexpressing a small heat-shock protein, sHSP17.7[J]. Plant Cell Reports, 2008, 27: 329-334. DOI:10.1007/s00299-007-0470-0 |
| [13] |
WATERS E R. The evolution, function, structure, and expression of the plant sHSPs[J]. Journal of Experimental Botany, 2013, 64(2): 391-403. DOI:10.1093/jxb/ers355 |
| [14] |
ZHANG Z, PEI X, ZHANG R, LU Y, ZHENG J, ZHENG Y. Molecular characterization and expression analysis of small heat shock protein 17.3 gene from Sorbus pohuashanensis (Hance) Hedl.in response to abiotic stress[J]. Molecular Biology Reports, 2020, 47(12): 9325-9335. DOI:10.1007/s11033-020-06020-2 |
| [15] |
YU C Y, LEUNG S K P, ZHANG W, LAI L T F, CHAN Y K, WONG M C, BENLEKBIR S, CUI Y, JIANG L, LAU W C Y. Structural basis of substrate recognition and thermal protection by a small heat shock protein[J]. Nature Communication, 2021, 12(1): 3007. DOI:10.1038/S41467-021-23338-Y |
| [16] |
CHEN Z L, GALLI M, GALLAVOTTI A. Mechanisms of temperature-regulated growth and thermotolerance in crop species[J]. Current Opinion in Plant Biology, 2022, 65: 102134. DOI:10.1016/j.pbi.2021.102134 |
| [17] |
LIU J, FENG L, GU X, DENG X, QIU Q, LI Q, ZHANG Y, WANG M, DENG Y, WANG E, HE Y, BÄURLE I, LI J, CAO X, HE Z. An H3K27me3 demethylase-HSFA2 regulatory loop orchestrates transgenerational thermome mory in Arabidopsis[J]. Cell Research, 2019, 29: 379-390. DOI:10.1038/s41422-019-0145-8 |
| [18] |
BALAZADEH S. A 'hot' cocktail: The multiple layers of thermomemory in plants[J]. Current Opinion in Plant Biology, 2022, 64: 102-147. DOI:10.1016/J.PBI.2021.102147 |
| [19] |
ZHAO Y, DU H, WANG Y, WANG H, YANG S, LI C, CHEN N, YANG H, ZHANG Y, ZHU Y, YANG L, HU X. The calcium-dependent protein kinase ZmCDPK7 functions in heat-stress tolerance in maize[J]. Journal of Integrative Plant Biology, 2021, 63: 510-527. DOI:10.1111/jipb.13056 |
| [20] |
LI Y, LI Y, LIU Y, WU Y, XIE Q. The sHSP22 heat shock protein requires the ABI1 protein phosphatase to modulate polar auxin transport and downstream responses[J]. Plant Physiology, 2018, 176(3): 2406-2425. DOI:10.1104/pp.17.01206 |
| [21] |
YANG Z, DU H, XING X, LI W, KONG Y, LI X, ZHANG C. A small heat shock protein, GmHSP17.9, from nodule confers symbiotic nitrogen fixation and seed yield in soybean[J]. Plant Biotechnology Journal, 2022, 20(1): 103-115. DOI:10.1111/PBI.13698 |
| [22] |
姜晓婷, 黄高翔, 熊小英, 黄芸培, 丁昌峰, 丁明军, 王鹏. 秧苗富锌对不同水稻品种镉积累及相关转运基因的影响[J]. 中国农业科学, 2022, 55(17): 3267-3277. DOI:10.3864/j.issn.0578-1752.2022.17.001 JIANG X T, HUANG G X, XIONG X Y, HUANG Y P, DING C F, DING M J, WANG P. Effects of seedling zinc enrichment on cadmium accumulation and related transport genes in different rice varieties[J]. Scientia Agriculture Sinica, 2022, 55(17): 3267-3277. DOI:10.3864/j.issn.0578-1752.2022.17.001 |
| [23] |
范锡麟, 杜强, 杨珍珍, 何艳冰, 王国梁, 王志龙. 水稻泛素连接酶基因OsRING6的克隆及表达分析[J]. 植物遗传资源学报, 2016, 17(2): 337-343. DOI:10.13430/j.cnki.jpgr.2016.02.019 FAN X L, DU Q, YANG Z Z, HE Y B, WANG G L, WANG Z L. Cloning and expression analysis of ubiquitin ligase gene OsRING6 in rice[J]. Journal of Plant Genetic Resources, 2016, 17(2): 337-343. DOI:10.13430/j.cnki.jpgr.2016.02.019 |
| [24] |
丁杰荣, 孙炳蕊, 王庆林, 范芝兰, 潘大建, 陈文丰, 李晨, 刘清. 水稻耐热相关功能基因的克隆及其分子机理研究进展[J]. 广东农业科学, 2021, 48(10): 23-31. DOI:10.16768/j.issn.1004-874X.2021.10.003 DING J R, SUN B R, WANG Q L, FAN Z L, PAN D J, CHEN W F, LI C, LIU Q. Cloning and molecular mechanism of functional genes related to heat resistance in rice[J]. Guangdong Agricultural Sciences, 2021, 48(10): 23-31. DOI:10.16768/j.issn.1004-874X.2021.10.003 |
| [25] |
PENG S, HUANG J, SHEEHY JE, LAZA R C, VISPERAS R M, ZHONG X, CENTENO G S, KHUSH G S, CASSMAN K G. Rice yields decline with higher night temperature from global warming[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(27): 9971-9975. DOI:10.1073/pnas.0403720101 |
| [26] |
MURAKAMI T, MATSUBA S, FUNATSUKI H, KAWAGUCHI K, SARUYAMA H, TANIDA M, SATO Y. Over-expression of a small heat shock protein, sHSP17.7, confers both heat tolerant and UV-B resistant to rice plants[J]. Molecular Breeding, 2004, 13: 165-175. DOI:10.1023/B:MOLB.0000018764.30795.c1 |
| [27] |
ZOU J, LIU C, LIU A, ZOU D, CHEN X. Overexpression of OsHsp17.0 and OsHsp23.7 enhances drought and salt tolerance in rice[J]. Journal of Plant Physiology, 2012, 169(6): 658-635. DOI:10.1016/j.jplph.2011.12.014 |
| [28] |
CHEN K, GUO T, LI X M, ZHANG Y M, YANG Y B, YE W W, DONG N Q, SHI C L, KAN Y, XIANG Y H, ZHANG H, LI Y C, GAO J P, HUANG X, ZHAO Q, HAN B, SHAN J X, LIN H X. Translational regulation of plant response to high temperature by a dual-function tRNA His guanylyltransferase in rice[J]. Molecular Plant, 2019, 12: 1123-1142. DOI:10.1016/j.molp.2019.04.012 |
| [29] |
LI Y, HAN X, REN H, ZHAO B, ZHANG J, REN B GAO H, LIU P. Exogenous SA or 6-BA maintains photosynthetic activity in maize leaves under high temperature stress[J]. The Crop Journal, 2023, 11(2): 605-617. DOI:10.1016/j.cj.2022.08.006 |
(责任编辑 马春敏)
 2023, Vol. 50
2023, Vol. 50