文章信息
基金项目
- 国家自然科学基金(32060473)
作者简介
- 丁法(2000—),男,苗族,学士,研究方向为作物遗传育种,E-mail:3242390277@qq.com.
通讯作者
- 刘芳(1975—),女,博士,副教授,研究方向为水稻分子育种,E-mail:liufang1975@163.com.
文章历史
- 收稿日期:2023-10-05
【研究意义】水稻细菌性条斑病简称“细条病”或“条斑病”,是由黄单胞菌属稻黄单胞菌致病变种(Xanthomonas oryzae pv. Oryzicola,Xoc)引发的细菌性病害[1]。近年来,该病已成为东南亚国家及我国南方稻区危害最严重的病害之一,每年都会在水稻主产区引起严重病害,造成水稻减产[2]。通过化学药剂防治细条病,易造成病菌耐药性、污染环境。植物激素是植物自身合成的一类微量有机化合物,其作用广泛而复杂,参与植物对多种外界刺激的应答过程,在病原菌与植物相互作用的过程中发挥关键作用。茉莉酸(JA)是一类环戊酮衍生物类物质,是重要的植物激素,包括JA及其衍生物茉莉酸甲酯(MeJA)等,在植物响应生物和非生物胁迫中具有重要功能,是诱导性系统抗性(Induced systemic resistance ISR)产生的关键信号分子[3-4]。外源JA在诱导植物抗病性方面的作用备受人们关注。研究外源JA对水稻细条病抗性的影响具有重要意义,可为探索绿色、安全的细条病防控措施提供依据。【前人研究进展】研究表明MeJA可诱导植物特异基因的表达,产生茉莉酸诱导蛋白,例如苯丙氨酸裂解酶(PAL)和查尔酮合成酶(CHS)等植物抗病防卫反应的关键酶,从而启动植物病害防御系统,进一步诱发植保素和木质素等。植保素和木质素分别通过抗菌作用和使受伤害的部位木质化形成化学屏障,以限制病原菌的扩展,参与多种抗病过程[5]。水稻细条病菌的侵染会引起抗、感近等基因系植株内源JA含量发生变化,参与抗病反应[6]。叶面喷施MeJA可显著降低水稻黑条矮缩病(Rice black-streaked dwarf virus disease,RBSDVD)的发病率,证明JA介导水稻对RBSDVD的抗性[7]。王云峰等[8]用外源JA处理与稻瘟病菌互作过程中特定时期的水稻,能减轻水稻稻瘟病的发病症状,并诱导水稻病程相关基因和茉莉酸途径相关基因上调表达,抑制水杨酸途径相关基因的大幅上调表达。向妙莲等[9]研究表明喷施外源MeJA能诱导水稻幼苗对白叶枯病的抗性,提高水稻相关防御酶的活性。当MeJA浓度为0.1 mmol/L时诱导效果最佳。外源MeJA也能诱导水稻幼苗对细条病的抗性,且诱导抗病性强弱与其浓度和处理时间有关[10]。【本研究切入点】前人多用单一水稻材料研究MeJA诱导水稻抗细条病的效果,而抗、感细条病材料对于MeJA的响应机制有何差异尚不清楚;MeJA如何诱导受细条病菌侵染水稻防御相关基因的表达,也尚未见报道。【拟解决的关键问题】研究MeJA处理后不同时间点接种细条病菌对细条病抗、感近等基因系的诱导抗病效果;探讨MeJA处理后,抗、感近等基因系响应细条病菌侵染的茉莉酸、水杨酸和乙烯途径相关基因以及病程相关基因的表达变化,为防治水稻细条病提供理论依据。
1 材料与方法 1.1 试验材料供试水稻:水稻细条病抗性近等基因系K9(简称K9植株)和感性近等基因系G9(简称G9植株),由广西大学野生稻资源保护与利用课题组提供。于2022年8月种植在广西大学农学院科学研究试验基地。
供试菌株:广西水稻细条病优势菌株GX01,由广西大学农学院何勇强教授提供。
1.2 试验方法1.2.1 激素处理与样品采集 待K9和G9植株长至分蘖期时,分别喷施0.1 mmol/L的茉莉酸甲酯溶液(MeJA),以喷施清水为对照。喷施至水稻植株叶面上有水珠自然滑落即可,每个处理间设置保护行。分别于喷施MeJA后的0、12、24、48、72 h接种水稻细条病病菌,充分发病后每个处理测量6株,记录其病斑长度。对于喷施MeJA 48 h后接种水稻细条病病菌的植株还进行取样,用于实时荧光定量PCR检测。分别在接种后的0、6、12、24、48 h采集接菌部位(以针孔为中心约1cm2),置于液氮保存。K9和G9植株各采集15株,每个处理3次重复。
1.2.2 水稻细条病病菌接种与病斑测量 用NA培养基活化GX01菌株,挑取单菌落置于200 mL NB培养基中,28 ℃、200 r/min恒温培养至对数期,即可用于接种。在天气良好、气温26 ℃左右的环境条件下,采用针刺法接种水稻细条病病菌。用针在水稻新叶中部偏上位置的叶脉两侧扎2个对称小孔,将扎好孔的叶片轻轻浸泡于上述菌液中,使菌液进入叶肉细胞间隙,接种后的叶片小孔位置会有明显的水浸润圈,每株接种3片叶。在水稻细条病充分发病后(约接种后15 d),测量其病斑长度。
1.2.3 RNA的提取、反转录和实时荧光定量PCR 使用植物VAHTS FastPure Universal Plant Total RNA Isolation Kit试剂盒(南京诺唯赞生物科技股份有限公司)提取叶片总RNA。反转录cDNA根据VAHTS HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)试剂盒的步骤操作。使用ABI Quant Studio 6 Flex Real-Time PCR仪进行荧光定量PCR检测。
PCR反应体系:1 μL cDNA模板、5 μL 2× ChamQ Universal SYBR qPCR Master Mix、上下游引物各0.2 μL,RNase-Free ddH2O调至总体积10 μL。荧光定量PCR反应程序:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环;72 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,0.05 ℃ /s速率升温至95 ℃(收集荧光),95 ℃ 15 s。以Actin为内参基因,目标基因相对表达量采用2-ΔΔCt方法进行分析,引物序列见表 1。每个cDNA样品3次重复。
1.3 统计分析
病斑数据采用Excel作图,荧光定量PCR结果采用Graghpad Prism软件进行作图分析。采用SPSS软件进行t测验。
2 结果与分析 2.1 外源喷施MeJA后接种细条病菌对水稻细条病发病的影响在分蘖期的K9、G9植株叶片喷施MeJA后,分别于0、12、24、48、72 h接种水稻细条病菌,并调查发病情况。如图 1A所示,除12 h外,K9植株各时间点的病斑长度均显著短于对照,其中48 h的病斑长度最短,表明喷施MeJA后48 h接种细条病菌,对水稻细条病发病的抑制效果最好。G9植株在MeJA处理后0 h和12 h接种的病斑长度显著长于对照,24 h和48 h接种的病斑长度与对照无显著差异,而72 h接种的病斑长度显著短于对照(图 1B)。表明G9植株在受到细条病菌侵染前72 h喷施MeJA才可抑制细条病发病。

|
| * 表示差异显著 * represents significant difference 图 1 茉莉酸甲酯处理后不同时间点接种细条病菌对K9(A)和G9(B)植株发病的影响 Fig. 1 Effect of different inoculation time points after MeJA treatment on symptoms of K9 (A) and G9 (B) plants |
2.2 外源喷施MeJA后48 h接种细条病菌对茉莉酸途径相关基因表达的影响
外源喷施MeJA 48 h后接种细条病病菌,利用qRT-PCR检测接种后0、12、24、48、72 h茉莉酸途径相关基因的表达变化。如图 2A~B所示,K9和G9植株的LOX2相对表达量在接种后0~6 h迅速升高,且均在6 h达到峰值。MeJA处理的K9和G9植株LOX2相对表达量在接种后各时间点均显著高于对照处理。表明外源MeJA会诱导抗、感性近等基因系植株LOX2基因在接种细条病菌后上调表达。

|
| K9:抗性近等基因系植株;G9:感性近等基因系植株;* 表示差异显著 K9: BLS-resistant near isogenic line plant; G9: BLS-susceptible near isogenic line plant; * represents significant difference 图 2 茉莉酸甲酯处理水稻植株48 h后接种细条病菌不同时间点茉莉酸途径相关基因的相对表达量 Fig. 2 Relative expression of jasmonate-pathway related genes at different time points after spraying MeJA on rice plants for 48 h then inoculated with Xoc |
如图 2C~D所示,喷施MeJA的K9和G9植株AOS2相对表达量在接种后0~24 h均大幅上调,K9植株在12 h达到峰值,G9植株则在24 h达到峰值。MeJA处理的K9和G9植株AOS2相对表达量在接种后0 h~24 h都显著高于对照处理。结果表明外源MeJA会诱导抗、感性近等基因系植株AOS2基因在接种细条病菌后上调表达。
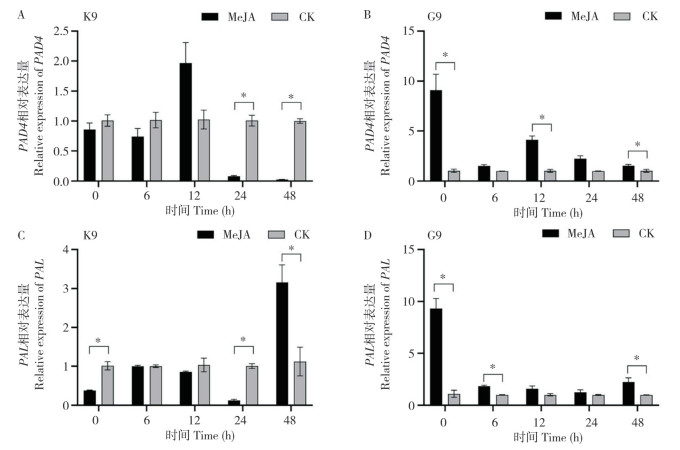
2.3 外源喷施MeJA后48 h接种细条病菌对水杨酸途径相关基因表达的影响外源喷施MeJA后48 h接种细条病病菌,利用qRT-PCR检测接种后0、12、24、48、72 h水杨酸途径相关基因的表达变化。如图 3A所示,喷施MeJA的K9植株PAD4相对表达量在接种后0~12 h与对照相比无显著差异,而在接种后24 h和48 h与对照相比显著下调。如图 3B所示,MeJA处理的G9植株PAD4相对表达量在接种后各时间点均高于对照处理,其中在接种后0 h、12 h和48 h差异显著。可见外源MeJA会引起K9植株PAD4基因在接种细条病菌后下调表达;而诱导G9植株PAD4基因在接种细条病菌后上调表达。如图 3C所示,喷施MeJA的K9植株PAL相对表达量在接种后0、24、48 h与对照相比差异显著,其中在接种后0 h和24 h,MeJA处理的PAL相对表达量显著低于对照处理,但在接种后48 h又显著高于对照处理。如图 3D所示,喷施MeJA的G9植株PAL相对表达量在接种后各时间点均高于对照处理的,其中在接种后0、6、48 h差异显著。可见外源MeJA会引起K9植株PAL基因在接种细条病菌后前期下调表达;而诱导G9植株PAL基因在接种细条病菌后上调表达。
|
| K9:抗性近等基因系植株;G9:感性近等基因系植株;* 表示差异显著 K9: BLS-resistant near isogenic line plant; G9: BLS-susceptible near isogenic line plant; * represents significant difference 图 3 茉莉酸甲酯处理水稻植株48 h后接种细条病菌不同时间点水杨酸途径相关基因的相对表达量 Fig. 3 Relative expression of salicylic acid-pathway related genes at different time points after spraying MeJA on rice plants for 48 h then inoculated with Xoc |
2.4 外源喷施MeJA后48 h接种细条病菌对乙烯途径相关基因表达的影响
外源喷施MeJA后48 h接种细条病病菌,利用qRT-PCR检测接种后0、12、24、48、72 h乙烯途径相关基因的表达变化。如图 4A~B所示,喷施MeJA的K9和G9植株EIN2相对表达量在接种后各时间点均受到抑制,即在接种后0~48 h均显著低于对照处理。可见,外源MeJA会抑制K9、G9植株EIN2基因在接种细条病菌后表达。

|
| K9:抗性近等基因系植株;G9:感性近等基因系植株;* 表示差异显著 K9: BLS-resistant near isogenic line plant; G9: BLS-susceptible near isogenic line plant; * represents significant difference 图 4 茉莉酸甲酯处理水稻植株48 h后接种细条病菌不同时间点乙烯途径相关基因的相对表达量 Fig. 4 Relative expression of ethylene-pathway related genes at different time points after spraying MeJA on rice plants for 48 h then inoculated with Xoc |
如图 4C所示,与对照相比,喷施MeJA的K9植株ERF70基因在接种后0、24、48 h的相对表达量显著下调,在接种后6 h和12 h的相对表达量与对照相比无显著差异。如图 4D所示,与对照相比,喷施MeJA的G9植株ERF70基因在接种后0 h的相对表达量显著上调,在其他时间点则无显著差异。整体上看,外源MeJA会抑制K9植株ERF70在接种细条病菌后表达,而对G9植株ERF70在接种细条病菌后的表达影响不大。
2.5 外源喷施MeJA 48 h后接种细条病菌对病程相关基因表达的影响外源喷施MeJA后48 h接种细条病病菌,利用qRT-PCR检测接种后0、12、24、48、72 h病程相关基因的表达变化。如图 5A所示,喷施MeJA的K9植株PR1a基因在接种细条病病菌后的表达明显受到抑制,与对照相比,喷施MeJA的K9植株PR1a相对表达量在接种后0、6、12、24 h显著下调。如图 5B所示,与对照相比,喷施MeJA的G9植株PR1a基因相对表达量在接种后0 h和12 h显著下调,在接种后6、24、48 h则显著上调,且在接种后24 h上调幅度最大。从整体上看,外源MeJA会抑制K9植株PR1a在接种细条病菌后表达;而诱导G9植株PR1a在接种细条病菌后表达。

|
| K9:抗性近等基因系植株;G9:感性近等基因系植株;* 表示差异显著 K9: BLS-resistant near isogenic line plant; G9: BLS-susceptible near isogenic line plant; * represents significant difference 图 5 茉莉酸甲酯处理水稻植株48 h后接种细条病菌不同时间点病程相关基因的相对表达量 Fig. 5 Relative expression of pathogenesis-related genes at different time points after spraying MeJA on rice plants for 48 h then inoculated with Xoc |
如图 5C所示,与对照相比,喷施MeJA的K9植株PR10基因相对表达量在接种后0、6、12、48 h显著上调,在接种后24 h显著下调;如图 5D所示,与对照相比,喷施MeJA的G9植株PR10基因在接种后各时间点均上调表达,且在接种后0、24、48 h差异达5% 显著水平。从整体上看,外源MeJA会诱导K9、G9植株PR10在接种细条病菌后上调表达。
3 讨论JA不仅可以通过诱导植物生理变化而形成防御性结构,也可以诱导信号途径下游防御基因的表达,是增强植物对病原物抗性的关键。水稻对半活体营养型稻瘟病病菌(Magrtaporthe oryzae)和白叶枯病病菌(Xanthomoras oryzae pv.oryzae)的抗性可以通过外源施用JA增强[11-12]。外源喷施JA还能增强水稻对死体营养型水稻纹枯病病菌(Rhizoctonia solani)的抗性[13]。应用4种不同浓度(0.01、0.1、0.5和1 mmol/L)的JA显著提高了水稻对R. solani的抗性,JA浓度为0.1 mmol/L时效果最佳,超过该浓度病斑长度开始增加,抗性下降[14]。向妙莲等[10]研究了MeJA诱导水稻幼苗对细条病抗性的适宜浓度,发现0.1、0.5和1.0 mmol/L 3种浓度的MeJA诱导效果较好,均达43.0% 以上,0.01和5.0 mmol/L的诱导效果次之,分别为19.6% 和21.5%。同时还探讨了MeJA处理后不同时间接种与细条病抗性的关系,结果表明,0.5 mmol/L MeJA处理水稻幼苗,1、3、5、7和10 d后接种,病情指数均明显低于对照,诱导效果依次为25.6、31.3、51.3、54.6和47.8%。本研究同样发现MeJA处理后接种时间点是影响细条病抗性的重要因素,随着MeJA处理后接种时间点的不同,抗、感近等基因系对细条病菌的抗性反应不同。抗性近等基因系植株在喷施MeJA后0、24、48、72 h接种都能增强细条病抗性,以48 h接种的效果最好;而感病近等基因系植株只在喷施MeJA后72 h接种才能对细条病发病产生抑制效果。我们注意到感性近等基因系在对照处理后0 h和24 h接种的病斑长度分别为17.4 mm和29.2 mm,呈现较大波动。推测是由于接种当天的温度和湿度差异所致。故在同一接种时间点上,对MeJA处理和对照处理进行比较,获得差异显著性分析结果。由于本试验MeJA只采用了一种浓度(0.1 mmol/L)进行处理,对于其他浓度的MeJA处理抗、感性材料是否也会具有相同趋势还有待试验进一步证明。
MeJA处理48 h后接种细条病菌,对抗性近等基因系的发病有抑制作用,对感性近等基因系的发病无影响。即此时间点接种对两者发病的抑制效果不同。因此我们进一步检测MeJA处理48 h后接种K9和G9植株激素途径相关基因的表达变化,以探讨外源MeJA诱导抗、感性近等基因系抗病效果不同的原因。脂氧合酶基因(LOX)和丙烯氧化物合酶基因(AOS)是茉莉酸合成途径的两个重要的基因[3]。PAL经由苯丙氨酸途径参与水杨酸的合成,植物抗毒素缺陷4基因(PAD4)经由异分支酸途径参与水杨酸的合成。乙烯不敏感受体2基因(EIN2)和乙烯响应因子70(ERF70)是与乙烯合成和信号途径有关的两个基因,EIN2是乙烯信号转导所必需的,ERF是乙烯信号转导途径中最下游的元件,同时影响乙烯的合成并在植物的应激反应中发挥作用。水稻中的病程相关蛋白1基因(PR1a)是双子叶植物PR 1的同源基因,在依赖水杨酸的防御转导途径中发挥作用。而病程相关蛋白10基因(PR10)则在依赖茉莉酸和依赖水杨酸途径中都发挥作用。上述基因常见于水稻与病原菌互作的抗性分子机理研究中[15-17],故本研究选用这8个基因进行检测。在受到病原菌侵害后,植物体内JA含量的增加,激活多种转录因子,从而启动LOX、AOS等JA反应基因的表达。JA信号通路作为主要的应激激素通路,与其他植物激素相互作用,形成一个与其他信号通路相连的复杂信号网络调节植物对环境的反应[18-20]。过表达OsWRKY30的转基因水稻株系对纹枯病和稻瘟病的抗性增强,与JA合成相关基因LOX、AOS2和病程相关基因PR3和PR10的激活表达,以及真菌病原体胁迫下内源性JA积累有关[21]。王云峰[8]等用外源JA处理水稻6 h后接种稻瘟病病菌,水稻JA途径相关基因AOS2相对表达量在各时间点均高于无菌水对照处理的;水杨酸途径相关基因EDS1和PAL相对表达量在接种后96 h和120 h显著低于对照处理的,结果表明茉莉酸与水杨酸互为拮抗。本研究喷施0.1 mmol/L外源MeJA后48 h接种水稻细条病菌,结果表明抗、感近等基因系水稻中JA途径相关基因AOS2和LOX2相对表达量上调。在抗性近等基因系中水杨酸合成途径的关键基因PAD4和PAL相对表达量下调,上述茉莉酸与水杨酸途径相关基因的表达方向相反;而在感性近等基因系中PAD4和PAL相对表达量上调,上述茉莉酸与水杨酸途径相关基因的表达方向相同。
乙烯通常与JA协同作用,诱导植物对死体营养型病原菌的抗性。研究表明,叶面喷施乙烯利可以激活水稻根部病程相关基因PRs和JA信号基因OsJAmyb,增强对根结线虫的抗性[22]。也有研究表明乙烯负调控水稻的免疫反应。阻断乙烯信号通路可以显著增强宿主对水稻矮缩病毒感染的耐受性[17, 23]。本研究用0.1 mmol/L MeJA处理水稻后48 h接种水稻细条病菌,结果表明外源MeJA会抑制抗、感性近等基因系植株乙烯信号转导通路关键基因EIN2的表达,抑制抗性近等基因系植株乙烯信号转导通路下游基因ERF70的表达,但对感性近等基因系ERF70的表达影响不大。这种JA和乙烯可以拮抗调控植物防御反应也见报道[24]。PR蛋白被认为是系统获得性抗性反应的标志物蛋白。PR10基因高水平表达意味着植物抗性增强[25]。本研究结果表明外源MeJA会诱导抗、感性近等基因系植株PR10在接种后上调表达。但是病程相关基因PR1a在两种材料中的表达方向则相反:外源MeJA抑制抗性近等基因系植株PR1a在接种后表达;而诱导感性近等基因系植株PR1a在接种后上调表达。可见喷施外源MeJA后,无论是抗性还是感性材料,一致通过上调茉莉酸途径相关基因AOS2、LOX2和病程相关基因PR10的表达量,下调乙烯途径相关基因EIN2的表达量来响应细条病菌的侵染。鉴于各种激素信号途径在植物抗病过程中不是独立存在的,而是它们之间的信号交互使植物能够有效地抵御病原菌的侵染[26],推测喷施外源MeJA后,在抗、感近等基因系中SA途径相关基因PAL、PAD4、乙烯途径相关基因ERF70和病程相关基因PR1a的差异表达(在抗性近等基因系下调,在感性近等基因系上调),可能导致外源MeJA诱导抗、感近等基因系的抗病效果不同。
4 结论MeJA处理后接种细条病菌时间点是影响细条病抗性的重要因素。喷施0.1 mmol/L MeJA后0、24、48、72 h接种水稻细条病菌发现,K9植株叶片病斑长度显著短于对照,48 h的病斑最短;G9植株0 h、12 h的叶片病斑长度显著长于对照,24 h和48 h与对照无显著差异,72 h的病斑长度显著短于对照,表明喷施MeJA后72 h接种对细条病发病有抑制作用。喷施0.1 mmol/L MeJA后48 h接种水稻细条病菌,对K9、G9植株发病的抑制效果不同。实时荧光定量PCR检测结果发现,茉莉酸途径相关基因AOS2、LOX2、病程相关基因PR10在K9、G9植株中相对表达量均较对照上调,乙烯途径相关基因EIN2下调;而水杨酸途径相关基因PAL、PAD4、乙烯途径相关基因ERF70和病程相关基因PR1a在K9植株中相对表达量较对照下调,在G9植株中,PAL、PAD4和PR1a相对表达量较对照上调,ERF70相对表达量较对照无显著差异。外源MeJA通过诱导上述激素途径相关基因的表达,参与对细条病侵染的防御反应。
| [1] |
NIÑO-LIU D O, RONALD P C, BOGDANOVE A J. Xanthomonas oryzae pathovars: Model pathogens of a model crop[J]. Molecular Plant Pathology, 2006, 7(5): 303-324. DOI:10.1111/j.1364-3703.2006.00344.x |
| [2] |
张荣胜, 陈志谊, 刘永锋. 水稻细菌性条斑病研究进展[J]. 江苏农业学报, 2014, 30(4): 901-908. DOI:10.3969/j.issn.1000-4440.2014.04.034 ZHANG R S, CHEN Z Y, LIU Y F. Research progress on rice bacterial stripe[J]. Jiangsu Agricultural Journal, 2014, 30(4): 901-908. DOI:10.3969/j.issn.1000-4440.2014.04.034 |
| [3] |
WASTERNACK C, HAUSE B. Jasmonates: Biosynthesis, perception, signal transduction and action in plant stress response, growth and development.An update to the 2007 review in annals of botany[J]. Annals of Botany, 2013, 111(6): 1021-1058. DOI:10.1093/aob/mct067 |
| [4] |
DE VLEESSCHAUWER D, GHEYSEN G, HÖFTE M. Hormone defense networking in rice: Tales from a different world[J]. Trends in Plant Science, 2013, 18(10): 555-565. DOI:10.1016/j.tplants.2013.07.002 |
| [5] |
王瑜, 吴丽芳, 余增亮. 茉莉酸及其甲酯在植物诱导抗病性中的作用[J]. 生物学杂志, 2000(1): 12-13. WANG Y, WU L F, YU Z L. The role of jasmonic acid and methy jasmonate in plant induced disease resistance[J]. Journal of Biology, 2000(1): 12-13. |
| [6] |
何圣贤, 万瑶, 覃雪梅, 张慧, 刘芳. 水稻细菌性条斑病菌侵染后抗、感近等基因系内源激素含量的变化[J]. 广东农业科学, 2020, 47(3): 90-96. DOI:10.16768/j.issn.1004-874X.2020.08.012 HE S X, WAN Y, QIN X M, ZHANG H, LIU F. Changes of endogenous hormone content in resistant and susceptible near-isogenic lines of rice after infection with Xanthomonas oryzae pv.oryzicola[J]. Guangdong Agricultural Sciences, 2020, 47(3): 90-96. DOI:10.16768/j.issn.1004-874X.2020.08.012 |
| [7] |
HE Y Q, ZHANG H H, SU Z T, LI J M, HONG G J, ZHU Q S, ZHOU X B, MACFARLANE S, YAN F, CHEN J P. Jasmonic acid-mediated defense suppresses brassinosteroid-mediated susceptibility to rice black streaked dwarf virus infection in rice[J]. New Phytologist, 2017, 214(1): 388-399. DOI:10.1111/nph.14376 |
| [8] |
王云锋, 王长秘, 李春琴, 刘林, 李晓杰, 李晓疆, 杨静. 稻瘟病菌侵染时水稻防御体系对外源茉莉酸的响应分析[J]. 南方农业学报, 2018, 49(7): 1324-1331. DOI:10.3969/j.issn.2095-1191.2018.07.10 WANG Y F, WANG C M, LI C Q, LIU L, LI X J, LI X J, YANG J. Response of rice defense system to exogenous jamonisic acids during rice blast strain infecting rice[J]. Journal of Southern Agriculture, 2018, 49(7): 1324-1331. DOI:10.3969/j.issn.2095-1191.2018.07.10 |
| [9] |
向妙莲, 何永明, 付永琦, 曾晓春, 黄俊宝, 黄友明. 茉莉酸甲酯对水稻白叶枯病的诱导抗性及相关防御酶活性的影响[J]. 植物保护学报, 2013, 40(2): 97-101. DOI:10.13802/j.cnki.zwbhxb.2013.02.009 XIANG M L, HE Y M, FU Y Y, ZENG X C, HUANG J B, HUANG Y M. Effect of methyl jasmonate on induced resistance of rice seedlings against bacterial leaf blight and activities of related defense enzymes[J]. Acta Phytophylacica Sinica, 2013, 40(2): 97-101. DOI:10.13802/j.cnki.zwbhxb.2013.02.009 |
| [10] |
向妙莲, 陈明, 曾晓春, 何永明, 黄俊宝. 茉莉酸甲酯对水稻幼苗抗细菌性条斑病的诱导效应[J]. 江西农业大学学报, 2011, 33(3): 679-683. DOI:10.13836/j.jjau.2011121 XIANG M L, CHEN M, ZENG X C, HE Y M, HUANG J B. Effects of methyl jasmonate on induced resistance of rice seedlings against bacterial leaf stripe[J]. Acta Agriculturae Universitatis Jiangxiensis, 2011, 33(3): 679-683. DOI:10.13836/j.jjau.2011121 |
| [11] |
YAMADA S, KANO A, TAMAOKI D, MIYAMOTO A, SHISHIDO H, MIYOSHI S, TANIGUCHI S, AKIMITSU K, GOMI K. Involvement of OsJAZ8 in jasmonate-induced resistance to bacterial blight in rice[J]. Plant and Cell Physiology, 2012, 53(12): 2060-2072. DOI:10.1093/pcp/pcs145 |
| [12] |
RIEMANN M, HAGA K, SHIMIZU T, OKADA K, ANDO S, MOCHIZUKI S, NISHIZAWA Y, YAMANOUCHI U, NICK P, YANO M, MINAMI E, TAKANO M, YAMANE H, IINO M. Identification of rice Allene Oxide Cyclase mutants and the function of jasmonate for defence against Magnaporthe oryzae[J]. The Plant Journal, 2013, 74(2): 226-238. DOI:10.1111/tpj.12115 |
| [13] |
TAHERI P, TARIGHI S. Riboflavin induces resistance in rice against Rhizoctonia solani, via jasmonate-mediated priming of phenylpropanoid pathway[J]. Journal of Plant Physiology, 2010, 167(3): 201-208. DOI:10.1016/j.jplph.2009.08.003 |
| [14] |
YOUNIS H, QINGYAN Z, FU L L, LILI P, SONGRUN Y, REXITI M, SHUO Y, WEI S Y, SIDDIQUE F, MENG W, JUNHUA Z. Exogenous application of jasmonic acid triggers the rice defense mechanisms against Rhizoctonia solani Kühn[J]. Russian Journal of Plant Physiology, 2022, 69(7): 167. DOI:10.1134/S1021443722601665 |
| [15] |
MA Z F, QIN G, ZHANG Y X, LIU C, WEI M Y, CEN Z L, YAN Y, LUO T P, LI Z J, LIANG H F, HUANG D H, DENG G F. Bacterial leaf streak 1 encoding a mitogen-activated protein kinase confers resistance to bacterial leaf streak in rice[J]. The Plant Journal, 2021, 107: 1084-1101. DOI:10.1111/tpj.15368 |
| [16] |
苏菁, 陈深, 朱小源. 水稻广谱抗病分子机理研究进展[J]. 广东农业科学, 2020, 47(11): 84-92. DOI:10.16768/j.issn.1004-874X.2020.11.010 SU J, CHEN S, ZHU X Y. Research progress in molecular mechanism of broad-spectrum disease resistance in rice[J]. Guangdong Agricultural Sciences, 2020, 47(11): 84-92. DOI:10.16768/j.issn.1004-874X.2020.11.010 |
| [17] |
NAHAR K, KYNDT T, DE VLEESSCHAUWET D, HÖFTE M, GHEYSEN G. The jasmonate pathway is a key player in systemically induced defense against root knot nematodes in rice[J]. Plant Physiology, 2011, 157(1): 305-316. DOI:10.1104/pp.111.177576 |
| [18] |
KAZAN K, MANNERS J M. Jasmonate signaling: Toward an integrated view[J]. Plant Physiology, 2008, 146(4): 1459-1468. DOI:10.1104/pp.107.115717 |
| [19] |
BROWSE J. Jasmonate passes muster: A receptor and targets for the defense hormone[J]. Annual Review of Plant Biology, 2009, 60(1): 183-205. DOI:10.1146/annurev.arplant.043008.092007 |
| [20] |
WASTERNACK C, STRNAD M. Jasmonate signaling in plant stress responses and development-active and inactive compounds[J]. New Biotechnology, 2016, 33(5): 604-613. DOI:10.1016/j.nbt.2015.11.001 |
| [21] |
PENG X X, HU Y J, TANG X K, ZHOU P L, DENG X B, WANG H H, GUO Z J. Constitutive expression of rice WRKY30 gene increases the endogenous jasmonic acid accumulation, PR gene expression and resistance to fungal pathogens in rice[J]. Planta, 2012, 236(5): 1485-1498. DOI:10.1007/s00425-012-1698-7 |
| [22] |
ZHAO S S, HONG W, WU J G, WANG Y, JI S Y, ZHU S Y, WEI C H, ZHANG J S, LI Y. A viral protein promotes host SAMS1 activity and ethylene production for the benefit of virus infection[J]. eLife, 2017, 6: e27529. DOI:10.7554/eLife.27529 |
| [23] |
陈建松, 周炼, 张师睿, 杨武, 秦碧霞, 赵均良. 南方水稻黑条矮缩病抗病遗传资源与分子机理研究进展[J/OL]. 广东农业科学.https://link.cnki.net/urlid/44.1267.S.20231213.1652.002
. CHEN J S, ZHOU S, ZHANG S Z, YANG W, QIN B X, ZHAO J L.Advances in genetic resources and molecular mechanisms of resistance to southern rice black-streaked dwarf virus disease[J/OL]. Guangdong Agricultural Sciences, https://link.cnki.net/urlid/44.1267.S.20231213.1652.002 . |
| [24] |
SONG S, QI T, WASTERNACK C, XIE D. Jasmonate signaling and crosstalk with gibberellin and ethylene[J]. Current Opinion in Plant Biology, 2014, 21: 112-119. DOI:10.1016/j.pbi.2014.07.005 |
| [25] |
LEMARIÉ S, ROBERT-SEILANIANTZ A, LARIAGON C, LEMOINE J, MARNET N, JUBAULT M, MANZANARES-DAULEUX M J, GRAVOT A. Both the jasmonic acid and the salicylic acid pathways contribute to resistance to the biotrophic clubroot agent plasmodiophora brassicae in Arabidopsis[J]. Plant Cell Physiology, 2015, 56(11): 2158-2168. DOI:10.1093/pcp/pcv127 |
| [26] |
WANG Y, MOSTAFA S, ZENG W, JIN B. Function and mechanism of jasmonic acid in plant responses to abiotic and biotic stresses[J]. International Journal of Molecular Sciences, 2021, 22: 8568. DOI:10.3390/ijms22168568 |
(责任编辑 陈丽娥)
 2023, Vol. 50
2023, Vol. 50