文章信息
基金项目
- 国家自然科学基金(32073006)
作者简介
- 卢春兰(1999—),女,在读硕士生,研究方向为水生动植物疫病防控,E-mail:2926698197@qq.com.
通讯作者
- 王蓓(1982—),女,博士,教授,研究方向为水生动物医学,E-mail:wong19820204@126.com.
文章历史
- 收稿日期:2022-05-31
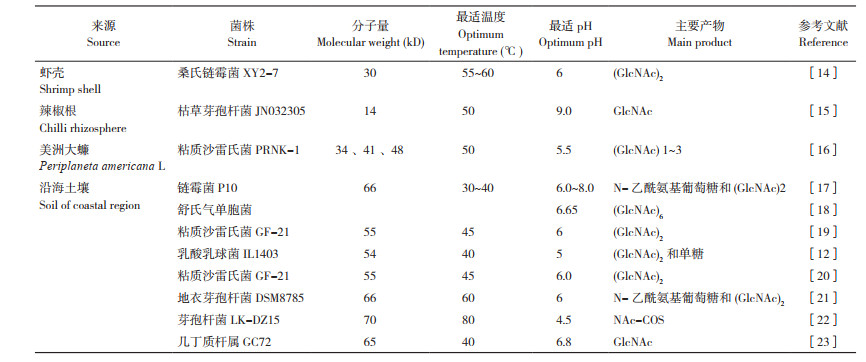
几丁质(又名甲壳质、甲壳素),广泛存在于甲壳动物如虾、蟹的外壳,是大多数真菌、藻类和昆虫细胞壁的成分,是自然界中除纤维素以外的第二大类天然多糖。几丁质经脱乙酰化处理后可得到壳聚糖。几丁质和壳聚糖均不溶于水,故其开发应用受影响。鉴于此,许多学者致力于降解几丁质或壳聚糖以期得到可溶性低聚糖,其中包括壳寡糖和几丁寡糖。壳寡糖(Chitosan Oligosaccharide,COS)是由β-1, 4糖苷键连接的2- 乙酰氨基-2- 脱氧-β-D- 葡萄糖醛酸糖(GlcNAc)和2- 氨基-2- 脱氧-β-D- 吡喃葡萄糖(GlcN)组成的低聚糖,共有2~10个氨基葡萄糖单元,聚合度(Degree of Polymerization,DP)小于20%,分子量(Molecular Weight,MW)≤ 3 200 Da[1-6]。几丁寡糖,又称N- 乙酰氨基壳寡糖(N-acetyl chito-oligosaccharides,NAc-COS),是由2~10个N- 乙酰氨基葡萄糖以β-1, 4糖苷键连接而成的糖类总称(GluNAc2 ~GluNAc10)[7]。壳寡糖和几丁寡糖已被证实具有良好的水溶性以及多种生物活性,在生物医药和功能食品领域表现出良好的应用前景,目前在水产的应用上已开展了一些试验性探索,多用于促生长以及增强鱼类的抗菌性、抗氧化性等,应用价值极高。
我国是水产养殖大国,但近几年来由于盲目扩大养殖规模和养殖密度,导致养殖环境不断恶化,发病率的明显升高给水产养殖业造成巨大经济损失。激素、抗生素、化学合成药物等对水产动物疾病预防和控制有一定疗效。但由于这些渔药的不合理使用,尤其是抗生素类药物的滥用导致出现许多问题,包括耐药菌株、药物残留、微生态环境失衡和抑制吞噬细胞使免疫系统遭受破坏等,致使水产品的品质下降,严重威胁水产养殖可持续发展、绿色发展。天然产物及其衍生物,例如壳寡糖和几丁寡糖,由于安全无毒、无残留且具有多种生物活性而逐渐引起众多学者重视,研究方向主要集中于壳寡糖和几丁寡糖作为绿色饲料添加剂或疫苗佐剂影响鱼类的生理代谢功能上。基于此,本文综述了壳寡糖和几丁寡糖的制备方法,探讨了壳寡糖和几丁寡糖在水产动物饲料添加剂、渔用疫苗佐剂和水产品保水保鲜中的应用,以期为壳寡糖和几丁寡糖在水产渔业上的深入研究和产业化应用提供参考。
1 壳寡糖和几丁寡糖的制备 1.1 酶解法酶解法是采用几丁质酶使几丁质在生物聚合物的末端或内部β-1-4- 糖苷键处裂解,产生基本上乙酰化的低聚糖。酶制剂可分为特异性酶和非特异性酶,壳聚糖酶、几丁质酶均为特异性酶;纤维素酶、木聚糖酶、α- 淀粉酶、果胶酶、木瓜蛋白酶、β- 糖苷酶、脂肪酶和胃蛋白酶均为非特异性酶[8-9]。此外,由壳聚糖酶和纤维素酶组成的复合酶体系比单一使用的酶对底物具有更高的消化效率和更强的亲和力。壳聚糖酶和纤维素酶在45 ℃条件下水解几丁质6 h,DP 6~8的COS得率为79.84%,能满足目前工业化生产的要求[10]。目前对壳聚糖酶和几丁质酶的底物结合和催化机制研究较为深入。
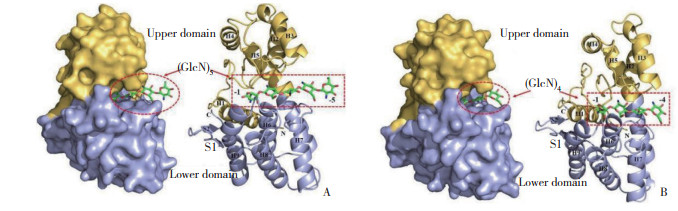
壳聚糖酶46A(GsCsn46A)的分子结构包含9个α- 螺旋和2个β链,可分为2个结构域,其中上结构域包含4个α- 螺旋(α1~α4),下结构域由α6~α9螺旋和β1~β2链组成,2个β链折叠成两个球状结构域,底物壳五糖(GlcN)5和壳四糖(GlcN)4位于它们之间(图 1),其中最长的螺旋α5跨越两个结构域,构成连接两个结构域的主链。壳聚糖酶识别聚合底物的三步反应机理如下:壳聚糖酶首先识别底物并结合底物;催化位点在与底物结合后发生构象变化,由开放型变为封闭型;随后酶可能会继续与其他亚位点上的残基相互作用,以稳定底物- 酶复合物(图 2)[11]。
|
| 整个酶呈黄色和淡蓝色的色带状,底物 (GlcN)5 和 (GlcN)4 用绿色表示,蛋白表面用黄色表示(上结构域)和浅蓝色表示(下结构域) The entire enzyme is shown as a yellow and light blue ribbon, the substrates (GlcN)5 and (GlcN)4 are shown in green, and the protein surface is shown in yellow (upper domain) and light blue (lower domain) 图 1 壳聚糖酶46A与底物(GlcN)5(A)、(GlcN)4(B)复合物的整体结构[11] Fig. 1 Overall structure of chitosanase 46A in complex with substrate (GlcN)5 (A) and (GlcN)4 (B)[11] |
而几丁质酶可根据作用方式分为三大类:(1)外几丁质酶:从还原性端和非还原性端裂解几丁质链形成(GlcNAc)2等;(2)内几丁质酶:在几丁质的内部随机裂解糖苷键,产生可溶性的低分子量GlcNAc多聚体,如壳四糖、壳三糖和壳二糖;(3)β-N- 乙酰氨基葡萄糖酶:从几丁质链主链连续催化非还原端去除GlcNAc残基。生产COS需要内几丁质酶,生产NAc-COS需要外几丁质酶和β-N- 乙酰氨基葡萄糖酶。以胶体几丁质为底物时,几丁质酶的降解产物主要为几丁二糖和单糖;以水溶性壳聚糖为底物时,降解产物除单糖、几丁二糖外,还存在其他单元结构的COS[12]。细菌和真菌生产的几丁质酶属于糖基水解酶18(GH18),而GH19主要为植物生产的几丁质酶[13]。为了获得COS和NAc-COS的高产率,目前已鉴定、表征和运用了大量的几丁质酶,几丁质酶降解几丁质的条件如表 1所示。
1.2 化学法
化学法是通过酸和氧化剂破坏聚合物分子内或者分子间的氢键以达到降解的目的。几丁质的化学转化常用酸有盐酸、硫酸、乙酸、乳酸、三氯乙酸和甲酸等,常用氧化剂有过氧化氢、臭氧、过硼酸钠、过硫酸钾等。采用传统化学法制备的具体过程为:将壳聚糖溶于2%(W/V)乙酸中,然后将30%(V/V)过氧化氢加入溶液中,在70 ℃下搅拌反应2 h后,溶液冰浴,使用NaOH中和至pH=8.0,通过沉淀除去高分子量壳聚糖,再以乙醇进行分馏,离心沉淀,洗涤并真空干燥,最终得到COS[1]。由于上述化学法使用的挥发性有机溶剂对于环境和人体健康有一定危害,因此,亟需开发一种环境友好的技术。溶液等离子体工艺(Solution Plasma Process,SPP)技术和离子液体克服了传统挥发性有机溶剂的局限性,成为一种新型替代品。SPP技术是施加电压以在液体中产生活性自由基和分子(例如OH-),产生的羟基自由基破坏了氢键,破坏了壳聚糖的有序晶体结构。该技术联合注入空气法,可以加速壳聚糖的降解过程,其原因是注入气泡可以显著增加气体和液体的接触表面积并产生更高能量的电子,从而产生更多的氧化物质。此外,鼓泡气体可以提高传质速率,提高反应性物质扩散到液体中的效率,从而促进氧化反应[24-25]。离子液体是一种新兴的绿色溶剂,具有蒸气压低,稳定性、溶解性和再利用性好等特点。它通过破坏多糖(几丁质、壳聚糖和COS)分子内和分子间的氢键,在多糖的阴离子、液体和羟基之间重新形成新的氢键,导致形成具有水合凝胶状结构的无定形几丁质,结晶度相对较低,从而可有效进行降解[13]。研究表明,壳聚糖在四氟硼酸甘氨酸体系中的降解效果优于在乙酸体系中的降解效果。在此条件下,COS的平均分子量约为1 500 Da,产率为76.36%[26]。
1.3 物理法物理法也被用于COS的生产,是通过超声波、γ射线、微波辐射或者球磨机使几丁质分子内的化学键断裂从而得到不同聚合度分子[27]。Hai等[28] 通过γ射线从壳聚糖中分离出COS,最后在甲醇- 丙酮溶液中沉淀分离。Hien等[29] 通过γ射线照射存在于过氧化氢溶液中的壳聚糖获得COS产品。Margoutidis等[30] 使用球磨机以受控方式在2 h内使几丁质结晶度降低50%,结晶度降低与分子间氢键的减少和糖苷键的断裂相关联。此外,在球磨机中添加天然粘土高岭石可使几丁质在中性和酸性条件下的溶解度均增加近1倍,随着碾磨时间的延长,几丁质裂解形成GlcNAc和(GlcNAc)2。
2 壳寡糖和几丁寡糖在水产饲料添加剂中的功能应用目前COS和NAc-COS用作水产饲料添加剂的研究最为广泛、透彻,已被证明可激发多种生物学功能,如免疫调节功能、促生长功能、抗氧化功能等。
2.1 免疫调节功能COS和NAc-COS在调节免疫方面有较好的表现,其免疫活性取决于分子大小或聚合程度。DP ≥ 6的COS具有更大的生物活性,COS5和COS6与补体Ⅲ受体(CR3)结合后,均可激活吞噬细胞,提高吞噬能力,增强抗体传递能力,但COS6引起的促进作用强于COS5。这是由于COS6的分子量高于COS5,COS6暴露的氨基葡萄糖基团的量也相对大于COS5,从而COS6具有更活跃的结合位点与巨噬细胞和淋巴细胞的CR3结合。此外COS6还可以改变CR3的配置,对CR3表现出更高的亲和力[6]。迄今为止,已知硬骨鱼类体液免疫包括特异性免疫和非特异性免疫,其中特异性免疫相关的3种免疫球蛋白为IgM、IgD和IgT。具有非特异性抵抗作用的分子存在于鱼类粘液或血液中,包括抗菌肽、细胞因子(白介素、干扰素、肿瘤坏死因子TNF-α和TNF-β、生长因子及趋化因子)、溶菌酶、补体(C1~C9)、凝集素等[31-33]。研究表明,COS可以提高水生动物的特异性免疫和非特异性免疫机能。壳聚糖在膜水平上诱导树突状细胞(DC)的活化,但不能诱导细胞因子的分泌。这导致活化的DC无法刺激T细胞增殖[34]。而COS可以诱导DC成熟,分泌TNF-α并促进T淋巴细胞(CD4T)增殖[35]。在评价COS、黄芪多糖和益生素3种免疫增强剂对草鱼免疫功能的效果,以碱性磷酸酶为考察指标,影响程度为COS>益生素>黄芪多糖,因此认为COS比较适合用作草鱼的免疫增强剂[36]。COS触发鱼类体液免疫的细胞和分子机制[37] 为:COS诱导鱼类脾脏IgM B细胞增殖和分化为IgMlo和IgMhi B细胞亚群;IgMlo B细胞被进一步鉴定为短寿命的浆细胞,分泌天然IgM,具有与脂多糖(LPS)和肽聚糖(PGN)结合的能力;天然IgM能与细菌结合,增强血清的杀菌活性,由天然IgM介导COS触发的体液免疫可以建立对细菌感染的早期免疫防御机制。此外,甘露糖受体(MR)和凝集素被鉴定为IgMlo浆细胞上COS的结合受体。MR与凝集素协同作用,触发细胞内信号转导,促进浆细胞生成和扩增。
血清溶菌酶活性是鱼类机体非特异性免疫反应的重要指标,其活性的提高表明巨噬细胞、多型核白细胞的活性加强[38]。孙梦洁[39] 以COS饲料饲喂鲟鱼,发现鲟鱼血清中的溶菌酶(LZM)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)的活性和补体C3、免疫球蛋白M的浓度较对照高,肠道中免疫基因(IL-1、IL-2、IL-10)的相对表达量高于对照,证明COS作为免疫增强剂可提高鱼类的免疫功能及抗病性能等。袁香丽[40] 在凡纳滨对虾饲料中添加COS,300 mg/kg添加处理显著提高了凡纳滨对虾血清ACP活力及肝胰腺AKP活力,300、600 mg/kg添加处理均可使血清LZM活力明显提高,900 mg/kg添加处理凡纳滨对虾感染副溶血弧菌后的死亡率降低,发挥了COS免疫增强剂的作用。霍圃宇[41] 在饲料中添加COS,明显增加了大菱鲆幼鱼的AKP和ACP活力;通过攻毒试验发现,COS显著增加了大菱鲆的疾病抵抗力,因此COS可作为一种免疫增强剂应用到水产动物的基础饲料中,建议添加量为5 000 mg/kg。苏鹏等[42] 研究发现,COS能显著提高红鳍东方鲀血清中的AKP、LZM活力和全血中的血小板数量,明显提高红鳍东方鲀对迟缓爱德华氏菌和哈维弧菌的抵抗力,前述各项指标随COS添加量的增加整体呈升高趋势,因此饲料中添加2 000 mg/kg COS能够提高红鳍东方鲀的非特异性免疫功能。Liu等[43] 研究发现,COS可激活团头鲂头肾巨噬细胞活性氧- 活性氮通路,刺激产生和分泌更多的细胞因子IL-1β、TNF-α,吞噬细菌的能力显著增强。Qin等[44] 研究认为,COS(分子量<1 500 Da)可显著降低罗非鱼肠道中的炎症反应和应激反应,TNF-α和热休克蛋白70(HSP70)mRNA表达水平下降,转化生长因子β(TGF-β)水平较高,这在抑制炎症和自身免疫性疾病方面起关键作用,表明该COS可以有效改善鱼类的免疫状态以及对致病细菌或病毒的抵抗力。李明波等[45] 研究证明了COS能显著促进杂交黄颡鱼“黄优1号”白细胞吞噬功能及淋巴细胞转化,并能提高体液免疫水平,建议有效剂量为80~120 mg/kg。以上研究结果表明,COS在一定程度上能提高水产动物的免疫相关酶活性和其他免疫相关指标,但对不同种属水产动物的作用效果不同,具体COS添加量还有待深入研究。
相比COS,NAc-COS的生物活性及其作用机理报道较少,目前仅在哺乳动物层面有所研究。已知NAc-COS对RAW264.7细胞的免疫增强作用与COS相似,所有NAc-COS均能显著增加吞噬活性,增强非特异性免疫反应;NAc-COS还可通过真核转录因子(NF-KB)信号通路促进促炎细胞因子(IL-1β、IL-6和TNF-a)产生。但与COS和脂多糖(LPS)不同,NAc-COS1和NAcCOS6显著抑制一氧化氮的产生[46]。
2.2 促生长功能饲料中添加适量的COS可促进水产动物的生长。陈伟军等[47] 在饲料中添加0.6‰的COS后,凡纳滨对虾的多个生长指标明显提升,饲料系数的降低效果尤为突出,肠道绒毛长度增加,上皮细胞排列更加整齐、紧密。孙飞等[48] 在饲料中添加0.02%COS,异育银鲫的特定生长率(Specific Growth Rate,SGR)升高16.20%,肠皱襞高度增加86.84%,肠壁厚度增加20.45%,肠皱襞宽度减少12. 18%。胡晓伟等[49] 在花鲈(Lateolabrax japonicus)幼鱼饲料中添加0.6% 和0.8%COS,其增重率、特定生长率、血清总蛋白和高密度脂蛋白胆固醇含量显著提高,添加0.6% 和1.0%COS可显著提高胰蛋白酶活性,添加0.4% 和0.8%COS可显著提高脂肪酶活性。黄鑫玮等[50] 研究表明,COS可促进幼建鲤的特定生长率和增重率,肠道皱襞密度、肠壁厚度显著提高。徐贵珠[51] 在饲料中添加COS,中华绒螯蟹的增重率、特定生长率极显著提高,饵料系数极显著降低,肝胰脏重量、肠道重量、肠道蛋白含量显著升高,由此可见在饲料中添加COS能提高中华绒螯蟹饲料利用率,促进机体和消化器官的生长发育。李明波等[45] 在饲料中添加COS,证明COS能显著提升杂交黄颡鱼的生长速度,降低饲料系数。苏鹏[52] 研究指出,随着COS添加量的增加,鱼体的增重率、特定生长率、肠指数逐渐增大,饵料系数逐渐降低,蛋白酶和脂肪酶活性增加。综上所述,根据COS在体内作用靶位的不同,将COS促进水产动物生长的机理概括如下:(1)COS诱导肠道消化酶的表达,包括蛋白酶、脂肪酶和淀粉酶,从而促进营养物质吸收,加速水生动物生长[53];(2)COS可以促进消化器官的生长和发育,如肝胰脏、肠等,从而加快食物分解成结构简单、可被吸收的小分子物质,提高水产动物增重率和生长率;(3)COS可以改善肠道的组织形态,从而增加肠道吸收营养物质的面积,提高机体对营养物质的吸收能力,有利于生长[54]。
但也有研究认为,COS对促进水产动物生长的影响不显著。袁香丽[40] 研究发现,低鱼粉饲料中不同COS水平对凡纳滨对虾的生长性能无显著影响,但能改善肠道和肝胰腺组织形态,缓解肠道炎症反应,从而提高对虾的营养物质利用能力,促进对虾健康生长,建议饲料中COS添加量为300~900 mg/kg。霍圃宇[41] 研究认为,在基础饲料中添加COS对大菱鲆幼鱼生长无显著促进作用,其中特定生长率、饲料系数、增重率、肝体比、脏体比差异均不显著,但通过降低平均红细胞体积、增加平均血红蛋白浓度可提高血液运输氧气的能力。Qin等[44] 研究认为,任何剂量的COS(分子量<1 500 Da)对罗非鱼的生长性能没有显著影响。
COS的促生长功能取决于剂量、分子量、喂养持续时间、环境温度、给药途径和物种。与中等剂量的COS相比,高水平的COS可降低水产动物体重、生长速率和饲料转化率,高水平的COS可能主要诱导降血脂活性[53]。同时水产动物生长与免疫作用存在竞争,COS在发挥免疫调节作用时,促生长作用不显著。因此若要发挥COS或NAc-COS的促生长作用,后续需进一步研究以确定合适剂量。
2.3 抗氧化功能COS具有较强的抗氧化活性,这主要与COS分子链较短因而暴露出更多的活性氨基和羟基有关[55]。COS分子上的活性氨基和羟基能有效消除机体内的自由基,减少生物大分子的自由基损伤。此外,COS的抗氧化活性也受到去乙酰化程度和MW的影响,抗氧化活性随着MW的减少而增加[56]。COS发挥抗氧化功能、缓解机体氧化应激的可能途径有两条:(1)COS提高过氧化氢酶(CAT)、谷胱甘肽还原酶、谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性,促进活性氧(ROS)的中和,驱动抗氧化功能;(2)COS通过抑制NF-KB信号通路、丝裂原活化蛋白激酶(MAPK)信号通路,降低促炎细胞因子的释放,进而细胞的氧化损伤得到缓解[57-58]。范超杰等[59] 研究表明,饲料中添加COS可以使黄河鲤鱼幼鱼的携氧能力显著提高、代谢能力增强、健康指数提升,建议添加的最适浓度为0.6%。陈伟军等[47] 研究指出,饲料中添加COS能够提高凡纳滨对虾的总抗氧化能力和SOD活性,降低肌肉组织中的丙二醛(MDA)含量。胡晓伟等[49] 在花鲈幼鱼饲料中添加0.6%COS能显著降低MDA含量,添加0.2%COS能增强SOD、AKP和CAT活性。苏鹏[52] 在饲料中添加COS后,红鳍东方鲀肝组织中的CAT、SOD活性显著提高,MDA含量显著降低。徐贵珠[51] 证明在饲料中添加COS能提高中华绒螯蟹的各项免疫指标,降低MDA含量,减少自由基对机体损伤,提高抗应激、抗氧化能力。董琦[60] 研究发现,饵料中添加COS可显著提高刺参肠道铜锌SOD、HSP70和TGF-β活化激酶的表达量,显著提高刺参体腔液的一氧化氮合酶(NOS)、CAT、SOD、LZM、总抗氧化能力(T-AOC)、GSH-Px的活性,显著降低MDA含量,表明饵料中添加COS可以在一定程度上提高刺参的免疫能力和抗氧化能力。综上所述,COS在一定程度上可提高水生动物的抗氧化酶活性,增强其抗氧化能力。
2.4 对鱼类体成分的影响一般认为采食添加了COS饲料的水生动物,其体内的蛋白质和总多不饱和脂肪酸含量比较高,水分和脂质以及总饱和脂肪酸含量比较低,这种现象可能与COS的抗氧化和降血脂活性有关[53]。研究表明,饵料中添加COS可提高刺参体壁的硬度、咀嚼性和弹性,降低刺参体壁的粘性,改善刺参口感;可使刺参体壁的粗蛋白含量提高22.02%、灰分含量提高6.67%、粗脂肪含量下降13.43%,Fe含量提高21.35%、K含量提高17.09%、Zn含量提高7.34%[60]。霍圃宇[41] 研究表明,随着COS添加量的增加,大菱鲆幼鱼体内的粗蛋白含量明显提高。
3 壳寡糖和几丁寡糖在水产疫苗和水产品保鲜上的应用 3.1 在动物疫苗佐剂中的应用相关研究表明,COS能够作为免疫佐剂增强亚单位疫苗的免疫能力,显著诱导动物机体的体液免疫和细胞免疫,而且不会产生毒副作用,其具有缓控、释控的能力,可以延缓抗原成分在体内释放,有效延长疫苗的免疫效果[61-62]。此外,COS可与机体特定受体结合激活免疫系统,发挥免疫调节功能。相较于简单的物理混合,将佐剂和抗原化学偶联成一个整体可更大程度地增强疫苗的免疫原性。在对COS佐剂潜能分析中,以斑马鱼为实验动物,灭活鳗弧菌接种1月后的相对免疫保护力为50% 左右;在加入一定量的COS后,灭活鳗弧菌的相对免疫保护力达85% 以上,与兽用油佐剂相当。以大菱鲆为实验动物,分析疫苗接种后3个月内的免疫保护效果,结果发现,加入COS后疫苗的相对免疫保护力均超过80%,明显高于灭活鳗弧菌单独接种效果;对免疫鱼血清抗体水平分析发现,COS能在一定程度上增强灭活鳗弧菌的体液免疫效果,而血清中的抗体也能与溶藻弧菌和哈维氏弧菌进行反应,故COS是一种较好的佐剂分子[63]。
3.2 在水产品保鲜中的应用COS对水产品的保鲜功能源于其抗菌能力。研究表明,几丁质和壳聚糖具有抑菌作用而非杀菌作用,与几丁质和壳聚糖不同的是,COS和NAc-COS具有杀菌作用。目前对COS的抑菌机理有以下5种解释:(1)COS和NAc-COS带正电的氨基与细胞表面带阴离子的物质或者细胞壁肽聚糖中N- 乙酰- 胞壁酸等相互结合,从而在细胞周围形成致密层,细胞膜的通透性改变,进而影响了细菌与外界的营养物质交换过程,细菌的代谢活性受到抑制;(2)COS和NAc-COS与某些金属离子、微量元素或必需营养素螯合,导致细菌因长期缺乏某种必需离子元素而代谢紊乱,最终死亡[64];(3)COS和NAc-COS分子量较低,其聚合物链具有更大的灵活性,可结合多个细菌,聚合物链迅速黏附细菌,进入细胞可以结合到细菌DNA分子上,通过阻止细菌DNA分子的复制和转录起到抑菌作用;(4)N- 乙酰氨基葡萄糖是COS结构的基本成分,也是肠道粘蛋白的成分,当细菌与宿主肠道结合时,其充当受体,有效减少细菌的粘附作用;(5)COS和NAc-COS可以作为有益肠道细菌的可发酵底物,诱导有机酸产生,从而降低肠道pH值,使肠道病原体的患病率降低[44, 65]。刘敏等[55] 采用2% COS溶液涂膜处理的鲫鱼在冷藏保鲜过程中的pH值、脂肪氧化腐败程度(TBA)值及挥发性盐基氮(TVB-N)值均明显低于对照,可见COS涂膜处理能有效减缓鲫鱼中蛋白腐败和脂肪氧化速率,减少细菌繁殖,从而延长鲫鱼的货架期。
4 展望COS和NAc-COS无毒副作用,原料来源广泛丰富,且与几丁质、壳聚糖等相比,具有十分突出的优点[66]:易溶于水,无毒性,在宿主体内较弱的累积效应。目前,COS和NAc-COS的适宜添加量依不同物种、不同年龄段和不同目标效果而异,添加80~5 000 mg/kg不等,行业尚未建立统一标准,很大程度上限制了COS和NAcCOS在水产上的大规模应用。同时,在COS和NAc-COS的实际生产过程中,不同厂家制备工艺千差万别,导致实际合成产物中寡糖的比例与设计中的目标比例存在一定差异,质量参差不齐。COS和NAc-COS分子大小或聚合程度存在差异,这将产生不同的生理活性,因此若能够大量获得合适分子大小和聚合程度的COS和NAc-COS,将有助于全面深入解析其在各种生物活性中的内在相关机制。此外,COS和NAc-COS具有调节水生动物免疫、促进生长、抗氧化、改善鱼类体成分等活性,对于病原体微生物有很强的抑制效果,例如副溶血弧菌、迟缓爱德华氏菌、哈维弧菌、亲水性气单胞菌和白斑综合征病毒等,但由于在构效关系方面的研究匮乏,导致对其主要作用靶标和作用机制尚不明确,限制了基于靶标相互作用的结构优化和进一步研发。目前国内外对COS和NAc-COS的大量研究都暗示其可以作为水生动物的免疫增强剂,可尝试联合其他免疫增强剂,最大限度地发挥其在水生动物体内的协同效应。COS和NAc-COS在水生动物疾病防控与治疗方面开发前景十分广阔。
| [1] |
SUN T, GUO X, ZHONG R, MA L, LI H, GU Z, GUAN J, TAN H, YOU C, TIAN M. Interactions of oligochitosan with blood components[J]. International Journal of Biological Macromolecules, 2019, 124: 304-313. DOI:10.1016/j.ijbiomac.2018.11.109 |
| [2] |
MUKHTAR AHMED K B, KHAN M M A, SIDDIQUI H, JAHAN A. Chitosan and its oligosaccharides, a promising option for sustainable crop production- a review[J]. Carbohydrate Polymers, 2020, 227: 115-331. DOI:10.1016/j.carbpol.2019.115331 |
| [3] |
BENCHAMAS G, HUANG G, HUANG S, HUANG H. Preparation and biological activities of chitosan oligosaccharides[J]. Trends in Food Science & Technology, 2021, 107: 38-44. DOI:10.1016/j.tifs.2020.11.027 |
| [4] |
马雪丽, 李建峰, 李喜凤. 壳寡糖在农业上的应用研究综述[J]. 乡村科技, 2018(24): 63-64. DOI:10.19345/j.cnki.1674-7909.2018.24.038 MA X L, LI J F, LI X F. A review of research on the application of chitosan in agriculture[J]. Rural Science and Technology, 2018(24): 63-64. DOI:10.19345/j.cnki.1674-7909.2018.24.038 |
| [5] |
施斐, 黄垚, 卢志杰, 邹翠云, 谭小红, 苏友禄, 汤开浩, 秦真东, 林蠡. 壳寡糖对虎龙斑的生长、免疫及肠道菌群的影响[J]. 水产学报, 2022, 46(9): 1689-1700. DOI:10.11964/jfc.20201212539 SHI F, HUANG Y, LU Z J, ZOU C Y, TAN X H, SU Y L, TANG K H, QIN Z D, LIN L. Effects of chitosan on growth, immunity and intestinal flora of tiger lizard (Lepidoptera tigris)[J]. Journal of Aquaculture, 2022, 46(9): 1689-1700. DOI:10.11964/jfc.20201212539 |
| [6] |
WEI X, WANG Y, XIAO J, XIA W. Separation of chitooligosaccharides and the potent effects on gene expression of cell surface receptor CR3[J]. International Journal of Biological Macromolecules, 2009, 45(4): 432-436. DOI:10.1016/j.ijbiomac.2009.07.003 |
| [7] |
黄丽萍, 刘宗明. 几丁寡糖、壳寡糖的应用与开发[J]. 中国微生态学杂志, 1998(3): 54-57. HUANG L P, LIU Z M. Application and development of chitooligosaccharides and chitosan[J]. Chinese Journal of Microecology, 1998(3): 54-57. |
| [8] |
MINH N C, NGUYEN V H, SCHWARZ S, STEVENS W F, TRUNG T S. Preparation of water soluble hydrochloric chitosan from low molecular weight chitosan in the solid state[J]. International Journal of Biological Macromolecules, 2019, 121: 718-726. DOI:10.1016/j.ijbiomac.2018.10.130 |
| [9] |
季珂, 李恒, 龚劲松, 耿燕, 丁振中, 蒋敏, 许正宏, 史劲松. 酶法制备壳寡糖及其抗肿瘤活性评价[J]. 食品与生物技术学报, 2021, 40(6): 93-99. DOI:10.3969/j.issn.1673-1689.2021.06.012 JI K, LI H, GONG J S, GENG Y, DING Z Z, JIANG M, XU Z H, SHI J S. Enzymatic preparation of chitosan and evaluation of its antitumor activity[J]. Journal of Food and Biotechnology, 2021, 40(6): 93-99. DOI:10.3969/j.issn.1673-1689.2021.06.012 |
| [10] |
DONG H Z, WANG Y S, ZHAO L M, ZHOU J C, XIA Q M, QIU Y J. Key technologies of enzymatic preparation for DP 6-8 chitooligosaccharides[J]. Journal of Food Process Engineering, 2015, 38(4): 336-344. DOI:10.1111/jfpe.12159 |
| [11] |
WANG Y, QIN Z, FAN L, ZHAO L. Structure–function analysis of Gynuella sunshinyii chitosanase uncovers the mechanism of substrate binding in GH family 46 members[J]. International Journal of Biological Macromolecules, 2020, 165: 2038-2048. DOI:10.1016/j.ijbiomac.2020.10.066 |
| [12] |
吕梦圆. 重组大肠杆菌几丁质酶的诱导表达、酶学性质及其应用研究[D]. 武汉: 湖北工业大学, 2015. LYU M Y. Study on the induced expression, enzymatic properties and application of recombinant Escherichia coli gibberellinase[D]. Wuhan: Hubei University of Technology, 2015. |
| [13] |
KUMAR M, RAJPUT M, SONI T, VIVEKANAND V, PAREEK N. Chemoenzymatic production and engineering of chitooligosaccharides and N-acetyl glucosamine for refining biological activities[J]. Frontiers in Chemistr y, 2020, 8: 469. DOI:10.3389/fchem.2020.00469 |
| [14] |
ZHANG W, LIU Y, MA J, YAN Q, JIANG Z, YANG S. Biochemical characterization of a bifunctional chitinase/lysozyme from Streptomyces sampsonii suitable for N-acetyl chitobiose production[J]. Biotechnology Letters, 2020, 42(8): 1489-1499. DOI:10.1007/s10529-020-02834-z |
| [15] |
SHIVAKUMAR S, KARMALI A N, RUHIMBANA C. Partial purification, characterization, and kinetic studies of a lowmolecular-weight, alkali-tolerant chitinase enzyme from Bacillus subtilis JN032305, A potential biocontrol strain[J]. Preparative Biochemistry & Amp; Biotechnology, 2014, 44(6): 617-632. DOI:10.1080/10826068.2013.844708 |
| [16] |
MOON C, SEO D J, SONG Y S, HONG S H, CHOI S H, JUNG W J. Antifungal activity and patterns of N-acetyl-chitooligosaccharide degradation via chitinase produced from Serratia marcescens PRNK-1[J]. Microbial Pathogenesis, 2017, 113: 218-224. DOI:10.1016/j.micpath.2017.10.039 |
| [17] |
MUKHERJEE G, SEN S. Purification, characterization, and antifungal activity of chitinase from Streptomyces venezuelae P10[J]. Current Microbiology, 2006, 53: 265-9. DOI:10.1007/s00284-005-0412-4 |
| [18] |
LIU C L, LAN C Y, FU C C, JUANG R S. Production of hexaoligochitin from colloidal chitin using a chitinase from Aeromonas schubertii[J]. International Journal of Biological Macromolecules, 2014, 69: 59-63. DOI:10.1016/j.ijbiomac.2014.05.028 |
| [19] |
夏秋瑜. 几丁质酶高产菌株的筛选及酶法制备几丁寡糖的研究[D]. 儋州: 华南热带农业大学, 2006. XIA Q Y. Screening of high chitinase producing strains and enzymatic preparation of chitinoligosaccharides[D]. Danzhou: South China University of Tropical Agriculture, 2006. |
| [20] |
郑家敏. 几丁质酶高产菌株选育及酶学性质研究[D]. 福州: 福州大学, 2018. ZHENG J M. Selection and breeding of high yielding strains of chitinase and study of enzymatic properties[D]. Fuzhou: Fuzhou University, 2018. |
| [21] |
SONGSIRIRITTHIGUL C, LAPBOONRUENG S, PECHSRICHUANG P, PESATCHA P, YAMABHAI M. Expression and characterization of Bacillus licheniformis chitinase (ChiA), suitable for bioconversion of chitin waste[J]. Bioresource Technology, 2010, 101(11): 4096-4103. DOI:10.1016/j.biortech.2010.01.036 |
| [22] |
YAHIAOUI M, LARIBI-HABCHI H, BOUACEM K, ASMANI K-L, MECHRI S, HARIR M, BENDIF H, AïSSANI-EL FERTAS R, JAOUADI B. Purification and biochemical characterization of a new organic solvent-tolerant chitinase from Paenibacillus timonensis strain LK-DZ15 isolated from the Djurdjura Mountains in Kabylia, Algeria[J]. Carbohydrate Research, 2019, 483: 107747. DOI:10.1016/j.carres.2019.107747 |
| [23] |
GAO C, ZHANG A, CHEN K, HAO Z, TONG J, OUYANG P. Characterization of extracellular chitinase from Chitinibacter sp. GC72 and its application in GlcNAc production from crayfish shell enzymatic degradation[J]. Biochemical Engineering Journal, 2015, 97: 59-64. DOI:10.1016/j.bej.2015.02.010 |
| [24] |
MA F, LI P, ZHANG B, ZHAO X, FU Q, WANG Z, GU C. Effect of solution plasma process with bubbling gas on physicochemical properties of chitosan[J]. International Journal of Biological Macromolecules, 2017, 98: 201-207. DOI:10.1016/j.ijbiomac.2017.01.049 |
| [25] |
MA F, ZHANG S, LI P, SUN B, XU Y, TAO D, ZHAO H, CUI S, ZHU R, ZHANG B. Investigation on the role of the free radicals and the controlled degradation of chitosan under solution plasma process based on radical scavengers[J]. Carbohydrate Polymers, 2021, 257: 117567. DOI:10.1016/j.carbpol.2020.117567 |
| [26] |
YU S, CHEN P, LIU X, LI L. Degradation of chitosan by modified cellulase in the ionic liquid system[J]. Catalysis Letters, 2015, 145: 1845-1850. DOI:10.1007/s10562-015-1596-2 |
| [27] |
周勇. 酶法脱乙酰化制备壳寡糖的研究进展[J]. 安徽农学通报, 2021, 27(11): 27-31, 118. DOI:10.16377/j.cnki.issn1007-7731.2021.11.011 ZHOU Y. Progress in the preparation of chitosan by enzymatic deacetylation[J]. Anhui Agricultural Bulletin, 2021, 27(11): 27-31, 118. DOI:10.16377/j.cnki.issn1007-7731.2021.11.011 |
| [28] |
HAI L, BANG DIEP T, NAGASAWA N, YOSHII F, KUME T. Radiation depolymerization of chitosan to prepare oligomers[J]. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms, 2003, 208: 466-470. DOI:10.1016/S0168-583X(3)01181-9 |
| [29] |
HIEN N Q, PHU D V, DUY N N, LAN N T K. Degradation of chitosan in solution by gamma irradiation in the presence of hydrogen peroxide[J]. Carbohydrate Polymers, 2012, 87(1): 935-938. DOI:10.1016/j.carbpol.2011.08.018 |
| [30] |
MARGOUTIDIS G, PARSONS V H, BOTTARO C S, YAN N, KERTONF M. Mechanochemical amorphization of alpha-Chitin and conversion into oligomers of N-Acetyl-D-glucosamine[J]. Acs Sustainable Chemistry & Engineering, 2018, 6(2): 1662-1669. DOI:10.1021/acssuschemeng.7b02870 |
| [31] |
姚一彬, 刘臻, 鲁双庆, 肖调义. 鱼类免疫因子作用机制及其应用[J]. 湖南饲料, 2011(3): 32-35. YAO Y B, LIU Z, LU S Q, XIAO T Y. Mechanism of fish immune factor and its application[J]. Hunan Feed, 2011(3): 32-35. |
| [32] |
张媛媛, 宋理平. 鱼类免疫系统的研究进展[J]. 河北渔业, 2018(2): 49-56. ZHANG Y Y, SONG L P. Research progress of fish immune system[J]. Hebei Fisheries, 2018(2): 49-56. |
| [33] |
林旺. 微囊藻毒素-LR对斑马鱼非特异性免疫功能的影响及其机制[D]. 武汉: 华中农业大学, 2020. LIN W. Effects of microcystin-LR on nonspecific immune function of zebrafish and its mechanism[D]. Wuhan: Huazhong Agricultural University, 2020. |
| [34] |
VILLIERS C, CHEVALLET M, DIEMER H, COUDERC R, FREITAS H, VAN DORSSELAER A, MARCHE P N, RABILLOUD T. From secretome analysis to immunology: chitosan induces major alterations in the activation of dendritic cells via a tlr4-dependent mechanism[J]. Molecular & Cellular Proteomics, 2009, 8(6): 1252-1264. DOI:10.1074/mcp.M800589-MCP200 |
| [35] |
DANG Y, LI S, WANG W, WANG S, ZOU M, GUO Y, FAN J, DU Y, ZHANG J. The effects of chitosan oligosaccharide on the activation of murine spleen CD11c+ dendritic cells via Toll-like receptor 4[J]. Carbohydrate Polymers, 2011, 83(3): 1075-1081. DOI:10.1016/j.carbpol.2010.08.071 |
| [36] |
张健, 蒋湘辉, 刘刚, 李敬伟, 杜华, 闫有利. 饲料中添加3种免疫增强剂对草鱼生长和非特异性免疫力的影响[J]. 水产学杂志, 2014, 27(2): 56-60. ZHANG J, JIANG X H, LIU G, LI J W, DU H, YAN Y L. Effects of adding three kinds of immune enhancers to the feed on the growth and nonspecific immunity of grass carp[J]. Journal of Fisheries, 2014, 27(2): 56-60. |
| [37] |
WANG J, WU C S, HU Y Z, YANG L, ZHANG X J, ZHANG Y A. Plasmablasts induced by chitosan oligosaccharide secrete natural IgM to enhance the humoral immunity in grass carp[J]. Carbohydrate Polymers, 2022, 281: 119073. DOI:10.1016/j.carbpol.2021.119073 |
| [38] |
苏永腾, 王恬. 寡糖在水产动物饲料上的应用[J]. 水产养殖, 2006(2): 15-17. SU Y T, WANG T. Application of oligosaccharides in aquatic animal feed[J]. Aquaculture, 2006(2): 15-17. |
| [39] |
孙梦洁. 壳寡糖对鱼类免疫、肠道菌群及外周血白细胞转录组的影响[D]. 青岛: 青岛大学, 2019. SUN M J. Effects of chitosan oligosaccharides on fish immunity, intestinal flora and transcriptome of peripheral blood leukocytes[D]. Qingdao: Qingdao University, 2019. |
| [40] |
袁香丽. 低鱼粉饲料添加壳寡糖对凡纳滨对虾生长、免疫和抗副溶血弧菌感染能力的影响[D]. 厦门: 集美大学, 2017. YUAN X L. Effects of low fishmeal feed supplementation with chitosan oligosaccharide on growth, immunity and resistance to Vibrio parahaemolyticus infection of Litopenaeus vannamei[D]. Xiamen: Jimei University, 2017. |
| [41] |
霍圃宇. 壳寡糖、褐藻酸寡糖对大菱鲆(Scophthalmus maximus) 生长、免疫指标、血液指标影响[D]. 大连: 大连海洋大学, 2016. HUO P Y. Effects of chitosan oligosaccharides and alginic acid oligosaccharides on the growth, immune indexes and blood indexes of turbot (Scophthalmus maximus)[D]. Dalian: Dalian Ocean University, 2016. |
| [42] |
苏鹏, 潘金露, 韩雨哲, 刘海映, 霍圃宇, 孙航, 姜志强. 壳寡糖对红鳍东方鲀血液指标和非特异性免疫指标的影响[J]. 大连海洋大学学报, 2016, 31(1): 37-43. DOI:10.16535/j.cnki.dlhyxb.2016.01.007 SU P, PAN J L, HAN Y Z, LIU H Y, HUO P Y, SUN H, JIANG Z Q. Effects of chitosan oligosaccharide on blood indexes and nonspecific immune indexes of redfin pufferfish[J]. Journal of Dalian Ocean University, 2016, 31(1): 37-43. DOI:10.16535/j.cnki.dlhyxb.2016.01.007 |
| [43] |
LIU L, ZHOU Y, ZHAO X, WANG H, WANG L, YUAN G, ASIM M, WANG W, ZENG L, LIU X, LIN L. Oligochitosan stimulated phagocytic activity of macrophages from blunt snout bream (Megalobrama amblycephala) associated with respiratory burst coupled with nitric oxide production[J]. Developmental & Comparative Immunology, 2014, 47(1): 17-24. DOI:10.1016/j.dci.2014.06.005 |
| [44] |
QIN C, ZHANG Y, LIU W, XU L, YANG Y, ZHOU Z. Effects of chitooligosaccharides supplementation on growth performance, intestinal cytokine expression, autochthonous gut bacteria and disease resistance in hybrid tilapia Oreochromis niloticus ♀ × Oreochromis aureus ♂[J]. Fish & Shellfish Immunology, 2014, 40(1): 267-274. DOI:10.1016/j.fsi.2014.07.010 |
| [45] |
李明波, 沈凡, 崔庆奎, 齐飘飘, 王银海, 张海龙, 丁运敏, 沈志刚. 壳寡糖对杂交黄颡鱼"黄优1号"(黄颡鱼♀×瓦氏黄颡鱼♂) 生长性能与免疫机能的影响[J]. 水生生物学报, 2020, 44(4): 707-716. DOI:10.7541/2020.085 LI M B, SHEN F, CUI Q K, QI P P, WANG Y H, ZHANG H L, DING Y M, SHEN Z G. Effects of chitosan oligosaccharide on the growth performance and immune function of hybrid yellow catfish "Huangyou No. 1" (Tachysurus fulvidraco ♀ × Tachysurus vachelli ♂)[J]. Chinese Journal of Aquatic Biology, 2020, 44(4): 707-716. DOI:10.7541/2020.085 |
| [46] |
DENG J J, LI Z Q, MO Z Q, XU S, MAO H H, SHI D, LI Z W, DAN X M, LUO X C. Immunomodulatory effects of N-Acetyl chitooligosaccharides on RAW264[J]. Marine Drugs, 2020, 18(8): 421. DOI:10.3390/md18080421 |
| [47] |
陈伟军, 朱传忠, 杨新冬, 班赛男, 易敢峰, 付维来, 李进国. 壳寡糖对凡纳滨对虾生长、抗氧化能力和肠道结构的影响[J]. 饲料研究, 2019, 42(12): 23-27. DOI:10.13557/j.cnki.issn1002-2813.2019.12.008 CHEN W J, ZHU C Z, YANG X D, BAN S N, YI G F, FU W L, LI J G. Effects of chitosan oligosaccharides on growth, antioxidant capacity and intestinal structure of Litopenaeus vannamei[J]. Feed Research, 2019, 42(12): 23-27. DOI:10.13557/j.cnki.issn1002-2813.2019.12.008 |
| [48] |
孙飞, 何杰, 叶元土, 蔡春芳, 吴萍, 吴代武, 周露阳, 高敏敏, 郁浓, 张艳芳. 壳寡糖对异育银鲫生长性能、肠道组织结构和非特异性免疫功能的影响[J]. 动物营养学报, 2018, 30(12): 5153-5163. DOI:10.3969/j.issn.1006-267x.2018.12.044 SUN F, HE J, YE Y T, CAI C F, WU P, WU D W, ZHOU L Y, GAO M M, YU N, ZHANG Y F. Effects of chitosan oligosaccharide on the growth performance, intestinal tissue structure and nonspecific immune function of the allotropic silver crucian carp[J]. Journal of Animal Nutrition, 2018, 30(12): 5153-5163. DOI:10.3969/j.issn.1006-267x.2018.12.044 |
| [49] |
胡晓伟, 上官静波, 黎中宝, 杨敏, 徐安乐. 饲料中添加壳寡糖对花鲈(Lateolabrax japonicus) 幼鱼的生长、消化和血清生化指标的影响[J]. 海洋学报, 2018, 40(2): 69-76. DOI:10.3969/j.issn.0253-4193.2018.02.007 HU X W, SHANGGUAN J B, LI Z B, YANG M, XU A L. Effects of chitosan oligosaccharide supplementation in feed on growth, digestion and serum biochemical indexes of juvenile Japanese seabass(Lateolabrax japonicus)[J]. Oceana Sinica, 2018, 40(2): 69-76. DOI:10.3969/j.issn.0253-4193.2018.02.007 |
| [50] |
黄鑫玮, 杨莎莎, 刘毅, 范涛, 明伟, 林荣楠, 温安祥. 壳寡糖对幼建鲤生长性能、脂肪代谢、非特异性免疫功能和肠道健康的影响[J]. 动物营养学报, 2015, 27(7): 2106-2114. DOI:10.3969/j.isssn.1006-267x.2015.07.016 HUANG X W, YANG S S, LIU Y, FAN T, MING W, LIN R N, WEN A X. Effects of chitosan oligosaccharide on growth performance, fat metabolism, non-specific immune function and intestinal health of juvenile Jian Carp[J]. Journal of Animal Nutrition, 2015, 27(7): 2106-2114. DOI:10.3969/j.isssn.1006-267x.2015.07.016 |
| [51] |
徐贵珠. 壳寡糖和茶多糖对中华绒螯蟹生长性能、免疫和抗氧化能力的影响[D]. 雅安: 四川农业大学, 2014. XU G Z. Effects of chitosan oligosaccharides and tea polysaccharides on growth performance, immunity and antioxidant capacity of Eriocheir sinensis[D]. Yaan: Sichuan Agricultural University, 2014. |
| [52] |
苏鹏. 壳寡糖对红鳍东方鲀(Takifugu rubripes) 生长、免疫酶及肠道菌群的影响[D]. 大连: 大连海洋大学, 2016. SU P. Effects of chitosan oligosaccharides on growth, immune enzymes and intestinal flora of Takifugu rubripes [D]. Dalian: Dalian Ocean University, 2016. |
| [53] |
ZHANG B. Dietary chitosan oligosaccharides modulate the growth, intestine digestive enzymes, body composition and nonspecific immunity of loach Paramisgurnus dabryanus[J]. Fish & Shellfish Immunology, 2019, 88: 359-363. DOI:10.1016/j.fsi.2019.03.006 |
| [54] |
王锐, 杨庆民. 寡糖饲料添加剂的研究应用进展[J]. 饲料博览, 2005(2): 38-40. WANG R, YANG Q M. Research and application progress of oligosaccharide feed additives[J]. Feed Expo, 2005(2): 38-40. |
| [55] |
刘敏, 包静, 刘均忠, 孙谧. 壳寡糖抗氧化性及对鲫鱼保鲜性能的研究[J]. 安徽农业科学, 2015, 43(20): 268-271. DOI:10.13989/j.cnki.0517-6611.2015.20.095 LIU M, BAO J, LIU J Z, SUN M. Antioxidative activity of chitosan oligosaccharide and its preservation performance on crucian carp[J]. Anhui Agricultural Sciences, 2015, 43(20): 268-271. DOI:10.13989/j.cnki.0517-6611.2015.20.095 |
| [56] |
LIAQAT F, ELTEM R. Chitooligosaccharides and their biological activities: A comprehensive review[J]. Carbohydrate Polymers, 2018, 184: 243-259. DOI:10.1016/j.carbpol.2017.12.067 |
| [57] |
MOHAN K, RAVICHANDRAN S, MURALISANKAR T, UTHAYAKUMAR V, CHANDIRASEKAR R, SEEDEVI P, ABIRAMI R G, RAJAN D K. Application of marine-derived polysaccharides as immunostimulants in aquaculture: A review of current knowledge and further perspectives[J]. Fish & Shellfish Immunology, 2019, 86: 1177-1193. DOI:10.1016/j.fsi.2018.12.072 |
| [58] |
GU M, PAN S, LI Q, QI Z, DENG W, BAI N. Chitosan and chitooligosaccharides attenuate soyabean meal-induced intestinal inflammation of turbot (Scophthalmus maximus): possible involvement of NF-kB, activator protein-1 and mitogen-activated protein kinases pathways[J]. British Journal of Nutrition, 2021, 126(11): 1651-1662. DOI:10.1017/s0007114521000489 |
| [59] |
范超杰, 熊建利, 吕成才, 刘强强, 苟健平, 陈万光, 任洪涛. 饲料中壳寡糖含量对黄河鲤鱼幼鱼血液参数的影响[J]. 黑龙江畜牧兽医, 2019(9): 161-164. DOI:10.13881/j.cnki.hljxmsy.2018.05.0010 FAN C J, XIONG J L, LYU C C, LIU Q Q, GOU J P, CHEN W G, REN H T. Effects of chitosan oligosaccharide content in feed on blood parameters of juvenile Yellow River carp[J]. Heilongjiang Animal Husbandry and Veterinary Medicine, 2019(9): 161-164. DOI:10.13881/j.cnki.hljxmsy.2018.05.0010 |
| [60] |
董琦. 饵料中添加壳寡糖对刺参免疫及产品品质的影响[D]. 大连: 大连工业大学, 2017. DONG Q. The effect of adding chitosan oligosaccharide to the bait on the immunity and product quality of sea cucumber[D]. Dalian: Dalian University of Technology, 2017. |
| [61] |
ZHANG G, JIA P, CHENG G, JIAO S, REN L, JI S, HU T, LIU H, DU Y. Enhanced immune response to inactivated porcine circovirus type 2 (PCV2) vaccine by conjugation of chitosan oligosaccharides[J]. Carbohydrate Polymers, 2017, 166: 64-72. DOI:10.1016/j.carbpol.2017.02.058 |
| [62] |
文继锋, 申欢欢, 阴文奇, 龚永平, 易可可, 邓英, 颜其贵. 壳寡糖对大熊猫轮状病毒VP6-VP7亚单位疫苗免疫作用的研究[J]. 浙江农业学报, 2019, 31(12): 2005-2010. DOI:10.3969/j.issn.1004-1524.2019.12.08 WEN J F, SHEN H H, YIN W Q, GONG Y P, YI K K, DENG Y, YAN Q G. Immune effect of chitosan oligosaccharide on giant panda rotavirus VP6-VP7 subunit vaccine[J]. Zhejiang Agricultural Journal, 2019, 31(12): 2005-2010. DOI:10.3969/j.issn.1004-1524.2019.12.08 |
| [63] |
LIU X, ZHANG H, GAO Y, ZHANG Y, WU H, ZHANG Y. Efficacy of chitosan oligosaccharide as aquatic adjuvant administrated with a formalin-inactivated Vibrio anguillarum vaccine[J]. Fish & Shellfi sh Immunology, 2015, 47(2): 855-860. DOI:10.1016/j.fsi.2015.10.012 |
| [64] |
CHOI B K, KIM K Y, YOO Y J, OH S J, CHOI J H, KIM C Y. In vitro antimicrobial activity of a chitooligosaccharide mixture against Actinobacillus actinomycetemcomitans and Streptococcus mutans[J]. International Journal of Antimicrobial Agents, 2001, 18(6): 553-557. DOI:10.1016/S0924-8579(1)00434-4 |
| [65] |
KIM J Y, LEE J K, LEE T S, PARK W H. Synthesis of chitooligosaccharide derivative with quaternary ammonium group and its antimicrobial activity against Streptococcus mutans[J]. International Journal of Biological Macromolecules, 2003, 32(1): 23-27. DOI:10.1016/S0141-8130(3)00021-7 |
| [66] |
易凡琪. 几丁寡糖对脂肪酸代谢紊乱的抑制作用及分子机制研究[D]. 泸州: 西南医科大学, 2017. YI F Q. Inhibitory effect and molecular mechanism of chitin oligosaccharide on fatty acid metabolism disorder[D]. Luzhou: Southwest Medical University,2017. |
 2023, Vol. 50
2023, Vol. 50