文章信息
基金项目
- 中央成品油价格调整对渔业补助预算资金(粤财农〔2022〕119号);仲恺农业工程学院研究生科技创新基金(KJCX2022031);广东农技服务轻骑兵重大农业技术乡村行推广项目(XYL2022GZ196C08)
作者简介
- 温彩怡(1997—),女,在读硕士生,研究方向为水产动物病害,E-mail: wency0627@126.com.
通讯作者
- 苏友禄(1981—),男,博士,研究员,研究方向为水产动物病原与疾病防控,E-mail: youlusu@zhku.edu.cn.
文章历史
- 收稿日期:2023-01-18
2. 佛山市顺德区活宝源生物科技有限公司,广东 佛山 528300
2. Foshan Shunde Huobaoyuan Biotechnology Co., Ltd., Foshan 528300, China
【研究意义】杂交鳢(Hybrid snakehead)属鲈形目(Perciformes)、攀鲈亚目(Anabantoidei)、鳢科(Channidae)、鳢属(Channa)[1],是以斑鳢(Channa maculata)为母本、乌鳢(Channa argus)为父本,通过杂交获得的子一代,俗称生鱼、黑鱼、财鱼等。杂交鳢不仅具有生长速度快、适应性强、耐运输、耐低氧、生长性状好、成活率高等优点,而且肉质鲜美、营养丰富,有滋补调养等药用价值,深受消费者喜爱[2-5],已成为我国重要的特种经济鱼类之一。2022年杂交鳢养殖年产量高达54.85万t,同比增长约10%[6]。自然状态下的杂交鳢抗病力强,极少发病,但由于养殖密度增大、水质富营养化和种质资源退化等原因,导致杂交鳢病害逐年递增暴发[7-9]。近年来,杂交鳢弹状病毒(Hybrid snakehead rhabdovirus, HSHRV)频繁检出,其可感染杂交鳢亲本、鱼苗和不同养殖规格的杂交鳢,已成为制约杂交鳢养殖产业可持续发展的重要因素[10]。开展HSHRV流行病学调查分析对杂交鳢养殖与病害防控具有重要的指导意义。
【前人研究进展】弹状病毒(Rhabdovirus)是一类有包膜的单股负链RNA病毒,其种类较多,在自然界中分布广泛,多数具有很强的致病性[11]。HSHRV粒子直径约60 nm,长度为160 nm,形态似椭圆形或圆形,通常具有5种主要结构蛋白(L、G、N、P和M)[12-13]。曾伟伟等[10]发现HSHRV与鳜鱼弹状病毒(Siniperca chuatsi rhabdovirus, SCRV)、鲤春病毒血症病毒(Spring viremia of carp virus, SVCV)等聚为一支;雷燕等[13]分析发现,大口黑鲈弹状病毒(Micropterus salmoides rhabdovirus, MSRV)与HSHRV、SCRV核苷酸序列同源性分别为96.9% 和95.3%,推测HSHRV可能为MSRV和SCRV的变异株。HSHRV曾被归属于水泡病毒属(Vesiculovirus),但根据国际病毒分类学委员会2022年最新分类结果显示,弹状病毒被分为45个属共265种,但仍有多种弹状病毒未被纳入分类,其中包括MSRV和HSHRV,而与其同源性较高的SCRV则归为Siniperhavirus属[14]。弹状病毒病在发病初期缺乏典型临床病症,且无防治特效药,因此对杂交鳢弹状病毒的快速、精准诊断尤为重要。病毒的检测方法主要包括细胞学、组织病理学、免疫学和分子生物学等,qPCR因具备特异性强、灵敏度高、快捷高效等优点,已成为水产病原检测的常用技术[15]。梁红茹等[16]利用双重PCR方法可特异检测出弹状病毒;而刘春等[17]基于杂交鳢弹状病毒的G蛋白序列构建了TaqMan qPCR检测方法,不仅特异性强、灵敏性高,还极大节省时间,非常适合杂交鳢弹状病毒的临床检测。【本研究切入点】珠三角地区主要养殖的杂交鳢、大口黑鲈、鳜鱼等名特优水品种产量居全国首位,且均为弹状病毒的易感宿主。近年来,广东省佛山市、中山市和江门市的杂交鳢主要养殖场频繁暴发弹状病毒病,引起巨大的经济损失。虽然珠三角地区杂交鳢养殖规模不断增大,但杂交鳢感染弹状病毒的流行病学仍缺乏全面系统的调查与分析。基于此,本研究对珠三角地区的杂交鳢弹状病毒进行完整周年的监测,以进一步了解该病毒的感染情况。【拟解决的关键问题】本研究从2021年3月至2022年2月对珠三角地区养殖的杂交鳢进行监测,从不同养殖时间和不同规格的宿主角度分析弹状病毒阳性率变化,以期探明HSHRV在杂交鳢不同养殖阶段的流行规律,为杂交鳢弹状病毒病的综合防治提供参考。
1 材料与方法 1.1 试验材料1.1.1 样品采集 样品采集时间为2021年3月至2022年2月,于珠三角地区(中山、佛山和江门)疑似染病的杂交鳢养殖场随机采集繁育阶段的杂交鳢亲本、鱼苗、水样以及不同养殖阶段的鱼体,共采集333份样品(每尾鱼的肝脏、脾脏和肾脏混合成1份样品,共292份;繁育阶段每池水样为1份样品,共8份;每20尾鱼苗混为1份样品,共33份)。杂交鳢样品均经无菌解剖后采集肝脏、脾脏和肾脏组织置于同一冻存管中,迅速放入液氮中冷冻后置于-80 ℃冰箱保存备用。
1.1.2 主要试剂 大肠杆菌DH5α感受态细胞、DNA凝胶回收试剂盒购于北京擎科生物有限公司,FastPure® Plasmid Mini Kit购于南京诺唯赞生物科技有限公司,动物组织总RNA提取试剂盒购于天根生化科技(北京)有限公司,TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix购于北京全氏金生物科技有限公司,2×M5 HiPer plus Taq HiFi PCR mix(with blue dye)购于北京聚合美生物科技有限公司,pMD-18T质粒、T4连接酶、DL2000 Marker、Premix Ex TaqTM(Probe qPCR)购于宝生物工程(大连)有限公司。
1.2 试验方法1.2.1 RNA提取与反转录 分别取样品约100 mg,采用动物组织总RNA提取试剂盒提取组织总RNA,随后利用TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒进行反转录,合成cDNA模板。
1.2.2 qPCR检测 参照刘春等[17]建立的弹状病毒TaqMan实时荧光定量(qPCR)检测方法,委托广州天一辉远生物科技有限公司合成引物和探针(引物1∶P1∶5’-CGCGGATCCATCATGAAATCAATCATTGCACT-3’,P2∶5’-CATCTGCAGAATTGATACTGCTGCAAAGGG-3’;引物2:HSHRV-2F∶5’-CACCAGTCATATCAATCC-3’,HSHRV-2R∶5’-CGGACTTAAACCTCATTC-3’;探针:HSHRV-2P-FAM-ACCTCTCCGCACATTGACATCT-BHQ1)。采用G蛋白引物P1、P2分别对合成的cDNA模板进行PCR扩增并构建重组质粒。
取cDNA模板进行qPCR检测,20 μL反应体系为:2×Premix Ex TaqTM 10 μL,10 μmol/L HSHRV-2F与HSHRV-2R引物各0.4 μL,10 μmol/L HSHRV-2P探针0.8 μL,cDNA模板1.6 μL,ddH2O 6.8 μL。同时设重组质粒为阳性对照、ddH2O为阴性对照。使用CFX96 Real-Time PCR Detection System(Bio-Rad)进行扩增反应;反应程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃延伸30 s,循环40次,在每个循环的60 ℃处采集FAM荧光信号。
1.2.3 数据处理与分析 病毒检测阳性评判标准:Ct值≤ 35为阳性;Ct值>35或显示为N/A,且没有特异性扩增曲线则判定为阴性。所有数据的图表绘制使用GraphPad 9.0和OriginPro。
2 结果与分析 2.1 不同规格杂交鳢感染弹状病毒的临床症状本研究根据体长将杂交鳢分成3种规格:小规格体长为1~10 cm,中规格体长为11~20 cm,大规格体长>20 cm。不同规格杂交鳢感染弹状病毒后均表现游动异常,小规格杂交鳢出现打转症状比例较高(图 1A),而中规格和大规格杂交鳢出现此症状的比例明显减少(图 1E)。解剖后发现小规格鱼体的脏器发红,但肿大症状不明显;而中规格和大规格鱼体的内脏器官普遍充血和肿大(图 1B、C、F),且中规格鱼体肠道充血、发炎(图 1D)的比例高于小规格鱼,还可在大规格鱼体中观察到鱼鳔充血和出血现象(图 1G)。
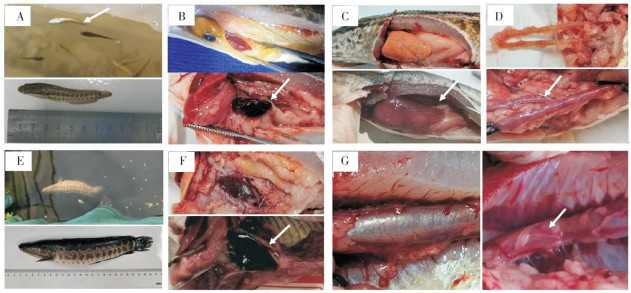
|
| A. 小规格鱼游动异常、打转;B. 中规格鱼脾脏:上图正常,下图肿大、发黑(箭头示);C. 中规格鱼肝脏:上图正常,下图肿大充血(箭头示);D.中规格鱼肠道:上图正常,下图充血、发炎(箭头示);E. 大规格鱼游动异常、打转,体表无明显症状;F. 大规格鱼脾脏:上图正常,下图肿大、发黑(箭头示);G. 大规格鱼鳔:左图正常,右图充血、出血(箭头示) A. Small-size fish swim abnormally and spin; B. Medium-size fish spleen: normal (figure above), swollen and blackened (figure below, arrowhead); C. Medium-size fish liver: normal (figure above), swollen and hyperemic (figure below, arrowhead); D. Medium-size fish intestine: normal (figure above), intestinal congestion and inflammation (figure below, arrowhead); E. Large-size fish swim abnormally, spin, body surface without obvious symptoms; F. Large-size fish spleen: normal (figure above), swollen and blackened (figure below, arrowhead); G. Large-size swim bladder: normal at left, swim bladder hyperemia and hemorrhage at right (arrowhead) 图 1 不同规格杂交鳢感染弹状病毒的主要临床症状 Fig. 1 Main clinical symptoms of rhabdovirus disease in different sizes of hybrid snakehead |
2.2 不同养殖阶段杂交鳢弹状病毒感染情况
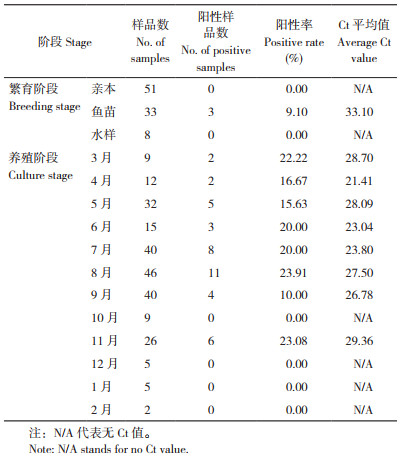
qPCR检测结果显示,333份样品的HSHRV平均阳性率为13.21%,其中,92份繁育阶段样品的平均阳性率较低、为3.26%,亲本和水样均未检出HSHRV,鱼苗阳性率为9.10%;241份养殖阶段样品的平均阳性率为17.01%,明显高于繁育阶段(表 1)。
|
2.3 不同养殖时间杂交鳢弹状病毒感染情况
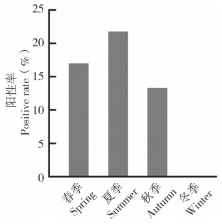
从季度角度分析,HSHRV阳性率呈现先升后降的趋势(图 2),阳性样品主要在春季和夏季检出;其中,春季样品的阳性率为16.98%,而夏季样品的阳性率则高达21.78%,秋季样品阳性率降到13.33%,冬季未检出阳性样品,这可能与冬季样品量相对较少有一定关系。
|
| 图 2 不同养殖季节杂交鳢弹状病毒阳性率 Fig. 2 Positive rates of HSHRV in different culture seasons of hybrid snakehead |
从月份角度分析,HSHRV阳性率表现为4 - 8月份不断增长,但从10月份开始(11月除外)多个月份未检出阳性样品。月份流行趋势与季度流行趋势大体一致,为先升后降。进一步分析发现,不同养殖月份的HSHRV阳性率存在一定差异,3月、6 - 8月和11月的HSHRV阳性率均≥ 20.00%,其中,8月份样品的阳性率最高(23.91%);4月、5月和9月的HSHRV阳性率较低,介于10.00% ~ 20.00%;总体来看,4月、6 - 9月平均Ct值较低,病毒载量较高,其中4月Ct值最低,为21.41;10月、12月至次年2月均未检出阳性样品(表 1)。
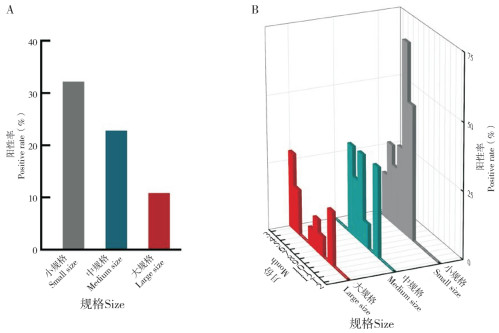
2.4 不同规格杂交鳢弹状病毒感染情况从不同规格的杂交鳢HSHRV检测结果来看,小规格杂交鳢的HSHRV感染率最高、平均阳性率为32.20%,中规格杂交鳢的H SHRV感染率次之(22.86%),大规格杂交鳢的HSHRV感染率最低(9.52%)(图 3A)。从感染的月份来看,小规格杂交鳢的HSHRV主要在3 - 9月检出,阳性率从3月开始逐月增加,8月阳性率最高、达71.43%,而从10月至次年2月均未检出该病毒;中规格杂交鳢的HSHRV主要在6 - 9月、11月中检出,其中,6月、8月和11月阳性率均为33.33%,7和9月样品阳性率分别为22.22% 和9.10%;大规格杂交鳢在春季与秋季HSHRV阳性率较高:3、4和11月阳性率较高,分别为28.57%、16.67% 和20.00%,而夏季阳性率较低,7 - 9月阳性率分别为6.67%、12.12% 和7.40%(图 3B)。
|
| 图 3 不同规格杂交鳢弹状病毒阳性率 Fig. 3 Positive rates of HSHRV in different sizes of hybrid snakehead |
3 讨论
弹状病毒可感染多种鱼类,并且感染后出现不同的临床症状。滕建等[8]研究发现弹状病毒可导致杂交鳢肝脏、脾脏肿大,鱼鳔血管严重肿胀和出血等病变;大口黑鲈感染弹状病毒后出现游动不规则、烂身、“花肝”和肾脏肿大现象[18-19]。Fu等[20]发现,鱼类感染弹状病毒后主要症状为出血性败血症,影响多种器官的功能。本研究发现,杂交鳢感染弹状病毒后表现出类似的上述临床症状,但不同规格杂交鳢感染弹状病毒后呈现一定差异:小规格杂交鳢主要出现不规则螺旋状翻转,解剖症状不明显;而中、大规格杂交鳢主要表现脏器充血发红或肿大,且多伴有肠道发炎现象。
弹状病毒在不同地区和不同品种的鱼类上的检出情况有一定差异。2014年和2015年,全国多种名特优养殖鱼类的弹状病毒平均阳性率分别为18.29% 和12.29%,其中,杂交鳢弹状病毒平均阳性率最高,分别为27.98% 和34.01%,大口黑鲈弹状病毒的平均阳性率分别为6.19% 和12.24%[21]。2007年和2018年,北京市和上海市地区SVCV阳性率分别为4.16% 和14.4%[22-23];林强等[24] 2016年3 - 11月对广东省鳜鱼养殖场进行病毒病监测,发现SCRV阳性率高达20.42%。本研究检测结果显示,HSHRV平均阳性率为13.21%,高于SVCV在其他鱼类中的阳性率。
王娟等[21]发现,鱼类弹状病毒在4 - 12月皆有检出,其中12月份的平均阳性率高达71.43%,而夏季的阳性率普遍低于10%。本研究与上述研究结果存在一定差异,而与黄志斌等[25]对珠三角地区鳜鱼病害调查结果较一致,即每年11月中下旬水温降低后死亡率大幅度下降。弹状病毒在25~28 ℃时稳定性高,对鳜鱼、斑马鱼等具有较强的感染能力[26-27]。本研究结果显示,HSHRV在春夏季节的检测Ct值较低,表明春夏季节病毒载量较高,这与大多数研究学者的结果一致。
本研究发现,繁育阶段的样品中,只有鱼苗检测出HSHRV,这可能与刚孵化的鱼苗自身免疫力低,因此更容易感染弹状病毒有关。但鱼苗检测Ct值较高,表明鱼苗携带弹状病毒载量很低,且未在杂交鳢亲本中检测出HSHRV,可能与繁育过程中注重筛选免疫力强、活力好的亲本有关。同时,本研究结果显示,HSHRV最易感体长10 cm以下的鱼苗,而对20 cm以上的大规格鱼感染率较低。也有研究发现MSRV可引起体长2~4 cm和更小规格(体长0.8~1 cm)的大口黑鲈幼鱼死亡[28-30];SVCV对大规格鲤鱼的感染率很低[31-32],这与鱼对弹状病毒的抵抗力随年龄增加而上升有一定关系[33]。人工感染斑鳢的结果表明,规格越大的亲本感染弹状病毒后,鱼体的死亡时间越慢[34],随着鱼体规格增大,机体代谢更加旺盛,其免疫力逐渐提高。与上述研究类似,本次调查的中规格和大规格杂交鳢弹状病毒阳性率呈现大幅度下降的趋势。
4 结论本研究对珠三角地区杂交鳢弹状病毒进行了周年监测,以明确感染弹状病毒的主要流行症状。患病杂交鳢体表症状不明显,小规格鱼出现打转现象,解剖症状不明显;中规格鱼主要表现为肝脏、脾脏充血发红以及肠炎;大规格鱼则主要表现为脾脏和鱼鳔充血发红和肿大现象。本次调查结果显示,杂交鳢弹状病毒的平均阳性率在13% 左右,养殖阶段的平均阳性率(17.01%)显著高于繁育阶段的平均阳性率(3.26%);该病毒病主要流行于4—11月份,夏季阳性率最高,冬季未检出阳性样品;该病毒最易感体长10 cm以下的小规格杂交鳢,而大规格杂交鳢弹状病毒阳性率低于10%。
| [1] |
张新铖, 陈昆慈, 朱新平. 乌鳢、斑鳢及杂交种养殖研究现状[J]. 广东农业科学, 2011, 38(22): 132-134. DOI:10.16768/j.issn.1004-874X.2011.22.073 ZHANG X C, CHEN K C, ZHU X P. Research status of Channa argus, C. maculata and their reciprocal hybrids[J]. Guangdong Agricultural Sciences, 2011, 38(22): 132-134. DOI:10.16768/j.issn.1004-874X.2011.22.073 |
| [2] |
刘苏, 朱新平, 陈昆慈, 赵建, 李凯彬, 潘德博. 杂交鳢(斑鳢♀×乌鳢♂) 及其自交后代细胞核型初步分析[J]. 动物学杂志, 2011, 46(1): 100-105. DOI:10.13859/j.cjz.2011.01.007 LIU S, ZHU X P, CHEN K C, ZHAO J, LI K B, PAN D B. Karyotype analysis of the hybrid snakehead (Channa maculata ♀× C. argus ♂) and its inbred progeny (F2)[J]. Chinese Journal of Zoology, 2011, 46(1): 100-105. DOI:10.13859/j.cjz.2011.01.007 |
| [3] |
刘文奎, 樊启学, 朱邦科, 杜海明. 饵料密度对杂交鳢仔鱼生长、存活的影响[J]. 华中农业大学学报, 2007, 26(3): 367-370. DOI:10.13300/j.cnki.hnlkxb.2007.03.022 LIU W K, FAN Q X, ZHU B K, DU H M. Effects of prey density on the growth and survival of larval hybrid snakehead[J]. Journal of Huazhong Agricultural University, 2007, 26(3): 367-370. DOI:10.13300/j.cnki.hnlkxb.2007.03.022 |
| [4] |
张新铖, 朱新平, 陈昆慈, 洪孝友. 乌鳢、斑鳢及杂交种耗氧率与窒息点的初步研究[J]. 广东农业科学, 2012, 39(9): 116-118. DOI:10.16768/j.issn.1004-874X.2012.09.071 ZHANG X C, ZHU X P, CHEN K C, HONG X Y. Studies on the oxygen consumption rate and asphyxiant point of Channa argus, C. maculata and their reciprocal hybrids[J]. Guangdong Agricultural Sciences, 2012, 39(9): 116-118. DOI:10.16768/j.issn.1004-874X.2012.09.071 |
| [5] |
孙龙芳, 梁旭方, 黄威, 方刘, 易提林, 骆小年, 李姣, 余德光, 谢骏, 白俊杰. 早期分级筛选对加州鲈和乌斑(乌鳢♀×斑鳢♂) 生长、成活率及水质的影响[J]. 广东农业科学, 2014, 41(11): 126-130. DOI:10.16768/j.issn.1004-874X.2014.11.043 SUN L F, LIANG X F, HUANG W, FANG L, YI T L, LUO X N, LI J, YU D G, XIE J, BAI J J. Effects of early size grading on growth, survival rate and water quality of Micropterus salmoides and the hybrid of Channa orgus ♀×C. maculata ♂[J]. Guangdong Agricultural Sciences, 2014, 41(11): 126-130. DOI:10.16768/j.issn.1004-874X.2014.11.043 |
| [6] |
农业农村部渔业渔政管理局. 2022中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022. The Fishery Administration of China's Agriculture Ministry. China fisheries statistics yearbook 2022[M]. Beijing: China Agricultural Press, 2022. |
| [7] |
LIU J Y, LI A H. First case of Aeromonas schubertii infection in the freshwater cultured snakehead fish, Ophiocephalus argus (Cantor), in China[J]. Journal of Fish Diseases, 2012, 35(5): 335-342. DOI:10.1111/j.1365-2761.2012.01350.x |
| [8] |
滕建, 陈红菊, 薛良义, 李岩, 路广金, 周敏, 张冲, 季相山. 乌鳢诺卡氏菌病致病菌的分离、鉴定及组织病理学观察[J]. 水产学报, 2022, 46(5): 836-847. DOI:10.11964/20201212535 TEN G J, CHEN H J, XUE L Y, LI Y, LU G J, ZHOU M, ZHANG C, JI X S. Isolation, identification, and histopathological observation of pathogen causing nocardiosis in Channa argus[J]. Journal of Fisheries of China, 2022, 46(5): 836-847. DOI:10.11964/20201212535 |
| [9] |
孔祎頔, 单晓枫, 牛小天, 吴莉芳, 王桂芹. 乌鳢真菌性、寄生虫性及病毒性疾病研究进展[J]. 水产科技情报, 2019, 46(2): 106-109. DOI: 10.16446/j.cnki.1001-1994.2019.02.009. KONG W D, SHAN X F, NIU X T, WANG G Q. Research progress on fungal, parasitic and viral diseases of Channa argus[J]. Fisheries Science and Technology Information, 2019, 46(2): 106-109. DOI: 10.16446/j.cnki.1001-1994.2019.02.009. |
| [10] |
曾伟伟, 王庆, 王英英, 刘春, 谭爱萍, 石存斌, 吴淑勤. 一株鳢科鱼源弹状病毒的分离及鉴定[J]. 水产学报, 2013, 37(9): 1416-1424. DOI:10.3724/SP.J.1231.201.38588 ZENG W W, WANG Q, WANG Y Y, LIU C, TAN A P, SHI C B, WU S Q. Isolation and characterization of a rhabdovirus from snakehead fish (Ophicephalus striatus)[J]. Journal of Fisheries of China, 2013, 37(9): 1416-1424. DOI:10.3724/SP.J.1231.201.38588 |
| [11] |
张莉娟, 杨圆圆, 方伟, 李宁求, 梁红茹, 林强, 刘礼辉, 黄志斌, 付小哲. 弹状病毒基因组及功能基因研究进展[J]. 基因组学与应用生物学, 2018, 37(2): 815-826. DOI:10.13417/j.gab.037.000815 ZHANG L J, YANG Y Y, FANG W, LI N Q, LIANG H R, LIN Q, LIU L H, HUANG Z B, FU X Z. Research progress on genome and functional genes of rhabdovirus[J]. Genomics and Applied Biology, 2018, 37(2): 815-826. DOI:10.13417/j.gab.037.000815 |
| [12] |
ZENG W W, WANG Q, WANG Y Y, LIU C, LIANG H R, FANG X, WU S Q. Genomic characterization and taxonomic position of a rhabdovirus from a hybrid snakehead[J]. Archives of Virology, 2014, 159(9): 2469-2473. DOI:10.1007/s00705-014-2061-z |
| [13] |
雷燕, 戚瑞荣, 崔龙波, 肖洋, 张文文, 马家好, 王雪鹏. 大口黑鲈鱼种弹状病毒病的诊断[J]. 大连海洋大学学报, 2015, 30(3): 305-308. DOI:10.16535/j.cnki.dlhyxb.2015.03.013 LEI Y, QI R R, CUI L B, XIAO Y, ZHANG W W, MA J H, WANG X P. Diagnosis of rhabdovirus disease in juvenile Largemouth bass Micropterus salmonids[J]. Journal of Dalian Ocean University, 2015, 30(3): 305-308. DOI:10.16535/j.cnki.dlhyxb.2015.03.013 |
| [14] |
WALKER P J, BIGARRÉ L, KURATH G, DACHEUX L, PALLANDRE L. Revised taxonomy of rhabdoviruses infecting fish and marine mammals[J]. Animals, 2022, 12(11): 1363-1379. DOI:10.3390/ani12111363 |
| [15] |
隗黎丽. 实时荧光定量PCR技术在鱼类病害研究中的应用[J]. 生物技术, 2012, 22(5): 82-85. DOI:10.3969/j.issn.1004-311X.2012.05.125 WEI L L. Application of real-time fluorescence quantitative PCR in fish disease research[J]. Biotechnology, 2012, 22(5): 82-85. DOI:10.3969/j.issn.1004-311X.2012.05.125 |
| [16] |
梁红茹, 范芷仪, 蔡秀珠, 付小哲, 林强, 刘礼辉, 黄志斌, 牛银杰, 林蠡, 李宁求. 鳜弹状病毒与传染性脾肾坏死病毒双重PCR检测方法的建立[J]. 西北农林科技大学学报(自然科学版), 2020, 48(3): 39-46, 53. DOI: 10.13207/j.cnki.jnwafu.2020.03.006. LIANG H R, FAN Z Y, CAN X Z, FU X Z, LIN Q, LIU L H, HUANG Z B, NIU Y J, LIN L. Establishment of duplex PCR assay for detecting Siniperca chuatsi rhabdovirus and infectious spleen and kidney necrosis virus[J]. Journal of Northwest A & F University (Natural Science Edition), 2020, 48(3): 39-46, 53. DOI: 10.13207/j.cnki.jnwafu.2020.03.006. |
| [17] |
刘春, 曾伟伟, 王庆, 李凯彬, 王芳, 常藕琴, 梁慧丽, 吴淑勤. 杂交鳢(斑鳢♀×乌鳢♂) 弹状病毒TaqMan实时荧光定量PCR检测方法的建立及应用[J]. 水产学报, 2014, 38(1): 136-142. DOI:10.3724/SP.J.1231.2014.48778 LIU C, ZENG W W, WANG Q, LI K B, WANG F, CHANG O Q, LIANG H L, WU S Q. Establishment and application of TaqMan real-time fluorescence quantitative PCR for detecting the hybrid snakehead rhabdovirus[J]. Journal of Fisheries of China, 2014, 38(1): 136-142. DOI:10.3724/SP.J.1231.2014.48778 |
| [18] |
MA D M, DENG G C, BAI J J, LI S J, YU L Y, QUAN Y C, YANG X J, JIANG X Y, ZHU Z M, YE X. A strain of Siniperca chuatsi rhabdovirus causes high mortality among cultured Largemouth bass in South China[J]. Journal of Aquatic Animal Health, 2013, 25(3): 197-204. DOI:10.1080/08997659.2013.799613 |
| [19] |
雷燕. 加州鲈鱼弹状病毒病流行特点及综合防控技术[J]. 当代水产, 2015, 40(5): 76. DOI:10.3969/j.issn.1674-9049.2015.05.027 LEI Y. Epidemic characteristics and comprehensive prevention and control technology of Micropterus salmoides rhabdovirus disease[J]. Current Fisheries, 2015, 40(5): 76. DOI:10.3969/j.issn.1674-9049.2015.05.027 |
| [20] |
FU X Z, LIN Q, LIANG H R, LIU L H, HUANG Z B, LI N Q, SU J G. The biological features and genetic diversity of novel fish rhabdovirus isolates in China[J]. Archives of Virology, 2017, 162(9): 2829-2834. DOI:10.1007/s00705-017-3416-z |
| [21] |
王娟, 张会军, 雷燕. 2015年鱼类病毒检测报告[J]. 当代水产, 2016, 41(2): 88-90. DOI:10.3969/j.issn.1674-9049.2016.02.028 WANG J, ZHANG H J, LEI Y. Fish virus detection report in 2015[J]. Current Fisheries, 2016, 41(2): 88-90. DOI:10.3969/j.issn.1674-9049.2016.02.028 |
| [22] |
王姝, 徐立蒲, 王小亮, 曹欢, 王静波, 张文, 景宏丽. 北京地区2007 ~2015年鲤春病毒血症病毒感染流行病学研究[J]. 病毒学报, 2017, 33(4): 593-597. DOI:10.13242/j.cnki.bingduxuebao.003187 WANG S, XU L P, WANG X L, CAO H, WANG J B, ZHANG W, JING H L. Epidemiological surveillance of spring viremia of carp in Beijing from 2007 to 2015[J]. Chinese Journal of Virology, 2017, 33(4): 593-597. DOI:10.13242/j.cnki.bingduxuebao.003187 |
| [23] |
邵玲, 肖雨, 汤茜, 何正侃, 高晓华. 上海地区2013—2018年鲤春病毒血症病毒的分离和进化特征分析[J]. 水产科技情报, 2019, 46(5): 253-258. DOI:10.16446/j.cnki.1001-1994.2019.05.003 SHAO L, XIAO Y, TANG Q, HE Z K, GAO X H. Isolation and phylogenetic analysis of spring viremia of carp virus in Shanghai from 2013 to 2018[J]. Fisheries Science and Technology Information, 2019, 46(5): 253-258. DOI:10.16446/j.cnki.1001-1994.2019.05.003 |
| [24] |
LIN Q, FU X Z, LI N Q, WAN Q Y, CHEN W J, HUANG Y M, HUANG Z B, LI J, ZHAO L J, LIN L. Co-infections of infectious spleen and kidney necrosis virus and Siniperca chuatsi rhabdovirus in Chinese perch (Siniperca chuatsi)[J]. Microbial Pathogensis, 2017, 111: 422-430. DOI:10.1016/j.micpath.2017.09.002 |
| [25] |
黄志斌, 吴淑勤, 石存斌, 潘厚军, 李凯彬. 珠江三角洲地区鳜鱼病害现状及综合防治对策[J]. 淡水渔业, 1999, 29(7): 12-14. DOI:10.1017/S0266078400010713 HUANG Z B, WU S Q, SHI C B, PAN H J, LI K B. Disease status and comprehensive control measures of Siniperca chuatsi in Pearl River Delta region[J]. Freshwater Fisheries, 1999, 29(7): 12-14. DOI:10.1017/S0266078400010713 |
| [26] |
XU Z D, HUANG Z Y, ZHONG J Y, ZHU Y Z, LIU X Y, WEI Y W. Thermal and environmental stability of Siniperca chuatsi Rhabdovirus[J]. Aquaculture, 2023, 568: 7393-7408. DOI:10.1016/j.aquaculture.2023.7393-7408 |
| [27] |
LIU X Y, ZHANG X D, XU Z D, HUANG Z Y, ZHONG J Y, ZHU Y Z, WEI Y W. Isolation, genomic and biological characterizations of a rhabdovirus from mandarin fish (Siniperca chuatsi)[J]. Aquaculture, 2023, 563: 7388-7394. DOI:10.1016/j.aquaculture.2022.738894 |
| [28] |
LYU S J, YUAN X M, ZHANG H Q, SHI W D, HANG X Y, LIU L, WU Y L. Isolation and characterization of a novel strain (YH01) of Micropterus salmoides rhabdovirus and expression of its glycoprotein by the baculovirus expression system[J]. Journal of Zhejiang University: science B, 2019, 20(9): 728-739. DOI:10.1631/jzus.B1900027 |
| [29] |
GAO E B, CHEN G F. Micropterus salmoides rhabdovirus (MS-RV) infection induced apoptosis and activated interferon signaling pathway in Largemouth bass skin cells[J]. Fish and Shellfish Immunology, 2018, 76: 161-166. DOI:10.1016/j.fsi.2018.03.008 |
| [30] |
章文言, 张玉军, 李陈, 石和荣, 刘学芹. 大口黑鲈弹状病毒的分离与鉴定[J]. 华中农业大学学报, 2022, 41(6): 230-236. DOI:10.13300/j.cnki.hnlkxb.2022.06.027 ZHANG W Y, ZHANG Y J, LI C, SHI H R, LIU X Q. Isolation and identification of Micropterus salmoides rhabdovirus[J]. Journal of Huazhong Agricultural University, 2022, 41(6): 230-236. DOI:10.13300/j.cnki.hnlkxb.2022.06.027 |
| [31] |
陈红莲. 狗鱼幼鱼弹状病毒的特性、基因组测序及分子生物学检测技术研究[D]. 武汉: 华中农业大学, 2009. DOI: 10.7666/d.y1805386. CHEN H L. The study on properties, complete genomic sequence analysis, and molecular detection methods of pike fry rhabdovirus[D]. Wuhan: Huazhong Agricultural University, 2009. DOI: 10.7666/d.y1805386 |
| [32] |
刘佳, 卢玉婷, 刘芸娜, 闫子豪, 汪惠庆, 李月红. 鲤春病毒血症病毒生物学研究进展[J]. 水产科技情报, 2022, 49(1): 48-52. DOI:10.16446/j.fsti.20210300130 LIU J, LU Y T, LIU Y N, YAN Z H, WANG H Q, LI Y H. Advances in the biological studies of spring viraemia of carp virus[J]. Fisheries Science and Technology Information, 2022, 49(1): 48-52. DOI:10.16446/j.fsti.20210300130 |
| [33] |
BOOTSMA R, KINKELIN P D, BERRE M. Transmission experiments with pike fry (Esox Indus L.) rhabdovirus[J]. Journal of Fish Biology, 1975, 7(2): 269-276. DOI:10.1111/j.1095-8649.1975.tb04599.x |
| [34] |
LIO-PO G D, ALBRIGHT L J, TRAXLER G S, LEANO E M. Pathogenicity of the epizootic ulcerative syndrome (EUS) associated rhabdovirus to snakehead Ophicephalus striatus[J]. Fish Pathology, 2001, 36(2): 57-66. DOI:10.3147/jsfp.36.57 |
(责任编辑 陈丽娥)
 2023, Vol. 50
2023, Vol. 50




