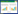文章信息
基金项目
- 国家国防基础科研计划项目(16ZG6101)
作者简介
- 蔡启航(1998—),男,在读硕士生,研究方向为放射性污染与重金属污染土壤的修复,E-mail:wy1287233192@163.com.
通讯作者
- 张宇(1978—),女,博士,教授,研究方向为生态环境修复以及区域环境管理,E-mail:zhangyuustc@163.com.
文章历史
- 收稿日期:2023-04-27
2. 西南科技大学材料学教育部工程研究中心,四川 绵阳 621000
2. Engineering Research Center for Material Materials, Ministry of Education, Southwest University of Science and Technology, Mianyang 621000, China
【研究意义】锰(Mn)是动植物生长代谢中必需的微量营养元素之一,通常在土壤和水中的浓度较低,一般不被认为是潜在的有毒元素[1]。过去的采矿、加工业和农业等人类活动,破坏了Mn含量的平衡,导致土壤、沉积物和水体中的Mn污染增加[2]。研究表明,Mn会对人体产生长期且隐性的危害,包括帕金森样症状以及生殖系统异常,也对免疫系统产生一定影响[3-4],Mn污染土壤修复已成为当前重要的环境问题[5]。传统的土壤修复方法主要为物理化学方法,如空气氧化法、氯氧化法和接触氧化法等[6-9],这些方法价格昂贵且易产生二次污染[6-7]。植物修复是一种经济、环保的修复方法,已被广泛用于治理重金属污染土壤。植物提取是植物修复技术最常用的方法,利用植物将土壤中的重金属元素富集到植物地上部分,再通过收割地上部分进行处理,能减少或除去土壤中的重金属污染物[8-9]。而植物修复污染土壤的关键在于筛选生物量大、生长周期短且重金属富集量高的新品种[10]。
【前人研究进展】目前,研究人员已对耐受Mn的植物进行了广泛研究,取得良好效果[17]。研究表明,苍耳(Xanthium sibiricum Patrin ex Widder)等草本植物在污染土壤中显示出较强的Mn吸收能力,但其生物量低、生长速度慢、根系浅,不适合大规模修复[11]。毛竹(Phyllostachys pubescens)是一种重要的经济竹种,我国种植面积超过527.76万hm2,占全国竹子总面积的70%[12-13]。毛竹具有环境适应强、生长速度快、用途多、生态价值高等特性,地上部分生物量占全竹90% 以上,且根系能在地下远距离蔓延生长,具有吸附重金属的先天优势。水培和盆栽试验表明,毛竹在高质量浓度重金属胁迫下无明显的坏死和黄化等中毒症状[14]。张玲等[15]研究发现,生长在铅(Pb)、锌(Zn)尾矿周边的毛竹芽中Pb含量高达1 182 mg/kg。Zhang等[16]在某废弃矿区发现生长良好的毛竹人工林,矿区土壤Pb含量高达286 mg/kg,表明毛竹对Pb胁迫具有较强的耐受能力。【本研究切入点】目前关于毛竹植物的研究大多在水培或盆栽试验条件进行,且只针对Pb、Zn等重金属元素,对Mn胁迫土壤的相关研究较少,无法充分了解毛竹对Mn胁迫土壤的修复效果。【拟解决的关键问题】本文探究标准土柱内Mn胁迫土壤3年生毛竹的生理响应,为Mn胁迫土壤的治理提供一定理论参考,为重金属污染土壤的修复提供新的植物资源。
1 材料与方法 1.1 试验材料毛竹苗购自四川洪雅县廷富苗木有限公司。
1.2 试验方法试验于2018年6月开始,通过五点取样法采自西南科技大学周边农田土作为供试土壤,土壤粘性30.81%,质地为中壤。利用便携式X射线荧光光谱(PXRF)技术[17]测定土壤中Cr、Mn、Fe、Ni、Cu和Zn含量分别为85.4、538.9、755.9、58.8、26.3、423.3 mg/kg,超出当地土壤背景值,本研究主要分析毛竹对上述6种重金属的富集特性。毛竹(Phyllostachys pubescens)种植于西南科技大学试验田长、宽、深均为1 m的土柱内,每个土柱装约1 000 kg土壤(四川绵阳,海拔500 m,年均气温14.7~17.3 ℃,年降水量825.8~1 417 mm)。土壤设置3个处理(Mn浓度分别为1 000、2 000、4 000 mg/kg),以不添加Mn的土壤为对照,每个处理3次重复,每个重复面积为1 m2,采用五点法栽种5株毛竹实生苗,自然光照和雨水灌溉,3年后采样。
1.3 毛竹生长特性测定1.3.1 采样与前处理 2021年7月,每个处理选取长势一致的3株毛竹,采集毛竹中部(从下往上数6~7节间)的茎与侧枝条发育较好的叶片,在土壤深度40 cm处采集根系。清理叶片和茎上杂物、根系上的土壤,放入液氮速冻,置于-80 ℃冰箱保存,备用。
1.3.2 表观数据 每组分别选取长势一致、叶片大小均一、生长状况相同的3株毛竹进行测定。叶长、叶宽、株高用卷尺测量。利用游标卡尺测量竹基部外径。每个处理5次重复。
1.3.3 纤维形态 利用LDA02型纤维质量浓度分析仪测定毛竹纤维形态[18]。选取部分茎杆切成火柴杆大小,置于10 mL离心管中,使用离析液(10% 硝酸与10% 铬酸)浸没样品,室温放置2 d。将离析后的样品置于玻璃皿中,用清水洗至无色后进行测定。每个处理3次重复,每个重复3个样品,每个样品测定5 000根纤维。
1.3.4 毛竹重金属元素累积量 利用破碎机将各组干燥后的根、茎和叶粉碎,通过微波消化法分别提取根、茎和叶中的元素。在微波反应系统中将10 mL硝酸与12 mL过氧化氢的混合物对0.100 g样品进行消解。微波消解方法:升温10 min,120 ℃加热5 min;升温10 min,150 ℃加热10 min;升温10 min,180 ℃加热30 min;待消解管冷却后,通过加热去酸。用硝酸溶液(体积分数为1%)冲洗3次,并将溶液转移到50 mL容量瓶中。提取物通过0.45 μm滤膜过滤,并在提取后3 d内采用电感耦合等离子体质谱法测定元素质量浓度。每个处理3次重复。
1.4 毛竹光合参数与叶绿素参数测定1.4.1 光合参数 毛竹的光合参数利用Li-6400系列便携式光合作用测定仪测定[19]。包括净光合速率(A,mmol H2O/m2·s)、蒸腾速率(E,mmol H2O/m2·s)、胞间CO2浓度(Ci,ppm)、水分利用率(WUE,g/kg)、叶片温度(Tleaf,℃)和叶片水汽压亏缺(VpdL,kPa)。每个处理9次重复。
1.4.2 叶绿素含量 采用乙醇丙酮(3∶1,V/V)萃取法测定叶绿素含量[20]。称取毛竹叶片0.1 g,加入5 mL色素提取物,快速研磨和浸出5 h(25 ℃)后,用分光光度计分别在645、663 nm波长下测量。每个处理5次重复。
1.4.3 叶绿素荧光参数 叶绿素荧光参数利用MIN-PAM仪器(Walz,Inc,德国)测定[21]。叶绿素荧光参数包括最大荧光产量(Fm)、可变荧光(Fv)、PS Ⅱ的最大光化学量子产率(Fv/Fm)、叶绿素荧光指标Y(Ⅱ)、相对电子传递速率(ETR)、光合有效辐射(PAR)、光化学淬灭系数(qP)和非光化学淬灭系数(qN)。每个处理9次重复。
1.5 抗氧化代谢酶活性与丙二醛含量测定使用试剂盒(Solarbio Science & Technology Ltd.,北京)测量抗氧化酶活性与丙二醛(MDA)含量。抗氧化酶包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)。每个处理5次重复。
1.6 统计分析利用OmicShare工具对数据进行标准化处理,对毛竹代谢的6种元素(Mn、Fe、Ni、Cr、Zn和Cu)进行主成分分析(PCA)和权重网络分析。选择权重在0.5~1.0之间的元素揭示元素间的相互作用。利用SPSS版本20.0软件计算数据的平均值与标准偏差,进行单因素方差分析,多重比较采用邓肯检验。转移系数(TF)为地上部的重金属质量浓度除以根的重金属质量浓度。
2 结果与分析 2.1 土壤中不同浓度锰胁迫对毛竹植物学性状的影响如图 1、图 2所示,与对照相比,在土壤4 000 mg/kg Mn胁迫浓度下,毛竹的株高、叶长、叶宽和基径分别下降22.6%、25.9%、21.3% 和26.7%,毛竹的生长发育受到抑制。

|
| 图 1 土壤中不同浓度锰胁迫下的毛竹生长形态 Fig. 1 Growth morphology of moso bamboo under different concentrations of Mn stress in soil |
|
| 小写英文字母不同者表示差异显著 Different lowercase letters indicate significant differences 图 2 土壤中不同浓度锰胁迫对毛竹生长指标的影响 Fig. 2 Effects of different concentrations of Mn stress in soil on growth index of moso bamboo |
2.2 土壤中不同浓度锰胁迫对毛竹纤维形态的影响
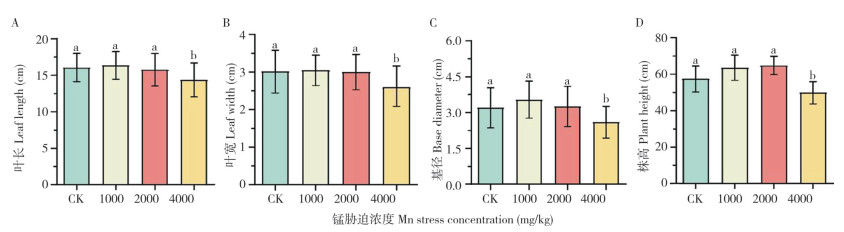
如表 1所示,与对照相比,在土壤2 000 mg/kg Mn胁迫浓度下,毛竹的细小纤维长度、宽度分别增加15.6%、20.6%,在2 000、4 000 mg/kg Mn胁迫浓度下,纤维的扭结指数分别增加26.6%、47.5%,在1 000 mg/kg Mn胁迫浓度下,毛竹的扭结角度和每毫米扭结数分别降低22.3%、21.5%,对毛竹纤维的平均长度和加权平均长度无显著影响。
|
2.3 土壤中不同浓度Mn胁迫对毛竹重金属富集特性的影响
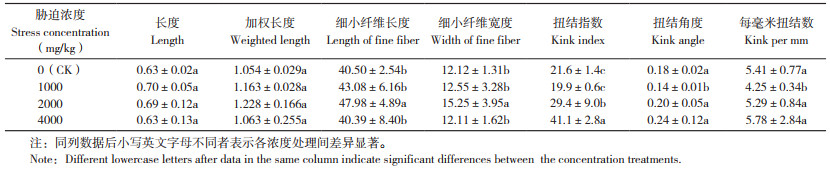
2.3.1 毛竹地上部与地下部对重金属的富集特性 如图 3所示,随着Mn胁迫浓度的增加,毛竹地上部与地下部对Mn的吸收量逐渐增大。在0、1 000、2 000和4 000 mg/kg Mn胁迫浓度下,毛竹对Mn的平均富集量分别为1 098.6、2 336.4、3 530.9、5 370.4 mg/kg,对Mn的转移系数分别为1.59、3.83、3.56和4.17(表 2),表明毛竹对土壤中的Mn有较强的富集能力。与对照相比,在土壤4 000 mg/kg Mn胁迫浓度下,Fe、Ni、Cr和Zn的转移系数分别降低38.1%、17.9%、28.5%、47.8%。表明毛竹对各类重金属有不同的富集特性,高浓度Mn胁迫阻碍重金属元素向毛竹地上部转移。
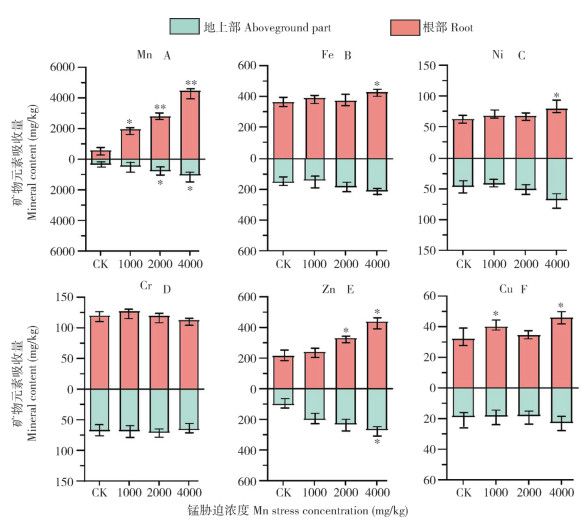
|
| “ *”和“**”表示在0.05和0.01水平上差异显著 "*" and "**" indicate significant differences at the 0.05 and 0.01 levels respectively 图 3 土壤中不同浓度锰胁迫对毛竹地上部与根部重金属吸收量的影响 Fig. 3 Effects of different concentrations of Mn stress in soil on the absorption of heavy metals in the aboveground parts and root of moso bamboo |
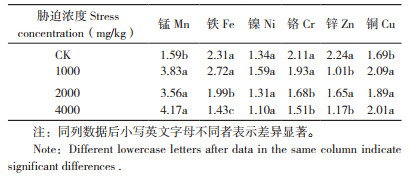
|
2.3.2 矿物元素的主成分分析和加权网络分析 为阐明Mn与其他元素的相互作用,对毛竹矿物元素进行主成分分析和加权网络分析。由图 4可知,不同浓度Mn胁迫下毛竹的矿物元素簇状位置差异显著,表明高浓度的Mn胁迫对毛竹的矿物代谢有显著干扰。Mn与Ni、Cu和Fe呈正相关关系,与Cr和Zn呈现负相关关系,与Fe的相关性最强。可见,高浓度的Mn胁迫导致毛竹的矿物元素代谢发生变化,是生长异常的主要原因之一。

|
|
元素间的不同线条(虚线和实线)表示相关程度 “+”表示正相关,“-”表示负相关 The different lines between the elements (dasned and solid lines) indicate the degree of correlation "+" indicates a positive correlation and "-" indicates a negative correlation 图 4 毛竹重金属元素代谢的主成分(A)和加权网络(B)分析 Fig. 4 Principal component (A) and weighted network(B) analysis of heavy metal element metabolism in moso bamboo |
2.4 土壤中不同浓度Mn胁迫对毛竹光合参数和叶绿素含量的影响
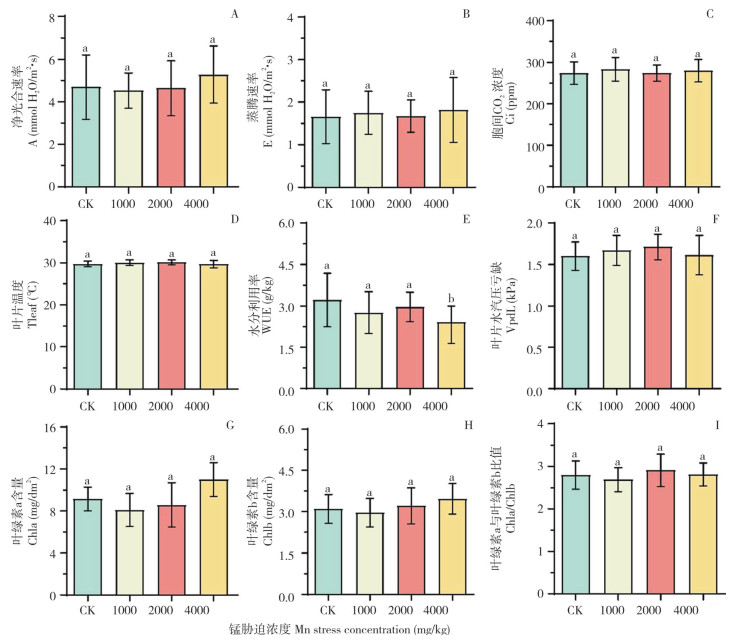
由图 5可知,与对照相比,不同浓度Mn胁迫对毛竹净光合速率的蒸腾速率、胞间CO2浓度、叶片温度和叶片水汽压亏缺无显著影响,而水分利用率显著降低30.6%,高浓度的Mn胁迫对毛竹的光合色素影响不显著。
|
| 小写英文字母不同者表示差异显著 Different lowercase letters indicate significant differences 图 5 土壤中不同浓度锰胁迫对毛竹光合参数的影响 Fig. 5 Effects of different concentrations of Mn stress in soil on photosynthetic parameters of moso bamboo |
2.5 土壤中不同浓度锰胁迫对毛竹叶绿素荧光参数的影响
如图 6所示,不同浓度Mn胁迫对毛竹叶片的叶绿素荧光参数影响显著。与对照相比,在1 000 mg/kg Mn胁迫下,最大荧光产量、可变荧光量显著降低11.6%、16.9%。2 000、4 000 mg/ kg Mn胁迫下的光化学淬灭指数分别下降19.8% 和29.8%,而非化学淬灭指数分别下降23.5% 和20.7%。PS Ⅱ的最大光化学量子产率、叶绿素荧光指标、光合有效辐射和相对电子传递速率没有显著变化。表明高浓度Mn胁迫使光化学淬灭能力和非光化学淬灭能力受到抑制,光合效率降低。

|
| 小写英文字母不同者表示各处理浓度间差异显著 Different lowercase letters indicate significant differences between the concentration treatments 图 6 土壤中不同浓度锰胁迫对毛竹叶绿素荧光参数的影响 Fig. 6 Effects of different concentrations of Mn stress in soil on chlorophyll fluorescence parameters of moso bamboo |
2.6 土壤中不同浓度锰胁迫对毛竹抗氧化代谢酶活性与丙二醛含量的影响
如表 3所示,与对照相比,1 000 mg/kg Mn胁迫浓度下,毛竹的SOD和CAT活性显著增加37.8%、18.4%;2 000 mg/kg Mn胁迫浓度下,SOD活性增加15.2%,而POD活性下降31.5%;在4 000 mg/kg Mn胁迫浓度下,POD与CAT活性分别下降39.4%、22.6%。不同浓度Mn胁迫对毛竹的抗氧化代谢酶的活性影响不同,对MDA含量无显著影响。
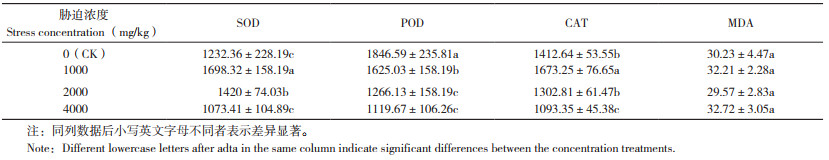
|
3 讨论
Mn在植物代谢和生长过程中起关键作用[22],参与光合作用、呼吸作用,苹果酸酶、硝酸还原酶等酶的生物合成,也是三羧酸循环中许多酶的激活剂[23]。研究表明,超过一定浓度范围,重金属会对植物的生长发育产生危害。重金属污染通过取代必需元素破坏电子传递链、细胞水分失衡、光合色素减少、胞内CO2含量的减少、叶绿素含量下降等[24]。毛竹作为具有一定修复能力的植物,具有调节机制,保护光合作用免受重金属诱导的胁迫,如信号通路、运输网络、活性氧清除、叶绿素相互转化、基因表达等[25]。
毛竹是一种生长快速的植物,高浓度Mn胁迫对毛竹的矿物代谢有显著干扰,损伤毛竹的根系、抑制毛竹叶片的水分利用能力,降低毛竹的生物学指标与生物量等。与对照相比,4 000 mg/kg Mn胁迫浓度下,毛竹的株高、叶长、叶宽和基径分别下降22.6%、25.9%、21.3% 和26.7%。在实际应用中,在毛竹发育早期可利用分枝、分层、扦插或枝条扦插的无性繁殖等方法适应重金属胁迫[26]。
细胞质膜是植物受到重金属胁迫时的第一道保护屏障,当重金属浓度超过植物耐受范围时,会造成氧化应激和损害,出现脂质过氧化现象。本研究中,与对照相比,4 000 mg/kg Mn胁迫下,POD活性与CAT活性分别下降39.4%、22.6%,对MDA含量没有显著影响。表明不同浓度Mn胁迫对毛竹的抗氧化代谢酶的活性影响显著,但对毛竹的膜系统的过氧化损伤有限。毛竹的存活率与生长状况较好,没有叶片枯死黄化、茎秆干枯损伤等现象,说明毛竹具有很强的重金属耐受性。Wang等[27]研究发现,水培试验中,Mn胁迫下栾树叶片光合作用下降,导致植物生物量和叶绿素含量显著下降。
与对照相比,在4 000 mg/kgMn胁迫浓度下的光化学淬灭指数下降29.8%,而非化学淬灭指数下降20.7%,表明高浓度Mn胁迫抑制毛竹光合作用的效率。光合作用期间产生的能量会用于防御重金属的诱导产生的氧化应激,以维持自身的生长发育[28]。在后续应用中可以调控毛竹的生长条件,如增加光照强度、增加CO2浓度、保持土壤水分等,用于增加毛竹的生物量,使之达到预期的修复效果[29]。
本研究中,毛竹虽没有达到超富集植物的标准,但在4 000 mg/kgMn胁迫浓度下,对Mn的转移系数为4.17,表明毛竹具有较强的富集能力[30]。而毛竹纤维形态数据表明,Mn胁迫不会影响毛竹的纤维长度,修复后毛竹依旧能作为纸浆加工的原材料。今后,我们将进一步从生理层面深入研究毛竹对Mn的耐受性,探讨重金属在毛竹体内的转移机制,揭示毛竹对重金属的解毒机理。可以将毛竹与其他超富集植物联合,修复更多的目标重金属土壤,提升空间利用率。还可探究在添加EDTA、槐糖脂等外源物质后毛竹对重金属污染的响应机制,为实现植物修复研究领域提供新的思路[31-33]。
4 结论本文以毛竹为研究对象,进行3年Mn胁迫土柱试验,对毛竹植物学性状、光合参数、叶绿素荧光参数等指标进行测定,阐明毛竹在不同浓度Mn胁迫下的毒性响应机制。结果表明,高浓度的Mn胁迫对毛竹的植物学性状指标有一定抑制作用,显著降低毛竹光化学淬灭能力和非光化学淬灭能力,影响毛竹的相关抗氧化代谢酶的活性。但在4 000 mg/kgMn胁迫下毛竹依旧生长,没有叶片枯死黄化等现象,对Mn的转移系数达到4.17,对Mn胁迫土壤有很好的富集作用。毛竹易于栽培、生物量大、环境适应能力较强,可作为一种新的Mn胁迫土壤的植物修复品种。该研究为今后重金属污染治理的应用与植物修复领域的研究提供参考。
| [1] |
FERREIRA A D, QUEIROZ H M, BARCELLOS D, OTERO X L, NóBREGA G N, BERNARDINO Â F, FERREIRA T O. Screening for natural manganese scavengers: Divergent phytoremediation potentials of wetland plants[J]. Journal of Cleaner Production, 2022, 365: 132811. DOI:10.1016/j.jclepro.2022.132811 |
| [2] |
GABRIEL F Â, FERREIRA A D, QUEIROZ H M, VASCONCELOS A L S, FERREIRA T O, BERNARDINO A F. Long-term contamination of the Rio Doce estuary as a result of Brazil's largest environmental disaster[J]. Perspectives in Ecology and Conservation, 2021, 19(4): 417-428. DOI:10.1016/j.pecon.2021.09.001 |
| [3] |
BRYAN M R, NORDHAM K D, ROSE D I R, O'BRIEN M T, JOSHI P, FOSHAGE A M, GONçALVES F M, NITIN R, UHOUSE M A, ASCHNER M, BOWMAN A B. Manganese acts upon insulin/igf receptors to phosphorylate akt and increase glucose uptake in huntington's disease cells[J]. Molecular Neurobiology, 2020, 57(3): 1570-1593. DOI:10.1007/s12035-019-01824-1 |
| [4] |
CHENG C, HE Q, ZHANG J, CHAI H, YANG Y, PAVLOSTATHIS S G, WU H. New insight into ammonium oxidation processes and mechanisms mediated by manganese oxide in constructed wetlands[J]. Water Research, 2022, 215: 118251. DOI:10.1016/j.watres.2022.118251 |
| [5] |
JIN Y, WANG L, SONG Y, ZHU J, QIN M, WU L, HU P, LI F, FANG L, CHEN C, HOU D. Integrated life cycle assessment for sustainable remediation of contaminated agricultural soil in China[J]. Environmental Science Technology, 2021, 55(17): 12032-12042. DOI:10.1021/acs.est.1c02535 |
| [6] |
郦丹, 余健, 张浩江. 氯接触氧化过滤去除原水中锰的试验研究[J]. 工业水处理, 2013, 33(10): 23-26. DOI:10.3969/j.issn.1005-829X.2013.10.006 LI D, YU J, ZHANG H J. Experimental study on the removal of manganese from raw water by chlorine contact oxidation filtration[J]. Industrial Water Treatment, 2013, 33(10): 23-26. DOI:10.3969/j.issn.1005-829X.2013.10.006 |
| [7] |
GAVRILESCU M. Enhancing phytoremediation of soils polluted with heavy metals[J]. Current Opinion in Biotechnology, 2022, 74: 21-31. DOI:10.1016/j.copbio.2021.10.024 |
| [8] |
GUIDI N W, PALM E, PANDOLFI C, MANCUSO S, AZZARELLO E. Willow and poplar for the phyto-treatment of landfill leachate in Mediterranean climate[J]. Journal of Environmental Management, 2021, 277: 111454. DOI:10.1016/j.jenvman.2020.111454 |
| [9] |
HE L, SU R, CHEN Y, ZENG P, DU L, CAI B, ZHANG A, ZHU H. Integration of manganese accumulation, subcellular distribution, chemical forms, and physiological responses to understand manganese tolerance in Macleaya cordata[J]. Environmental Science and Pollution Research, 2022, 29(26): 39017-26. DOI:10.1007/s11356-022-19562-8 |
| [10] |
HORNING K J, JOSHI P, NITIN R, BALACHANDRAN R C, YANKO F M, KIM K, CHRISTOV P, ASCHNER M, SULIKOWSKI G A, WEAVER C D, BOWMAN A B. Identification of a selective manganese ionophore that enables nonlethal quantification of cellular manganese[J]. Journal of Biological Chemistry, 2020, 295(12): 3875-3890. DOI:10.1074/jbc.RA119.009781 |
| [11] |
BIAN F, ZHONG Z, ZHANG X, YANG C, GAI X. Bamboo - An untapped plant resource for the phytoremediation of heavy metal contaminated soils[J]. Chemosphere, 2020, 246: 125750. DOI:10.1016/j.chemosphere.2019.125750 |
| [12] |
PAN G, LIU W, ZHANG H, LIU P. Morphophysiological responses and tolerance mechanisms of Xanthium strumarium to manganese stress[J]. Ecotoxicology and environmental safety, 2018, 165: 654-661. DOI:10.1016/j.ecoenv.2018.08.107 |
| [13] |
高平珍, 陈双林, 郭子武, 杨清平. 毛竹林下固氮植物资源及其经济价值分析[J]. 浙江农林大学学报, 2018, 35(1): 161-166. DOI:10.11833/j.issn.2095-0756.2018.01.021 GAO P Z, CHEN S L, GUO Z W, YANG Q P. Analysis of nitrogen-fixing plant resources under moso bamboo forests and their economic value[J]. Journal of Zhejiang Agriculture and Forestry University, 2018, 35(1): 161-166. DOI:10.11833/j.issn.2095-0756.2018.01.021 |
| [14] |
CHEN X, ZHANG X, ZHANG Y, BOOTH T H, HE X. Changes of carbon stocks in bamboo stands in China during 100 years[J]. Forest Ecology and Management, 2009, 258: 1489-1496. DOI:10.1016/j.foreco.2009.06.051 |
| [15] |
TONG R, ZHOU B, CAO Y, GE X, JIANG L. Metabolic profiles of moso bamboo in response to drought stress in a field investigation[J]. Science Total Environ, 2020, 720: 137722. DOI:10.1016/j.scitotenv.2020.137722 |
| [16] |
张玲, 叶正钱, 李廷强, 杨肖娥. 铅锌矿区污染土壤微生物活性研究[J]. 水土保持学报, 2006(3): 136-140. DOI:10.3321/j.issn:1009-2242.2006.03.033 ZHANG L, YE Z Q, LI T Q, YANG X E. Microbial activity of contaminated soils in lead-zinc mining areas[J]. Journal of Soil and Water Conservation, 2006(3): 136-140. DOI:10.3321/j.issn:1009-2242.2006.03.033 |
| [17] |
ZHANG B, GAO Y, ZHANG L, ZHOU Y. The plant cell wall: Biosynthesis, construction, and functions[J]. Journal of Integrative Plant Biology, 2021, 63(1): 251-272. DOI:10.1111/jipb.13055 |
| [18] |
邓述培, 范鹏飞, 唐玉霜, 谭丽娟, 王茁, 黄利宁, 徐洪柳. X射线荧光光谱(XRF)法测定土壤污染样品中9种重金属元素[J]. 中国无机分析化学, 2019, 9(4): 12-15. DOI:10.3969/j.issn.2095-1035.2019.04.003 DENG S P, FAN P F, TANG Y S, TAN L J, WANG Z, HUANG L N, XU H L. Determination of nine heavy metals in soil contaminated samples by X-ray fluorescence spectrometry (XRF)[J]. Inorganic Analytical Chemistry of China, 2019, 9(4): 12-15. DOI:10.3969/j.issn.2095-1035.2019.04.003 |
| [19] |
吴玉涛, 高浩博, 李昌俊. 纤维素基可穿戴压力传感材料的制备与应用[J]. 齐鲁工业大学学报, 2020, 34(5): 8-15. DOI:10.16442/j.cnki.qlgydxxb.2020.05.002.qlgydxxb.2020.05.002 WU Y T, GAO H B, LI C J. Preparation and application of cellulosicbased wearable pressure sensing materials[J]. Journal of Qilu University of Technology, 2020, 34(5): 8-15. DOI:10.16442/j.cnki.qlgydxxb.2020.05.002.qlgydxxb.2020.05.002 |
| [20] |
姜生秀, 严子柱. 不同欧李幼苗品种光合特性比较[J]. 华北农学报, 2020, 35(6): 122-132. DOI:10.7668/hbnxb.20191272 JIANG S X, YAN Z Z. Comparison of photosynthetic characteristics of different oleander seedling varieties[J]. Acta Agriculturae BorealiSinica, 2020, 35(6): 122-132. DOI:10.7668/hbnxb.20191272 |
| [21] |
梁艺馨, 李洁, 刘康. 气相色谱- 串联质谱同位素内标法测定果蔬食品中有机锡类农药残留[J]. 现代食品科技, 2021(1): 268-275. DOI:10.13982/j.mfst.1673-9078.2021.01.0607 LIANG Y X, LI J, LIU K. Determination of organotin pesticide residues in fruits and vegetables by gas chromatography-tandem mass spectrometry with isotope internal standard[J]. Modern Food Science and Technology, 2021(1): 268-275. DOI:10.13982/j.mfst.1673-9078.2021.01.0607 |
| [22] |
赵弢, 高志奎, 徐广辉, 王梅, 高荣孚. 非调制式荧光仪测定叶绿素荧光参数的研究[J]. 生物物理学报, 2006, 22(1): 34-38. DOI:10.3321/j.issn:1000-6737.2006.01.006 ZHAO T, GAO Z K, XU G H, WANG M, GAO R F. Determination of chlorophyll fluorescence parameters by unmodulated fluorometry[J]. Acta Biophysica Sinica, 2006, 22(1): 34-38. DOI:10.3321/j.issn:1000-6737.2006.01.006 |
| [23] |
李欣航, 肖泽华, 匡雪韶, 王悟敏, 罗亮宇, 刘文胜. 锰胁迫下鸡眼草的富集特征及生理响应[J]. 草业学报, 2021, 30(7): 9. DOI:10.11686/cyxb2020259 LI X H, XIAO Z H, KUANG X S, WANG W M, LUO L Y, LIU W S. Enrichment characteristics and physiological response of chickweed under manganese stress[J]. Acta Prataculturae Sinica, 2021, 30(7): 9. DOI:10.11686/cyxb2020259 |
| [24] |
GAWĘDA T, MAŁEK S, BŁOŃSKA E, JAGODZIŃSKI A M, BIJAK S, ZASADA M. Macro- and micronutrient contents in soils of a chronosequence of naturally regenerated birch stands on abandoned agricultural lands in central poland[J]. Forests, 2021, 12(7): 956. DOI:10.3390/f12070956 |
| [25] |
WANG D, HU P, TIE N. Responses of photosynthesis and antioxidant activities in Koelreuteria paniculata young plants exposed to manganese stress[J]. South African Journal of Botany, 2022, 147: 340-347. DOI:10.1016/j.sajb.2021.12.040 |
| [26] |
PARDO H M, LóPEZ D M, MARTí G J M, MARTíNEZ-LORENTE S E, RIVERO R M. ROS and NO Phytomelatonin-induced signaling mechanisms under metal toxicity in plants: a review[J]. Antioxidants (Basel), 2021, 10(5): 775. DOI:10.3390/antiox10050775 |
| [27] |
WANG D B, HU P, TIE N. Responses of photosynthesis and antioxidant activities in Koelreuteria paniculata young plants exposed to manganese stress[J]. South African Journal of Botany, 2022, 147: 340-348. DOI:10.1016/j.sajb.2021.12.040 |
| [28] |
EMAMVERDIAN A, DING Y, BARKER J, MOKHBERDORAN F, RAMAKRISHNAN M, LIU G, LI Y. Nitric oxide ameliorates plant metal toxicity by increasing antioxidant capacity and reducing Pb and Cd translocation[J]. Antioxidants, 2021, 10(12): 1981. DOI:10.3390/antiox10121981 |
| [29] |
YANG Y, JIANG M, LIAO J, LUO Z, GAO Y, YU W, HE R, FENG S. Effects of simultaneous application of double chelating agents to pb-contaminated soil on the phytoremediation efficiency of Indocalamus decorus QH Dai and the soil environment[J]. Toxics, 2022, 10(12): 713. DOI:10.3390/toxics10120713 |
| [30] |
BAKER A. Accumulators and excluders strategies in response of plants to heavy metals[J]. Journal of Plant Nutrition, 1981, 3: 643-654. DOI:10.1080/01904168109362867 |
| [31] |
HUANG R, CUI X, LUO X, MAO P, ZHUANG P, LI Y, LI Y, LI Z. Effects of plant growth regulator and chelating agent on the phytoextraction of heavy metals by Pfaffia glomerata and on the soil microbial community[J]. Environmental Pollution, 2021, 283: 117159. DOI:10.1016/j.envpol.2021.117159 |
| [32] |
SHAH V, DAVEREY A. Effects of sophorolipids augmentation on the plant growth and phytoremediation of heavy metal contaminated soil[J]. Journal of Cleaner Production, 2021, 280: 124406. DOI:10.1016/j.jclepro.2020.124406 |
| [33] |
ZHANG X, BIAN F, ZHONG Z, GAI X, YANG C. Deciphering the rhizosphere microbiome of a bamboo plant in response to different chromium contamination levels[J]. Journal of Hazardous Materials, 2020, 399: 123107. DOI:10.1016/j.jhazmat.2020.123107 |
 2023, Vol. 50
2023, Vol. 50