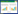文章信息
基金项目
- 广东省重点领域研发计划项目(2018B030335001)
作者简介
- 冯婷茵(1996—),女,在读硕士生,研究方向为生物信息学,E-mail:1186679472@qq.com.
通讯作者
- 邢珂(1977—),男,博士,教授,研究方向为生物信息学,E-mail:550421387@qq.com.
文章历史
- 收稿日期:2023-03-24
【研究意义】动物的性别决定机制有两种类型,分别是遗传性别决定型(Genetic sex determination,GSD)和环境依赖性别决定型(Environment dependent sex determination,ESD)。高等脊椎动物,如哺乳动物和鸟类的性别决定机制属于遗传性别决定型[1],而鱼类、两栖类和爬行类动物的性别决定机制不完全依赖于染色体,环境温度、pH值、激素、行为模式等因素都会改变和影响个体的性别分化[2-5],而且这种影响可以贯穿个体发育的全过程。因此,在很多鱼类和爬行类动物中都可以观察到环境因素诱导的性别逆转现象。
在水产养殖中,鱼类的个体大小、外形、体色等具有经济价值的性状通常与某一特定性别关联。如雄性罗非鱼(Oreochromis niloticus)和乌斑杂交鳢(Channa)都比其雌性个体生长速度快、体型大,具有更高的经济价值[6-7];而大菱鲆(Scophthalmus maximus)雌鱼体型比雄鱼大50%[8]。西部食蚊鱼(Gambusia affinis)为暖水性的小型硬骨鱼类,生活于水库、湖泊、坝塘、沼泽、稻田、水渠、洼地等各类静水水体中。因其嗜食蚊子幼虫及具有观赏价值而被引入我国,分布于长江以南诸多省区[9]。由于食蚊鱼具有容易获得、生长速度快、繁殖能力强、性别二态性,且与哺乳动物对化学物质的反应方式相似等特点,近年来食蚊鱼被当成一种很好的模式生物,广泛应用于进化和生态等研究领域[10-12]。因此,利用食蚊鱼研究鱼类性别逆转,有助于在水产养殖业中控制种群性别比例、培养全单性种群,具有重要的科学意义和经济价值[13-15]。
【前人研究进展】食蚊鱼的性别决定染色体为ZW/ZZ型,但其性别分化同时受到环境因素的影响。研究发现,养猪场、纸浆造纸厂和城镇污水处理厂附近水域中高含量的孕激素使雌性食蚊鱼的性腺发育、生殖交配行为受到损害,并使其出现雄鱼的第二性征,进而改变该种群的雌雄比例[16-17]。深入研究表明由雌性食蚊鱼通过性别逆转产生的伪雄性食蚊鱼具有与野生雄性食蚊鱼相似的追逐、摇摆、交配等行为[18-19],但其摆动臀鳍的频率更低。此外,这些伪雄性食蚊鱼的生殖足无法与雌性个体完全匹配,需要在交配中保持更高的交配频率。以上研究表明,雌性食蚊鱼在环境中高剂量孕激素的诱导下可发生性别逆转现象,且其产生的伪雄性个体获得了部分生殖行为能力。
【本研究切入点】虽然目前针对硬骨鱼类的性别逆转已有一些研究,但针对食蚊鱼的性别逆转研究鲜有报道,从单细胞基因表达水平探讨其性别逆转机制的研究仍为空白。本研究以养殖业中广泛应用的新型孕激素——孕二烯酮(Gestodene,GES)作为外源激素[20],以西部食蚊鱼(以下简称食蚊鱼)为研究对象,从形态学和单细胞转录组水平研究孕二烯酮诱导下雌性食蚊鱼雄性化过程中性腺单细胞水平基因表达的变化。【拟解决的关键问题】本研究利用单细胞转录组测序技术,从单细胞水平分析孕二烯酮诱导后雌性食蚊鱼性腺基因表达谱的变化,挖掘雌性食蚊鱼雄性化的关键基因,初步解析食蚊鱼性别逆转的分子机理,丰富动物性腺单细胞数据,为后续研究提供更多有效的数据资源。
1 材料与方法 1.1 试验材料2022年10月于广州市花地湾花鸟鱼虫市场购买4月龄左右的西部食蚊鱼,转至广州大学实验室水循环养殖系统培养驯化,设置温度26(±1)℃,光周期14 h: 10h(光照︰黑暗),水体硬度140(±2.5) mg/L,水体导电性20(±0.3) μS/cm,pH值7.4(±0.5),溶解氧含量7.4(±0.2) mg/L。经过2个月驯化稳定后,食蚊鱼死亡率小于5%,已性成熟可用于试验。实验鱼的使用和实验操作符合“实验动物3R原则” [21]。
主要试剂包括孕二烯酮(GES, 纯度99.4%)购自上海西格玛奥德里奇贸易有限公司(Sigma-Aldrich)、二甲基亚砜(DMSO, 纯度99.9%)购自上海生工生物工程公司。500 ng/L孕二烯酮溶液:将24 μL 2 mg/mL孕二烯酮溶液溶于4 776 μL二甲基亚砜中,取1 250 μL加进25 L水中。
4 ℃预冷的400 μg/mL磷酸盐缓冲生理盐水(PBS)溶液(含0.04% BSA, 无Ca2+、Mg2+);30℃预热的400 μg/mL 1×HBSS缓冲液(含0.04% BSA,有Ca2+、Mg2+);消化酶混合液:1 000 μL 1× HBSS缓冲液(30℃预热)+ 1 μL DNA酶Ⅰ(2 000 U/mL)+ 10 μL胶原酶Ⅰ(10%)+ 10 μL胶原酶Ⅱ(10%)+ 10 μL胶原酶Ⅳ(10%)+ 5 μL透明质酸酶(10%)+ 10 μL中性蛋白酶(5%)+ 2 μL离子缓冲液。
1.2 试验方法1.2.1 试验分组与处理 挑选体长为3.0(±0.5)cm、体质量为130(±50)mg的成年雌性食蚊鱼(6月龄)和体长为1.9(±0.6)cm、体质量为110(±70)mg的成年雄性食蚊鱼(6月龄)参与孕二烯酮暴露实验。设置雄性和雌性食蚊鱼的空白对照(FC,female control;MC,male control)以及雌性食蚊鱼孕二烯酮暴露4周和8周的处理组(F4,female treated for 4 weeks;F8,female treated for 8 weeks),各组设3个重复。孕二烯酮处理组为每个容积12 L的缸中放置10条雌性成鱼和10 L孕二烯酮暴露溶液。
1.2.2 单细胞悬液制备 用解剖剪刀由食蚊鱼肛门开始沿腹部剪至鳃盖下缘,再从两端分别向背部解剖,在体视镜下取出性腺组织,使用预冷至4 ℃的1×PBS洗涤2~3次。将组织切成小碎片,然后转移到消化酶混合液中,30 ℃消化30~50 min,每隔3 min摇1次,进行初步显微镜检查。消化后的细胞悬液用70 μm过滤器过滤,用2 mL 1× PBS清洗离心管和细胞筛。用水平离心机在4 ℃下以200 g离心5 min;取上清,加入5 mL 1×PBS重悬细胞,再以200 g离心5 min,洗涤2~3次;根据沉淀的量加入预冷的1×PBS溶液(沉淀较大加入1 mL,较少则加入0.5 mL,几乎看不到沉淀则加100 μL),轻轻混匀。利用显微镜细胞计数板和0.2% 台盼蓝染色液检测细胞浓度和活性并记录。
1.2.3 单细胞文库构建及测序 使用10×GenomicsTM微流控芯片,将单细胞悬液和Chromium Single Cell 3’ Reagent(v3,10×Genomics)试剂盒混合,在油相反应体系中形成单细胞珠状凝胶液滴[22]。随后,在53 ℃下反转录45 min、85 ℃下反应5 min后终止反应,制备出测序所需的cDNA。将cDNA进行PCR扩增,对得到的扩增cDNA进行片段化、末端修复和补全polyA尾巴,添加测序接头并进行文库扩增,最终制备出单细胞cDNA文库。单细胞测序采用10×Genomics Novaseq 6000测序平台,并用CellRanger(10×GenomicsTM)比对得到原始测序数据。
1.3 数据处理及分析使用Seurat[23]进行主成分分析(Principle Component Analysis,PCA),选择适当的主成分进行下一步非监督聚类和UMAP(Uniform Manifold Approximation and Projection)分析。根据单细胞聚类结果,在Seurat中进行特征基因筛选,确定每个细胞亚群的特征基因,并利用CellKB[24]和Fish Enrichr[25-26]数据库鉴定每个细胞亚群对应的细胞类型。
根据细胞类型注释的结果,选择相关的细胞群进行细胞轨迹分析。使用Monocle[27]将单细胞数据集转换成CDS(Cell dataset object)类型,进行预处理(使用降维函数将数据缩小到较低维度,reduction_method =“UMAP”,preprocess_method=“Aligned”),嵌入降维数据,进行拟时序计算。在过滤掉低质量数据后进行细胞聚类分析,根据不同的细胞状态分类并进行可视化分析。
根据上述拟时序计算和细胞分化轨迹结果,找到关键细胞群的分化节点,通过BEAM(Branch Expression Analysis Modeling)分析筛选对分化节点最关键的基因[28-29],并使用cluster Profiler[30]进行KEGG富集分析。
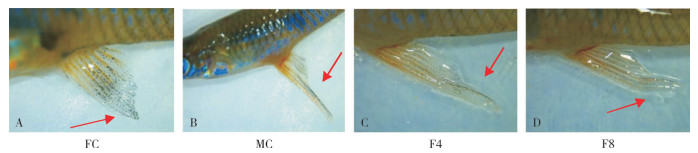
2 结果与分析 2.1 孕二烯酮诱导后的食蚊鱼鳍部形态变化孕二烯酮诱导后的雌性食蚊鱼臀鳍形态发生了雄性化的变化。野生雌性食蚊鱼的臀鳍为扇形或三角形,而雄性的臀鳍具有特化的生殖足结构。经孕二烯酮诱导处理4~8周后,雌性食蚊鱼臀鳍发生了不同程度的特化现象,呈现出类似于雄性生殖足的结构(图 1)。结果表明,孕二烯酮在雌性食蚊鱼的性别逆转过程中起重要的调节作用,能够促进其雄性化外部特征的出现。
|
| 图 1 孕二烯酮诱导后的食蚊鱼鳍部形态变化 Fig. 1 Changes in fin morphology of mosquitofish exposed to GES |
2.2 孕二烯酮诱导后的食蚊鱼性腺细胞构成变化
为进一步探究孕二烯酮诱导下雌性食蚊鱼雄性化的分子机制,本研究分别收集MC、FC、F4和F8组的食蚊鱼性腺进行单细胞测序。测序产生的数据使用CellRanger软件进行单细胞基因表达定量分析;将表达数据进行质量控制和筛选,剔除低质量单细胞数据,最终获得每个样本的单细胞基因表达谱。MC、FC、F4和F8样本的测序数据如表 1所示,单个样本有效细胞数介于8 982~13 873之间,检测到的有效表达基因数目介于19 891~20 250之间,有效Barcodes比例均在97% 以上,表明数据质量优秀。
分析使用Sctransform对4个样本的数据进行归一化并整合,利用UMAP进行降维处理。由图 2B可见,野生雌性FC组和孕二烯酮处理后的雌性F4、F8组细胞重叠较好,而雄性MC组的细胞相对呈独立分布特征,说明成年雌性食蚊鱼和雄性食蚊鱼性腺细胞构成具有较大差异,且经孕二烯酮诱导后的雌性性腺细胞构成仍与雄性不同。
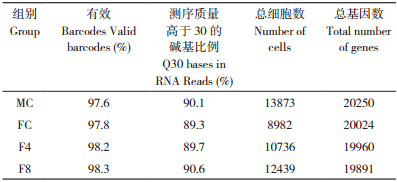
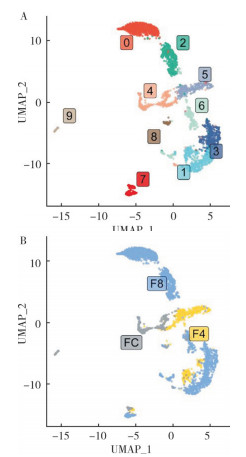
为了确定食蚊鱼性腺的具体细胞构成类型和对应的基因表达情况,本研究进一步对细胞进行聚类,提取每个细胞类群特异高表达的marker基因,利用CellKB和Fish Enrichr对细胞类型进行注释分析。剔除血液细胞和免疫细胞后,结果发现食蚊鱼性腺一共包含6种主要的细胞类型(图 2A,表 2)。不同样本间比较发现,雄性食蚊鱼性腺主要由成纤维细胞、雄性生殖细胞、上皮细胞和原始生殖细胞构成,而雌性性腺主要由内皮细胞、成纤维细胞、卵母细胞和原始生殖细胞构成。孕二烯酮诱导处理4~8周后,雌性食蚊鱼性腺中产生少量的雄性生殖细胞(F4 0.79%,F8 0.39%)。此外,诱导8周后性腺中原始生殖细胞比例较野生雌性样本极显著上升。

|
| A:细胞类型UMAP;B:细胞来源UMAP A: UMAP of cell types; B: UMAP of cell sources 图 2 食蚊鱼性腺单细胞UMAP图谱 Fig. 2 Single-cell UMAP diagrams of gonads in mosquitofish |
2.3 原始生殖细胞的基因表达与分化
2.3.1 原始生殖细胞的基因表达 提取来自FC、F4和F8样本的原始生殖细胞进行重聚类和分析,并重点分析与性别决定相关重要基因的表达情况。结果表明,来自FC、F4和F8的原始生殖细胞可以被划分为9个亚类型(图 3)。值得注意的是,不同性别分化的关键基因在不同细胞类群里出现差异表达情况。几个与雄性生殖细胞分化密切相关的基因(如amh、fabp3、dmrt1、wt1a和wt1b)在cluster1和cluster3中高表达;对雌性性腺发育和卵子形成有重要作用的cyp19a1a及fgf16基因则在cluster 0和cluster 2中高表达(图 4)。结果表明,在孕二烯酮诱导下原始生殖细胞类群中同时出现了两种具有不同性别决定潜能的细胞。
|
| A:细胞状态UMAP;B:细胞来源UMAP A: UMAP of cell state; B: UMAP of cell sources 图 3 原始生殖细胞状态和细胞来源UMAP图谱 Fig. 3 UMAP diagrams of primordial germ cells state and sources |
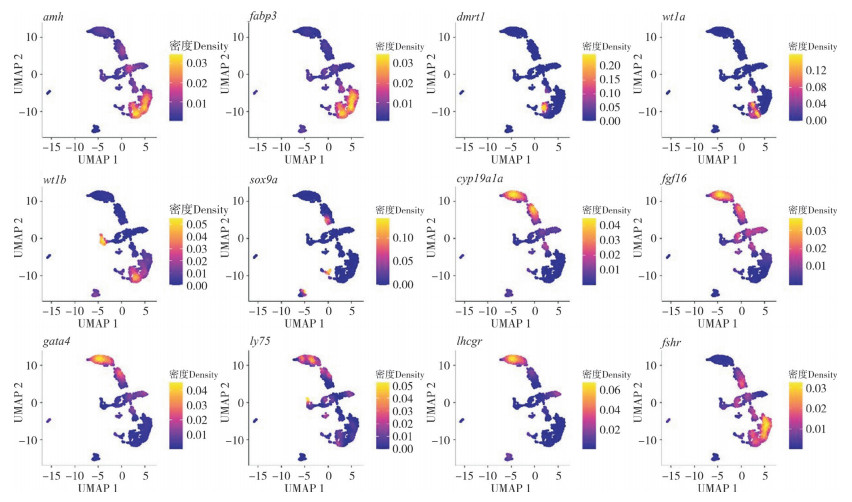
|
| 图 4 原始生殖细胞性别特征基因表达图谱 Fig. 4 Gene expression profiles of sex characteristics in primordial germ cells |
2.3.2 原始生殖细胞的分化 利用单细胞轨迹分析和拟时序分析研究原始生殖细胞的分化过程以及对应的基因表达变化序列,结果(图 5B)显示,来自FC的样本主要集中分布在原始生殖细胞分化轨迹的早期,来自F4和F8的细胞主要集中分布在分化轨迹的中晚期。孕二烯酮诱导后,原始生殖细胞出现了两种截然不同的分化方向。结合图 4中性别分化关键基因的表达情况,推测部分原始生殖细胞出现向雄性生殖细胞分化的趋势,而部分细胞维持向雌性生殖细胞分化的趋势(图 5C)。

|
| A:不同细胞亚类型分化轨迹;B:不同细胞来源分化轨迹;C:细胞拟时序分化轨迹 A: Differentiation trajectories of different seurat-clusters of cell; B: Differentiation trajectories of different sample sources; C: Differentiation trajectories of cell pseudotime 图 5 原始生殖细胞分化轨迹 Fig. 5 Trajectory analysis of primordial germ cells |
基于上述细胞分化轨迹,通过BEAM分析发现,有2 477个基因在两个不同的分化方向表现出不同的表达模式(图 6A)。对差异最大的前200个基因进行KEGG通路富集分析,结果发现Toll-like receptor、TGF-beta、Notch等信号通路参与了原始生殖细胞向雄性化逆转的过程(图 6B);甘氨酸,丝氨酸、苏氨酸、半胱氨酸、甲硫氨酸代谢、氨基糖和核苷酸糖代谢等途径也与该过程相关(图 6C);不饱和脂肪酸、类固醇激素生物合成,醚酯、亚油酸代谢等途径则对维持原始生殖细胞向雌性性腺分化有重要作用(图 6B)。
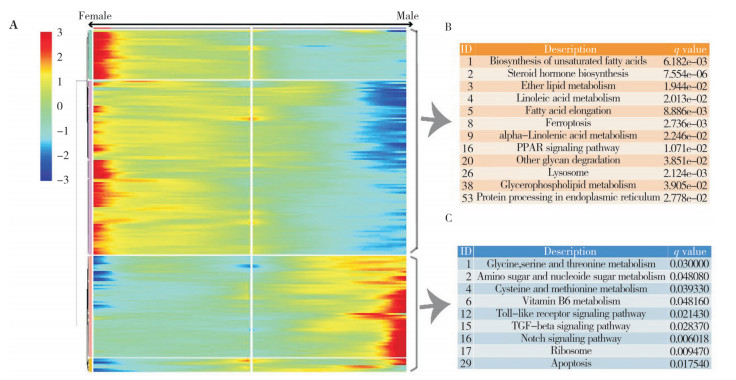
|
| A:原始生殖细胞BEAM分析结果;B、C:分别为雌性、雄性生殖细胞分化相关基因KEGG富集结果 A: BEAM analysis of primordial germ cell; B: KEGG enrichment of female germ cell related genes; C: KEGG enrichment of male germ cell related gene 图 6 原始生殖细胞BEAM分析及基因富集分析结果 Fig. 6 BEAM analysis of primordial germ cells and enrichment analysis of genes |
3 讨论
原始生殖细胞是一类生殖干细胞,具有向不同性别生殖细胞分化的潜能,是鱼类性别决定和分化过程中最重要的一类细胞。其形成方式目前存在两种学说,第一种是先成论,指受精卵带有母源生殖质,随着细胞分裂进行,生殖质被不均等地分配,获得生殖质的细胞将发育成原始生殖细胞,否则发育成体细胞,如斑马鱼(Danio rerio)、泥鳅(Misgurnus anguillicaudatus)和大菱鲆等;另一种是后成论,指受精卵早期分裂中的体细胞与生殖细胞没有区别,但会因某些细胞间信号诱导分化成原始生殖细胞,如哺乳动物、青鳉(Oryzias latipes)、真鲷(Pagrosomus major)[31-34]。本研究发现孕二烯酮刺激下,随着时间增加,雌性食蚊鱼中的原始生殖细胞数量不断上升,推测食蚊鱼原始生殖细胞形成方式属于后成论。通过富集分析发现Toll-like receptor、TGF-beta、Notch等信号通路参加了食蚊鱼雄性化的过程,推测以上通路也可能诱导原始生殖细胞生成。
原始生殖细胞的基因表达和细胞数量都有可能影响鱼类的性别决定。在斑马鱼和青鳉的研究中发现,原始生殖细胞数量不足的个体倾向于发育为雄鱼,而原始生殖细胞较多的个体则倾向于发育为雌鱼[35-37]。相比之下,泥鳅的性别决定则与原始生殖细胞的数量无关[38]。本研究发现孕二烯酮刺激下雌性食蚊鱼出现向雄性化逆转的现象,且伴随原始生殖细胞数量显著上升,这一结果与在斑马鱼、青鳉和泥鳅中观察到的情况均不相同。分析其原因可能与不同鱼类多样化的性别决定机制有关,且这一结果进一步说明原始生殖细胞数目是决定鱼类性别分化的重要因素之一。
本研究发现孕二烯酮刺激下有几个与鱼类性别分化密切相关的基因(amh、fabp3、dmrt1、wt1a、wt1b、cyp19a1a和fgf16)在原始生殖细胞内出现差异表达的情况。其中TGFβ超家族成员amh基因是硬骨鱼睾丸分化的关键基因。哺乳动物中该基因诱导缪勒氏管退化,并阻止雌性生殖管发育[39]。而在鱼类中amh被发现可以通过调节cyp11a1、cyp17和cyp19a1a的表达进而影响性腺中的睾酮含量[40]。研究发现,东部食蚊鱼(Gambusia holbrooki)雄性胚胎中amh基因的表达量是雌性胚胎的25倍[41]。本研究中amh基因在孕二烯酮诱导后在部分原始生殖细胞中出现了高表达的情况,说明这部分细胞可能出现了向雄性化分化的特征。此外,本研究还发现amh和cyp19a1a基因具有截然相反的表达模式,侧面印证了性腺分化过程中amh基因对cyp19a1a的抑制作用。
促卵泡激素(Follicle-stimulating hormone,FSH)和促黄体化激素(Luteninzing hormone,LH)通过与其对应的受体FSHR和LHCGR相结合调控性腺发育。fshr和lhcgr基因在青鳉卵巢和睾丸中均具有较高的表达水平,在睾丸形成过程中,两个基因的表达均有上调现象[42],说明这两个基因对雄性性腺的发育有重要作用。本研究发现,在食蚊鱼原始生殖细胞向雄性化分化的过程中,fshr出现上调现象,但lhcgr则并未出现明显上调。由于在卵泡形成过程中lhcgr的表达相比fshr存在一定的滞后现象[43],推测这两个基因在雄性化过程中的表达同样存在表达时间差异的可能。比较野生雌性食蚊鱼和孕二烯酮处理后雌性食蚊鱼的单细胞图谱,本研究发现诱导后的原始生殖细胞开始出现向雄性化分化的特征,出现极少量的分化后雄性生殖细胞(精原细胞),这说明诱导后的雌鱼已经在一定程度上具有雄性食蚊鱼的生殖功能,但其生殖能力还远远低于正常的雄性食蚊鱼。在本试验所用孕二烯酮剂量下,完全的雄性化过程可能需要更长的时间。在前期的预实验中发现,当环境中孕二烯酮浓度达到500 ng/L时,培养2个月后的食蚊鱼就开始出现死亡情况,且随着时间增加死亡数目不断上升,3个月时70% 的食蚊鱼已经死亡。因此,为了确保获得足够的样本进行测序和分析,本研究选择8周作为最长的暴露时间来观察食蚊鱼的性别逆转现象。下一步研究将通过调节暴露浓度和延长暴露时间进一步跟踪雌性食蚊鱼完全雄性化的过程。
已有多项研究证明雌性食蚊鱼暴露在孕激素中会诱导出与雄鱼类似的生殖足,即发生臀鳍雄性化。雄鱼生殖足的形成和发育主要由类固醇激素决定,特别是雄激素[44-45]。在一些鱼类中,雄激素尤其是11- 酮睾酮(11KT)可刺激鱼鳍的伸长,而雄激素拮抗剂或雄激素合成抑制剂会干扰睾丸功能和外生殖器发育[46]。研究发现ar、shh、ptc1、cyp19a、er和vtgc等基因都与性别二态性鱼类臀鳍发育相关[47-48],本研究也发现cyp19a基因存在特异性表达,与以往研究结果符合。
单细胞测序是一项新兴的组学研究技术,凭借其高通量的准确性和特异性,广泛应用于生物的各种生理过程研究。目前利用单细胞测序分析来研究鱼类性别逆转的报道有半滑舌鳎(Cynoglossus semilaevis),其雌性个体在发育早期用高温诱导可使雌鱼的性逆转率达到73%[49]。利用单细胞测序技术发现,在未分化的伪雄性精原细胞中,CaSR基因和MAPK信号因子上调[50]。本研究未发现该基因和信号因子上调,可能原因是不同机制诱导的性别逆转涉及到的信号通路不同,以及不同鱼类遗传背景也会导致性别转变机制不同。鱼类的性别逆转是个复杂过程,仍需要大量的研究来填补该空白领域。
4 结论将雌性食蚊鱼置于浓度为500 ng/L孕二烯酮溶液暴露4~8周后,发现雌性食蚊鱼臀鳍出现雄性化特征;分别取野生雌性、雄性食蚊鱼和暴露4、8周雌性食蚊鱼的性腺进行单细胞转录组测序并进行数据分析,结果发现野生雌性食蚊鱼和雄性食蚊鱼性腺细胞构成明显不同,暴露4、8周后的雌性食蚊鱼性腺中出现少量的雄性生殖细胞(精原细胞),且原始生殖细胞数量有明显上升;在孕二烯酮诱导下雌性食蚊鱼原始生殖细胞中性别决定关键基因amh、fabp3、dmrt1、wt1a、wt1b、cyp19a1a和fgf16出现差异化表达情况;细胞轨迹分析表明,部分原始生殖细胞出现向雄性化分化的特征。Toll-like receptor、TGF-beta、Notch和一些氨基酸代谢信号通路参与了原始生殖细胞向雄性化逆转的过程。
| [1] |
NAGAHAMA Y, CHAKRABORTY T, PAUL-PRASANTH B, OHTA K, NAKAMURA M. Sex determination, gonadal sex differentiation, and plasticity in vertebrate species[J]. Physiological Reviews, 2021, 101(3): 1237-1308. DOI:10.1152/physrev.00044.2019 |
| [2] |
CASTAÑEDA-CORTÉS D C, FERNANDINO J I. Stress and sex determination in fish: from brain to gonads[J]. The International Journal of Developmental Biology, 2021, 65(4/5/6): 207-214. DOI:10.1387/ijdb.200072jf |
| [3] |
YAMAMOTO Y, HATTORI R S, PATIÑO R, STRÜSSMANN C A. Environmental regulation of sex determination in fishes: Insights from Atheriniformes[J]. Current Topics in Developmental Biology, 2019, 134: 49-69. DOI:10.1016/bs.ctdb.2019.02.003 |
| [4] |
GARCÍA-CRUZ E L, YAMAMOTO Y, HATTORI R S, DE VASCONCELOS L M, YOKOTA M, STRÜSSMANN C A. Crowding stress during the period of sex determination causes masculinization in pejerrey Odontesthes bonariensis, a fish with temperature-dependent sex determination[J]. Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology, 2020, 245: 110701. DOI:10.1016/j.cbpa.2020.110701 |
| [5] |
KOBAYASHI Y, NAGAHAMA Y, NAKAMURA M. Diversity and plasticity of sex determination and differentiation in fishes[J]. Sexual Development, 2013, 7(1/3): 115-125. DOI:10.1159/000342009 |
| [6] |
颉晓勇, 李思发, 蔡完其, 钟金香, 张汉华, 叶卫, 陈辉崇. 吉富品系尼罗罗非鱼生长性能的选择响应分析[J]. 广东农业科学, 2011, 38(1): 135-138. DOI:10.16768/j.issn.1004-874X.2011.01.057 XIE X Y, LI S F, CAI W Q, ZHONG J X, ZHANG H H, YE W, CHEN H C. Selection response to growth performance of F6~F9 of GIFT strain Oreochromis niloticus[J]. Guangdong Agricultural Sciences, 2011, 38(1): 135-138. DOI:10.16768/j.issn.1004-874X.2011.01.057 |
| [7] |
欧密, 赵建, 罗青, 刘海洋, 黄容, 汪亚平, 陈昆慈. 鳢性别控制育种及应用研究进展[J]. 中国农业科技导报, 2022, 24(2): 11-25. DOI:10.13304/j.nykjdb.2021.0578 OU M, ZHAO J, LUO Q, LIU H Y, HUANG R, WANG Y P, CHEN K C. Research progress on the breeding and application of sex control in Snakehead[J]. Journal of Agricultural Science and Technology, 2022, 24(2): 11-25. DOI:10.13304/j.nykjdb.2021.0578 |
| [8] |
IMSLAND A.K, FOLKVORD A, GRUNG G L, STEFANSSON S O, TARANGER G L. Sexual dimorphism in growth and maturation of turbot, Scophthalmus maximus (Rafinesque, 1810)[J]. Aquaculture Research, 1997, 28(2): 101-114. DOI:10.1046/j.1365-2109.1997.t01-1-00829.x |
| [9] |
李家乐. 中国外来水生动植物[M]. 上海: 上海科技出版社, 2007: 58. LI J L. Exotic aquatic plants and animals of China[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2007: 58. |
| [10] |
徐涛, 孙刚, 房岩, 胡子祎. 环境激素的作用机制及研究进展[J]. 广东农业科学, 2011, 38(23): 155-157. DOI:10.16768/j.issn.1004-874X.2011.23.014 XU T, SUN G, FANG Y, HU Z Y. Action mechanism and research advances of environmental hormone[J]. Guangdong Agricultural Sciences, 2011, 38(23): 155-157. DOI:10.16768/j.issn.1004-874X.2011.23.014 |
| [11] |
HOU L P, CHEN S D, LIU J, GUO J, CHEN Z, ZHU Q, ZHANG W, XU G, LIANG Y, WU R R, FANG X W, ZHANG C P, XING K. Transcriptomic and physiological changes in western mosquitofish (Gambusia affinis) after exposure to norgestrel[J]. Ecotoxicology and Environmental Safety, 2019, 171: 579-586. DOI:10.1016/j.ecoenv.2018.12.053 |
| [12] |
HOU L P, CHEN S D, CHEN H X, YING G G, CHEN D Y, LIU J, LIANG Y, WU R R, FANG X W, ZHANG C P, XIE L T. Rapid masculinization and effects on the liver of female western mosquitofish (Gambusia affinis) by norethindrone[J]. Chemosphere, 2019, 216: 94-102. DOI:10.1016/j.chemosphere.2018.10.130 |
| [13] |
OGITA M, KARINO K. Effect of body coloration on male-male competition in a cyprinid fish Puntius titteya[J]. Zoological Science, 2019, 36(2): 141-146. DOI:10.2108/zs180110 |
| [14] |
周连宁, 黎双飞, 刘芳, 吴属连, 赵政业. TBTC对斑马鱼磷酸酶、ATPase和类固醇激素影响的研究[J]. 广东农业科学, 2013, 40(1): 119-122. DOI:10.16768/j.issn.1004-874X.2013.01.001 ZHOU L N, LI S F, LIU F, WU S L, ZHAO Z Y. Effect of TBTC on phosphatase, ATPase and steroid hormones in zebra fish[J]. Guangdong Agricultural Sciences, 2013, 40(1): 119-122. DOI:10.16768/j.issn.1004-874X.2013.01.001 |
| [15] |
SÁNCHEZ-GONZÁLEZ J R, NICIEZA A G. Individual differences in dominance-related traits drive dispersal and settlement in hatchery-reared juvenile brown trout[J]. Scientifi c Reports, 2021, 11(1): 7277. DOI:10.1038/s41598-021-86613-4 |
| [16] |
HUANG G Y, LIANG Y Q, LIU Y S, SHI W J, LIU S S, HU L X, XIE L, YING G G. Swine farm wastewater discharge causes masculinization of western mosquitofish (Gambusia affinis)[J]. Environment International, 2019, 123: 132-140. DOI:10.1016/j.envint.2018.11.066 |
| [17] |
HUANG G Y, LIU Y S, LIANG Y Q, SHI W J, YANG Y Y, LIU S S, HU L X, CHEN H X, XIE L, YING G G. Endocrine disrupting effects in western mosquitofish Gambusia affinis in two rivers impacted by untreated rural domestic wastewaters[J]. The Science of the Total Environment, 2019, 683: 61-70. DOI:10.1016/j.scitotenv.2019.05.231 |
| [18] |
KROTZER M J. The effects of induced masculinization on reproductive and aggressive behaviors of the female mosquitofish, Gambusia affinis affinis[J]. Environmental Biology of Fishes, 1990, 29(2): 127-134. DOI:10.1007/BF00005029 |
| [19] |
STEINBACH C, CÍSAŘ P, ŠAUER P, KLICNAROVÁ J, SCHMIDT-POSTHAUS H, GOLOVKO O, KOCOUR KROUPOVÁ H. Synthetic GES etonogestrel negatively affects mating behavior and reproduction in Endler's guppies (Poecilia wingei)[J]. The Science of the Total Environment, 2019, 663: 206-215. DOI:10.1016/j.scitotenv.2019.01.276 |
| [20] |
WIEGRATZ I, THALER C J. Hormonal contraception--what kind, when, and for whom?[J]. Deutsches Arzteblatt International, 2011, 108(28–29): 495-505. DOI:10.3238/arztebl.2011.0495 |
| [21] |
苏达, 高利红. 实验动物伦理新原则的框架分析与我国相关立法发展方向[J]. 中国比较医学杂志, 2022, 32(11): 107-112. DOI:10.3969/j.issn.1671-7856.2022.11.014 SU D, GAO L H. Analysis of the framework of new principles of laboratory animal ethics and the direction of relevant legislative development in China[J]. Chinese Journal of Comparative Medicine, 2022, 32(11): 107-112. DOI:10.3969/j.issn.1671-7856.2022.11.014 |
| [22] |
潘婷, 武园园, 郭广生, 汪夏燕. 基于流体动力单细胞高效捕获的微流控芯片结构研究进展[J]. 分析化学, 2023, 1-15. DOI:10.19756/j.issn.0253-3820.231008 PAN T, WU Y Y, GUO G S, WANG X Y. Advances in microfluidic chip structures based on efficient capture of hydrodynamic single cells[J]. Chinese Journal of Analytical Chemistry, 2023, 1-15. DOI:10.19756/j.issn.0253-3820.231008 |
| [23] |
HAO Y, HAO S, ANDERSEN-NISSEN E, MAUCK W M, ZHENG S, BUTLER A, LEE M J, WILK A J, DARBY C, ZAGER M, HOFFMAN P, STOECKIUS M, PAPALEXI E, MIMITOU E P, JAIN J, SRIVASTAVA A, STUART T, FLEMING L M, YEUNG B, ROGERS A J, MCELRATH J M, BLISH C A, GOTTARDO R, SMIBERT P, SATIJA R. Integrated analysis of multimodal single-cell data[J]. Cell, 2021, 184(13): 3573-3587. DOI:10.1016/j.cell.2021.04.048 |
| [24] |
PATIL A. CellKb immune: A manually curated database of mammalian immune marker gene sets optimized for rapid cell type identification[J]. bioRxiv, 2020, 12: 389890. DOI:10.1101/2020.12.01.389890 |
| [25] |
CHEN E Y, TAN C M, KOU Y, DUAN Q, WANG Z, MEIRELLES G V, CLARK N R, MA'AYAN A. Enrichr: interactive and collaborative HTML5 gene list enrichment analysis tool[J]. BMC Bioinformatics, 2013, 14: 128. DOI:10.1186/1471-2105-14-128 |
| [26] |
TRAPNELL C, CACCHIARELLI D, GRIMSBY J, POKHAREL P, LI S, MORSE M, LENNON N J, LIVAK K J, MIKKELSEN T S, RINN J L. The dynamics and regulators of cell fate decisions are revealed by pseudotemporal ordering of single cells[J]. Nature Biotechnology, 2014, 32(4): 381-386. DOI:10.1038/nbt.2859 |
| [27] |
QIU X, HILL A, PACKER J, LIN D, MA Y A, TRAPNELL C. Single-cell mRNA quantification and differential analysis with census[J]. Nature Methods, 2017, 14(3): 309-315. DOI:10.1038/nmeth.4150 |
| [28] |
TRAPNELL C, CACCHIARELLI D, GRIMSBY J, POKHAREL P, LI S, MORSE M, LENNON N J, LIVAK K J, MIKKELSEN T S, RINN J L. The dynamics and regulators of cell fate decisions are revealed by pseudotemporal ordering of single cells[J]. Nature Biotechnology, 2014, 32(4): 381-386. DOI:10.1038/nbt.2859 |
| [29] |
QIU X, MAO Q, TANG Y, WANG L, CHAWLA R, PLINER H A, TRAPNELL C. Reversed graph embedding resolves complex single-cell trajectories[J]. Nature Methods, 2017, 14(10): 979-982. DOI:10.1038/nmeth.4402 |
| [30] |
YU G, WANG L G, HAN Y, HE Q Y. cluster Profiler: An R package for comparing biological themes among gene clusters[J]. Omics : a Journal of Integrative Biology, 2012, 16(5): 284-287. DOI:10.1089/omi.2011.0118 |
| [31] |
STROME S, UPDIKE D. Specifying and protecting germ cell fate. Nature reviews[J]. Molecular Cell Biology, 2015, 16(7): 406-416. DOI:10.1038/nrm4009 |
| [32] |
BLASER H, EISENBEISS S, NEUMANN M, REICHMAN-FRIED M, THISSE B, THISSE C, RAZ E. Transition from non-motile behaviour to directed migration during early PGC development in zebrafish[J]. Journal of Cell Science, 2005, 118(Pt 17): 4027-4038. DOI:10.1242/jcs.02522 |
| [33] |
SHINOMIYA A, TANAKA M, KOBAYASHI T, NAGAHAMA Y, HAMAGUCHI S. The vasa-like gene, olvas, identifies the migration path of primordial germ cells during embryonic body formation stage in the medaka, Oryzias latipes[J]. Development, Growth & Differentiation, 2000, 42(4): 317-326. DOI:10.1046/j.1440-169x.2000.00521.x |
| [34] |
李华金, 许文婷, 肖亚梅, 彭亮跃. 多倍体鲫鲤原始生殖细胞的标记及其迁移研究[J]. 生命科学研究, 2018, 22(6): 454-460. DOI:10.16605/j.cnki.1007-7847.2018.06.004 LI H J, XU W T, XIAO Y M, PENG L Y. Visualization and migration of primordial germ cells in polyploid crucian carp[J]. Life Science Research, 2018, 22(6): 454-460. DOI:10.16605/j.cnki.1007-7847.2018.06.004 |
| [35] |
KUROKAWA H, SAITO D, NAKAMURA S, KATOH-FUKUI Y, OHTA K, BABA T, MOROHASHI K, TANAKA M. Germ cells are essential for sexual dimorphism in the medaka gonad[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(43): 16958-16963. DOI:10.1073/pnas.0609932104 |
| [36] |
NAKAMURA S, WATAKABE I, NISHIMURA T, TOYODA A, TANIGUCHI Y, TANAKA M. Analysis of medaka sox9 orthologue reveals a conserved role in germ cell maintenance[J]. PLoS One, 2012, 7(1): e29982. DOI:10.1371/journal.pone.0029982 |
| [37] |
SAITO T, GOTO-KAZETO R, ARAI K, YAMAHA E. Xenogenesis in teleost fish through generation of germ-line chimeras by single primordial germ cell transplantation[J]. Biology of Reproduction, 2008, 78(1): 159-66. DOI:10.1095/biolreprod.107.060038 |
| [38] |
TZUNG K W, GOTO R, SAJU J M, SREENIVASAN R, SAITO T, ARAI K, YAMAHA E, HOSSAIN M S, CALVERT M E K, ORBÁN L. Early depletion of primordial germ cells in zebrafish promotes testis formation[J]. Stem Cell Reports, 2015, 4(1): 61-73. DOI:10.1016/j.stemcr.2014.10.011 |
| [39] |
LEE M M, DONAHOE P K. Mullerian inhibiting substance: a gonadal hormone with multiple functions[J]. Endocrine reviews, 1993, 14(2): 152-164. DOI:10.1210/edrv-14-2-152 |
| [40] |
WANG X G, ORBAN L. Anti-Müllerian hormone and 11 beta-hydroxylase show reciprocal expression to that of aromatase in the transforming gonad of zebrafish males[J]. Developmental Dynamics : an Offi cial Publication of the American Association of Anatomists, 2007, 236(5): 1329-1338. DOI:10.1002/dvdy.21129 |
| [41] |
KWAN T N, PATIL J G. Sex biased expression of anti-Mullerian hormone (amh) gene in a live bearing fish, Gambusia holbrooki: Evolutionary implications and potential role in sex differentiation[J]. Comparative Biochemistr y and Physiolog y. Part B, Biochemistry & molecular biology, 2019, 231: 59-66. DOI:10.1016/j.cbpb.2019.02.004 |
| [42] |
BUROW S, MIZRAHI N, MAUGARS G, VON KROGH K, NOURIZADEH-LILLABADI R, HOLLANDER-COHEN L, SHPILMAN M, ATRE I, WELTZIEN F A, LEVAVI-SIVAN B. Characterization of gonadotropin receptors Fshr and Lhr in Japanese medaka, Oryzias latipes[J]. General and Comparative Endocrinology, 2020, 285: 113276. DOI:10.1016/j.ygcen.2019.113276 |
| [43] |
LIU K C, LIN S W, GE W. Differential regulation of gonadotropin receptors (fshr and lhcgr) by estradiol in the zebrafish ovary involves nuclear estrogen receptors that are likely located on the plasma membrane[J]. Endocrinology, 2011, 152(11): 4418-4430. DOI:10.1210/en.2011-1065 |
| [44] |
FRANKEL T E, MEYER M T, ORLANDO E F. Aqueous exposure to the GES, levonorgestrel, alters anal fin development and reproductive behavior in the eastern mosquitofish (Gambusia holbrooki)[J]. General Comparative Endocrinology, 2016, 234: 161-169. DOI:10.1016/j.ygcen.2016.01.007 |
| [45] |
HOU L P, YANG Y, SHU H, YING G G, ZHAO J L, FANG G Z, XIN L, SHI W J, YAO L, CHENG X M. Masculinization and reproductive effects in western mosquitofish (Gambusia affinis) after long-term exposure to androstenedione[J]. Ecotoxicol Environ Safety, 2018, 147: 509-515. DOI:10.1016/j.ecoenv.2017.08.004 |
| [46] |
MIURA T, YAMAUCHI K, TAKAHASHI H, NAGAHAMA Y. Hormonal induction of all stages of spermatogenesis in vitro in the male Japanese eel (Anguilla japonica)[J]. Proc Natl Acad Sci U S A, 1991, 88(13): 5774-5778. DOI:10.1073/pnas.88.13.5774 |
| [47] |
OGINO Y, KATOH H, YAMADA G. Androgen dependent development of a modified anal fin, gonopodium, as a model to understand the mechanism of secondary sexual character expression in vertebrates[J]. FEBS Letters, 2004, 575(1/3): 119-126. DOI:10.1016/j.febslet.2004.08.046 |
| [48] |
ZHONG L, LIANG YQ, LU M, PAN CG, DONG Z, ZHAO H, LI C, LIN Z, YAO L. Effects of dexamethasone on the morphology, gene expression and hepatic histology in adult female mosquitofish (Gambusia affinis)[J]. Chemosphere, 2021, 274: 129797. DOI:10.1016/j.chemosphere.2021.129797 |
| [49] |
SHAO C, LI Q, CHEN S, ZHANG P, LIAN J, HU Q, SUN B, JIN L, LIU S, WANG Z, ZHAO H, JIN Z, LIANG Z, LI Y, ZHENG Q, ZHANG Y, WANG J, ZHANG G. Epigenetic modification and inheritance in sexual reversal of fish[J]. Genome Research, 2014, 24(4): 604-615. DOI:10.1101/gr.162172.113 |
| [50] |
WANG H Y, LIU X, CHEN J Y, HUANG Y, LU Y, TAN F, LIU Q, YANG M, LI S, ZHANG X, QIN Y, MA W, YANG Y, MENG L, LIU K, WANG Q, FAN G, NÓBREGA R H, LIU S, PIFERRER F, SHAO C. Single-cell-resolution transcriptome map revealed novel genes involved in testicular germ cell progression and somatic cells specification in Chinese tongue sole with sex reversal[J]. Science China. Life Sciences, 2023, 66(5): 1151-1169. DOI:10.1007/s11427-021-2236-4 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50