文章信息
基金项目
- 国家重点研发计划项目(2022YFD1801000);“十四五”广东省农业科技创新十大主攻方向“揭榜挂帅”项目(2022SDZG02);广东省农业科学院创新基金-产业专项(202144);云南省廖明专家工作站(202105AF150077)
作者简介
- 胡鑫宇(1996—),女,在读硕士生,研究方向为预防兽医学,E-mail:425055646@qq.com.
通讯作者
- 廖明(1968—),男,博士,教授,研究方向为预防兽医学,E-mail:mliao@scau.edu.cn.
文章历史
- 收稿日期:2023-03-29
2. 广东省农业科学院动物卫生研究所 / 广东省畜禽疫病防治研究重点实验室 / 农业农村部禽流感等家禽重大疾病防控重点实验室,广东 广州 510640
2. Institute of Animal Health, Guangdong Academy of Agricultural Sciences / Guangdong Key Laboratory of Livestock Disease Prevention / Key Laboratory for Prevention and Control of Avian Influenza and Other Major Poultry Diseases, Ministry of Agriculture and Rural Affairs, Guangzhou 510640, China
【研究意义】禽腺病毒(Fowl adenovirus,FAdV)属于腺病毒科(Adenoviridae)禽腺病毒属(Aviadenovirus),是一种无囊膜的双股DNA病毒。禽腺病毒属Ⅰ群可根据病毒结构特征分为5个种(以A~E表示),根据血清交叉中和反应可分为12种血清型(FAdV1~7、8a、8b、9~11)[1]。禽腺病毒Ⅰ群所有血清型均可引发包涵体肝炎(Inclusion body hepatitis,IBH)[2],其中FAdV-4被认为是引发心包积液-肝炎综合征(Hydropericardium hepatitis syndrome,HHS)的特定病原,发病禽可见明显的心包积液和肝炎、肾炎,致死率高,其流行给我国养禽业造成巨大损失[3]。目前接种疫苗仍是FAdV防控的有效手段[4],但禽腺病毒Ⅰ群血清型较多,且不同血清型之间没有或只有微弱的的交叉保护力[5]。FAdV-4能够中和FAdV-11,但不能中和FAdV-8a和FAdV-8b,FAdV-8a和FAdV-8b不能交叉中和,FAdV-8b和FAdV-11能够相互中和[6]。研究FAdV不同血清型的致病性可以进一步认识禽腺病毒的危害,为科学有效防控奠定基础。
【前人研究进展】2007—2018年调查表明,我国占据主导地位的禽腺病毒流行型为FAdV-4,其次为FAdV-8a、-8b、-11。近年来,同属于FAdV-D的FAdV-2、-8a、-8b、-11在我国南方省份被分离发现的占比不断上升[7-8],其中FAdV-2的分离率逐年上升。FAdV-2已在中国、加拿大[9]、日本[10]和波兰[11]等许多国家检出,主要感染3~5周龄肉鸡,导致严重的IBH,平均死亡率为5%~10%[12]。目前,有关FAdV-2的致病性尚不清楚,发病禽的病理变化等仍不明确。
【本研究切入点】通过对养殖场鸡群健康状况调查发现,免疫过鸡新城疫、禽流感(H9亚型)、禽腺病毒病(Ⅰ群FAdV-4)三联灭活疫苗的鸡群出现死亡,剖检可见典型的HHS症状。该情况说明除FAdV-4外可能还存在同样能引发HHS的病毒,因此对该病死鸡的组织样品进行病毒分离鉴定,明确疑似腺病毒的血清型,并通过动物回归试验建立发病模型。
【拟解决的关键问题】FAdV-4被认为是导致HHS症状的主要病原,其发病模型稳定。为建立稳定的FAdV-2发病模型,本研究从HHS发病鸡组织样品中分离出KM株,对其基因序列进行分析,通过比较不同攻毒途径和不同攻毒剂量的致病性差异,筛选出建立发病模型的最佳攻毒途径和攻毒剂量,并对发病评价指标进行验证,为FAdV-2的免疫原性评价和疫苗效果评价提供参考。
1 材料与方法 1.1 试验材料1.1.1 样品来源 云南昆明某养殖场鸡群出现不明原因死亡,剖检可见肝炎、肾炎和心包积水等HHS样临床症状。该养殖场鸡群已经免疫过两次鸡新城疫、禽流感(H9亚型)、禽腺病毒病(Ⅰ群FAdV-4)三联灭活疫苗。为了明确导致此次疾病的病原,采集病死鸡的肝脏、脾脏和肾脏样本,冷藏保存,送至实验室检查。
1.1.2 试验动物 6周龄SPF鸡70只,购自北京梅里亚维通公司,于动物隔离器中饲养。
1.1.3 试剂和引物 DMEM-F12培养基、胎牛血清、胰酶购自赛默飞世尔科技有限公司;鸡肝癌细胞(LMH细胞)购自广州市华南农大生物药品有限公司;DL2000 Marker、2×Taq Master Mix、磷酸缓冲溶液(PBS)购自南京诺唯赞生物科技股份有限公司;DNA提取试剂盒购自宝日医生物技术(北京)有限公司。
参照文献[13]设计FAdV鉴定通用引物(上游引物5' CAARTTCAGRCAGACGGT 3',下游引物5' TAGTGATGMCGSGACATCAT 3',目的片段大小为897 bp);将GenBank登记的GX01株作为参考序列,分别设计FAdV-2 Fiber序列扩增引物(上游引物5' ATGGCAAAATCGACTCCTTTC 3',下游引物5' TTAGGGTTGTGTTAATTTATT 3',目的片段大小约为1 700 bp)和FAdV-2 Hexon序列扩增引物(上游引物5' CGTCGCATGTGTTATTGACC 3',下游引物5' GTCCCAGCCATTATAAGCAG 3',目的片段大小约为3 000 bp)。引物由生工生物工程(上海)股份有限公司合成。
1.2 病毒分离鉴定1.2.1 病原鉴定 将病死鸡组织样本置于研钵,研磨匀浆加PBS后放入5 mL EP管中,反复冻融3次,5 000 r/min离心5 min,按照Takara DNA提取试剂盒说明书的操作步骤抽提上清液DNA作为模板,用FAdV通用引物进行鉴定。PCR体系为:2×Taq Master Mix 5 μL、FAdV上下游引物各1 μL、模板DNA 1 μL、ddH2O 2 μL。反应程序为:95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 50 s,30个循环;72 ℃ 5 min。PCR产物经1% 琼脂糖凝胶电泳分析,出现预期条带则视为样本禽腺病毒阳性。
1.2.2 病毒分离 取LMH细胞生长至密度达90%~95% 的T25细胞瓶,弃去瓶中培养基后加入无菌PBS,平铺润洗后弃去洗液,重复2次。加入经孔径0.22 μm滤膜过滤后的1.2.1阳性样本液200 μL和DMEM-F12培养基300 μL,晃动平铺后置于37 ℃、5%CO2培养箱中孵育2 h,弃接毒液后加入5 mL含5% FBS的DMEM-F12培养基,放于细胞培养箱中培养72 h,每天观察,培养结束时反复冻融后收获。按照上述接毒方法盲传3代。
1.2.3 病毒鉴定 取盲传3代后的培养液,用DNA提取试剂盒抽提病毒DNA,作为PCR特异性扩增的模板。PCR体系和反应程序按照1.2.1操作。PCR产物经1% 琼脂糖凝胶电泳分析,出现预期条带则送测序,并对序列进行比对。
1.3 分离株KM的Fiber和Hexon序列分析以1.2.3制备的病毒DNA作为模板,分别用Fiber、Hexon引物进行PCR扩增。PCR体系为:2×Taq Master Mix 25 μL、上下游扩增引物各2 μL、模板DNA 2 μL、ddH2O 19 μL。反应程序为:95 ℃ 5 min;95 ℃ 50 s、55 ℃ 50 s、72 ℃ 1 min 20 s,30个循环;72 ℃ 7 min。PCR产物经1% 琼脂糖凝胶电泳分析,出现预期条带则送测序。
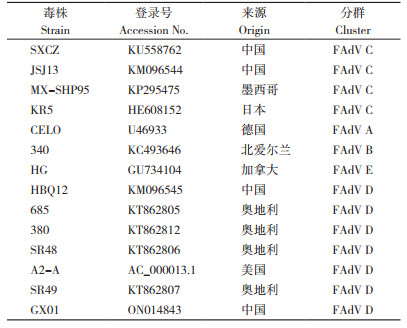
在GenBank中下载14株禽腺病毒参考株(表 1)的全基因组序列,利用MegAlign软件的Clustal W方法将本研究的分离株KM与参考株进行核苷酸序列比对和相似性分析,采用MEGA7.0软件构建核苷酸系统发育树(算法NJ邻接法,Bootstrap值设为500)。应用生物软件DNAStar中的Editseq推导分离株的主要结构基因Hexon和Fiber的氨基酸序列,并与GX01株相应蛋白的氨基酸序列进行比对分析。
1.4 KM株扩增及TCID50测定
将KM株F2代病毒液接种于T75细胞瓶中孵育2 h,弃去接种液并用PBS润洗2次,37 ℃下观察,出现80% 以上病变则将细胞瓶置于-80 ℃下繁毒冻融3次使病毒充分释放,分装,-80 ℃保存待测TCID50。将LMH细胞铺于96孔板中,待其生长至密度达85%~95% 时进行试验。用DMEM-F12培养液将病毒液进行10倍稀释,使病毒液浓度为原液的10-10~10-1,分别取100 μL接种于96孔细胞板中,每个稀释度8个重复,第11列为空白对照,第12列为阳性对照。置于37 ℃温箱中孵育2 h后弃去病毒液,加入含1% FBS的DMEM-F12细胞维持液。将细胞板放入37 ℃培养箱中,观察7 d,记录病变孔数,按照ReedMuench法计算病毒TCID50。
1.5 KM株发病模型建立1.5.1 KM株纯净性检测 分别用试剂盒抽提两代感染毒KM株病毒液中的DNA,并用常见的禽病病毒特异性检测引物进行PCR特异性扩增检测,供检测的病毒包括鸡传染性喉气管炎病毒(ILTV)、减蛋综合征病毒(EDSV)、禽支原体(MS/MG)、马立克病病毒(MDV)、新城疫病毒(NDV)、传染性法氏囊病毒(IBDV)、禽传染性脑炎病毒(AEV)、禽呼肠孤病毒(ARV)、鸡传染性病病毒(CAV)、鸡白血病(ALV)、传染性支气管炎(IBV)。PCR体系为:2×Taq 5 μL、上下游引物各1 μL、DNA模板1 μL、ddH2O 1 μL。反应程序为:95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 50 s,30个循环;72 ℃ 5 min,PCR产物用1% 琼脂糖凝胶电泳进行分析。
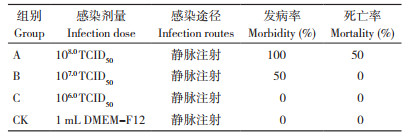
1.5.2 不同攻毒途径的KM株致病性分析 以F3代病毒作为感染毒,将30只6周龄SPF鸡随机分成3组(a、b、对照),每组10只。对a、b组SPF鸡分别经静脉注射和肌肉注射两种方式注射107.2TCID50的病毒液,空白对照组中5只经静脉注射1 mL DMEM-F12(CK1),另外5只经肌肉注射1 mL DMEM-F12培养基(CK2)。攻毒后3组SPF鸡分别在隔离器中饲养,每天观察并记录鸡群状态。攻毒1、3、5、7 d后用棉签采集泄殖腔拭子,-80 ℃保存;攻毒7 d后处死全部鸡,剖检观察脏器病变情况,并采集心、肝、脾、肾组织样品,-80 ℃保存。
1.5.3 不同攻毒剂量的KM株致病性分析 以F3代作为感染毒,将40只6周龄SPF鸡随机分成4组(A、B、C、对照),每组10只。对A、B、C组SPF鸡分别静脉注射108.0TCID50、107.0TCID50和106.0TCID50病毒液,空白对照组(CK)静脉注射1 mL培养基。攻毒后4组SPF鸡分别于隔离器中饲养,每天观察并记录鸡群状态。攻毒1、3、5、7 d后用棉签采集泄殖腔拭子保存于添加PBS的EP管中,-80 ℃保存;攻毒7 d后处死全部鸡,剖检观察脏器病变情况,采集心、肝、脾、肾组织样品,-80 ℃保存。
1.5.4 组织样品核酸检测 将心、肝、脾、肾组织样品置于室温下融化、研磨制成匀浆,置于5 mL EP管中,加入3 mL灭菌PBS,反复倒置混合均匀,放入-80 ℃冰箱中反复冻融3次,5 000 r/min离心5 min,取上清液,用试剂盒抽提上清液中的核酸,PCR体系和反应程序同1.2.1,PCR产物经1% 琼脂糖凝胶电泳分析。
1.5.5 泄殖腔拭子核酸检测 将泄殖腔拭子于室温中融化,用试剂盒抽提核酸,PCR体系和反应程序同1.2.1,将PCR产物置于1% 琼脂糖凝胶中电泳分析。
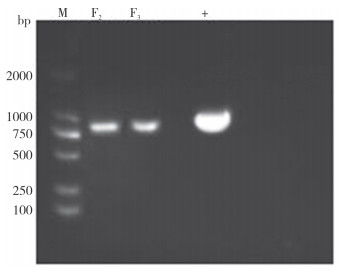
2 结果与分析 2.1 病毒鉴定结果本研究分离的病毒盲传3代后,LMH细胞出现CPE,表现为变圆、脱落(图 1),抽提核酸后经PCR鉴定(图 2)为禽腺病毒。经测序并比对序列,所分离的病毒Hexon基因核苷酸序列与GX01株相似度达99.64%,鉴定为禽腺病毒Ⅰ群D种中的禽腺病毒血清2型(FAdV-2),将该毒株命名为KM株。

|
| A:对照LMH细胞;B:病变的LMH细胞 A: The control LMH cells; B: The cytopathic LMH cells 图 1 KM株感染LMH细胞引起的细胞病变 Fig. 1 LMH cell pathological changes after KM strain infection |
|
| M:DL2000 Marker;F2、F3:F2、F3代病毒核酸鉴定;+:阳性对照 M: DL2000 Marker; F2, F3: F2 and F3 generation virus nucleic acid identification; +: Positive control 图 2 FAdV-2的PCR鉴定 Fig. 2 Identification of FAdV-2 by PCR assay |
2.2 KM株Fiber基因和Hexon基因的进化分析
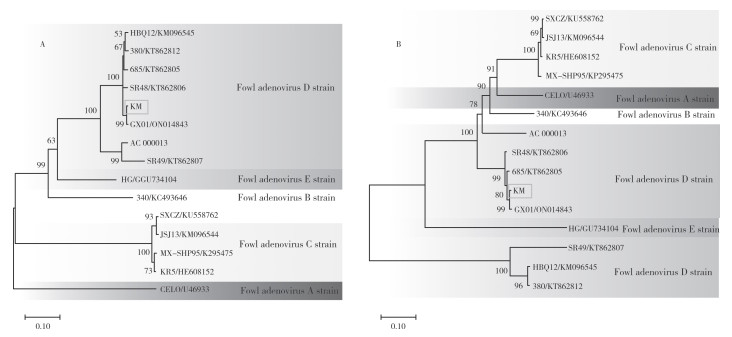
采用MEGA 7.0软件的Clustal W方法将KM株与5个群共14株FAdV毒株的Fiber基因和Hexon基因核苷酸序列进行分析。根据Fiber遗传进化树(图 3A)来看,KM株与国内分离的FAdV-2血清型GX01株距离最近,同属于禽腺病毒Ⅰ群D种,与其他的A、B、C、E群距离较远;根据Hexon遗传进化树(图 3B)来看,KM株与GX01株距离也最近,同属于禽腺病毒Ⅰ群D种。
|
| 图 3 KM株基于Fiber基因(A)和Hexon基因(B)的系统遗传进化树 Fig. 3 Phylogenetic tree of KM strain based on Fiber gene (A) and Hexon gene (B) |
采用MegAlign对15株FAdV的Fiber和Hexon基因序列进行核苷酸同源性分析,结果显示,KM株Fiber基因核苷酸序列与GX01、380、685、A-A2、HBQ12、SR48、SR49病毒核苷酸序列同源性为71.8%~98.9%,其中与GX01株同源性为98.9%,该8株病毒同属于禽腺病毒Ⅰ群D种(图 4);KM株Hexon基因核苷酸序列与GX01、380、685、A-2A病毒核苷酸序列同源性为79.9%~99.6%,与380、SR49、HBQ12病毒核苷酸序列同源性为39.0%~39.1%,其中KM与GX01、685、SR48病毒核苷酸序列同源性为97.8%~99.6%(图 5)。
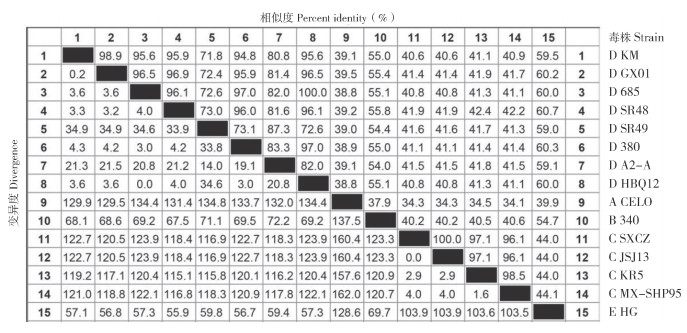
|
| 图 4 KM株Fiber基因核苷酸序列同源性分析结果 Fig. 4 Homology analysis result of nucleotide sequence of Fiber gene from KM strain |
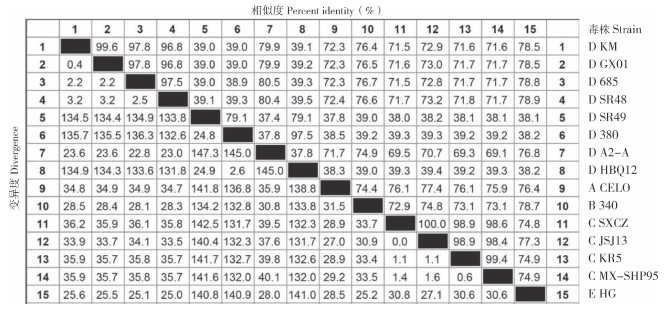
|
| 图 5 KM株Hexon基因核苷酸序列同源性分析结果 Fig. 5 Homology analysis result of nucleotide sequence of Hexon gene from KM strain |
利用DNAStar中的Editseq软件将分离株KM的主要结构基因Hexon和Fiber翻译为氨基酸序列,采用MegAlign对15株FAdV的Fiber氨基酸序列和Hexon氨基酸序列分别进行同源性分析。结果显示,KM株Fiber氨基酸序列与GX01、685、380、HBQ12的同源性为94.8%~98.9%,其中与GX01株的同源性最高、为98.9%(图 6);KM株Hexon氨基酸序列也与GX01株同源性最高、为98.8%,与685、SR48同源性为33.1% 和47.9%,表明KM株与国外分离的毒株同源性较低(图 7)。

|
| 图 6 KM株Fiber氨基酸序列同源性分析结果 Fig. 6 Homology analysis result of the deduced amino acid sequence of Fiber from KM strain |
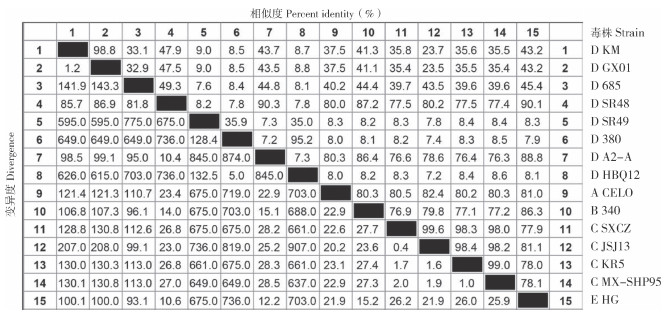
|
| 图 7 KM株Hexon氨基酸序列同源性分析结果 Fig. 7 Homology analysis result of the deduced amino acid sequence of Hexon from KM strain |
2.3 KM株的TCID50效价
分别记录病毒液不同稀释度(10-10~10-1)出现CPE的孔数,计算每个稀释度出现CPE的占比,按照Reed-Muench计算可得,KM株F3代滴度为1×107.2TCID50/0.1 mL。
2.4 KM株纯净性检测经PCR特异性扩增后,凝胶电泳结果显示KM株未检测到外源病毒可疑条带,可见KM株F3代无ILTV、EDSV、MS/MG、MDV、NDV、IBDV、AEV、ARV、CAV、ALV、IBV病毒污染。
2.5 不同攻毒途径的KM株致病性a组SPF鸡通过静脉注射107.2TCID50 KM株,感染后2 d出现排黄绿色稀粪、站立困难、食欲下降等临床症状;攻毒3 d后死亡1只,5 d后死亡1只,死亡率为20%;7 d后处死并剖检每只鸡,可见心包积液、肝脏肿大带出血点、肾肿大等病理变化。b组SPF鸡通过肌肉注射107.2TCID50 KM株,感染后3 d出现少许黄绿色稀粪,无食欲下降、趴卧不起等临床症状,无死亡;攻毒7 d后处死剖检无发现肝炎、肾炎等症状。对照CK1、CK2的鸡精神状态良好,食欲正常,7 d后处死剖检无发现肝炎、肾炎等症状。

|
2.6 不同攻毒剂量的KM株致病性
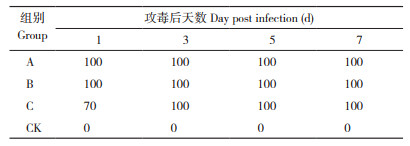
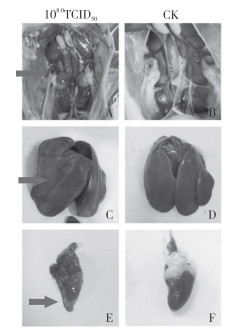
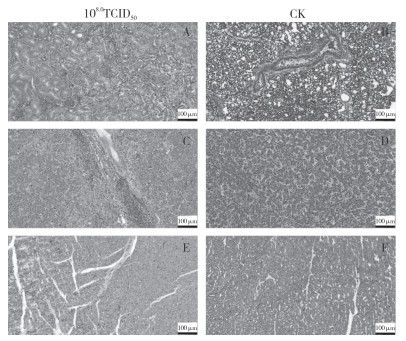
KM株经静脉注射剂量为106.0TCID50(C组)时,鸡群未出现精神沉郁、排黄绿色稀粪等临床症状,剖检无发现心包积液、肝炎症状。静脉攻毒剂量为107.0TCID50(B组)时,在7 d内5只SPF鸡出现精神沉郁、趴卧不起、羽毛凌乱、食欲下降等发病症状,但未出现鸡只死亡的情况(表 3),但剖检可见3只出现明显肝炎、肾炎症状。静脉攻毒剂量达108.0TCID50(A组)时,10只SPF鸡发病,出现黄绿色稀粪、精神不振、食欲下降等临床症状,且在攻毒3 d内死亡2只,攻毒后7 d内死亡5只,死亡率为50%(表 3);剖检可见明显的心包积液、肝炎、肾炎症状,肌胃、腺胃无变化(图 8);攻毒死亡的鸡组织病理切片(图 9)显示,心脏组织间隙增宽、心肌纤维增粗、间质性水肿,肝脏炎性细胞和嗜碱性包涵体浸润,肾脏炎性细胞浸润,间质充血;对照组鸡的心脏、肝脏和肾脏组织病理切片显示正常(表 3)。为保证KM株感染模型中同时存在发病和死亡的情况,选择静脉注射感染途径为宜,感染剂量为108.0TCID50。
|
|
| A、C:分别为脏炎症、肝脏炎症(攻毒后5 d死亡);E:心包积水(攻毒后3 d死亡) A, C: Kidney inflammation, liver inflammation (death at 5 d post infection), respectively; E: Pericardial hydrops (death at 3 d post infection) 图 8 KM株静脉注射108.0TCID50死亡鸡只的剖检结果 Fig. 8 Necropsy examination of dead chickens infected with KM strain 108.0TCID50 in intravenous route |
|
| A:肾脏炎性细胞浸润,间质充血(攻毒5 d死亡);C:肝脏炎性细胞和嗜碱性包涵体浸润(攻毒5 d死亡);E:心脏组织间隙增宽,心肌纤维增粗,间质性水肿(攻毒3 d死亡) A: Kidney inflammatory cell infiltration, interstitial congestion (death at 5 d post infection); C: Infiltration of hepatic inflammatory cells and basophilic inclusion bodies (death at 5 d post infection); E: Widening of heart tissue gap, thickening of myocardial fibers, interstitial edema (death at 3 d post infection) 图 9 KM株静脉注射108.0TCID50死亡鸡只的组织病理切片 Fig. 9 Histological examination of dead chickens infected with KM strain 108.0TCID50 by intravenous route |
2.7 脏器组织核酸检测
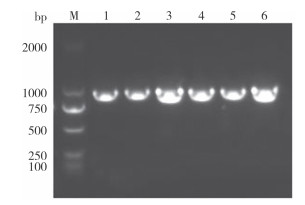
采集KM株静脉注射108.0TCID50死亡的5只鸡和攻毒7 d后统一处死的5只鸡的肝脏、肾脏样本,提取核酸并利用FAdV-2特异性引物进行PCR扩增,均检出大小符合预期的条带,约897 bp(图 10),确认为KM株感染。
|
| M:DL2000 Marker;1~5:分别为5只死亡鸡组织样本;6:阳性对照 M: DL2000 Marker; 1-5: Tissue samples from 5 dead chickens, respectively; 6: Positive control 图 10 组织样本的FAdV-2 PCR核酸检测 Fig. 10 PCR detection of FAdV-2 in tissue samples |
2.8 泄殖腔拭子核酸检测
A、B、C试验组攻毒前泄殖腔拭子核酸检测均无目标条带检出,静脉注射KM株,攻毒后1 d的检测结果显示均有目标条带,攻毒后3~7 d各组全部鸡均检出目标条带(表 4)。
3 讨论
我国是畜禽养殖大国,规模化畜禽养殖业为社会带来巨大经济效益[14]。2015年发现禽心包积液-肝炎综合征[15],2016年各地均有病例报告。随着对该病的认识逐渐深入,以及各种疫苗、防控手段应用,2019—2020年该病呈下降趋势[16]。3~5周龄的种鸡和蛋鸡是心包积液-肝炎综合征最为易感的鸡群,致死率为30%~90%[17]。FAdV-4被认为是引发心包积液-肝炎综合征的特定病原[18]。本研究结果显示,高剂量(108.0TCID50)的FAdV-2经静脉感染也可引发心包积液-肝炎综合征典型症状进而导致动物死亡,说明FAdV-2对禽类养殖存在较大威胁,研发针对FAdV-2的疫苗仍然是防控的第一选择。
Xie等[19]对FAdV-2的致病性进行研究,经肌肉注射感染3日龄和10日龄SPF鸡后,试验鸡虽无死亡,但出现明显的体重下降。目前未有报道进行过静脉注射感染大日龄SPF鸡的致病性研究,无法明确在静脉感染途径下大日龄SPF鸡感染FAdV-2的临床症状。为验证不同攻毒途径下FAdV-2的致病性差异,本试验分别通过静脉注射和肌肉注射107.2TCID50的病毒液,发现经静脉注射107.2TCID50剂量,6周龄SPF鸡出现死亡,剖检可见心包积液和肝炎,死亡率为20%,对未死亡鸡剖检可见明显病理变化。
实验动物、剂量选择、发病症状通常是建立发病模型最为关键的参数。本研究在进行不同攻毒剂量致病性试验设计时分别选择108.0TCID50、107.0TCID50、106.0TCID50 3个攻毒剂量,感染途径为静脉注射,结果表明,静脉攻毒剂量达到107.0TCID50时,6周龄SPF鸡出现黄绿色稀粪,无死亡,泄殖腔拭子攻毒后1 d全部阳性;攻毒剂量达到108.0TCID50时,试验鸡死亡率达50%,剖检可见明显病理变化,泄殖腔拭子攻毒后1 d全部阳性。
本研究结合不同攻毒途径和不同攻毒剂量致病性分析结果,建立了FAdV-2 KM株感染6周龄SPF鸡的发病模型:攻毒途径为静脉注射,剂量为108.0TCID50,试验鸡可见黄绿色稀粪临床症状,死亡率为50%,剖检脏器可见明显病理变化,攻毒1 d内泄殖腔排毒阳性。本试验分别在感染途径和感染剂量两个方面进行了最优剂量筛选,并通过动物回归试验验证了发病模型的结果。该发病模型证明FAdV-2是引发心包积液-肝炎综合征的病原之一。
4 结论本试验成功分离出1株FAdV-2野毒株,并将其命名为KM株,通过生物信息学软件对其Hexon和Fiber基因进行遗传演化分析,结果表明,KM株与FAdV-2 GX01株的同源性最高;此外,通过动物实验分析KM株在不同感染途径和不同感染剂量下对6周龄SPF鸡的致病性,发现FAdV-2也可以引发心包积液-肝炎综合征并导致SPF鸡死亡,同时验证了静脉注射途径感染导致的发病严重程度高于肌肉注射。本研究建立了FAdV-2 KM株感染SPF鸡的动物发病模型,为研究FAdV-2的免疫原性和评价疫苗效果提供参考。
| [1] |
MCFERRAN J B, ADAIR B M. Avian adenoviruses-A review[J]. Avian Pathology, 1977, 6(3): 189-217. DOI:10.1080/03079457708418228 |
| [2] |
MORSHED R, HOSSEINI H, LANGEROUDI A G, FARD M H B, CHARKHKAR S. Fowl Adenoviruses D and E cause inclusion body hepatitis outbreaks in broiler and broiler breeder pullet flocks[J]. Avian Diseases, 2017, 61(2): 205-10, 6. DOI:10.1637/11551-120516-Reg.1 |
| [3] |
张贤群, SALEEMI M K. 预防心包积水综合征所造成的损失[J]. 国外畜牧学(猪与禽), 2010, 30(5): 29-31. ZHANG X Q, SALEEMI M K. Preventing losses caused by pericardial effusion syndrome[J]. Animal Science Abroad (Pigs and Poultry), 2010, 30(5): 29-31. |
| [4] |
王慧, 程小果, 郭建友, 陈申秒, 程宁. 近期鸡群Ⅰ群禽腺病毒的流行与防治[J]. 上海畜牧兽医通讯, 2016(2): 62-63. DOI:10.14170/j.cnki.cn31-1278/s.2016.02.027 WANG H, CHENG X G, GUO J Y, CHEN S M, CHENG N. Recent epidemic and prevention of group i avian adenovirus in chicken colonies[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2016(2): 62-63. DOI:10.14170/j.cnki.cn31-1278/s.2016.02.027 |
| [5] |
尹燕博. 我国Ⅰ群禽腺病毒主要流行血清型及其防控[J]. 中国家禽, 2018, 40(3): 1-5. DOI:10.16372/j.issn.1004-6364.2018.03.001 YIN Y B. Investigation on dominant circulating serotypes of Group Ⅰ fowl adenovirus in China and the control[J]. China Poultry, 2018, 40(3): 1-5. DOI:10.16372/j.issn.1004-6364.2018.03.001 |
| [6] |
邹开宇, 高倩文, 江之瑶, 孙举, 王守春, 王建琳, 徐守振, 尹燕博. 我国Ⅰ群禽腺病毒主要流行血清型间交叉中和作用的初步研究[J]. 黑龙江畜牧兽医, 2018(11): 150-3. DOI:10.13881/j.cnki.hljxmsy.2018.01.0306 ZOU K Y, GAO Q W, JIANG Z Y, SUN J, WANG S C, WANG J L, XU S Z, YIN Y B. A Preliminary study on cross neutralization among the main prevalent serotypes of avian adenovirus Group Ι in China[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(6): 150-153. DOI:10.13881/j.cnki.hljxmsy.2018.01.0306 |
| [7] |
CHANGJING L, HAIYING L, DONGDONG W, JINGJING W, YOUMING W, SHOUCHUN W, JIDA L, PING L, JIANLIN W, SHOUZHEN X, SHANGJIN C, YI Z, YANBO Y. Characterization of fowl adenoviruses isolated between 2007 and 2014 in China[J]. Veterinary Microbiology, 2016, 197: 62-67. DOI:10.1016/j.vetmic.2016.11.005 |
| [8] |
SCHACHNER A, MATOS M, GRAFL B, HESS M. Fowl adenovirus-induced diseases and strategies for their control -A review on the current global situation[J]. Avian Pathology, 2018, 47(2): 111-26. DOI:10.1080/03079457.2017.1385724 |
| [9] |
OJKIC D, MARTIN E, SWINTON J, VAILLANCOURT J P, BOULIANNE M, GOMIS S. Genotyping of Canadian isolates of fowl adenoviruses[J]. Avian Pathology, 2008, 37(1): 95-100. DOI:10.1080/03079450701805324 |
| [10] |
NAKAMURA K, MASE M, YAMAMOTO Y, TAKIZAWA K, KABEYA M, WAKUDA T, MATSUDA M, CHIKUBA T, YAMAMOTO Y, OHYAMA T, TAKAHASHI K, SATO N, AKIYAMA N, HONMA H, IMAI K. Inclusion body hepatitis caused by fowl adenovirus in broiler chickens in Japan, 2009—2010[J]. Avian Diseases, 2011, 55(4): 719-723. DOI:10.1637/9813-052511-Case.1 |
| [11] |
NICZYPORUK J S. Phylogenetic and geographic analysis of fowl adenovirus field strains isolated from poultry in Poland[J]. Archives of Virology, 2016, 161(1): 33-42. DOI:10.1007/s00705-015-2635-4 |
| [12] |
TRIVEDI R N, KUMAR R, METWAL M, KHAN A S, TIWARI A, PANDAY G, KUMAR A. Epidemiological observations on some natural outbreaks of inclusion body Hepatitis-Hydropericardium Syndrome (IBH-HPS) in domestic chicken[J]. International Journal of Current Microbiology and Applied Sciences, 2018, 7(8): 3012-3022. DOI:10.20546/ijcmas.2018.708.320 |
| [13] |
MEULEMANS G, BOSCHMANS M, BERG T P, DECAESSTECKER M. Polymerase chain reaction combined with restriction enzyme analysis for detection and differentiation of fowl adenoviruses[J]. Avian Pathology, 2001, 30(6): 655-660. DOI:10.1080/03079450120092143 |
| [14] |
李琴, 桂双林, 易其臻, 吴九九, 闫冰, 詹聪. 畜禽粪便生物炭理化性质及其在环境修复应用中的研究进展[J]. 广东农业科学, 2022, 49(2): 73-84. DOI:10.16768/j.issn.1004-874X.2022.02.009 LI Q, GUI S L, YI Q Z, WU J J, YAN B, ZHAN C. Research progress on physicochemical properties of biochar in livestock and poultry manure and its application in environmental remediation[J]. Guangdong Agricultural Sciences, 2022, 49(2): 73-84. DOI:10.16768/j.issn.1004-874X.2022.02.009 |
| [15] |
ZHANG T, JIN Q, DING P, WANG Y, CHAI Y, LI Y, LIU X, LUO J, ZHANG G. Molecular epidemiology of hydropericardium syndrome outbreak-associated serotype 4 fowl adenovirus isolates in central China[J]. Virology Journal, 2016, 13(1): 188. DOI:10.1186/s12985-016-0644-x |
| [16] |
尹卫卫, 元娜, 袁万哲. 鸡心包积液-肝炎综合症近6年发病情况调查[J]. 中国动物保健, 2022, 24(10): 62-64. DOI:10.3969/j.issn.1008-4754.2022.10.030 YIN W W, YUAN N, YUAN F Z. Investigation on the incidence of chicken pericardial effusion hepatitis syndrome in the past 6 years[J]. China Animal Health, 2022, 24(10): 62-64. DOI:10.3969/j.issn.1008-4754.2022.10.030 |
| [17] |
MENG K, YUAN X, YU J, ZHANG Y, AI W, WANG Y. Identification, pathogenicity of novel fowl adenovirus serotype 4 SDJN0105 in Shandong, China and immunoprotective evaluation of the newly developed inactivated oil-emulsion FAdV-4 vaccine[J]. Viruses, 2019, 11(7). DOI:10.3390/v11070627 |
| [18] |
MA H, DING Y, DU K, CHANG K, NIU Y. FAdV-4 induce autophagy via the endoplasmic reticulum stress-related unfolded protein response[J]. Veterianry Microbiology, 2022, 269: 109388. DOI:10.1016/j.vetmic.2022.109388 |
| [19] |
XIE Z, ZHANG J, SUN M, ZENG Q, HUANG Y, DONG J, LI L, HUANG S, LIAO M. The first complete genome sequence and pathogenicity characterization of fowl adenovirus serotype 2 with inclusion body hepatitis and hydropericardium in China[J]. Frontiers in Veterinary Science, 2022, 9: 951554. DOI:10.3389/fvets.2022.951554 |
(责任编辑 崔建勋)
 2023, Vol. 50
2023, Vol. 50